El aneurisma de aorta abdominal (AAA) comparte diversos factores de riesgo con la aterosclerosis. De entre estos la diabetes mellitus (DM) podría tener un efecto negativo en la formación, crecimiento y expansión del AAA. En este sentido, diversas revisiones sistemáticas y metaanálisis publicados hasta 2016 han mostrado resultados concordantes en cuanto al posible efecto protector de la DM en la formación y progresión del AAA.
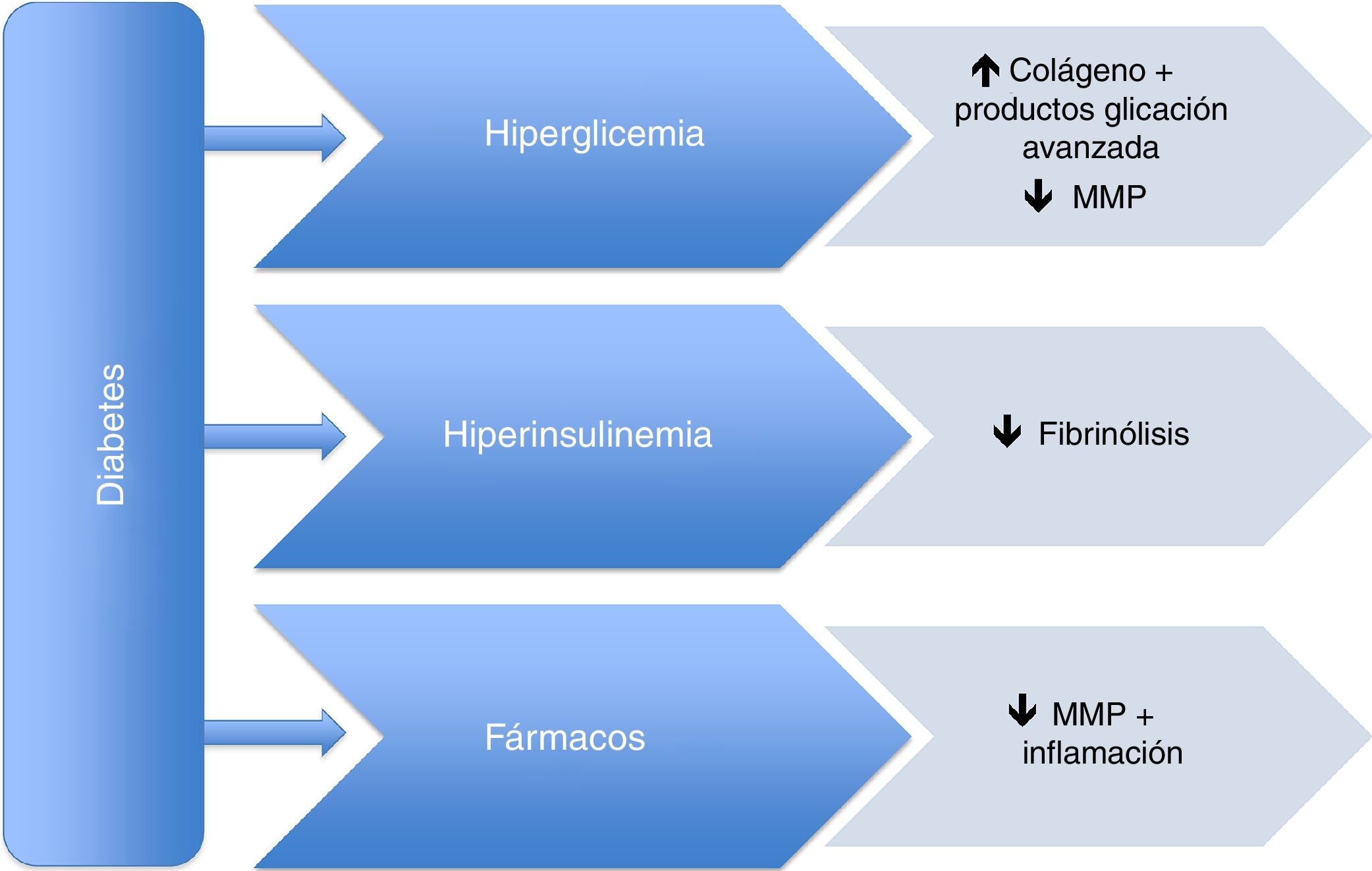
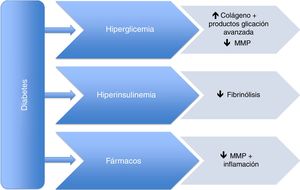
No obstante, los mecanismos fisiopatológicos de esta supuesta protección son aún desconocidos. Parece que tanto la hiperglucemia como la hiperinsulinemia asociadas a la DM, al causar un incremento de los productos de glicación avanzada, una disminución de la fibrinólisis y alteraciones en las células musculares lisas, comportarían un menor riesgo de expansión aneurismática. Se considera que este papel protector está principalmente mediado por una disminución de las metaloproteasas, en concreto la tipo 2 y 9. Además, los fármacos utilizados en el tratamiento tanto de la DM tipo 2 como de la hipertensión arterial y la dislipidemia también podrían desempeñar un papel en este efecto protector. La metformina, las tiazolidinedionas, los inhibidores del DPP4, las estatinas y los inhibidores de la enzima conversora de la angiotensina han sido evaluados en este sentido.
En conclusión, los estudios publicados hasta el momento parecen confirmar el efecto protector de la DM en la formación y expansión del AAA, aunque son necesarios futuros estudios a largo plazo para confirmar los mecanismos fisiopatológicos implicados, así como el papel de la medicación concomitante.
Abdominal aortic aneurysm (AAA) shares several risk factors with atherosclerosis. Among these, diabetes mellitus (DM) could have a negative effect on the formation, growth and expansion of AAA. Several systematic reviews and meta-analyses reported up to 2016 have shown concordant results regarding the possible protective effect on AAA formation.
However, the pathophysiological mechanisms of this supposed protective effect are still unknown. It appears that both hyperglycaemia and hyperinsulinemia, which are closely associated with DM, cause an increase in advanced glycation end-products, a decrease in fibrinolysis, and alterations in smooth muscle cells, leading to a decreased risk of aneurysm growth and expansion. This protective role is mainly mediated by a decrease in metalloproteinases, mainly type 2 and 9. In addition, drugs used to treat type 2 DM, as well as those for hypertension and dyslipidaemia could also play an important role in this protective effect. Metformin, thiazolidinediones, DPP4 inhibitors, statins, and angiotensin-converting enzyme inhibitors have been evaluated in this field.
In conclusion, studies reported so far seem to confirm the protective effect of DM in both the formation and expansion of AAA, although future long-term studies are needed to confirm the pathophysiological mechanisms involved, as well as the role of concomitant medication.
El aneurisma de aorta abdominal (AAA) es una enfermedad con una importante carga familiar que comparte con la aterosclerosis varios factores de riesgo cardiovascular, como la edad avanzada (>60 años), el sexo masculino, la raza blanca, la hipertensión arterial, la hipercolesterolemia, a expensas de las lipoproteínas de baja densidad (LDL), el tabaquismo, la enfermedad aterosclerótica avanzada, la obesidad, así como la historia familiar o personal de enfermedad cardiovascular1. Sin embargo, aunque la diabetes mellitus (DM) sea un factor de riesgo para el desarrollo de enfermedad cardiaca coronaria, cerebrovascular y arterial periférica, podría tener un efecto negativo en la formación, crecimiento y expansión del AAA. En este sentido, estudios previos han sugerido un posible efecto protector de la DM en la prevalencia del AAA2,3, resultados en consonancia con los descritos en 2 metaanálisis previos4,5. Sin embargo, la relación patogénica entre el AAA y la DM es desconocida, y los posibles mecanismos fisiopatológicos asociados a este supuesto efecto protector aún no están establecidos.
El diámetro normal de la arteria aorta varía en función de la edad, el sexo y el peso corporal, y su calibre disminuye de forma gradual hasta la bifurcación de las arterias iliacas6. El AAA se define como una dilatación patológica de la aorta mayor de 3cm, siendo la localización infrarrenal la más frecuente. Es conocido el aumento de morbimortalidad en la población adulta asociado al AA, especialmente cuando se localiza a nivel abdominal. La historia natural de la enfermedad suele ser silente hasta que aparece alguna de sus complicaciones: rotura, con una probabilidad directamente proporcional al tamaño y a la velocidad de crecimiento del aneurisma, formación de trombo en la pared aórtica o la compresión de órganos adyacentes7. Sin embargo, la mortalidad del AAA y la disección aórtica se han mantenido estables en los últimos años, probablemente debido, al menos en parte, al notable avance en las herramientas diagnóstico-terapéuticas. En España un total de 1.876 pacientes fallecieron en el año 2013 debido a la presencia de AAA o disección aórtica (CIE 10 I71)8, de los cuales 1.477 eran varones.
Tradicionalmente el AAA se ha considerado una manifestación focal de la enfermedad aterosclerótica avanzada9. Sin embargo, las nuevas evidencias apuntan a que el AAA es una forma localizada de una enfermedad sistémica vascular, caracterizada por una pérdida progresiva de la capacidad de resistencia de la pared aórtica debido a una elevada presión intraluminal y a una progresiva degradación de la misma.
Por todo ello hemos considerado de interés analizar la evidencia existente en la asociación entre la DM y el AAA, y describir los posibles mecanismos fisiopatológicos involucrados en el supuesto efecto protector. También se ha revisado la posible asociación entre la medicación utilizada para la DM tipo 2, la hipertensión arterial o la dislipidemia y su efecto en la progresión aneurismática.
Evidencias clínicasUno de los primeros estudios que subrayó la posible asociación negativa entre la DM y el AAA fue el llevado a cabo por Lederle et al.10 en 1997. Basado en el Aneursym Detection and Management (ADAM) se analizaron 73.451 pacientes sin historia previa de AAA, con una edad entre 50 y 79 años, de los cuales el 97% eran varones y demostraron que el sexo femenino (odds ratio [OR] 0,22 [intervalo de confianza —IC— 0,07 a 0,68]), la raza negra (OR 0,49 [IC 0,35 a 0,69]) y la presencia de DM (OR 0,54 [IC 0,44 a 0,65]) estaban asociados de manera negativa al AAA.
Después de este estudio seminal varias revisiones sistemáticas y metaanálisis han reproducido hallazgos similares. En este sentido, Shantikumar et al.5 incluyeron, hasta septiembre de 2009, 11 estudios con el objetivo principal de evaluar la asociación entre el AAA y la DM y establecer los mecanismos fisiopatológicos asociados al supuesto efecto protector. La prevalencia de DM en los pacientes con AAA fue del 6% al 14%, y la prevalencia de DM en pacientes del grupo control sin AAA fue del 17% al 36%. Asimismo, los resultados sugerían una reducción de la tasa de DM en los pacientes con AAA en comparación con aquellos sin enfermedad aórtica (OR 0,65 [IC 0,60 a 0,70], p<0,001). En la misma línea, el metaanálisis de De Rango et al.4 incluyó 54 estudios realizados en los últimos 20 años, valorando por separado los estudios de cribado poblacional, caso-control y prospectivos para mantener la homogeneidad entre los mismos. En 17 estudios de prevalencia se objetivó una asociación inversa entre la DM y el AAA (OR 0,80 [IC 0,70 a 0,90], p=0,0009), mientras que no se observaron diferencias significativas en los estudios caso-control. Asimismo, se observó una disminución en la incidencia de AAA de novo en pacientes con DM en 6 estudios prospectivos (OR 0,54 [IC 0,31 a 0,91], p=0,03). Finalmente, los pacientes con DM presentaban un aumento de la mortalidad a los 30 días del ingreso hospitalario por cirugía de AAA (OR 1,26 [IC 1,10 a 44], p=0,0008).
Es importante resaltar los hallazgos de 2 revisiones sistemáticas realizadas en los últimos 2 años. En primer lugar Takagi et al.11 publicaron una revisión sistemática de los estudios publicados hasta julio de 2015, incluyendo un total de 11 estudios que evaluaban la asociación entre AAA y DM. Un primer metaanálisis incluía 9 estudios con pacientes presentando una rotura del AAA, demostrando que la DM estaba asociada a una menor prevalencia/incidencia de rotura de AAA (OR 0,71 [IC 0,56 a 0,89], p=0,003). Un segundo metaanálisis de 11 estudios concluyó que la DM estaba asociada a una menor prevalencia/incidencia de rotura de AAA (OR 0,77 [IC 0,63 a 0,95], p=0,01). Por último, el metaanálisis de Xiong et al.12 incluyó 49 estudios con el objetivo principal de valorar el efecto de la DM sobre la presencia y crecimiento del AAA. Así, se objetivó una asociación negativa entre la DM y la prevalencia de AAA en estudios de cribado poblacional (OR 0,66 [IC 0,58 a 0,75]) y estudios prospectivos (OR 0,52 [CI 0,43 a 0,63]) pero, una vez más, no en los estudios caso-control (OR 0,48 [IC 0,20 a 1,15]). El efecto de la DM en el crecimiento anual del AAA fue de –0,60mm/año (IC –0,76 a –0,43).
En resumen, las diferentes revisiones sistemáticas y metaanálisis publicados hasta 2016 (tabla) muestran resultados concordantes en cuanto al posible efecto protector de la DM en la formación y progresión del AAA.
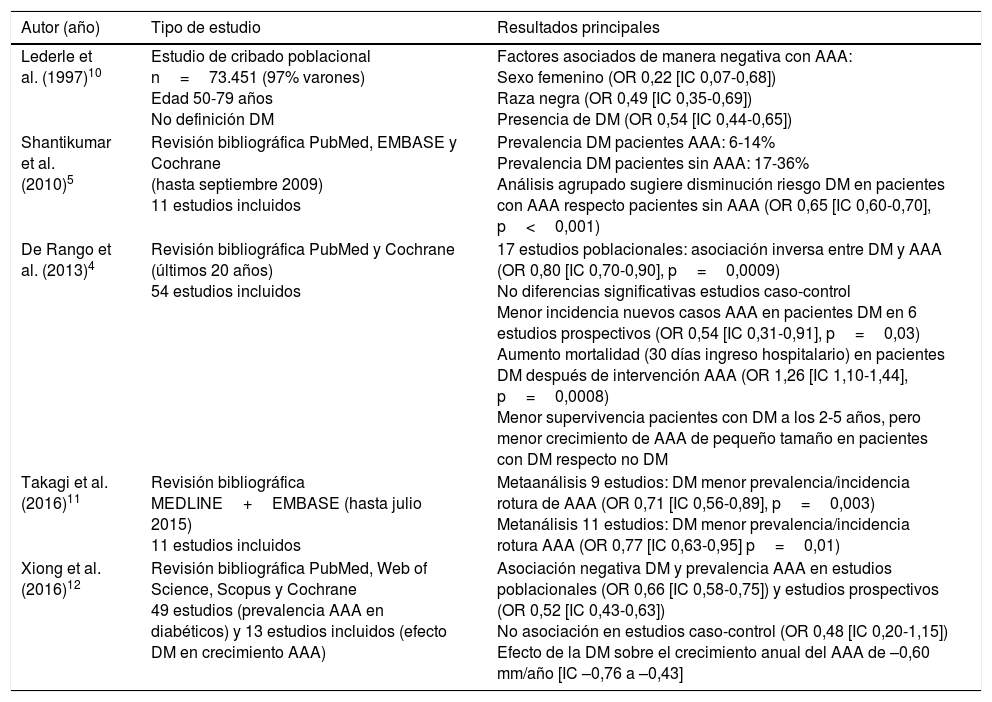
Principales estudios que evalúan el efecto de la DM sobre el AAA
| Autor (año) | Tipo de estudio | Resultados principales |
|---|---|---|
| Lederle et al. (1997)10 | Estudio de cribado poblacional n=73.451 (97% varones) Edad 50-79 años No definición DM | Factores asociados de manera negativa con AAA: Sexo femenino (OR 0,22 [IC 0,07-0,68]) Raza negra (OR 0,49 [IC 0,35-0,69]) Presencia de DM (OR 0,54 [IC 0,44-0,65]) |
| Shantikumar et al. (2010)5 | Revisión bibliográfica PubMed, EMBASE y Cochrane (hasta septiembre 2009) 11 estudios incluidos | Prevalencia DM pacientes AAA: 6-14% Prevalencia DM pacientes sin AAA: 17-36% Análisis agrupado sugiere disminución riesgo DM en pacientes con AAA respecto pacientes sin AAA (OR 0,65 [IC 0,60-0,70], p<0,001) |
| De Rango et al. (2013)4 | Revisión bibliográfica PubMed y Cochrane (últimos 20 años) 54 estudios incluidos | 17 estudios poblacionales: asociación inversa entre DM y AAA (OR 0,80 [IC 0,70-0,90], p=0,0009) No diferencias significativas estudios caso-control Menor incidencia nuevos casos AAA en pacientes DM en 6 estudios prospectivos (OR 0,54 [IC 0,31-0,91], p=0,03) Aumento mortalidad (30 días ingreso hospitalario) en pacientes DM después de intervención AAA (OR 1,26 [IC 1,10-1,44], p=0,0008) Menor supervivencia pacientes con DM a los 2-5 años, pero menor crecimiento de AAA de pequeño tamaño en pacientes con DM respecto no DM |
| Takagi et al. (2016)11 | Revisión bibliográfica MEDLINE+EMBASE (hasta julio 2015) 11 estudios incluidos | Metaanálisis 9 estudios: DM menor prevalencia/incidencia rotura de AAA (OR 0,71 [IC 0,56-0,89], p=0,003) Metanálisis 11 estudios: DM menor prevalencia/incidencia rotura AAA (OR 0,77 [IC 0,63-0,95] p=0,01) |
| Xiong et al. (2016)12 | Revisión bibliográfica PubMed, Web of Science, Scopus y Cochrane 49 estudios (prevalencia AAA en diabéticos) y 13 estudios incluidos (efecto DM en crecimiento AAA) | Asociación negativa DM y prevalencia AAA en estudios poblacionales (OR 0,66 [IC 0,58-0,75]) y estudios prospectivos (OR 0,52 [IC 0,43-0,63]) No asociación en estudios caso-control (OR 0,48 [IC 0,20-1,15]) Efecto de la DM sobre el crecimiento anual del AAA de –0,60 mm/año [IC –0,76 a –0,43] |
AAA: aneurisma aorta abdominal; DM: diabetes mellitus; IC: intervalo de confianza del 95%; OR: odds ratio.
Los mecanismos fisiopatológicos responsables de la asociación negativa entre la DM y el AAA no están aún bien definidos, por lo que a continuación presentaremos la información más relevante de los estudios in vitro e in vivo5,13.
La pared aórtica de los aneurismas presenta niveles disminuidos de colágeno y elastina debido a un aumento de la actividad proteolítica. Esta alteración está estrechamente ligada a un aumento de las enzimas proteolíticas, en concreto de las metaloproteasas (MMP). Dentro de este grupo de proteasas la MMP tipo 2 (MMP-2) de las células musculares lisas (CML) y la tipo 9 (MMP-9)14,15 que provienen de los macrófagos son las responsables de la degradación de la matriz proteica y de la pared arterial. De hecho, se han descrito niveles elevados de MMP-2 y MMP-9 en pacientes con AAA, y también se ha constatado en modelos animales deficientes en estas 2 MMP la ausencia de crecimiento de aneurismas a nivel aórtico16.
La DM promueve un aumento de la síntesis y una disminución de la degradación de la matriz extracelular, con el consiguiente menor riesgo en la formación de aneurismas13. Por otra parte, los estudios in vitro han puesto de manifiesto que la hiperglucemia incrementa la síntesis de colágeno17, con el resultante aumento de grosor de la pared aórtica y una disminución concomitante de los niveles de MMP. De hecho, el grosor de la pared aórtica de los pacientes con DM es mayor que en los pacientes sin DM, y un estudio en humanos objetivó una disminución de MMP-2 y MMP-9 en las arterias coronarias de pacientes con DM18. Por tanto, una disminución similar de estas subclases de MMP en la pared aórtica aneurismática de los pacientes con DM podría explicar el efecto negativo en el crecimiento y desarrollo del AAA.
Además, los pacientes con DM suelen presentar un estado de hiperglucemia e hiperinsulinemia. Esto conlleva a un aumento de productos de glicación avanzada en la matriz extracelular, con una unión de estos a la elastina y el colágeno de la pared arterial, promoviendo también la proliferación de las CML19,20. Todos estos cambios contribuyen a que la pared aórtica sea más firme y resistente y, por lo tanto, con un riesgo disminuido de la formación de aneurismas. Sin embargo, otros estudios han mostrado resultados contradictorios, sugiriendo que la presencia de los productos avanzados de glicación podría estar asociada a un aumento de MMP y otras citoquinas inflamatorias, y por tanto promoviendo la formación de AAA21,22.
Asimismo, las alteraciones en las CML podrían explicar, al menos en parte, la patogenia del AAA. En un estudio reciente se constataron diferencias morfológicas in vitro entre CML de pacientes con DM tipo 2 con respecto a pacientes con un metabolismo hidrocarbonado estrictamente normal23. Esto se debe a un aumento de la vinculina, proteína que une la matriz extracelular con el citoesqueleto. Este incremento de vinculina podría ser el responsable de la marcada rigidez de la pared aórtica en los pacientes con DM24, confiriendo por tanto un menor riesgo en la formación de aneurismas.
También podría desempeñar un papel esencial la alteración del sistema fibrinolítico dentro de la pared aórtica. Un estudio previo observó que el tapón fibroso en pacientes con DM estaba alterado, siendo más denso, menos poroso y más resistente a la fibrinólisis25. Es posible que la situación de hiperinsulinismo conduzca a un aumento del fibrinógeno y del inhibidor del activador del plasminógeno-1 (PAI-1), este último actuando principalmente en la inhibición de la conversión de plasminógeno a plasmina, y por tanto suprimiendo el sistema fibrinolítico. Además, la plasmina es responsable de la conversión de las pro-metaloproteasas a su forma activa, relacionada con la formación del AAA26,27. Por tanto, el aumento de niveles de PAI-1 como consecuencia de la hiperinsulinemia en los pacientes con DM podría facilitar la estabilización de la pared aórtica, previniendo la formación de aneurismas, al disminuir los niveles de MMP28.
Agentes terapéuticosSe ha especulado que el supuesto efecto protector de la DM en la formación de los AAA podría ser debido no solo a las alteraciones de los mecanismos fisiopatológicos comentados anteriormente, sino también a los fármacos utilizados para el control de los diversos factores de riesgo cardiovascular presentes en los pacientes con DM. Parece que podría existir una relación no solo en el tratamiento utilizado para la DM tipo 2, sino también con el tratamiento para la hipertensión arterial o la dislipidemia. Muchos de estos pacientes, con un riesgo cardiovascular aumentado, comparten estos 3 factores de riesgo y utilizan medicación activa para estas enfermedades.
Estudios previos ya se han centrado en este punto. Así, Thompson et al.29 en 2010 demostraron que algunos fármacos utilizados para tratar la DM tipo 2 disminuían el tamaño del AAA independientemente de la insulina. Otros estudios han mostrado resultados similares. A continuación, expondremos la evidencia que existe sobre los diversos fármacos en cuanto a su efecto en el desarrollo de aneurismas aórticos. En la figura se exponen los principales mecanismos fisiopatológicos, así como la acción de la medicación concomitante.
Medicación utilizada en la diabetes mellitus tipo 2En primer lugar, se ha descrito un posible papel protector de la metformina en el desarrollo de AAA. Dicho fármaco, considerado como de primera línea para el inicio de tratamiento farmacológico en el paciente con DM tipo 2, conlleva a una disminución del riesgo vascular en estos pacientes, pero además parece que podría desempeñar un papel complementario a nivel aórtico. Así, estudios in vitro han descrito que la metformina inhibe el efecto de la leptina sobre la proliferación de las CML y los niveles de MMP-2, con la consiguiente disminución de los niveles de MMP y una menor proliferación de CML de la pared aórtica de humanos, y por tanto impidiendo la formación de aneurismas30.
Otro grupo farmacológico terapéutico de la DM tipo 2, las tiazolidinedionas, podría desempeñar un papel en del desarrollo aneurismático. En este sentido, la rosiglitazona ha demostrado en modelos animales que disminuye los niveles de MMP-9, así como otros marcadores proinflamatorios como la proteína C reactiva31,32. Estos cambios podrían disminuir el riesgo de AAA, y de manera global desempeñar un papel importante en la reducción del riesgo cardiovascular de estos pacientes.
Otro grupo farmacológico de más reciente introducción en el tratamiento de la DM, los inhibidores del DPP-4, podrían presentar igualmente un efecto negativo en cuanto al desarrollo aneurismático. Estudios en modelos animales han objetivado una disminución en la formación y expansión del AAA al recibir tratamiento con alogliptina, siendo este efecto dosis dependiente y atribuido a un efecto antioxidante33. En otro estudio más reciente con modelos animales, la sitagliptina mostró un efecto beneficioso en la formación de aneurismas aórticos, al aumentar la actividad GLP-1, con una disminución MMP-2 y MMP-934.
Por tanto, parece que el efecto beneficioso de la DM en cuanto a la formación y progresión de los aneurismas a nivel aórtico podría estar mediado por el tratamiento farmacológico utilizado en estos pacientes, y no solo por la presencia de la DM tipo 2 por sí sola.
Medicación hipolipemiantePor lo que hace referencia al tratamiento farmacológico de la dislipidemia, las estatinas se han relacionado con un efecto negativo en la formación de aneurismas. Se han llevado a cabo varios ensayos con dichos fármacos hipolipemiantes, tanto en modelos animales como humanos, objetivando unos niveles disminuidos de MMP en la pared aórtica35, así como una disminución en la expansión del AAA, independientemente de otros factores de riesgo relacionados con el crecimiento aneurismático36.
Medicación antihipertensivaLos inhibidores de la enzima conversora de la angiotensina, fármacos ampliamente utilizados como tratamiento antihipertensivo, han demostrado que podrían desempeñar un papel protector en la formación de AAA. El principal efecto involucrado reside en una disminución en la inflamación vascular, un aumento de depósitos de elastina y una inhibición de las MMP37, aunque falta por confirmar todos los mecanismos fisiopatológicos relacionados. En los modelos animales este grupo terapéutico ha logrado una inhibición en la expansión y rotura del AAA, independientemente del efecto de estos fármacos a nivel hemodinámico para disminuir la presión arterial38.
ConclusionesGran parte de la evidencia clínica descrita en la presente revisión confirma el efecto protector de la DM en la formación y expansión del AAA. Sin embargo, estos estudios no siempre diferencian los distintos tipos de DM, factor que podría desempeñar un papel significativo en la aparente protección. Por otro lado, los estudios experimentales apuntan a que los mecanismos fisiopatológicos implicados están íntimamente relacionados con las MMP-2 y MMP-9. No obstante, la medicación concomitante para tratar la DM tipo 2, la hipertensión y la dislipidemia también podría desempeñar un papel. Por todo ello, son necesarios más estudios que evalúen el impacto de la DM, y sobre todo de la medicación concomitante en la evolución del AAA para obtener conclusiones más sólidas en este campo.
Conflicto de interesesNinguno.