Presentamos una serie de 111 citologías en portadoras de DIU, afectas de infección por Actinomyces. Sobre 99.405 citologías en 8 años, representan el 0,11%. Se comparan con un grupo control de 535 citologías.
Con Actinomyces, en 17 casos (15,3%) hubo infecciones mixtas. Con hongos, en el 6,30% y con vaginosis bacteriana,(VB) en el 6,30%. Hubo diferencias significativas en las infecciones mixtas con hongos en el grupo Actinomyces (p<0,001).
Con Actinomyces hubo inflamación en el 64,86%, reparación típica en el 17,11%, y no hubo atipias. Hubo diferencias significativas en la inflamación en el grupo Actinomyces (p<0,001). No hubo diferencias significativas en atipias o cáncer. En el grupo control hubo más atrofia de forma significativa (p<0,001), al tener un rango de más edad, con posmenopáusicas.
En conclusión, la citología con Actinomyces es más inflamatoria y hay mayor frecuencia de infecciones mixtas, con VB y hongos.
We present a series of 111 cytologies in intrauterine device (IUD) wearers with Actinomyces infection, representing 0.11%of 99,405 cytologies performed in an 8-year period. These cytologies were compared with a control group of 535 cytologies.
In the Actinomyces group, mixed infections were found in 17 cases (15.3%), with yeasts in 6.30%, and bacterial vaginosis in 6.30%. Significant differences were found in mixed infections with yeasts in the Actinomyces group (p<0.001).
Inflammation was found in 64.86%, typical repair in 17.11%, and no atypias. Significant differences were found in inflammation in this group (p<0.001). No differences were found in atypias or cancer. In the control group, there was significantly more atrophy (p<0.001) in the older age range, which included postmenopausal women.
In conclusion, a cytological finding of Actinomyces is more frequently associated with inflammation, mixed infections, bacterial vaginosis and yeasts.
Los Actinomyces pertenecen al orden actinomicetales, familia actinomicetae, género Actinomyces, y hay varias especies como Actinomyces bovis, Actinomyces israeli, Actinomyces naeslundi, etc. Son no móviles, no forman esporas, anaerobios o anaerobios facultativos, bacterias gram positivas, filamentosas, difteroides, y que responden a la terapéutica antibiótica1.
Los Actinomyces se dan con el dispositivo intrauterino (DIU), desde 6 meses a 13 años, pero con una media de 2–5 años. Se produce una leucorrea marrón, oscura y maloliente. Hay síntomas en 1/4 casos. Hay un patrón de inflamación variable. Pero el riesgo es que puede dar enfermedad inflamatoria pélvica (EIP), pelvis leñosa y abscesos tuboováricos (ATO), y también abscesos hepáticos.
Los Actinomyces son bacterias saprofitas, en la cavidad oral, criptas amigdalinas. Afectan al tracto digestivo, el apéndice. No hay diseminación hematógena, y la vía linfática es excepcional. La actinomicosis pélvica puede ser grave2. Cursa con dolor abdominal, el 64%, en una serie de 22 casos entre 1979 y 1998, en mujeres de 24–58 años. El retraso en el diagnóstico puede ser de semanas a años. Hubo tratamiento quirúrgico en el 82%, con resección de ATO, apendicectomía, drenajes, tratamiento de la obstrucción intestinal, histerectomía, y antibióticos (penicilina), durante tiempo prolongado.
En otra serie de actinomicosis pélvica3, se presentan 5 casos del año 2002, de 35–52 años (media de 41,4 años), con DIU de 4–9 años. La infección por Actinomyces se extiende por los planos anatómicos, y da abscesos y tractos fibrosos. Hubo dolor abdominal en el 85%, fiebre en el 60%, pérdida de peso en el 44% y leucorrea en el 24%. Hay que hacer cultivos. Y pensar en el diagnóstico. También pensar en cáncer de ovario, hacer tomografía axial computadorizada para ver la extensión, y resonancia magnética nuclear. En primer lugar, tratar con penicilina y luego la intervención: drenaje de abscesos y tratar la obstrucción. Hoy se tiende a ser más conservador, pero la infección puede ser grave.
La actinomicosis pélvica es rara, pero la infección por Actinomyces en la citología no, en portadoras de DIU. El autor4 ya estudió este tema, con una serie de 25 casos en 1 año. La prevalencia sobre 4.939 citologías fue del 0,50%, y sobre 274 DIU fue del 10,12%. La edad media de las pacientes fue de 31 años. El 80% estaban asintomáticas. La citología fue muy inflamatoria en el 44%, y hubo atipias reactivas en el 24%. Se retiró el DIU en el 40% de los casos. La citología es un buen método diagnóstico.
La citología hace el diagnóstico práctico de las infecciones más frecuentes, y tiene valor para el diagnóstico de la infección vaginal, aunque menor que el cultivo, que es el que identifica el germen, pero tiene más coste5. Con el diagnóstico citológico según la clasificación de Bethesda y la tinción de Papanicolaou sobre 562 citologías cervicovaginales, se detectó infección en 69 casos (12,27%). La sensibilidad fue del 44%, la especificidad del 90%, el valor predictivo positivo (VPP) del 36% y el valor predictivo negativo del 93%.
En este trabajo estudiamos los Actinomyces en la citología cervicovaginal en portadoras de DIU, haciendo especial referencia a las infecciones mixtas.
Material y métodosEn el Servicio de Anatomía Patológica del Hospital Arnau de Vilanova de Valencia, durante los 8 años (2001–2008) se han estudiado 99.405 citologías cervicovaginales. De ellas, 111 estaban afectas de infección por Actinomyces, el 0,11%, en portadoras de DIU.
Se comparan con un grupo control de citologías correspondientes al año 2007, en el período del 1 al 18 de enero, recogiendo 541 casos. En este grupo se excluyen 6 casos que eran citologías endometriales, por lo que el grupo control queda en 535 casos. Este grupo no era de portadoras de DIU, excepto un caso.
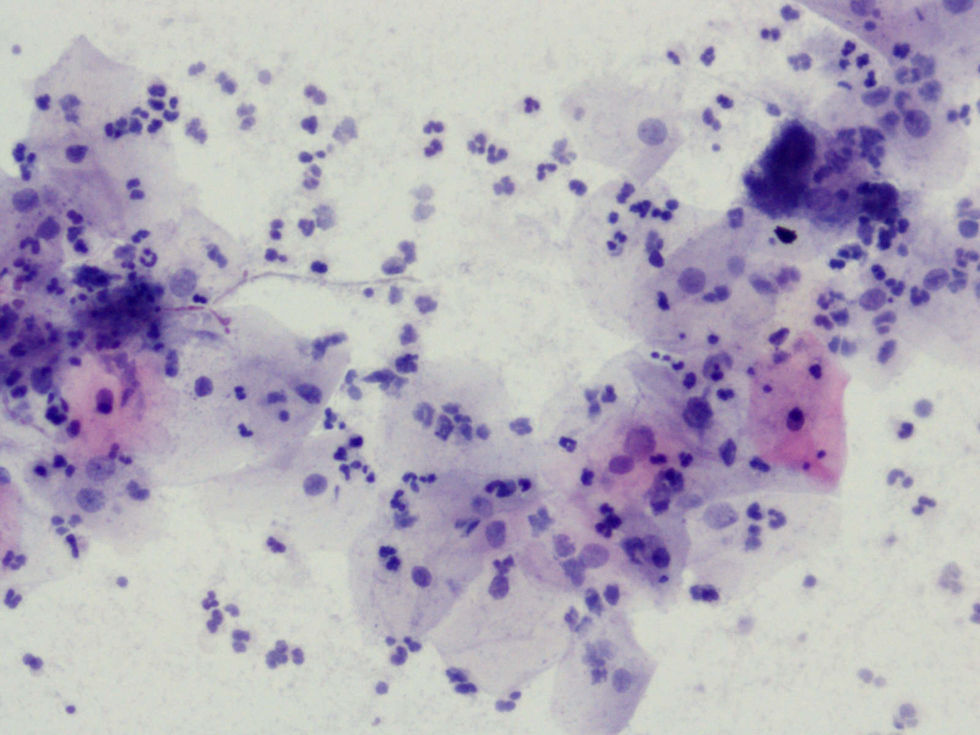
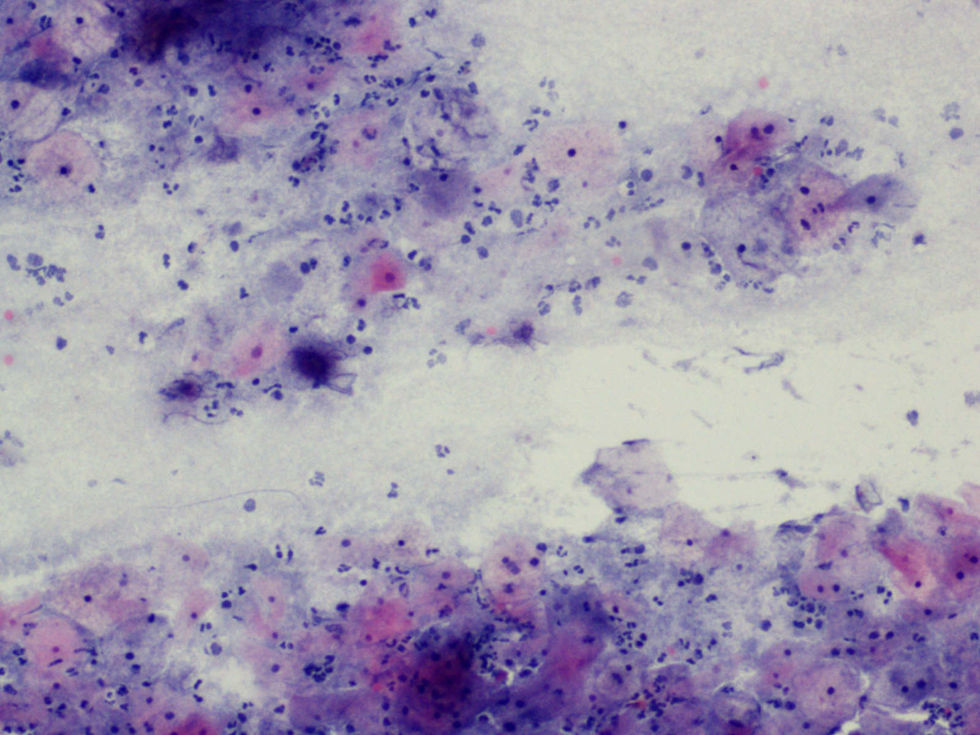
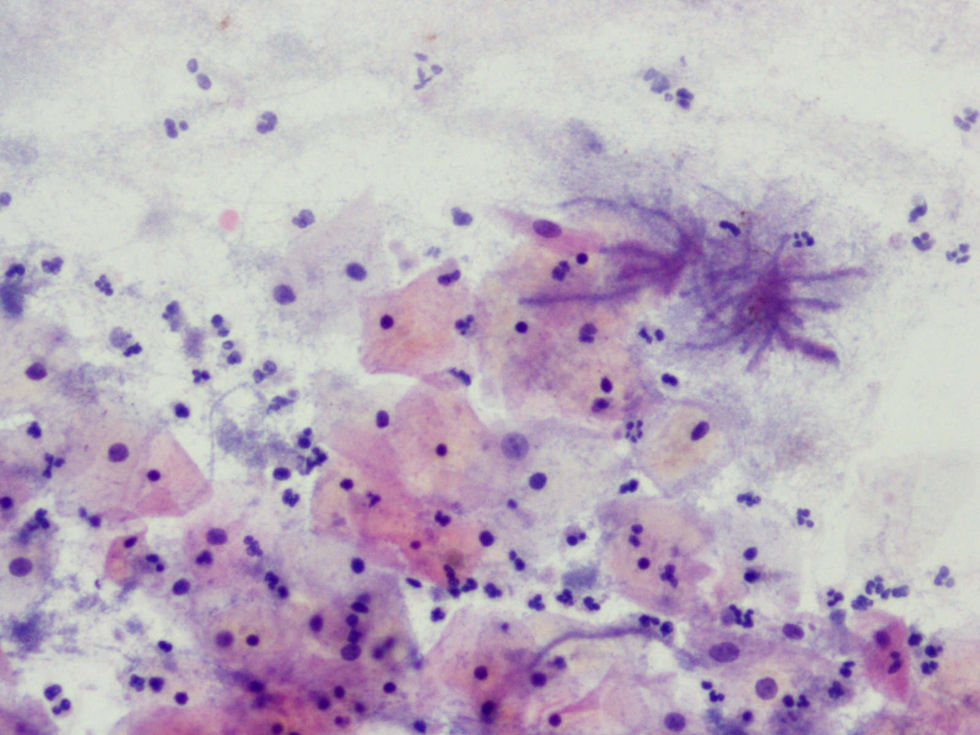
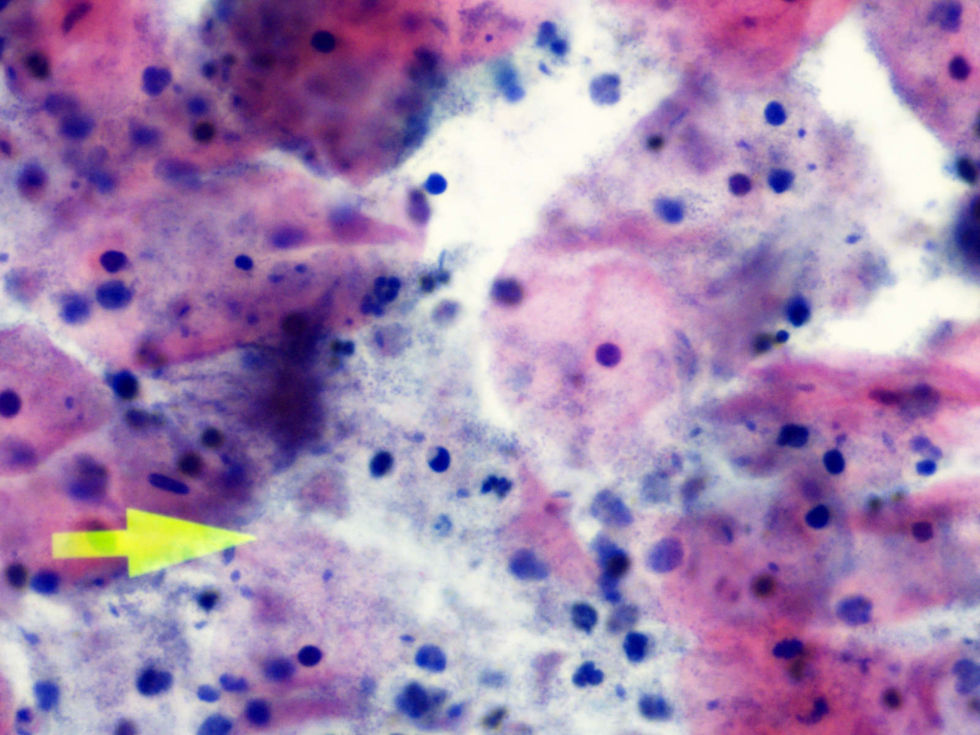
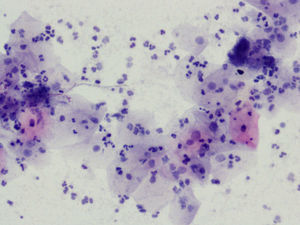
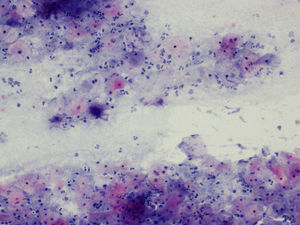
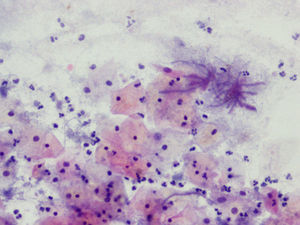
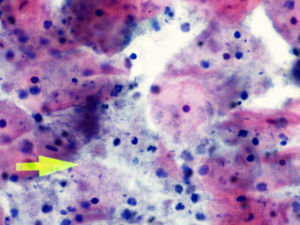
La tinción empleada en todos los casos ha sido la tinción de Papanicolaou. Los criterios utilizados para el diagnóstico de infección por Actinomyces4 han sido fundamentalmente dos: la visualización de conglomerados basófilos con una porción central oscura, de donde emergen de forma radial formaciones filamentosas que se ramifican en ángulo agudo, extendiéndose más allá de los límites de estos conglomerados. Y dos, la detección de formas filamentosas ramificadas aisladas, en las cuales se observa un eje central con bacilos dispuestos perpendicularmente dando el típico aspecto de «cola de rata». Otros criterios, como la presencia de granos de azufre, no han sido tenidos en cuenta si se visualizaban de forma aislada, dado que no son específicos de esta infección.
El diagnóstico diferencial debe hacerse con la presencia de infecciones en las que existan formas filamentosas como: Candida, Aspergillus, Nocardia, Leptothrix y bacilos de Döderlein filamentosos.
En el estudio estadístico, se expresan los datos cuantitativos como rango, media y desviación standard. Los datos cualitativos se expresan en porcentajes. Para la comparación de medias se utiliza la t de Student. Para la comparación de datos cualitativos se utiliza el test de Pearson del X2 (chi cuadrado), siempre con un nivel de significación del 95%, p<0,05.
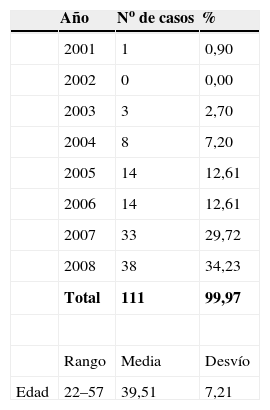
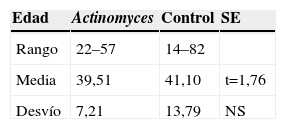
ResultadosEn la tabla 1 se presenta la distribución de citologías afectas de infección por Actinomyces, en los años 2001–2008. Son 111 en total. Sobre 99.405 citologías, representa el 0,11%. La edad del grupo estudio, entre 22 y 57 años, con una media de 39,51 años.
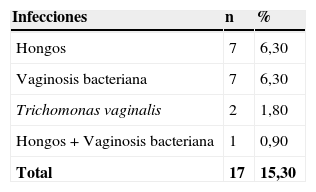
En la tabla 2 se presentan las infecciones mixtas con Actinomyces, el objetivo del estudio. En total son 17 (15,3%). En 7 casos con hongos, en 7 casos con vaginosis bacteriana (VB), en 2 casos con Trichomonas y en un caso asociada a hongos y a VB. En las figuras 1–4 mostramos varios ejemplos.
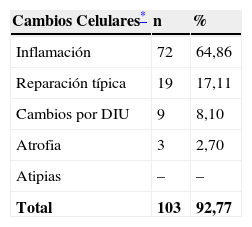
En la tabla 3 se expresan los cambios celulares en la citología con Actinomyces. Así, los cambios pueden ser varios en una misma citología. Y se han considerado inflamación, 72 casos (64,86%); reparación típica, 19 casos (17,11%); cambios por el DIU (todas son portadoras), en 9 casos (8,10%), y atrofia, en 3 casos (7,70%). No hubo presencia de atipias.
Cambios celulares en la citología con Actinomyces
| Cambios Celulares* | n | % |
| Inflamación | 72 | 64,86 |
| Reparación típica | 19 | 17,11 |
| Cambios por DIU | 9 | 8,10 |
| Atrofia | 3 | 2,70 |
| Atipias | – | – |
| Total | 103 | 92,77 |
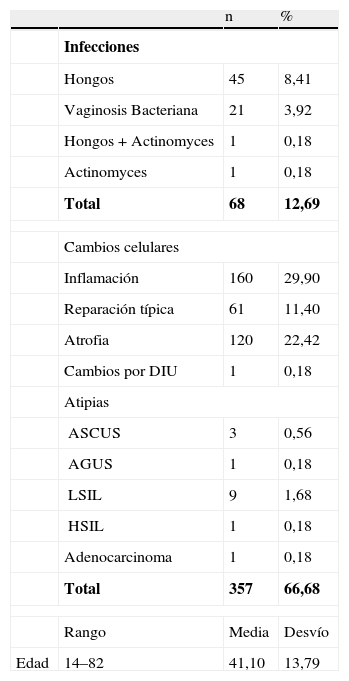
En la tabla 4, correspondiente al grupo control, se expresan la edad media, de 41,10 años, entre 14 y 82 años.
Grupo control; n=535
| n | % | ||
| Infecciones | |||
| Hongos | 45 | 8,41 | |
| Vaginosis Bacteriana | 21 | 3,92 | |
| Hongos + Actinomyces | 1 | 0,18 | |
| Actinomyces | 1 | 0,18 | |
| Total | 68 | 12,69 | |
| Cambios celulares | |||
| Inflamación | 160 | 29,90 | |
| Reparación típica | 61 | 11,40 | |
| Atrofia | 120 | 22,42 | |
| Cambios por DIU | 1 | 0,18 | |
| Atipias | |||
| ASCUS | 3 | 0,56 | |
| AGUS | 1 | 0,18 | |
| LSIL | 9 | 1,68 | |
| HSIL | 1 | 0,18 | |
| Adenocarcinoma | 1 | 0,18 | |
| Total | 357 | 66,68 | |
| Rango | Media | Desvío | |
| Edad | 14–82 | 41,10 | 13,79 |
AGUS: atipia glandular de significado incierto; ASCUS: atipias de significado incierto; DIU: dispositivo intrauterino; HSIL: lesión escamosa de alto grado; LSIL: lesiones escamosas de bajo grado.
Las infecciones: por hongos en 45 casos (8,41%); por VB, en 21 casos (3,92%); por hongos y Actinomyces, en 1 caso (0,18%), la única infección mixta. Y en 1 caso (0,18%), infección por Actinomyces. En total, 68 casos (12,71%).
Los cambios celulares fueron inflamación en 106 casos (29,90%); reparación típica en 61 casos (11,40%); atrofia en 110 casos (22,42%), y cambios por el DIU, en 1 caso (0,18%). Pero hay atipias en 14 casos: 3 atipias de significado incierto (0,56%); 1 atipia glandular de significado incierto (0,18%); 9 lesiones escamosas de bajo grado (1,68%) y 1 lesión escamosa de alto grado (0,18%). También un caso de adenocarcinoma (0,18%).
En la tabla 5 se compara la edad de ambos grupos, no encontrando diferencias significativas. Aunque en el grupo control, al ser de ginecología general, el rango de edades es mayor.
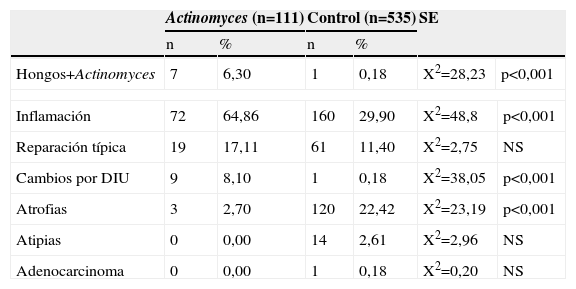
En la tabla 6 se comparan las infecciones mixtas y los cambios celulares. Respecto a las infecciones mixtas, sólo se comparan hongos+Actinomyces, siendo 7 versus 1 caso, con diferencias significativas, p<0,001. En el grupo Actinomyces, hay más infecciones mixtas, como hemos visto en la tabla 2, y hay más infección con hongos que en el grupo control.
Comparativa infecciones mixtas y cambios celulares
| Actinomyces (n=111) | Control (n=535) | SE | |||||
| n | % | n | % | ||||
| Hongos+Actinomyces | 7 | 6,30 | 1 | 0,18 | X2=28,23 | p<0,001 | |
| Inflamación | 72 | 64,86 | 160 | 29,90 | X2=48,8 | p<0,001 | |
| Reparación típica | 19 | 17,11 | 61 | 11,40 | X2=2,75 | NS | |
| Cambios por DIU | 9 | 8,10 | 1 | 0,18 | X2=38,05 | p<0,001 | |
| Atrofias | 3 | 2,70 | 120 | 22,42 | X2=23,19 | p<0,001 | |
| Atipias | 0 | 0,00 | 14 | 2,61 | X2=2,96 | NS | |
| Adenocarcinoma | 0 | 0,00 | 1 | 0,18 | X2=0,20 | NS | |
DIU: dispositivo intrauterino; NS: no significativo; SE: significación estadística.
Respecto a los cambios celulares, hay diferencias significativas en inflamación (p<0,001) y cambios por DIU (p<0,001) en el grupo Actinomyces. En el grupo control hay diferencias significativas en atrofia (p<0,001), dado que en este grupo el rango de edades es mayor, y hay más mujeres posmenopáusicas.
No hay diferencias significativas en atipias ni en cáncer. Aunque, como hemos visto en la tabla 4, en el grupo control hay 14 casos de atipias y 1 caso de adenocarcinoma, lo normal en un grupo de población general.
Como conclusiones de estos resultados, diremos:
- 1)
En el grupo Actinomyces hay más infecciones mixtas y más infecciones con hongos (p<0,001) que en el grupo control.
- 2)
Hay diferencias significativas en inflamación (p<0,001) en el grupo Actinomyces.
- 3)
No hay casos de atipias ni de cáncer con Actinomyces.
Los Actinomyces es una infección de origen orogenital. El sexo oral, felación y cunnilingus llevan los Actinomyces de la cavidad oral, su reservorio, a los genitales1. Los Actinomyces pueden estar asociados a otros gérmenes como hongos y amebas.
En la citología de Papanicolaou, los Actinomyces se ven como agregados basófilos, pueden ser pequeños y sin infiltrado leucocitario, o grandes, como islas de material amorfo, con gran infiltrado leucocitario, corazón central del que parten los filamentos radiados6. En una serie de 300 citologías en portadoras de DIU, la incidencia total fue del 19,7%. En otra serie de 36 casos7 hubo 9 que desarrollaron EIP, el 25%.
Los Actinomyces son importantes porque pueden dar complicaciones. Por el sexo oral, coito rectal y vaginal, el organismo llega al cérvix. Si hay DIU puede dar endometritis, EIP y ATO8. Con DIU y menorragia, o sangrado anormal, leucorrea, fiebre, dispareunia, dolor abdominal o pélvico, estudiar el caso, retirar el DIU y hacer cultivo. Porque puede haber complicaciones y secuelas: fiebre postoperatoria, síntomas de menopausia, candidiasis, abscesos intraperitoneales, formación de fístulas, infección pélvica, absceso subfrénico, esterilidad y muerte.
Los Actinomyces dan infección con cuerpo extraño, y tienen existencia simbiótica con otros organismos anaerobios. Los DIU de plástico predisponen a la colonización de Actinomyces tras largo tiempo de uso. En cambio, el cobre es bacteriostático. En una serie de 293 citologías con DIU9, en la citología con Actinomyces hubo 5 veces más inflamación. En otra serie de 1.919 citologías de Planificación Familiar, con DIU hubo Actinomyces en 3810, el 25% de 147 citologías con DIU. No hubo evidencia de infección pélvica, pero aumentaron las células atípicas (en 22 casos) y discarióticas (en 7 casos), p<0,001.
En un estudio11 en 100 mujeres de 18–45 años, media de 22,7 años (94 sin DIU), con citología y anticuerpos por inmunofluorescencia para detectar A. israeli y Arachnia propionica, que son componentes de la flora normal de la boca y tracto gastrointestinal, no se detectaron, lo que demuestra que no son componentes habituales de la flora vaginal.
En un estudio en India, en 350 mujeres con DIU, hubo 12 Actinomyces12. Se confirmó con inmunofluorescencia en 10 casos, la prevalencia fue del 2,8%. El contacto orogenital es poco frecuente en la India, aquí ningún caso. Otro mecanismo sería la ruta ascendente desde el periné.
En otro estudio13 sobre 1.784 mujeres y citologías, en 815 con DIU hubo 57 positivos para Actinomyces, con una prevalencia del 6,99%. Con inmunofluorescencia, A. israeli se detectó en 57 casos, y en 40 cultivos, A. israeli fue positivo en 23 casos. El uso prolongado del DIU (>2 años) promueve el crecimiento de Actinomyces en la vagina, y se detecta en la citología. Además, promueve la invasión pélvica de otros gérmenes como Escherichia coli, estreptococos anaerobios, etc. Pero hay mayor riesgo a partir de los 5 años de llevar el DIU14. Por ello se recomienda quitar el DIU15, es efectivo para evitar la colonización con Actinomyces, y tiene efecto protector. La colonización con Actinomyces continúa si no se retira el DIU, y más a más tiempo del DIU. A 24 meses, el riesgo relativo (RR)=2; a 36 meses, el RR=2,16, y a 48 meses, el RR=2,66. La citología posterior a la retirada del DIU fue negativa para Actinomyces en el 100% (p< 0,005).
Los Actinomyces tienen bajo potencial de virulencia. La enfermedad es con barreras mucosas alteradas, por trauma, cirugía o inflamación–infección, y en condiciones de baja presión tisular de O216.
Hay fluctuaciones estacionales en las enfermedades y hay verdaderos ritmos de detección17. El ritmo es una característica de la vida. Se ha estudiado en las infecciones y en el cáncer o lesiones premalignas. Así, en invierno es alta la detección de Trichomonas y Actinomyces. Y en verano, el virus del papiloma humano (VPH), displasias y cáncer. Los factores que influirían serían el ritmo endógeno, los cambios del ambiente (temperatura y humedad), la conducta sexual, los factores generales de salud, la interacción germen-huésped y los factores inmunológicos.
La vaginitis es un síndrome complejo, y es la enfermedad más frecuente para el ginecólogo18. Se da en 1/3 mujeres. Es importante, porque la vaginitis recurrente en la mujer altera su vida sexual y le produce depresión. En las vaginitis no específicas se incluyen Gardnerella vaginalis, la vaginitis por anaerobios, y la vaginitis indeterminada19.
La G. vaginalis es anaerobio facultativo, no forma esporas, no encapsulado, no móvil, pleomórfico, cocos gram variables (pero se considera gram negativo). La G. vaginalis puede ser flora vaginal endógena y prerrequisito para VB. La VB es G. vaginalis+anaerobios. La G. vaginalis es marcador de presencia de anaerobios anormales en la vagina o de sobrecrecimiento de anaerobios, o bien alterando el medio vaginal permite el crecimiento de los anaerobios, y se da la VB20.
Hay diferencias epidemiológicas entre las infecciones por Candidas y Trichomonas21. La infección por Trichomonas es una enfermedad de transmisión sexual, una infección venérea, y está relacionada con las condiciones socioeconómicas y la higiene personal. En cambio, las candidiasis, no. Los factores de riesgo para Trichomonas son: a) más de una pareja sexual (odds ratio [OR]=5,07; p=0,01; b), educación primaria o analfabeta (OR=1,86; p=0,05), y c) mala higiene (OR=1,46; p=0,05). El condón protege de las Trichomonas (OR=3,8; p=0,05).
Respecto a las infecciones mixtas, hay asociación a Actinomyces de cocobacilos o VB, y de Trichomonas1.
En un estudio en población de bajo nivel socioeconómico, en Sudáfrica22, con 208 mujeres de 16–52 años, media de 26,10 años, hubo infección vaginal en 104 (50%), infección endocervical en 18 (9%), y ambas en 41 (20%). La VB en 73 (35%). Es una alta prevalencia, de VB sola o en coinfección, que predispone a infecciones ascendentes y a complicaciones del embarazo (rotura prematura de membranas, parto pretérmino, endometritis). Hubo VB+Trichomonas en el 41%; VB+Candidas en el 22%; VB+gonorrea en el 14% y VB+clamidia en el 16%. Son prevalencias mucho mayores que en los países desarrollados. Aquí, se necesita programa de screening, y tratamiento adecuados.
En cambio, en los países desarrollados hay mujeres que se creen en salud y tienen infecciones genitales por uno o más agentes. Muchas infecciones de transmisión sexual son asintomáticas y en estado de portador. Hay necesidad de excluirlas. Los VPP para síntomas específicos y signos son generalmente bajos (<20%)23. En un estudio con 996 mujeres sanas, 494 tenían infección genital y 112 (22,7%) infección mixta. Con clamidia y VPH, el mal olor de la secreción es significativo. En los condilomas son significativos la disuria y el dolor abdominal bajo. Con las Candidas, la leucorrea, el eritema superficial y las ulceraciones y fisuras, son significativas. Con una doble infección, hay más síntomas y signos.
El diagnóstico clínico de la infección vaginal es inadecuado, y el cuidado o tratamiento es subóptimo24. En una serie de 67 mujeres de 18–45 años, media de 33,5 años, con diagnóstico de infección, hubo Candidas en 26 (38,8%); VB en 18 (26,8%); Trichomonas en 3 (4,5%), e infecciones mixtas en 20 (29,9%). La seguridad del diagnóstico clínico fue del 43,2% (con síntomas, observación directa, leucorrea homogénea, pH >4,5 y prueba de KOH al 10%). Pero con test microbiológicos, la correlación con el diagnóstico clínico fue en 17/39 casos del 43,6%. El diagnóstico clínico no es adecuado, hay que confirmarlo con el estudio microbiológico.
Respecto al tratamiento, interesan los tratamientos minuto, de dosis mínimas y únicas, y más cuando hay infecciones mixtas, que se dan en el 38%25. Con la combinación de dos fármacos hubo curación microbiológica en el 82–86% para VB+Trichomonas. En las infecciones mixtas hay que comprobar la erradicación microbiológica.
Finalmente, en nuestro trabajo, sobre 111 casos de Actinomyces en la citología en portadoras de DIU, hubo infección mixta en 17 casos (15,3%). La más frecuente asociación fue con hongos en el 6,30% y con VB en el 6,30%. También con Trichomonas en el 1,80%. Al compararlas con el grupo control, Actinomyces+hongos hay diferencias significativas, p<0,001.
Los cambios celulares en la citología, inflamación en el 64,86%, reparación típica en el 17,11%. No hubo atipias. En el grupo control hubo diferencias significativas en inflamación (p<0,001), no en atipias ni en cáncer. La conclusión es que con Actinomyces hay una citología mucho más inflamatoria, y hay mayor frecuencia de infecciones mixtas, sobre todo por hongos y VB.