Determinar las concentraciones de colesterol, triglicéridos (TG), lipoproteínas de baja densidad (LDL) y lipoproteínas de alta densidad (HDL) en menopáusicas tratadas con raloxifeno luego de 3 meses de tratamiento.
MétodoSe seleccionaron 45 mujeres menopáusicas que fueron tratadas con 60mg/día de raloxifeno oral por 3 meses y se determinaron las concentraciones de colesterol, TG, LDL y HDL.
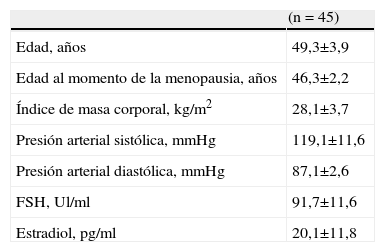
ResultadosLa edad promedio de las menopáusicas fue de 49,3±3,9 años y el promedio del índice de masa corporal de 28,1±3,7kg/m2. Las concentraciones de FSH y estradiol fueron de 91,7±11,6Ul/ml y 20,1±11,8pg/ml, respectivamente. Las concentraciones de colesterol (231,3±36,8mg/dl al inicio y 216,5±21,3mg/dl luego de 3 meses) y LDL (154,6±11,2mg/dl al inicio y 138,9±14,6mg/dl luego de 3 meses) presentaron disminuciones significativas (del 6% y del 10%, respectivamente) luego de 3 meses del uso de raloxifeno (p<0,05). No se encontraron modificaciones significativas en las concentraciones de TG y HDL luego del uso de raloxifeno (p=ns).
ConclusiónEl uso de raloxifeno en menopáusicas produce disminuciones significativas en las concentraciones de colesterol y LDL, sin modificar las concentraciones de TG y LDL, luego de 3 meses de tratamiento.
To determine cholesterol, triglyceride, low-density lipoprotein (LDL) and high-density lipoprotein (HDL) concentrations in postmenopausal women treated with raloxifene after 3 months of treatment.
MethodsForty-five postmenopausal women were treated with 60mg/day of oral raloxifene for 3 months. Cholesterol, triglyceride, LDL, and HDL concentrations were assessed.
ResultsThe mean age of the postmenopausal women was 49.3±3.9 years and the mean body mass index was 28.1±3.7Kg/m2. Follicle-stimulating hormone and estradiol concentrations were 91.7±11.6UI/ml and 20.1±11.8pg/ml, respectively. Cholesterol (231.3±36.8mg/dl at baseline and 216.5±21.3mg/dl after 3 months) and LDL concentrations (154.6±11.2mg/dl at baseline and 138.9±14.6mg/dl after 3 months) were significantly reduced (6% and 10%, respectively) after 3 months of raloxifene use (p<0.05). There were no significant variations in triglycerides or HDL concentrations after raloxifene use (p=ns).
ConclusionRaloxifene use in postmenopausal women significantly reduces cholesterol and LDL concentrations without modifying triglyceride and LDL concentrations after 3 months of treatment.
Las alteraciones metabólicas observadas posteriormente al cese de la función ovárica son importantes en el desarrollo de las enfermedades cardiovasculares. Los potenciales cambios proaterogénicos en el perfil lipídico asociados a la menopausia incluyen: incremento sérico en las lipoproteínas de baja densidad (LDL-C) y disminución en la concentración de lipoproteínas de alta densidad (HDL-C)1. La terapia de reemplazo hormonal con estrógenos solos produce disminuciones clínicamente importantes en las concentraciones de LDL-C, mientras que incrementan los niveles de HDL-C2. Además, los estudios observacionales indican que la terapia de reemplazo hormonal a largo plazo está asociada a una reducción de aproximadamente el 50% en la incidencia de la enfermedad cardiovascular arteriosclerótica3,4.
Un gran número de menopáusicas enfrenta en la actualidad un difícil dilema: ¿deben o no utilizar la terapia de reemplazo hormonal convencional? Los estrógenos utilizados para proteger de la osteoporosis y la enfermedad cardiaca coronaria pueden incrementar el riesgo de cáncer de mama y endometrio5. Los estrógenos no son el tratamiento ideal, por lo que se ha buscado el desarrollo de medicamentos que tengan efectos estrogénicos en algunos tejidos, como el hueso y el sistema cardiovascular6,7. Esta selectividad por los tejidos es biológicamente posible debido a la conformación de complejos entre las drogas y los receptores de estrógeno que determinan la respuesta particular de la célula en la cual actúan. Potencialmente, estos fármacos pueden tener los mismos beneficios que el uso de estrógenos. Luego de los resultados del Estudio de Iniciativa de Salud para las Mujeres (WHI por sus siglas en inglés), se ha colocado un nuevo énfasis sobre las alternativas al tratamiento con terapia hormonal de reemplazo convencional para el manejo de las osteoporosis y la enfermedad cardiovascular8.
El raloxifeno, un derivado benzotiofeno, ha sido clasificado como un modulador selectivo de los receptores de estrógenos y tiene efectos benéficos sobre el hueso y algunos factores de riesgo cardiovascular (en especial el metabolismo lipídico y algunos marcadores inflamatorios)9,10 y también tiene efectos antiestrogénicos sobre las mamas y el útero11. Administrado a menopáusicas sanas por un periodo de 2 años suprime el recambio óseo a un rango premenopáusico normal, incrementa la densidad mineral ósea en la columna y la cadera sin estimular la proliferación del endometrio12. Los resultados de varias investigaciones indican que el tratamiento con raloxifeno disminuye la incidencia de nuevas fracturas vertebrales comparado con menopáusicas tratadas con placebo por 3 años13.
Además de los efectos sobre el metabolismo óseo, el tratamiento con raloxifeno está asociado a la disminución consistente de los marcadores de riesgo para la enfermedad cardiovascular, incluyendo la disminución de la concentración de LDL-C, colesterol y triglicéridos (TG), que conlleva la reducción significativa en el riesgo de aparición de eventos cardiovasculares en mujeres con riesgo cardiovascular elevado11–14. Aunque se han reportado los efectos del tratamiento del raloxifeno a largo plazo, son pocos los datos disponibles sobre los efectos del uso de raloxifeno a corto plazo sobre los lípidos.
El objetivo fue determinar las concentraciones de lípidos y lipoproteínas en menopáusicas tratadas con raloxifeno luego de 3 meses de tratamiento.
MétodoLa muestra fue de 45 menopáusicas que fueron tratadas con raloxifeno como terapia hormonal de reemplazo. Se incluyeron mujeres con menopausia natural con por lo menos 1 año de evolución, con concentraciones de FSH superiores a 35Ul/ml y estradiol (E2) menor de 30pg/ml que acudieron a la Consulta de Menopausia del Hospital Central Dr. Urquinaona. Se excluyeron todas las mujeres con antecedentes familiares o personales de alergia al raloxifeno, que consumieran cualquier medicamento que alterara la coagulación, fibrinólisis, metabolismo lipídico u óseo. Ninguna de las menopáusicas tenía historia familiar o personal de alteraciones lipídicas o glucémicas. La investigación fue aprobada por el Comité de Ética e Investigación del Hospital.
Antes del inicio del estudio se obtuvo el consentimiento por escrito de todas las mujeres, luego se les realizaron las determinaciones de las concentraciones de FSH y E2 sérico para confirmar el estado menopáusico. Las concentraciones séricas de colesterol, TG, HDL-C y LDL-C se determinaron antes del inicio del tratamiento y luego de tres meses del uso de E2 acetato de nortisterona oral o E2 transdérmico.
Después de un ayuno de 12h se tomó una muestra de la vena antecubital con las mujeres en posición sentada. La muestra de suero se almacenó a -201 ºC antes del ensayo. El colesterol total y los TG se midieron usando procesadores enzimáticos automáticos en un analizador de acceso al azar. La concentración de HDL-C se determinó después de una precipitación selectiva usando manganeso-heparina posterior a la determinación enzimática de colesterol. La concentración de LDL-C se calculó usando la fórmula de Friedwald.
Los valores se expresaron como valores absolutos y relativos. Los datos se presentan en tablas. Para comparar las concentraciones iniciales y después de seis meses de tratamiento en las concentraciones séricas de colesterol, TG, HDL-C, LDL-C y lipoproteína (a) se utilizó el test de la t de Student para muestras relacionadas. El porcentaje de cambio (en comparación con el inicio) en las concentraciones del parámetro se calculó como: [(concentración 6 meses)−(concentración inicial)/(concentración inicial)]×100. Se consideró una p<0,05 como estadísticamente significativa.
ResultadosLas características generales de las 45 menopáusicas seleccionadas para el estudio se muestran en la tabla 1. La edad promedio fue de 49,3±3,9 años y el promedio del índice de masa corporal de 28,1±3,7kg/m2. Las concentraciones de FSH y E2 fueron de 91,7±11,6Ul/ml y de 20,1±11,8pg/ml, respectivamente.
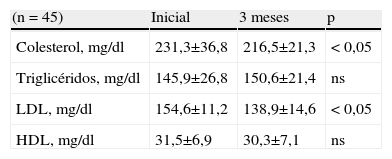
En la tabla 2 se muestran las concentraciones de colesterol, TG, LDL-C y HDL-C antes y después de 3 meses de tratamiento. El valor inicial de colesterol fue de 231,3±36,8mg/dl, que luego de 3 meses de tratamiento presentó una disminución significativa de más del 6% para alcanzar un valor de 216,5±21,3mg/dl (p<0,05). Con respecto a las concentraciones de TG, los valores iniciales y a los 3 meses de tratamiento fueron de 145,9±26,8 y de 150,6±21,4mg/dl, respectivamente. Este aumento fue de aproximadamente el 3% y se consideró no significativo (p=ns).
Lípidos y lipoproteínas séricas antes y después de seis meses de tratamiento
| (n = 45) | Inicial | 3 meses | p |
| Colesterol, mg/dl | 231,3±36,8 | 216,5±21,3 | < 0,05 |
| Triglicéridos, mg/dl | 145,9±26,8 | 150,6±21,4 | ns |
| LDL, mg/dl | 154,6±11,2 | 138,9±14,6 | < 0,05 |
| HDL, mg/dl | 31,5±6,9 | 30,3±7,1 | ns |
HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; ns: no significativo.
Al analizar las concentraciones de LDL-C (tabla 2), se observó que el valor inicial fue de 154,6±11,2mg/dl. Luego de 3 meses se observó una disminución de los valores superiores al 10% para alcanzar una concentración promedio de 138,9±14,6mg/dl, la cual fue considerada como significativa (p<0,05). Con relación a las concentraciones de HDL-C, los valores promedio iniciales fueron de 31,5±6,9mg/dl, sufriendo una disminución cercana al 4% de su valor inicial para alcanzar un valor promedio a los 3 meses de 30,3±7,1mg/dl. Esta disminución tampoco se consideró significativa (p=ns).
DiscusiónEl uso de raloxifeno, un modulador selectivo de los receptores de estrógeno, como terapia hormonal de reemplazo produce disminuciones significativas en las concentraciones plasmáticas de colesterol y LDL-C, sin producir modificaciones significativas en las concentraciones de TG y HDL-C luego de 3 meses de uso.
Los efectos del raloxifeno sobre los TG plasmáticos se han reportado como neutrales 12–16. La mayoría de los estudios han reportado que no se producen cambios en la concentración de TG con el uso de raloxifeno, pero esos estudios en su mayoría han excluido a mujeres con diabetes insulinodependiente, las cuales son más susceptibles de sufrir hipertrigliceridemia11. Pero otras investigaciones han descrito incrementos significativos en las concentraciones de TG17. Se ha reportado que el aumento de los TG en mujeres que utilizan estrógenos equinos conjugados puede ser influido por el aumento de la apolipoproteína B18. Pero se ha demostrado que las mujeres con hipertrigliceridemia previa al tratamiento o diabetes no presentan aumentos significativos en las concentraciones de TG posteriores al uso de raloxifeno, tanto por cortos como por largos periodos11.
Mientras que el raloxifeno y los estrógenos tienen diferentes efectos sobre el metabolismo óseo, tienen patrones diferentes de efectos sobre los lípidos plasmáticos. Se ha reportado que el raloxifeno no tiene efecto sobre las concentraciones de HDL-C (como se encontró en esta investigación) y la apolipoproteína A1, mientras que los estrógenos aumentan las concentraciones de ambas moléculas7,8,19. Los estrógenos producen un incremento sustancial en las concentraciones de TG, mientras que los efectos del raloxifeno observados en la presente investigación sobre la concentración de TG demostraron ser escasos.
Existen hallazgos similares sobre los efectos lípidicos del raloxifeno y el citrato de tamoxifeno, el otro modulador de los receptores estrogénicos ampliamente utilizado en la práctica clínica20–22. Debido a que las diferentes investigaciones son difíciles de comparar, el porcentaje de cambio que produce cada uno de los medicamentos puede no ser directamente comparable entre las diferentes muestras estudiadas. Sin embargo, esos estudios demuestran que el tamoxifeno y el raloxifeno producen efectos similares sobre los lípidos plasmáticos y estos efectos son menores a los descritos para los estrógenos6,20–22. La igualdad de los efectos para raloxifeno y tamoxifeno es útil debido a que los cambios producidos pueden ser responsables de su aparente efecto cardioprotector22,23. Este efecto es apoyado por estudios observacionales en menopáusicas con cáncer de mama que recibieron tamoxifeno, donde se encontró una disminución significativa en los infartos del miocardio mortales24. En otro estudio clínico, las mujeres tratadas con raloxifeno presentaron un número menor de hospitalizaciones por enfermedad cardiaca23. Un tercer estudio encontró una tendencia a un menor número de muerte por causas cardiovasculares en mujeres que utilizaban tamoxifeno, pero esta disminución del riesgo no llegaba a ser estadísticamente significativa20.
Los hallazgos de esta investigación son similares a los reportados en investigaciones previas con el uso de raloxifeno a corto plazo5,16,25. Es difícil predecir si los efectos del raloxifeno sobre los componentes del perfil lipídico son favorables para la prevención de la enfermedad cardiovascular con los datos de esta investigación. Los efectos de los estrógenos tienden a ser más favorables debido a que sus efectos benéficos sobre la concentración de colesterol son mayores a los reportados para el uso de raloxifeno, tanto a corto como a medio y largo plazo, pero probablemente estos efectos sean contrapuestos a los marcados aumentos en la concentración de TG y proteína C reactiva6,9,10. En un estudio que utilizó raloxifeno por 4 años, no se observó una variación significativa en el riesgo de eventos cardiovasculares26.
En forma específica, la disminución del LDL-C observada en esta investigación reduciría el riesgo de enfermedad cardiaca coronaria. Los estudios epidemiológicos han demostrado que las concentraciones de LDL-C están relacionadas con el riesgo de enfermedad cardiaca coronaria, tanto en hombres como en mujeres27,28. Más aún, en los estudios clínicos en los que se produce disminución de las concentraciones de LDL-C en mujeres, se ha observado una reducción en la incidencia de un segundo evento cardiaco coronario29. En esas investigaciones se ha reportado que una disminución del 30% de las concentraciones de LDL-C en las mujeres está asociada a una reducción del 46% en los eventos cardiovasculares14,17. Esto sugeriría que la reducción del 10% en las concentraciones de LDL-C observadas en esta investigación podría disminuir la incidencia de infartos del miocardio en aproximadamente el 15%.
Una diferencia importante entre los estrógenos y el raloxifeno es su efecto sobre las concentraciones de HDL-C, las cuales no son afectadas en forma significativa por el raloxifeno. Debido a esto, el raloxifeno no parece tener una actividad antagónica completa sobre el o los blancos que modulan los estrógenos para aumentar las concentraciones27,28. En contraste, la disminución de las concentraciones de LDL-C representan un efecto agonista estrogénico por parte del raloxifeno y es similar en magnitud al efecto de los estrógenos. Este hallazgo es consistente con las observaciones in vitro del raloxifeno sobre la LDL-C14,28.
Los cambios producidos por el tratamiento con raloxifeno son similares a los cambios observados durante el tratamiento con reemplazo estrogénico13. No se observaron cambios en las concentraciones de TG y HDL-C durante el tratamiento con raloxifeno, mientras que ambos se incrementan en mujeres que utilizan estrógenos8,15,16. Los cambios en el perfil lipídico demuestran que el raloxifeno puede ser clínicamente útil11–13,15; y, tomados en conjunto con los hallazgos clínicos en conejos alimentados con dietas ricas en colesterol en los cuales el tratamiento con raloxifeno disminuyó la acumulación aórtica de colesterol11, sugieren que el raloxifeno puede tener un efecto favorable sobre la incidencia de las enfermedades cardiovasculares.
Se concluye que el uso de raloxifeno produce en menopáusicas disminuciones significativas en las concentraciones de colesterol y LDL-C, sin encontrar modificaciones significativas en las concentraciones de TG y HDL-C luego de 3 meses de uso.