En el 5% de los estudios mamográficos de cribado se detectan adenopatías intramamarias. La ausencia de centro graso, la pérdida del hilio ganglionar, un tamaño superior al centímetro o un crecimiento con respecto a controles previos son motivos suficientes para realizar un estudio histológico de la adenopatía, con el objetivo de descartar enfermedad tumoral.
A pesar del avance en los estudios radiológicos de cribado y el empleo generalizado de la técnica de biopsia selectiva del ganglio centinela en el tratamiento quirúrgico del carcinoma mamario precoz, el hallazgo de adenopatías intramamarias afectadas por tumor, en el carcinoma de mama infiltrante es generalmente un hallazgo casual durante la cirugía o en el subsiguiente exámen anatomopatológico.
En la actualidad existe controversia en cuanto al manejo quirúrgico de la axila ante el hallazgo de una adenopatía intramamaria metastásica.
Independientemente, tanto del manejo quirúrgico de la axila, como de la presencia o no de afectación tumoral ganglionar axilar, la afectación metastásica de una adenopatía intramamaria cambia no sólo el pronóstico de la paciente sino también la actitud en cuanto a terapia adyuvante.
Intramammary lymph nodes are detected in 5% of screening mammographies. Sufficient grounds for histological examination to exclude malignancy are the absence of the hilar fatty radiolucent notch, a reduction in the volume of the central echogenic hilum, size greater than 1cm or an increase in size compared with previous screens.
Despite advances in radiological screening and the widespread use of sentinel lymph node biopsy in the surgical treatment of early breast carcinoma, breast cancer metastasis to intramammary lymph nodes is usually an incidental finding during surgery or in subsequent histological examination.
The surgical treatment of the axilla in cases of metastatic intramammary lymph nodes is currently controversial.
Independently of the surgical management of the axilla and the presence or absence of metastatic axillary lymph node, a finding of a metastatic intramammary lymph node changes not only the patient's prognosis but also the approach to the use of adjuvant therapy.
Tanto la adhesión creciente de la población a los estudios mamográficos en las campañas de chequeo poblacionales de cáncer de mama, como el mapeo linfático previo a la realización de la técnica de biopsia selectiva de ganglio centinela en el carcinoma de mama precoz, hacen posible la detección de adenopatías intramamarias, que por otra parte, hubiesen pasado desapercibidas.
Aunque en la mayoría de los casos su carácter es benigno, existen criterios radiológicos que aconsejan su estudio histopatológico para descartar su asociación a un proceso neoplásico. En relación al carcinoma de mama, pueden acompañar a un tumor primario como localización de diseminación regional, pueden ser foco de recidiva o incluso ser la única manifestación de un carcinoma de mama (carcinoma oculto), como el caso clínico que describimos.
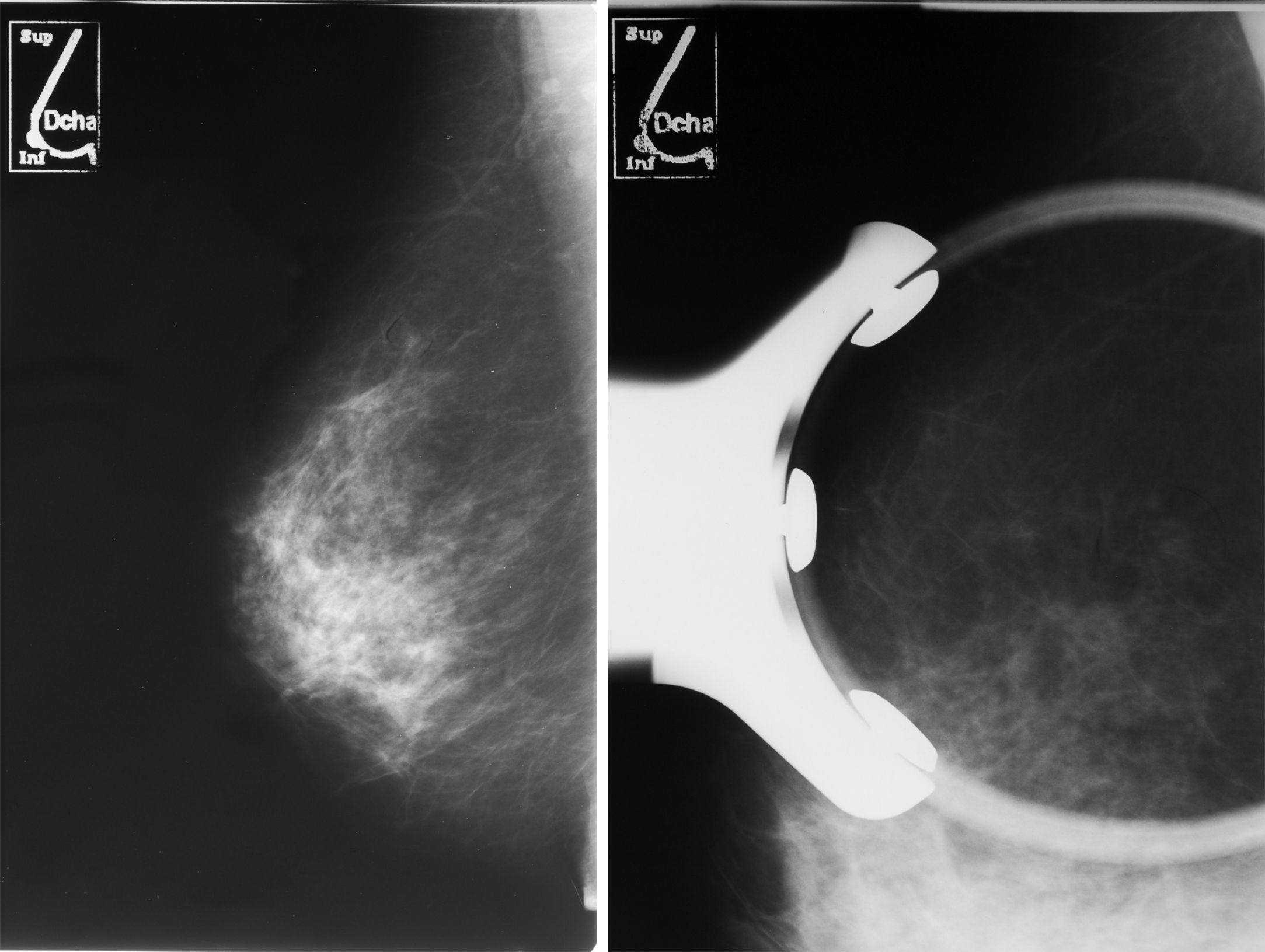
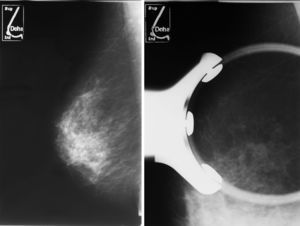
Caso clínicoPaciente de 59 años de edad remitida del programa de detección precoz por hallazgo en mamografía de screening de un cúmulo de microcalcificaciones en cuadrante supero-externo de mama derecha (Birads 4). (figs. 1 y 2)
Como antecedentes familiares destaca el fallecimiento de dos hermanos, uno a los 52 años por un carcinoma de colon y otro a los 61 por un carcinoma esofágico.
La paciente es fumadora de 20 cigarrillos/día. La menarquia fue a los 12 años y la menopausia a los 55 y tuvo 4 embarazos y partos. Realizó tratamiento hormonal substitutivo (THS) durante 2 años.
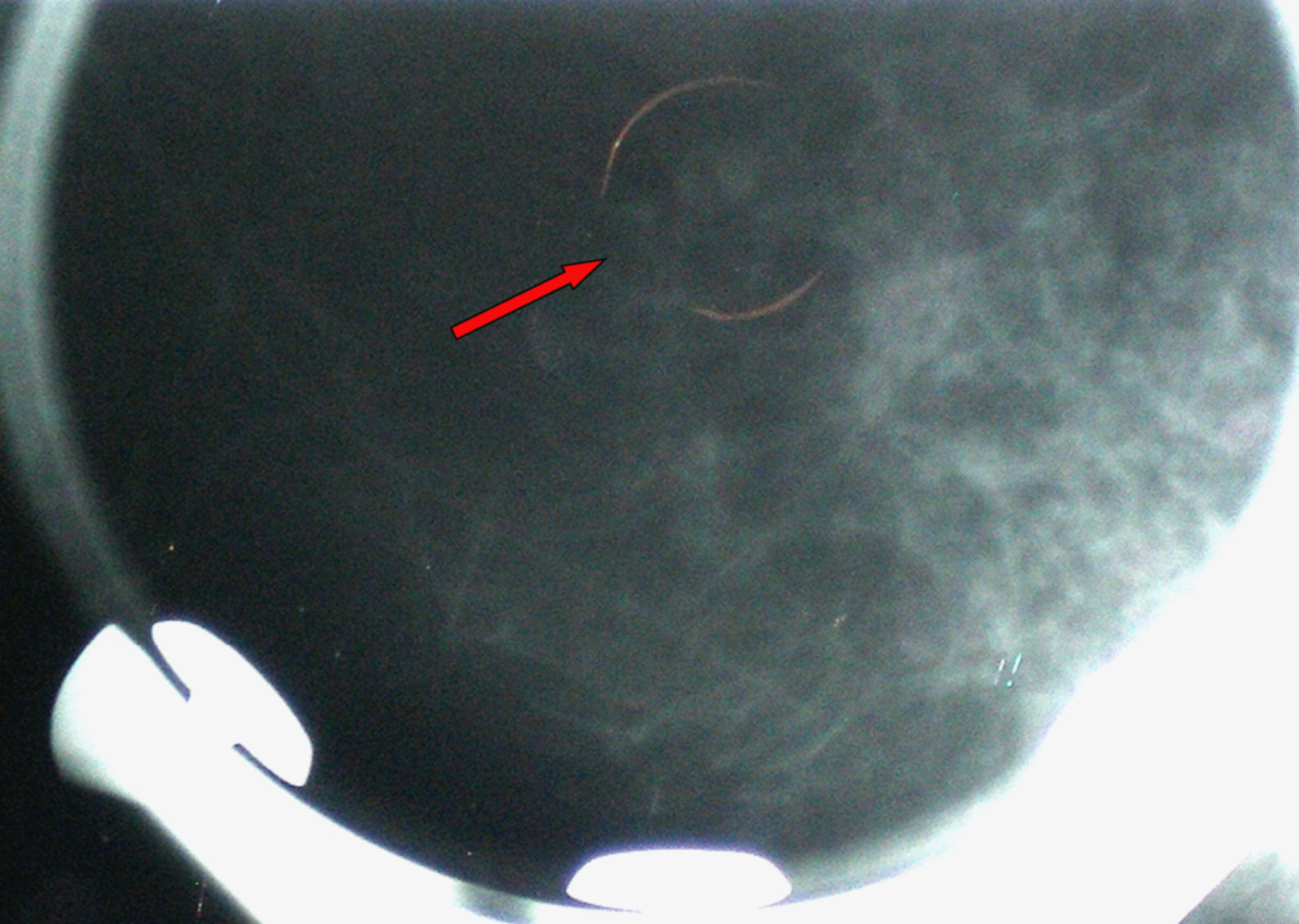
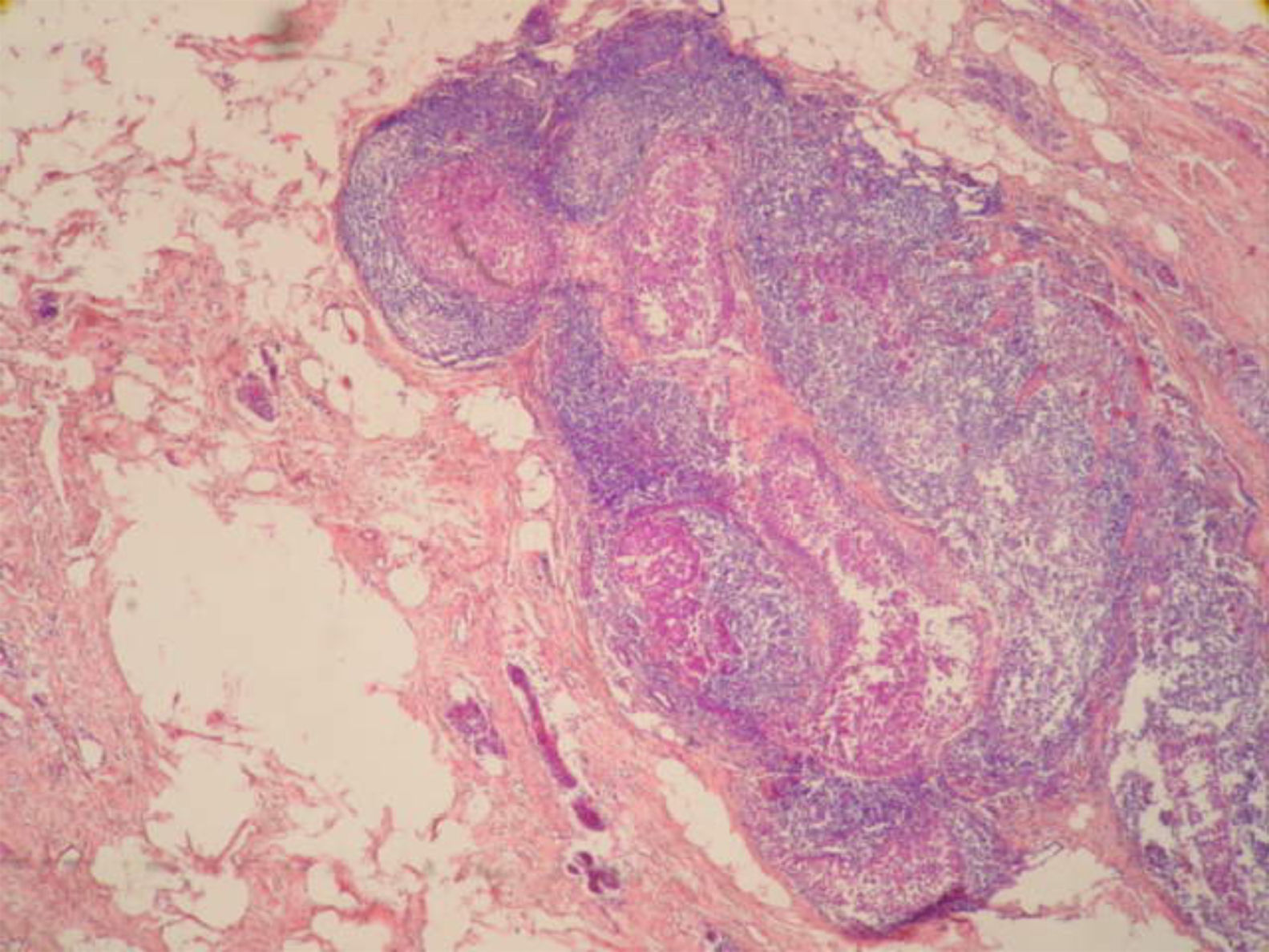
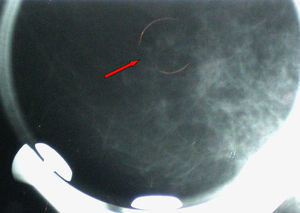
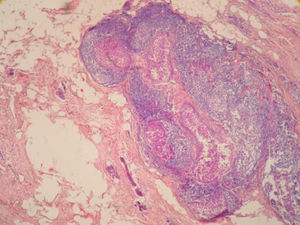
Se realizó biopsia percutánea por estereotaxia digital del grupo de microcalcificaciones (fig. 3) con resultado anatomo-patológico de ganglio linfático intramamario con micrometástasis de probable origen ductal asociado a microcalcificaciones (fig. 4).
Reevaluados los estudios radiológicos, no se detectó ninguna otra zona sospechosa en la mama ipsilateral.
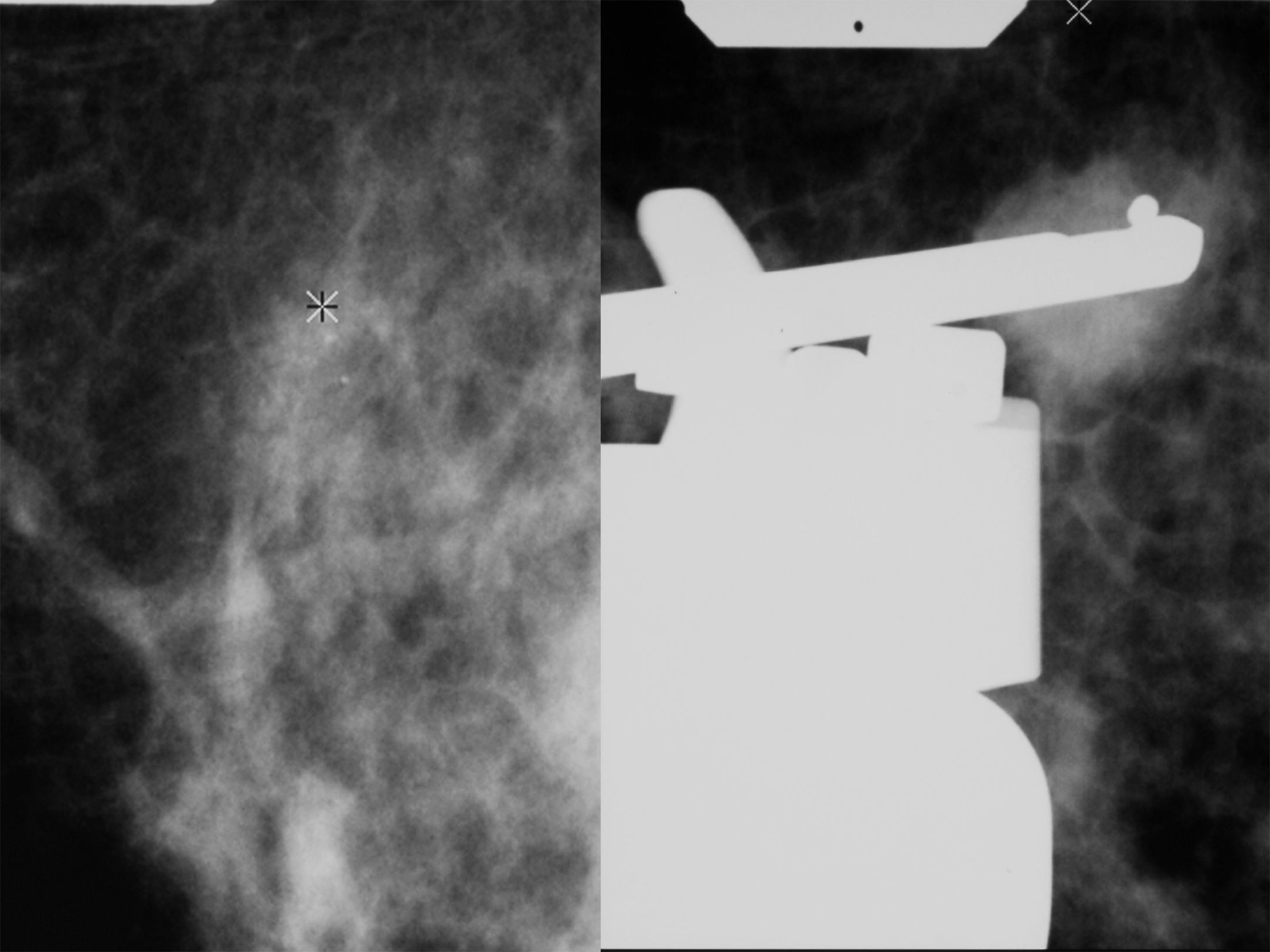
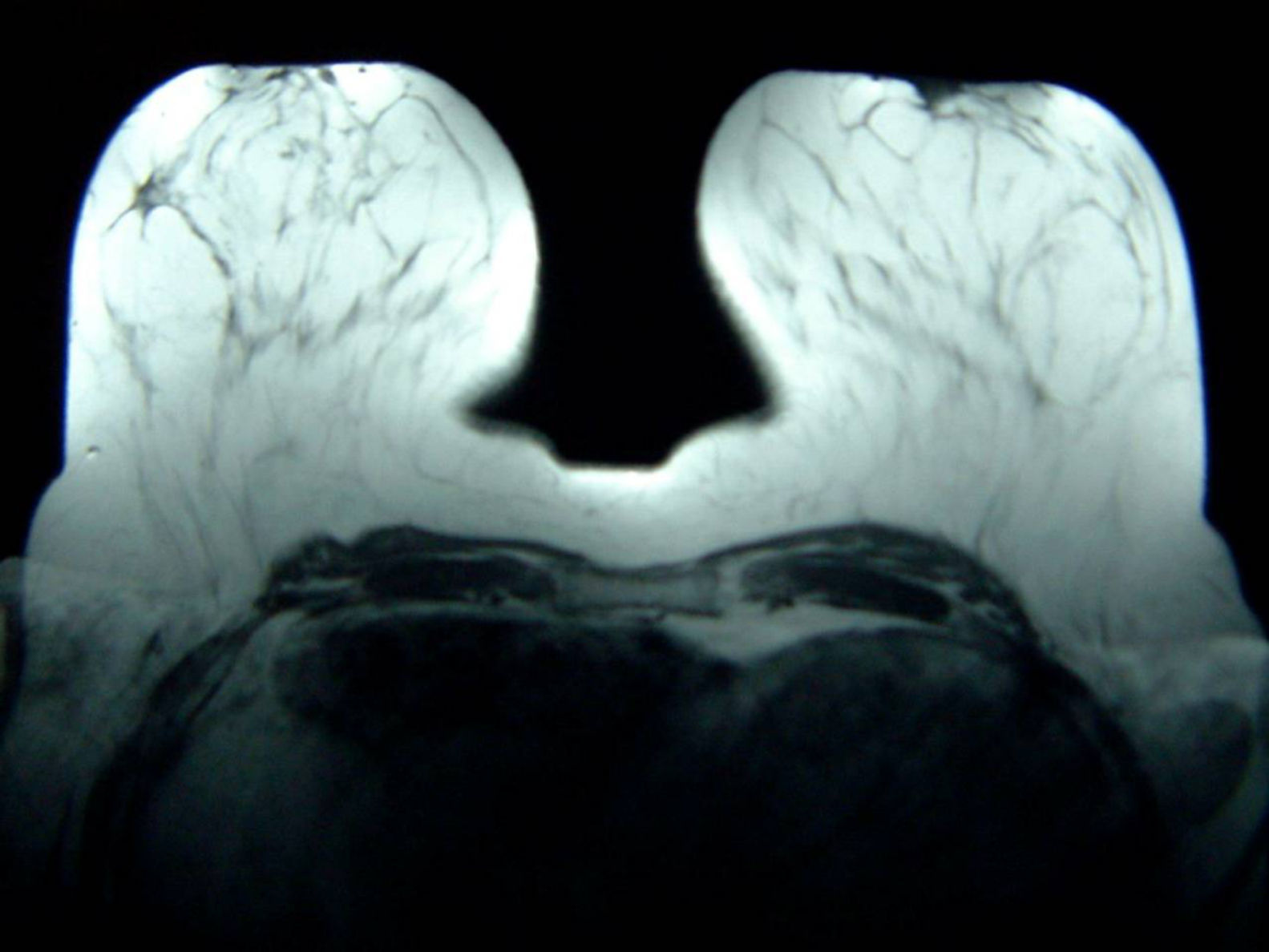
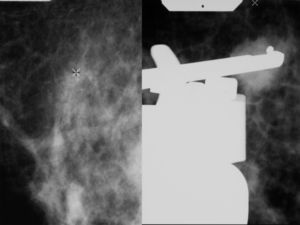
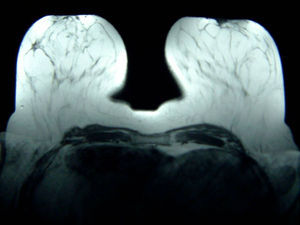
Con el diagnóstico de presunción de carcinoma oculto de mama y con el objetivo de localizar el carcinoma primario se solicitó RMN mamaria. En las secuencias morfológicas se indentifica una asimetría en cuadrante supero externo (CSE) de mama derecha con un nódulo irregular de 13mm de diámetro máximo, hipointensa en T1 y T2 sin realce tras la administración de gadolinio que parece corresponder con el área biopsiada previamente. No se objetivan nódulos o realces sospechosos en ambas mamas ni hallazgos significativos en huecos axilares (fig. 5).
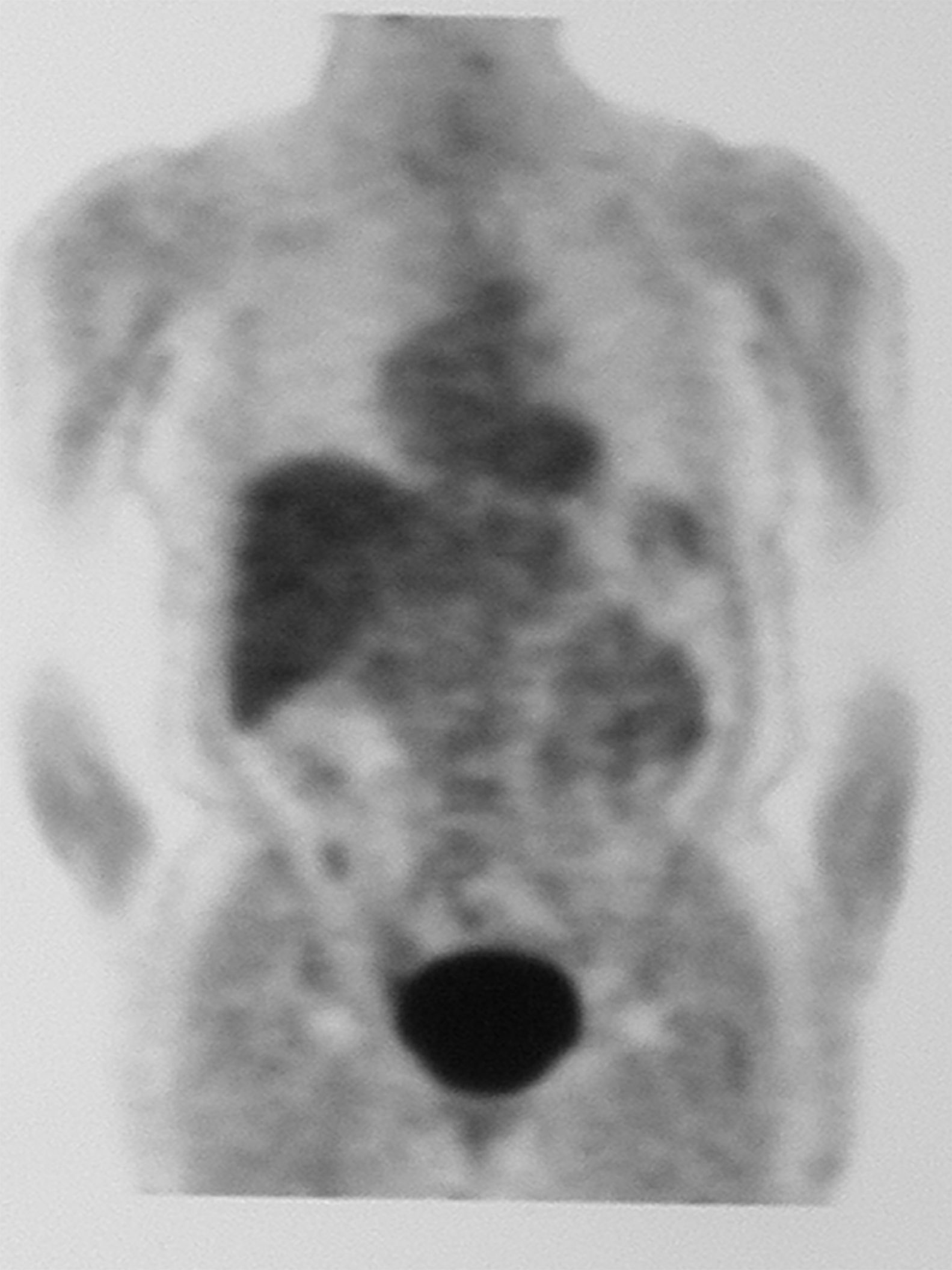
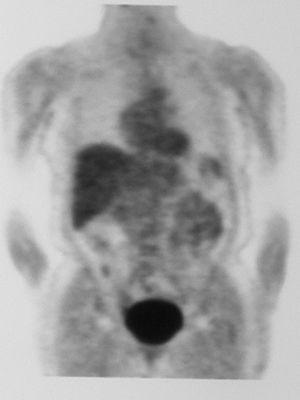
Ante estos hallazgos se realizó un PET que no detectó imágenes sospechosas mamarias ni en otras localizaciones a distancia (fig. 6).
Con el diagnóstico de adenopatía intramamaria metastásica y con el consentimiento informado de la paciente se realizó cuadrantectomía con marcaje radiológico del CSE de mama derecha asociado a linfadenectomía axilar ipsilateral.
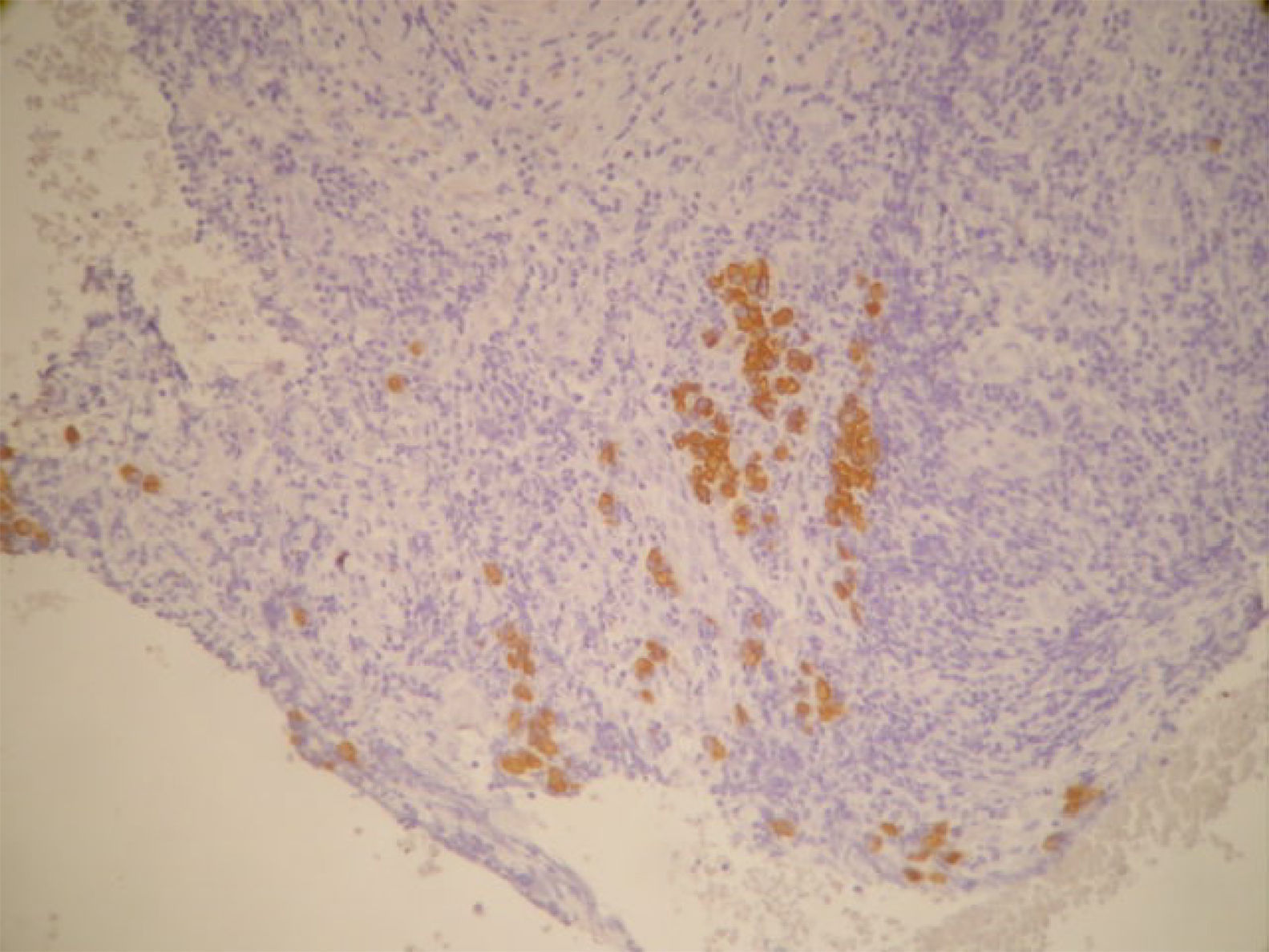
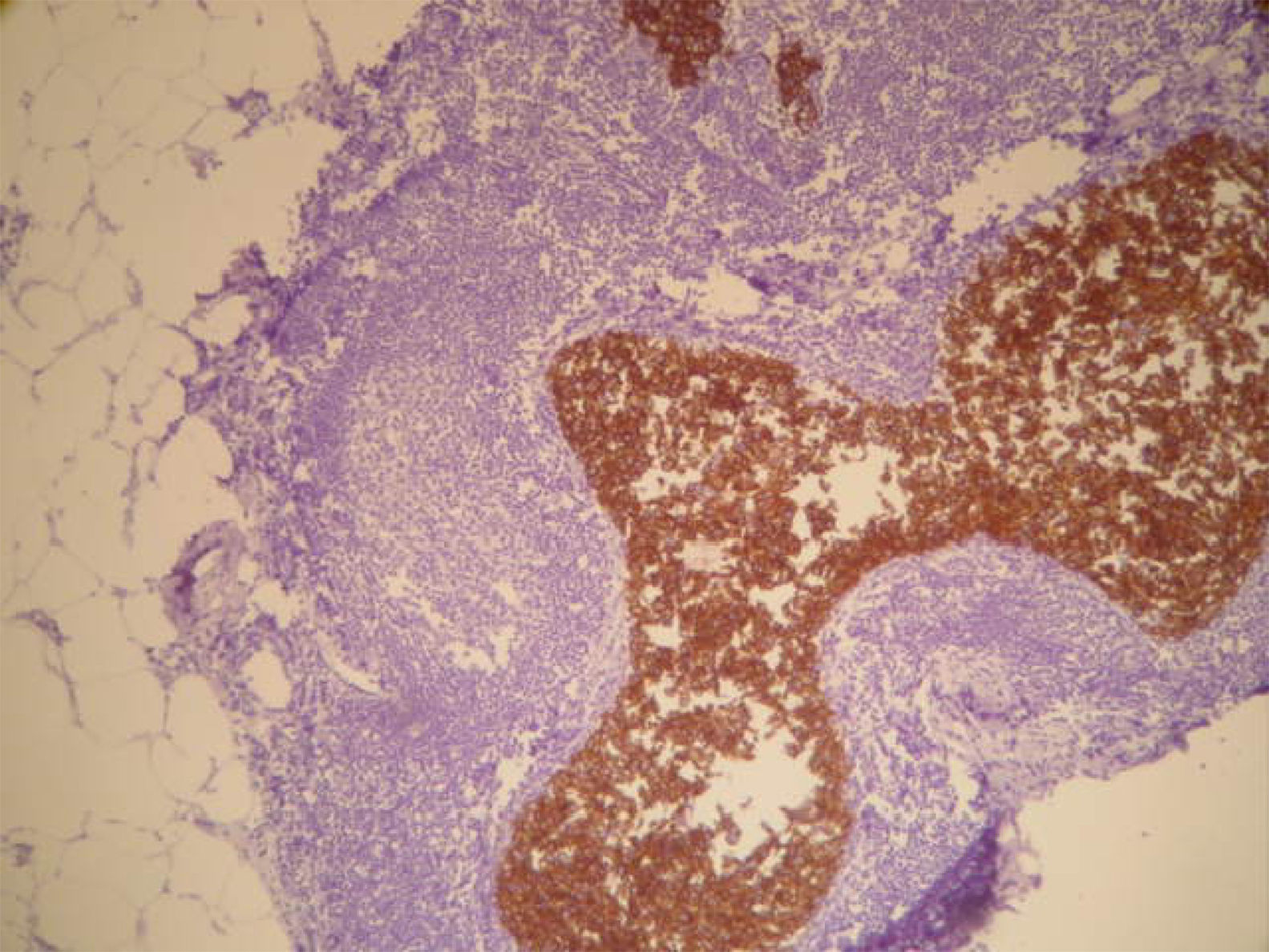
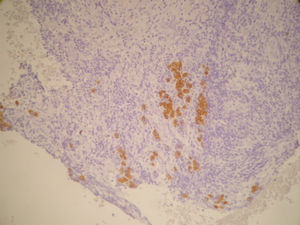
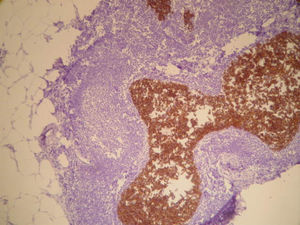
La anatomía patológica informó de ganglio intramamario con metástasis de carcinoma ductal infiltrante pobremente diferenciado (CDI GIII). Receptores de estrógenos y de progesterona negativos, p53+++ en el 60% de células tumorales, ki-67 + en 20-30% de células tumorales y positividad de membrana fuerte y completa para c-erb B2 (+++) (figs. 7 y 8). Las 20 adenopatías axilares resecadas se encuentran libres de tumor. No se detectó tumor primario en el tejido mamario resecado.
El estudio de extensión postquirúrgico no detectó enfermedad tumoral a distancia.
Se ha realizado tratamiento quimioterápico adyuvante con pauta Taxotere – adriamicina – ciclofosfamida (TAC) durante 6 ciclos y posterior tratamiento radioterápico con 2 campos tangenciales, isocéntricos y conformados, con fotgfes de 6Mv sobre el parénquima mamario, alcanzando una dosis total de 50Gy a 2Gy/fracción.
Posteriormente se ha realizado tratamiento con trastuzumab en régimen de adyuvancia, en pauta trisemanal durante un año, con buena tolerancia y sin complicaciones.
En la actualidad la supervivencia libre de enfermedad (SLE) es de 35 meses.
DiscusiónLa prevalencia de adenopatías intramamarias no está bien definida. Su detección preoperatoria por pruebas de imagen es poco frecuente, de hecho, en estudios mamográficos de rutina se detectan entre el 3,9%1, el 5%2,3 y el 7,5%4. En la mayoría de los casos son detectadas de forma incidental en el estudio histopatológico de especimenes de mastectomía5. De hecho, se ha descrito una prevalencia tan variable como entre el 1 y el 28% de los especimenes de mastectomía examinados histopatológicamente1,6,7.
Con la incorporación de la técnica de biopsia selectiva de ganglio centinela y el mapeo linfático, es más frecuente la detección de ganglios centinela intramamarios. En una revisión reciente se ha descrito que entre un 0,7 y un 14% de las pacientes sometidas a la técnica de biopsia selectiva de ganglio centinela en el cáncer de mama precoz, su localización es intramamaria8,9.
Los ganglios linfáticos intramamarios presentan un aspecto mamográfico similar al de las adenopatías axilares. Se caracterizan por estar bien definidos, ser de densidad mixta o media-baja y de contorno redondeado u ovoideo con una hendidura central grasa. Por definición se encuentran rodeados de tejido mamario, lo que les diferencia de las adenopatías de localización axilar baja10.
Se pueden localizar en cualquier zona de la glándula mamaria, aunque preferentemente se localizan en cuadrantes superiores (67-72%), sobre todo en el CSE o unión de cuadrantes externos y su tamaño generalmente es menor al centímetro11.
En más del 50% de los casos, las adenopatías metastásicas intramamarias se encuentran en el mismo cuadrante que el tumor primario6,12,13.
El carácter mamográfico de las adenopatías no patológicas es el de un nódulo bien circunscrito, lobulado, menor de 10mm y típicamente con hendidura hiliar y centro graso. El estudio ecográfico muestra un hilio hipoecoico y configuran masas bien circunscritas10.
Aunque los hallazgos radiológicos están bien definidos, en más de un 50% de los casos no se detectan en los estudios radiológicos convencionales11.
Independientemente de la causa de su incremento de tamaño, una adenopatía patológica en la mamografía presenta una densidad uniforme, con pérdida de la radiolucencia central y de la hendidura hiliar, mientras que en los ultrasonidos, el centro ecogénico está ausente presentándose como una masa hipoecogenica y homogénea y con pérdida de la morfología arriñonada14,15. La reducción del volumen del hilio ecogénico central está asociada a una marcada hipoecogenicidad de la corteza ganglionar. Esta ecogenicidad de la coteza ganglionar es considerada anormal cuando su hipoecogenicidad es marcada en relación a la grasa subcutánea de la mama.
Generalmente las adenopatías intramamarias de carácter maligno presentan un tamaño superior al centímetro, pero existen estudios en los que se refiere hasta un 79% de casos con afectación metastásica en adenopatías menores al centímetro11.
Son muchos los procesos que causan un aumento en el tamaño de las adenopatías intramamarias, entre los que se incluye tanto patología benigna como maligna.
En cuanto a la patología benigna, se ha descrito en relación a cambios inflamatorios, hiperplásicos, fibrosis, tuberculosis, hiperplasia linfoide, histiocitosis sinusal, toxoplasma, linfadenitis, sarcoidosis, linfadenopatía dermatopática o adenopatía en relación a enfermedad reumatoide o lupus eritematoso, pigmentación melánica, infiltración grasa y depósitos de oro simulando microcalcificaciones en la mamografía en una paciente que recibió crisoterapia por artritis reumatoide 17 años antes1.
A pesar de su localización mamaria, también pueden ser reflejo de patología maligna no mamaria como linfoma no Hodgkin o incluso ser de carácter metastático.
La presencia de adenopatías intramamarias metastásicas secundarias a carcinoma mamario ipsilateral oscila entre el 0,1 y el 10% de los casos. También pueden estar presentes en el contexto de una enfermedad recurrente o metastásica o incluso representando al ganglio centinela7,11.
También se ha descrito como adenopatía única intramamaria con metástasis de carcinoma mamario sin evidencia de tumor primario tanto en mamografía como en pieza quirúrgica, como en el caso que describimos5,14.
El dilucidar con técnicas de imagen el carácter de benignidad o malignidad es imposible. Cuando existe sospecha de malignidad tanto en el estudio radiológico o en la citología o en la linfogammagrafía para técnica de biopsia selectiva de ganglio centinela es aconsejable un examen histológico completo para un diagnóstico final10.
Por todo ello es aconsejable el estudio biópsico mediante estereotaxia digital o guiado por ultrasonidos y BAG o estudio biópsico abierto.
Se recomienda biopsiar todas aquellas adenopatías intramamarias mayores al centímetro, que no presenten infiltración grasa a no ser que se relacionen claramente con mastitis o dermatitis o si su tamaño se ha incrementado con respecto a controles previos16.
El estudio citológico ecoguiado no revela la estructura histológica ganglionar, pero puede sugerir un sustrato patológico tal como una metástasis o un linfoma. Generalmente es aconsejable un estudio histológico tanto de la adenopatía como del tejido mamario circundante17.
Su detección puede realizarse de forma preoperatoria mediante pruebas de imagen (mamografía, ecografía, resonancia magnética nuclear o linfoescintigrafía) o intraoperatoria o durante el exámen anatomopatológico (detectados de forma «incidental»).
El 90% de los casos se diagnostican en el estudio anatomopatológico del tejido escindido18.
Si la detección de la adenopatía se realiza de modo preoperatorio se recomienda realizar biopsia tipo core con la finalidad de planificar la cirugía19.
La afectación metastásica de adenopatías intramamarias es un marcador de severidad de la enfermedad e incluso su reconocimiento puede influir en la elección de la terapia adyuvante. Se ha estudiado si realmente es un marcador de riesgo de enfermedad más agresiva, o en cambio es un lugar de paso o tránsito de metástasis o representa un estadio intermedio entre la paciente con ganglios positivos o con ganglios negativos.
Se acepta que la afectación de una adenopatia intramamaria es un predictor de afectación ganglionar axilar de un 40% y se asocia a canceres más agresivos, con un tamaño tumoral más grande, de más alto grado, altas tasas de invasión linfovascular, más afectación axilar y más frecuentemente enfermedad multifocal y un estadio tumoral más avanzado18,20,21.
Se discute en la literatura, si el hecho de haber realizado una cirugía más radical hace posible encontrar con más facilidad adenopatias intramamarias o simplemente se realizó mastectomía por ser tumores más agresivos con un mayor grado nuclear, lo que podría ser un factor de confusión en cuánto a la valoración de la prevalencia de adenopatías intramamarias metastásicas22,23.
Una revisión reciente del M.D. Anderson Center concluyó que la supervivencia libre de enfermedad y supervivencia global es significativamente más corta en el grupo con afectación de adenopatias intramamarias22.
De hecho, en un estudio reciente se ha descrito que en el 46% de las pacientes a quienes se realizó mastectomía tras habérsele realizado previamente cirugía de conservación mamaria, se detectaron adenopatías intramamarias. Tras el estudio histopatológico de las mismas se comprobó que el 10% de las mismas fueron previamente infraestadiadas24.
Parece que las pacientes con afectación metastásica simultánea de adenopatías centinela tanto intramamaria como axilares presentan un peor pronóstico que aquellas con sólo afectación ganglionar axilar (no estadísticamente significativo en SLE y SG). Aunque se ha sugerido que las adenopatías intramamarias pueden indicar una estación intermedia entre el estadio I y II del cáncer de mama, hay estudios que manifiestan que tanto la supervivencia libre de enfermedad como la supervivencia global es menor en aquellas pacientes con afectación metastásica en ganglios intramamarios sin afectación metastásica axilar22.
En relación al manejo quirúrgico, el Instituto de Tumores de Milán considera que si la detección se realiza como parte del mapeo linfático está indicado realizar la biopsia selectiva del ganglio centinela. De aquí surge la controversia de si se debe de realizar la linfadenectomía axilar reglada en casos con afectación metastásica aislada de una adenopatía intramamaria25.
De considerarse conveniente, la linfadenectomía axilar pudiera ser un procedimiento razonable, pero se consideraría un sobretratamiento para aquellos 20-30% de pacientes sin afectación ganglionar, por lo que es recomendable el estadiaje axilar estándar con ganglio centinela en pacientes con adenopatía intramamaria negativa.
La afectación metastásica de adenopatías intramamarias favorece la afectación de adenopatías axilares (entre un 60 y un 81%)21,22,26 por lo que para algunos autores hace necesaria la realización de la linfadenectomía axilar23. Incluso en los estadios T1 la afectación metastásica en una adenopatía intramamaria está asociada con una alta frecuencia de afectación ganglionar axilar, sobre todo si la afectación es macrometastásica, puesto que en estos casos puede alcanzar hasta un 75%18.
Dos estudios han examinado el significado pronóstico de la afectación metastásica de adenopatías intramamarias. Según Shen et al es un factor predictor independiente de menor SLE y SG22. Gunt et al recomiendan la realización de linfadenectomía axilar en pacientes con afectación metastásica de adenopatías intramamarias, puesto que se asocian a cánceres más agresivos, con mayores tasas de afectación linfovascular y axilar y peor grado de diferenciación23,27.
El empleo casi generalizado en el carcinoma mamario precoz de la técnica de biopsia selectiva de GC juega en la actualidad un papel importante en el estadiaje del carcinoma mamario. Así mismo, el empleo de la linfoscintigrafía preoperatorio puede facilitar la identificación de áreas de drenaje linfático extraaxilar. Al realizar el mapeo linfático puede ocurrir que el drenaje sea combinado tanto a adenopatías axilares como a intramamarias.
A día de hoy, existe controversia en el manejo quirúrgico axilar de las pacientes con afectación metastásica de adenopatías intramamarias.
En un análisis de 166 casos, el ganglio centinela ha sido detectado en regiones extraaxilares en 10 casos (incluidas áreas infraclavicular y mamaria interna). La localización en adenopatía intramamaria del ganglio centinela ha sido documentada en 4 casos (2,5%)28. Otro estudio detectó un 19% de ganglio centinela extraaxilar, sobre todo en mamaria interna. La localización intramamaria alcanzó el 2,6%8.
Ocasionalmente se presentan casos con detección de ganglios centinela tanto a nivel axilar como a nivel intramamario, y es entonces cuando existe controversia en el manejo quirúrgico.
En una serie de 30 casos, se ha estudiado la concordancia de los ganglios tanto intramamarios como axilares considerados centinela con los siguientes resultados. En aquellos casos en los que se realiza la técnica de biopsia selectiva de ganglio centinela, en un 60% de los casos tanto el centinela intramamario como el axilar son negativos, pero en un 17% de los casos el centinela intramamario está afectado por tumor y el axilar se encuentra libre. En un 13% de los casos el centinela axilar es positivo y en el intramamario no se detecta diseminación metastásica21.
Por lo que de obviarse el estudio de la adenopatía intramamaria «centinela», el 17% de los casos serían infraestadiados.
Con inyección peri o intratumoral y debido a la proximidad del sitio de inyección, las adenopatías intramamarias son difíciles de localizar con la gamma sonda. Con el objetivo de reducir el riesgo de falsos negativos la inyección subareolar de agentes radiactivos asociado a linfoescintigrafía preoperatorio podría ser una alternativa, incluso conociendo la menor frecuencia de drenaje extraaxilar29,30.
El Instituto Europeo de Oncología sobre 9.632 casos de pacientes con carcinoma de mama con axila clínicamente negativa, detectó migración a adenopatias axilares en el 99,4% de los casos. En 22 casos (0,2%) el drenaje fue combinado a axila y adenopatías intramamarias.
En 15 casos se extirparon las adenopatías centinela axilares e intramamarias. La afectación metastasica intramamaria se detectó en 6 casos (3 micrometástasis). En los 15 casos las adenopatías axilares centinela fueron negativas. Se realizó linfadenectomía axilar en 2 pacientes con adenopatía intramamaria positiva y en 1 con negativa. En los tres casos las adenopatías resecadas en la disección axilar no presentaron tumor25.
Los miembros del Instituto Europeo de Oncología (IEO) concluyeron que la positividad en adenopatias intramamarias puede mejorar el estadiaje pero no implica la afectación axilar. Sugieren que cuando los ganglios centinela son axilares e intramamarios se deben de biopsiar las dos zonas.
El manejo de la axila se debe de basar en el estado del ganglio centinela axilar. En aquellos casos con drenaje a adenopatías intramamarias como única localización de drenaje en la linfoescintigrafía, las decisiones de manejo axilar deben de ser individualizadas. En contra de las recomendaciones de Intra et al25, otros autores recomiendan la disección axilar ante la presencia de una adenopatía intramamaria metastásica incluso cuando el ganglio centinela axilar es negativo18.
Se ha documentado un caso con afectación de adenopatía intramamaria y ganglio centinela axilar negativo en el que se omitió la limpieza ganglionar axilar, y recidivó en axila a los 19 meses de seguimiento, por lo hay autores que preconizan la disección axilar en casos de de afectación metastásica de adenopatías intramamarias, incluso con ganglio centinela axilar negativo5.
Existe controversia en cuanto a la necesidad de realizar linfadenectomía axilar en todas las pacientes con afectación metastásica de adenopatías intramamarias. En base a la estrecha asociación con afectación metastásica axilar (61%), hay autores que así lo recomiendan. En caso de detectarse drenaje tanto a ganglio centinela axilar e intramamario, debe de ser el estado del ganglio centinela axilar quien indique la actitud quirúrgica posterior de la axila5,23.
Con la realización de la linfogammagrafía prequirúrgica, en el 4% de los pacientes únicamente se detecta drenaje extraaxilar. Si a pesar de ello, durante el acto quirúrgico nos servimos de la gamma-sonda y del colorante azul, en el 75% de los casos en los que no se detecta drenaje axilar en la linfogammagrafía, es posible detectarlo en el acto quirúrgico. Únicamente en el 1% de los casos el drenaje es exclusivamente extraaxilar. Y según parece, en estos casos no parece adecuado realizar un muestreo axilar como parte del protocolo quirúrgico31.
Hoy en día, existen controversias en cuanto a la significación pronóstica de la presencia de adenopatías intramamarias metastásicas así como a su implicación terapéutica posterior.
Las siguientes cuestiones permanecen en debate:
¿La afectación metastásica de adenopatías intramamarias supone una localización intermedia de tránsito hacia la afectación ganglionar axilar?
¿Se debería de realizar mastectomía y no cirugía conservadora en casos de afectación ganglionar intramamaria?
¿Implica su afectación la necesidad de linfadenectomía axilar?
¿Cuál es el tratamiento quirúrgico óptimo si la adenopatía intramamaria es positiva y el ganglio centinela axilar es negativo?
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.