Determinar los patrones de recaída y la respuesta patológica en relación con los diferentes tipos subrogados de cáncer de mama tras tratamiento neoadyuvante para analizar supervivencia y optimizar la vigilancia.
Material y métodosAnálisis retrospectivo de 112 pacientes con 116 tumores, con axila clínicamente negativa, tratados con quimioterapia neoadyuvante en nuestro Centro entre 2008 y 2014, y operadas posteriormente con cirugía conservadora o radical. Analizamos respuesta patológica en función de los tipos subrogados, tasas de recurrencia y sus patrones, supervivencia libre de enfermedad (SLE) y supervivencia global (SG).
ResultadosSe logró una respuesta patológica completa (RPC) en el 52,6%, constatando que estas pacientes tenían mejor supervivencia (p<0,05). En cuanto a los tipos subrogados, observamos RPC en el 85% de los tumores Her-2/neu positivos puros, el 65,6% de los triple negativos, el 43,8% de Luminal B Her-2 positivo, el 40% de Luminal B Her-2 negativo y en el 25% de Luminal A (p<0,05). Con un tiempo medio de seguimiento de 53 meses encontramos una tasa de recaídas del 9%. Los tipos menos agresivos tenían un tiempo a recaída loco-regional de 38,5 meses y a recurrencia sistémica de 74 meses. Los tipos más agresivos mostraron un tiempo medio a recaída loco- regional de 36,2 meses y a recurrencia sistémica de 8 meses.
ConclusionesLa quimioterapia neoadyuvante adaptada al tipo subrogado es una estrategia válida para intentar alcanzar una RPC. Las diferencias observadas en el patrón de recurrencia permiten optimizar el seguimiento.
To determine relapse patterns and pathological response in relation to surrogate types of breast cancer after neoadjuvant treatment to analyse survival and optimize surveillance.
Material and methodsRetrospective analysis of 112 patients with 116 tumours, with negative axillary involvement, treated with neoadjuvant chemotherapy at our hospital, between 2008 and 2014, who systematically underwent surgery. We analysed pathological response according to surrogate subtypes, rates and patterns of recurrence, disease free survival (DFS) and overall survival (OS).
ResultsPathological complete response (pCR) was achieved in 52.6%, finding that these patients had better survival (p<.05). Looking at surrogate subtypes, we observed a pCR in 85% of pure Her-2/neu positive tumours, 65.6% of triple negatives, 43.8% of Her -2 positive Luminal B, 40% of Luminal B and 25% of Luminal A (p<.05). With a median follow-up of 53 months, we found a 9% rate of relapses. The less aggressive types had a median loco-regional relapse time of 38.5 months and a systemic recurrence time of 74 months. The more aggressive types showed a loco-regional relapse time of 36.2 months and systemic recurrence time of 8 months.
ConclusionsNeoadjuvant chemotherapy according to surrogate type is a useful strategy to attempt pCR. Loco-regional relapse and systemic recurrence patterns allow surveillance adjustments.
El tratamiento sistémico primario es un esquema cada vez más utilizado en el planteamiento terapéutico de la neoplasia maligna de mama con el fin de disminuir la estadificación inicial, aumentar las tasas de cirugía conservadora y comprobar la quimiosensibilidad in vivo1–3. Adicionalmente, la evaluación de la respuesta tumoral a nivel de la pieza quirúrgica permite estimar el riesgo de recurrencia. En este sentido, se comportan mejor las pacientes que desarrollan una RPC4–6, mientras que en aquellas en las que existe enfermedad residual se pueden identificar potencialmente marcadores de resistencia al tratamiento y, por tanto, posibles estrategias de consolidación. Tanto es así, que la información que proporciona la respuesta al tratamiento sistémico está cobrando mayor importancia pronóstica que el estado de la axila previo a la neoadyuvancia7.
Con respecto al momento de realización de la biopsia selectiva de ganglio centinela (BSGC). la mayoría de las guías dejan abierta la opción de realizarla antes o después de la neoadyuvancia8,9, aunque la tendencia actual es recomendarla después, tal y como en su momento hicimos nosotros10,11. Con el uso de esta estrategia se consigue una disminución del número de linfadenectomías axilares, además de mantener una tasa de identificación de ganglio centinela y de falsos negativos similar a las observadas en pacientes tratadas con cirugía primaria11,12.
El objetivo de nuestro estudio fue determinar la respuesta patológica y los patrones de recaída de los diferentes tipos tumorales subrogados mamarios en pacientes con axila negativa de inicio y tratadas con quimioterapia, neoadyuvante, valorando el tipo de recaída y el tiempo medio hasta la misma, con el fin de ajustar el seguimiento con base en las necesidades de cada paciente.
Material y métodosPoblación de estudioSobre un total de 615 pacientes tratadas por neoplasia maligna de mama en nuestro Centro entre los años 2008-2014, se estudiaron de forma consecutiva las historias clínicas de 112 pacientes correspondientes a 116 tumores (en cuatro de ellas el tumor fue bilateral de diferente histología) que contaban con las características comunes de haber sido tratadas con quimioterapia neoadyuvante y tener axila clínicamente negativa. Se consideraron criterios de exclusión el presentar axila positiva al diagnóstico, información clínica incompleta y/o periodo de seguimiento inferior a 7 meses.
En las cuatro pacientes con tumores sincrónicos se escogió para el análisis y el diseño del tratamiento el indicado por el tipo histológico más agresivo.
Estadificación y diagnósticoLas pacientes fueron estadificadas según la 7ª edición de la clasificación Tumour Nodes Metastasis (TNM) de la AJCC (American Joint Committee on Cancer)13.
El diagnóstico se realizó mediante biopsia con aguja gruesa (BAG) o con biopsia con aspiración y vacío (BAV) guiadas por imagen. En el informe de anatomía patológica se informó del tipo histológico, el grado según escala de Nottingham14, el estado de los receptores hormonales expresado mediante Allred Score15, Ki-67 y el grado de expresión de Her-2/neu por inmunohistoquímica, esclareciendo los casos dudosos mediante FISH (Fluorescence In Situ Hybridization). Posteriormente, los tumores se reasignaron a cada uno de los tipos subrogados aceptados actualmente, asimilables a los tipos moleculares descritos por Perou16, a saber: Luminal A (receptores hormonales positivos, Her-2/neu negativo y Ki-67≤15%), Luminal B Her-2 negativo (receptores hormonales positivos, Her-2/neu negativo y Ki-67>15%), Luminal B Her-2 positivo (receptores hormonales positivos, Her-2/neu positivo), Triple negativo (receptores hormonales negativos y Her-2/neu negativo) y Her-2/neu sobreexpresado puro (receptores hormonales negativos y Her-2/neu positivo) (tabla 1). Se consideraron para el análisis como tipos subrogados menos agresivos el Luminal A y el Luminal B Her-2 negativo, y como más agresivos el Luminal B Her-2 positivo, el Her-2 puro y el triple negativo.
Como estudio de extensión previo al inicio de la quimioterapia, se practicó a todas las pacientes tomografia computarizada de tórax, abdomen y pelvis, gammagrafía ósea, ecografía axilar y resonancia magnética de mama bilateral con difusión (RM).
Tratamiento médico y quirúrgicoEl esquema de tratamiento médico fue adaptado al tipo subrogado, incluyendo antraciclinas, taxanos, carboplatino17, trastuzumab y esquemas bajo ensayo clínico. Para el control de la respuesta al tratamiento se realizó exploración clínica en las visitas mensuales a consulta, una nueva RM a mitad del tratamiento y otra al final del mismo.
Las pacientes fueron operadas con cirugía conservadora o radical por cirujanos expertos en patología mamaria, siendo ofrecida reconstrucción mamaria inmediata a las pacientes operadas mediante cirugía radical. Se propuso mastectomía profiláctica contralateral en las pacientes portadoras de mutación en genes BRCA.
La BSGC se realizó sistemáticamente tras la quimioterapia neoadyuvante, marcando el lecho tumoral el día previo a la cirugía, mediante inyección intratumoral de 148 MBq (MegaBecquerel) de 99mTc-nanocoloide en 0.2mL y 0.2mL de gadolinio guiada por RM18, salvo en los casos iniciales, que se marcaron con arpón de titanio guiado con RM. En estos últimos, la inyección fue periareolar. Todos los ganglios se enviaron para estudio intraoperatorio seccionándose, en fresco, de modo sagital, con improntas citológicas y, posteriormente, realizando cortes a intervalos de 2mm incluyéndose en OCT™ y congelándose en nitrógeno líquido. Se realizaron secciones de 5 micras y se tiñeron con hematoxilina-eosina y/o Diff-Quick™.
En las piezas quirúrgicas fue informado el grado de respuesta al tratamiento según la escala de Miller y Payne19.
Las pacientes tratadas con cirugía conservadora recibieron radioterapia sobre la mama, indicándose adyuvancia con hormonoterapia en el caso de tumores hormonodependientes y con trastuzumab hasta completar un año en caso de tumores Her-2/neu positivos.
SeguimientoLas pacientes fueron vigiladas mediante un protocolo de revisión periódica inicialmente trimestral y posteriormente semestral hasta completar 5 años, siendo anual en las pacientes que sobrepasaron este tiempo de seguimiento. Se incluyó la última visita registrada y el status de la paciente en ese momento.
Análisis estadísticoSe realizó un estudio estadístico descriptivo para reflejar las características de las pacientes y se subclasificaron según el tipo subrogado del tumor. Las frecuencias se expresaron como número absoluto y porcentaje para las variables cualitativas. Los datos correspondientes a variables cuantitativas se resumieron como media±desviación típica si seguían una distribución normal, o como mediana y rango intercuartílico si no era así. Para comprobar si los datos se ajustaban a una distribución normal se utilizó la prueba de Kolmogorov-Smirnov.
Se analizaron la SG y la SLE definiendo la primera como el tiempo desde el diagnóstico hasta la última visita registrada y la segunda como el tiempo desde el diagnóstico hasta registro de evento de recaída o muerte por la enfermedad.
El estadístico utilizado fue el test de Kaplan-Meier, añadiendo Log-rank (Mantel-Cox) para estudiar diferencias entre subgrupos. Para comparación de variables cualitativas se utilizó el test de χ2 de Pearson. Se consideraron estadísticamente significativos valores de P inferiores a 0,05. Se utilizó el software SPSS versión 21 para Windows (IBM Corporation, Chicago, IL, EE. UU.).
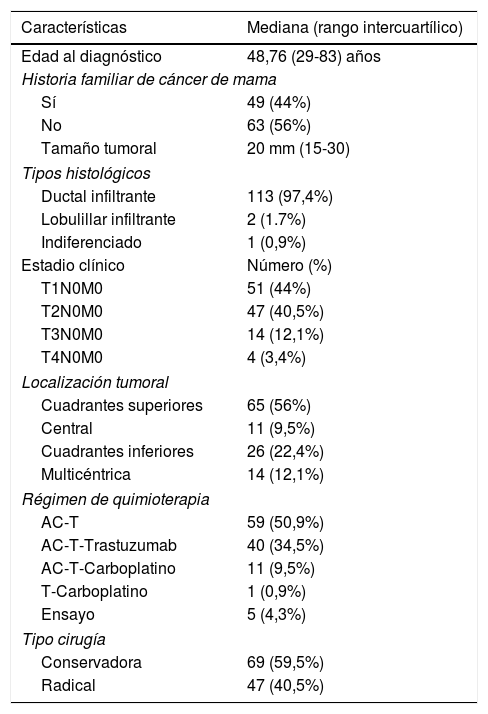
ResultadosEn la tabla 2 se resumen las principales características clínico-patológicas de la muestra.
Características clínico-patológicas
| Características | Mediana (rango intercuartílico) |
|---|---|
| Edad al diagnóstico | 48,76 (29-83) años |
| Historia familiar de cáncer de mama | |
| Sí | 49 (44%) |
| No | 63 (56%) |
| Tamaño tumoral | 20 mm (15-30) |
| Tipos histológicos | |
| Ductal infiltrante | 113 (97,4%) |
| Lobulillar infiltrante | 2 (1.7%) |
| Indiferenciado | 1 (0,9%) |
| Estadio clínico | Número (%) |
| T1N0M0 | 51 (44%) |
| T2N0M0 | 47 (40,5%) |
| T3N0M0 | 14 (12,1%) |
| T4N0M0 | 4 (3,4%) |
| Localización tumoral | |
| Cuadrantes superiores | 65 (56%) |
| Central | 11 (9,5%) |
| Cuadrantes inferiores | 26 (22,4%) |
| Multicéntrica | 14 (12,1%) |
| Régimen de quimioterapia | |
| AC-T | 59 (50,9%) |
| AC-T-Trastuzumab | 40 (34,5%) |
| AC-T-Carboplatino | 11 (9,5%) |
| T-Carboplatino | 1 (0,9%) |
| Ensayo | 5 (4,3%) |
| Tipo cirugía | |
| Conservadora | 69 (59,5%) |
| Radical | 47 (40,5%) |
Se realizó mastectomía profilactica contralateral en 23,4% de las 47 pacientes sometidas a cirugía radical, siendo portadoras de mutación en genes BRCA solo 3 pacientes. El resto de las cirugías profilácticas se realizaron por deseo expreso de la paciente.
La tasa de detección de ganglio centinela fue del 100%, obteniéndose una media de 1,8 ganglios (1-5). Hubo cinco casos con ganglio centinela metastásico, en todos ellos existía baja carga tumoral (micrometástasis). De estas pacientes, dos (25%) sufrieron recaída posterior, una a distancia y otra locorregional.
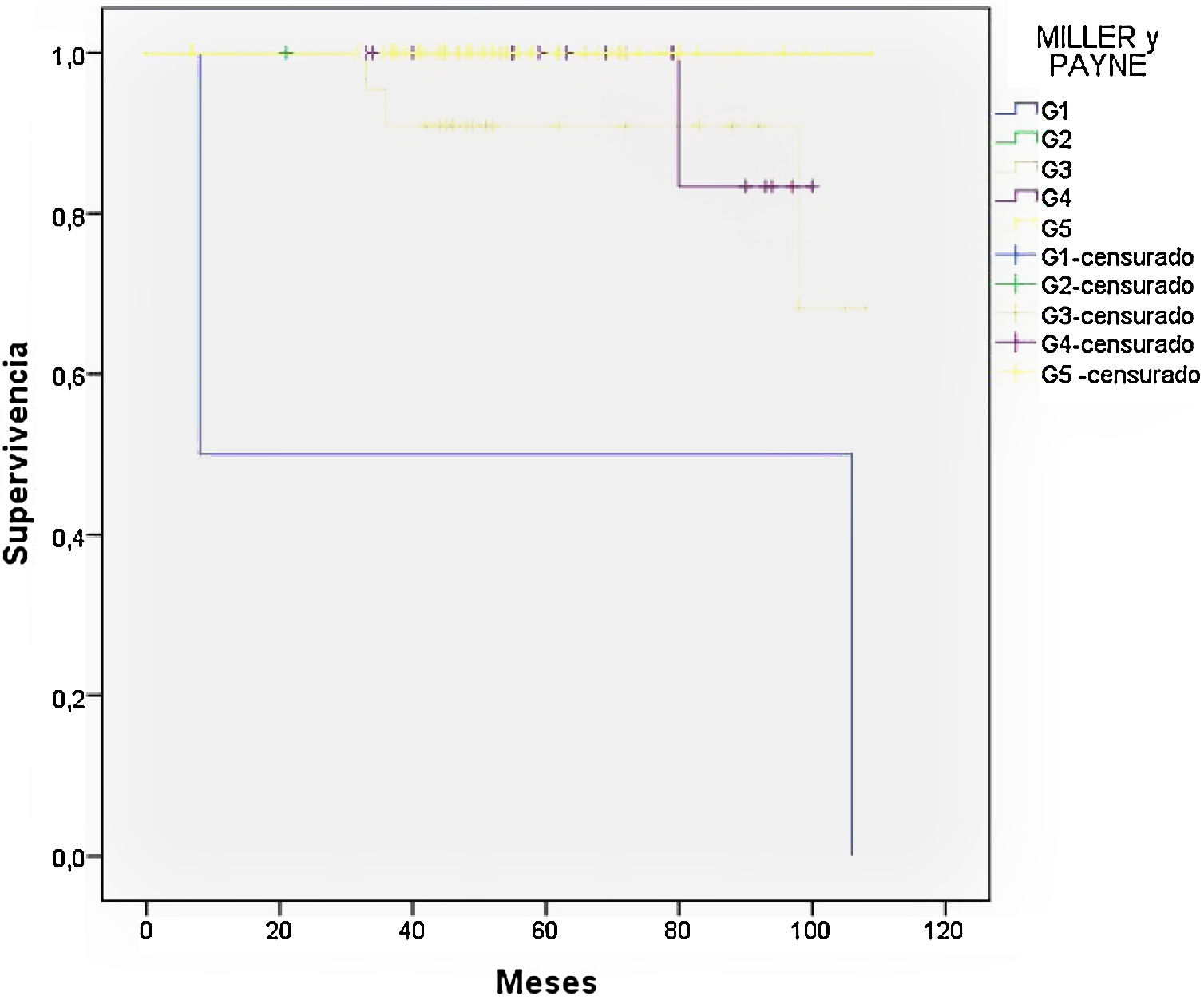
La respuesta objetivada en la mama, según escala de Miller y Payne tras la neoadyuvancia, fue G5 en el 52,6% de los casos y G4 en el 23,3%, por lo que en torno al 76% de los casos respondieron de forma muy importante al tratamiento. Analizando la respuesta G5 según tipo subrogado, en los tumores con sobreexpresión de Her-2/neu pura, el tumor desaparece en un 84,6%, en los triples negativos en un 65,6%, en Luminal B Her-2 positivos el 43.8%, en Luminal B el 40% y en Luminal A el 25% siendo las diferencias estadísticamente significativas (P=0,018).
La SG fue del 99,1% y la SLE del 91,4% para una mediana de seguimiento de 53 meses (7-109).
Las recidivas supusieron un 8,93%, considerando locorregionales (5,5%), a distancia (3,5%) y un caso de ambas (1%) correspondiente a una paciente con tipo subrogado Her-2/neu puro que tuvo una respuesta pobre al tratamiento neoadyuvante. Hubo 7 pérdidas de seguimiento.
El grupo mas favorable en cuanto a supervivencia fue el que obtuvo una respuesta G5 de Miller y Payne (P=0,045) (fig. 1).
Las pacientes a las que se realizó cirugía radical y optaron por cirugía profiláctica contralateral no obtuvieron mejor supervivencia (P=0,442).
Se observaron eventos de recaída en 10 pacientes. Cuatro eran T1 al diagnóstico, cinco T2 y solo un caso T3. En cuanto a la distribución por tipos subrogados, 1 era Luminal A, 4 Luminal B Her-2 negativo, 2 triples negativos, 1 Her-2 puro y 2 Luminal B Her-2 positivo. De las 10 pacientes con recaída, solo 2 tuvieron respuesta G5 de Miller y Payne tras la neoadyuvancia. Estudiando el número de recaídas según respuesta G5 o no, se observa significación al analizar el porcentaje de pacientes sin respuesta G5 vs. no respuesta G5 (17,02% vs. 3,39%) (P=0,031). El tiempo medio a recaída fue de 45,2 meses. Seis pacientes son rescatadas encontrándose actualmente libres de enfermedad, todas ellas con tipos subrogados luminales salvo una con tumor triple negativo. La mediana de supervivencia tras recaída fue de 27 meses (43,2-10,7). Las pacientes con tipo subrogado menos agresivo (Luminal A y Luminal B Her-2 negativo) presentan un tiempo medio de recaída locorregional de 38,5 meses y un patrón temporal de recaída a distancia de 74 meses. Sin embargo, las pacientes con tipos subrogados más agresivos (Luminal B Her-2 positivo, Triple Negativo y Her-2 sobreexpresado puro) presentan un tiempo medio de recaída locorregional de 36,2 meses y a distancia de 8 meses. Al cierre del estudio, de las 10 pacientes que recayeron, 6 estaban libres de enfermedad, 2 vivían con enfermedad, una falleció por la enfermedad y otra se perdió para seguimiento a los 36 meses. De las 6 pacientes rescatadas, 5 tenían enfermedad locorregional, tratada con cirugía y tratamiento sistémico, y la restante, enfermedad a distancia en forma de metástasis pulmonar única que se trató mediante metastasectomía.
DiscusiónLa quimioterapia neoadyuvante en el cáncer de mama ha mostrado ser una herramienta muy eficaz, no solo en los tumores localmente avanzados sino en aquellos que por su agresividad biológica tienen tendencia a una diseminación temprana. La respuesta tumoral obtenida tras el tratamiento, sobre todo la RPC, tiene cada vez más significación pronóstica4–6. Este tipo de respuesta la alcanzan fundamentalmente los subtipos Her-2 positivo y triple negativo, afianzando la importancia de escoger un esquema de neoadyuvancia adecuado a los mismos, tal y como hicimos en nuestra Unidad, y confirmando que esta estrategia tiene impacto en la supervivencia4–6,20.
Series históricas que se han ocupado de analizar el riesgo de recurrencia en pacientes que recibieron quimioterapia neoadyuvante adolecen de carencias en el tratamiento de tumores Her-2 positivos, sobre todo la ausencia de aplicación sistemática de terapias diana como trastuzumab, y también del uso de técnicas de marcaje menos evolucionadas para ayuda quirúrgica21. En este sentido, todas nuestras pacientes con tumores Her-2 positivo recibieron trastuzumab, realizando siempre FISH en casos dudosos por inmunohistoquímica, y todas aquellas con tumores triple negativo recibieron platino; además, todas ellas presentaban axila clínicamente negativa (cN0) al inicio. Estas características aportan homogeneidad a nuestra serie. Del mismo modo, en nuestra casuística, la quimioterapia neoadyuvante no se indicó exclusivamente por avance local del tumor sino por su tipo subrogado, lo que condiciona, en nuestra opinión, mejores tasas de respuesta que las referidas en los estudios publicados7. Adicionalmente, debemos resaltar una apreciable tasa de respuestas completas en tumores luminales (36,26%), lo cual plantea considerar la neoadyuvancia como una alternativa factible en estos casos, sobre todo en los tipos subrogados Luminal B Her-2 negativo, siendo este hecho diferencial también respecto a otras series21,22. También corroboramos que la obtención de una RPC se convierte en un buen predictor de supervivencia para estas pacientes, fortaleciendo la idea de poder aplicar esquemas de quimioterapia neoadyuvante en determinados subtipos luminales.
Desde el punto de vista quirúrgico, no pareció haber influido negativamente la realización sistemática de BSGC después de la neoadyuvancia en la evolución posterior de las pacientes, ni en un empeoramiento en las tasas de identificación10,11,23,24, por lo que creemos que es la cirugía axilar de elección. Así mismo, la cirugía guiada por imagen mostró gran seguridad, ya que la respuesta tumoral tras la neoadyuvancia, en muchas ocasiones, no es concéntrica sino parcheada, y este hecho condiciona la precisión del marcaje, pudiendo influir en las tasas de recidiva local. Este hecho probablemente no ocurrió en nuestro estudio al disponer de la secuencia completa de RM adquirida durante el tratamiento quimioterápico neoadyuvante como herramienta para la señalización adecuada del lecho tumoral. A pesar de obtener una buena respuesta a la quimioterapia neoadyuvante y observar una tasa de cirugía conservadora del 59,5%, merece comentario no haber practicado más a menudo esta cirugía, hecho este atribuido a que en la muestra existía un porcentaje significativo de tumores de localizacion central, multicéntrica y en cuadrantes inferiores, suponiendo un resultado cosmético más desfavorable y, por tanto, una mayor indicación de la esperada de cirugía radical (tabla 2). Consideramos también que la ausencia de ventaja de supervivencia en la realización de mastectomía profiláctica contralateral en nuestras pacientes no mutadas, apoya desaconsejar de forma rutinaria esta práctica25, a pesar de que un porcentaje alto de las pacientes del estudio la solicitaran de forma electiva, y no mostraran superioridad clínica en el análisis estadístico.
Globalmente hemos observado un tiempo medio a recaída de aproximadamente 4 años para todos los casos, siendo los subtipos luminales los que tienen los tiempos a recaída más prolongados. Merece comentario adicional la mala evolución clínica de pacientes con tumores Her-2 positivos que no responden adecuadamente al tratamiento diana neoadyuvante, y por tanto, su infausto pronóstico.
En cuanto al patrón de recaída a nivel locoregional, no hemos encontrado diferencias entre los diferentes subtipos histológicos. Sin embargo, en la recaída a distancia, encontramos un patrón temporal tardío en los subtipos menos agresivos, sobre todo las pacientes con tumores Luminal A. Este hecho sugiere que ambos podrían vigilarse con un protocolo similar y, consecuentemente, una menor necesidad de utilización de una amplia batería de pruebas diagnósticas para enfermedad a distancia al inicio del seguimiento. En cambio, esta podría ser útil en los subtipos más agresivos, dada su tendencia de aparición más temprana y, de este modo, optimizar las pruebas diagnósticas recomendadas durante el seguimiento26,27. Las Guías, actualmente, no especifican si las pacientes que han recibido quimioterapia neoadyuvante precisan un seguimiento concreto adaptado a cada tipo subrogado, indicando únicamente como pertenecientes al grupo de alto riesgo de recaída a las pacientes con respuesta parcial al tratamiento, sobre todo en los tumores triple negativo y Her-2 positivo.
El 60% de las pacientes que recayeron pudieron rescatarse manteniéndose sin enfermedad hasta el final del periodo de seguimiento. Por tanto, el hecho de recaer no ensombrece el pronóstico de manera significativa en nuestro estudio, permitiendo una mediana de supervivencia tras recaída de 27 meses, después de instaurar la terapia adecuada de rescate. Cabe destacar que se realizó tratamiento quirúrgico de enfermedad a distancia en la paciente con recaída exclusiva pulmonar.
El estudio presenta limitaciones, sobre todo en lo referido al tamaño muestral y al carácter retrospectivo, así como estar realizado en una sola institución. Además, como ya se ha comentado, las excelentes tasas de respuesta a la neoadyuvancia observadas, probablemente estén influidas por la indicación de dicho tratamiento, no solo en pacientes con tumores localmente avanzados, sino también en pacientes operables de entrada en estadios precoces, que constituyen la mayoría de las pacientes del estudio. Estos hechos podrían potencialmente condicionar una mejor evolución posterior.
A pesar de lo anterior, pensamos que el trabajo permite optimizar las pruebas diagnósticas necesarias durante el seguimiento en este grupo de pacientes y contemplar una mayor apertura en cuanto a indicación de tratamiento neoadyuvante en los tipos subrogados luminales, de cara a aumentar el control de la enfermedad a distancia y las tasas de cirugía conservadora. La publicación de los resultados del estudio INSPIRE28, que compara seguimiento standard vs. seguimiento intensivo en pacientes con alto riesgo de recaída, y en concreto la validez predictiva del marcador Ca 15.3, entre otros parámetros, será muy útil para esclarecer estos aspectos aún pendientes de concretar.
ConclusionesLa quimioterapia neoadyuvante adaptada a cada tipo subrogado es una estrategia válida de cara a controlar la enfermedad desde el inicio, con el objetivo de intentar alcanzar una RPC, dado que se ha mostrado como un buen predictor de comportamiento clínico favorable. Los patrones de recaída observados permiten seleccionar pacientes para seguimiento más intensivo en el caso de respuesta parcial al tratamiento neoadyuvante, y probablemente la duración del seguimiento de pacientes con subtipos luminales deba ser prolongada dada la aparición tardía de las recaídas a distancia. El impacto en la supervivencia de estas estrategias de tratamiento y seguimiento deberá ser esclarecido en mayor medida en futuras investigaciones.
Cumplimiento de las normas éticasConsentimiento informado: este estudio fue aprobado por nuestro Comité de Ética y debido a su naturaleza retrospectiva, no se requirió consentimiento específico.
Aprobación ética:este estudio está de acuerdo con las normas éticas del comité de investigación de referencia del Centro y con la declaración de Helsinki de 1964 y sus modificaciones posteriores o normas éticas comparables.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciacionEste estudio se financió parcialmente con una subvención de la Universidad Europea de Madrid, sin ningún número asignado, a favor del primer autor.
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses.