El virus del papiloma humano (VPH) está implicado en infecciones humanas (enfermedades de transmisión sexual [ETS]), de piel y en enfermedades tumorales femeninas como es el cáncer de cuello de útero. Las técnicas moleculares de detección de VPH son necesarias para conocer el grado de agresividad del tratamiento y seguimiento clínico. La utilidad de las técnicas de detección del VPH, como cribado, forman parte de los esquemas diagnósticos y terapéuticos de las sociedades oncológicas y ginecológicas más importantes.
Material y métodosSe ha realizado un estudio retrospectivo de 996 citologías desde noviembre de 2008 hasta diciembre de 2011. Los objetivos de nuestro estudio han sido analizar las lesiones preneoplásicas (
lesiones de significado incierto [ASCUS], lesiones escamosas intraepiteliales de bajo riesgo [LSIL], lesiones escamosas intraepitelies de alto riesgo [HSIL]) o sospechosas por parte del servicio de ginecología y la coinfección mixta entre virus del papiloma humano de alto y bajo riesgo (VPH-AR/BR), incluyendo las infecciones por el VPH-AR o VPH-BR y la trascendencia clínica de dichos hallazgos.
ResultadosDe 996 determinaciones de VPH-AR/BR, se hallaron 541 VPH positivos (alto, bajo o ambos) procedentes de citologías en medio líquido de 541 pacientes distintas. El número total de coinfecciones mixtas (VPR-AR/BR) en muestras normales, ASCUS, inflamación, HSIL y LSIL de VPH-AR/BR fue de 37, 100, 1, 3 y 29 respectivamente.
ConclusionesExiste un alto porcentaje de infecciones mixtas por el VPH de alto y bajo riesgo en lesiones de significado incierto o lesiones precancerosas.
Human papillomavirus (HPV) is involved in human infections (sexually-transmitted infections [STI]), and in skin and female tumoral disease such as cervical cancer. Molecular techniques for HPV detection are required to determine the aggressiveness of treatment and clinical follow-up. Evaluating the usefulness of techniques to detect HPV, such as as screening, are among the most important diagnostic and therapeutic activities of oncology and gynecological societies.
Material and methodsWe performed a retrospective study of 996 smears from November 2008 to December 2011. The objectives of our study were to analyze preneoplasic lesions (atypical squamous cells of undetermined significance [ASCUS], low-grade squamous intraepithelial lesions [LSIL], high-grade squamous intraepithelial lesions [HSIL]), those suspected by the department of gynecology, mixed infections with high-risk (HR)/low-risk (LR) HPV, including HR-HPV or LR-HPV infections, and the clinical significance of these findings.
ResultsOf 996 HR/LR HPV determinations, 541 were HPV positive (high, low or both) in liquid-based Pap smears from 541 different patients. The total number of mixed infections (HR/LR HPV) was 37 in normal samples, 100 in ASCUS, 1 in inflammation, 3 in LSIL and and 29 in HSIL.
ConclusionsThere are a high percentage mixed HR/LR HPV infections in lesions of undetermined significance and precancerous lesions.
El virus del papiloma humano (VPH) es un virus pequeño, que pertenece a la familia Papillomaviridae, icosaédrico de 72 capsómeros y ADN circular de doble cadena. Presenta gran diversidad genética y se clasifica en 120 genotipos distintos. Está implicado, en su gran mayoría, en infecciones humanas (ETS) y de piel.
Actualmente, la importancia de su diagnóstico y las expectativas de su conocimiento en la oncogénesis son cada día más relevantes, principalmente por las enfermedades tumorales femeninas, como es el cáncer de cuello de útero.
El cáncer de cuello de útero es la tercera causa de causa de incidencia y la cuarta de mortalidad por cáncer en mujeres de todo el mundo1 y responsable de un 5,2% de todos los tumores en humanos2.
En 1980 se estableció la relación que existe entre el VPH y los diversos procesos malignos neoplásicos del área genitourinaria y, desde entonces, la investigación en este campo de la virología se ha multiplicado exponencialmente.
De entre las técnicas de cribado que se iniciaron, la citología y el test de Papanicolaou han reducido la mortalidad, pero no cabe duda de que la implantación de técnicas moleculares para el diagnóstico viral han contribuido a aumentar la sensibilidad en el diagnóstico y el descenso añadido y sustancial de la mortalidad. Se postula que la utilización de ambas técnicas a la vez permite aumentar los intervalos de control a 3 años con buenos resultados (ej. ensayo de cohortes, Kaiser Permanent, Northern California, EE. UU.). Actualmente, podemos afirmar el protagonismo que van a desempeñar nuevos biomarcadores como son el ARN-m de VPH1 (carga viral) u otros como la p16-INK4a3 o Ki-67, MCM2 y TOP2a1.
Las técnicas de detección de VPH son necesarias para conocer el grado de agresividad del tratamiento y seguimiento clínico. La utilidad de las técnicas de detección del VPH, como cribado, forman parte de los esquemas diagnósticos y terapéuticos de las sociedades oncológicas y ginecológicas más importantes.
Actualmente se conoce que el 10% de las mujeres infectadas por el VPH de tipo 16 o 18 desarrollan HSIL (CIN3) en 3 años después de la infección4 y que existe una fuerte relación entre infección del VPH tipo 16 y el carcinoma de células escamosas (CCS) o entre el VPH tipo 18 y el adenocarcinoma de cuello de útero5,6.
La capacidad oncogénica del virus reside en las regiones E6 y E7 de su genoma. Son capaces de inhibir las proteínas antioncogénicas Rb-p53 y dan lugar a la transformación neoplásica e inhibición de la apoptosis celular en procesos tumorales7. Actualmente se considera que la infección por el VPH de alto riesgo (VPH-AR) en cuello de útero es necesaria para el desarrollo de cáncer pero resulta a veces insuficiente, dado que es necesario que intervengan otros factores como el consumo de tabaco8, la inmunodepresión9, los anticonceptivos orales10 o la coinfección con otros virus11. También se ha planteado la existencia de cáncer de cuello de útero sin asociación con VPH12,13.
Antes de plantear nuestro estudio, debemos conocer el tipo de lesiones preneoplásicas que están presentes con infecciones del VPH-AR y de bajo riesgo (VPH-BR) oncogénico. Según la clasificación o terminología de Bethesda, se clasifican en lesiones escamosas intraepiteliales de bajo riesgo (LSIL) y de alto riesgo (HSIL)14.
Nuestro objetivo ha sido conocer la prevalencia de infecciones por el VPH-AR (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 y 82) y de VPH-BR (6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81 y CP6108) en todo tipo de lesiones preneoplásicas (LSIL, HSIL, ASCUS) y, con especial interés, las coinfecciones mixtas o exclusivas (VPH-AR/BR) en lesiones de carácter incierto (ASCUS) y las LSIL.
MétodosSe ha realizado un estudio retrospectivo de 996 citologías desde noviembre de 2008 hasta diciembre de 2011. El criterio de inclusión del estudio ha sido el análisis viral de todas las muestras remitidas desde el servicio de ginecología o aquellas citologías que se derivaron directamente desde anatomía patológica por ser lesiones de significado incierto (ASCUS) o preneoplásicas. Se ha incluido un estudio pormenorizado de las citologías positivas con VPH-BR exclusivamente y se ha analizado la progresión anatomopatológica de estas lesiones.
Los objetivos de nuestro estudio han sido analizar las lesiones preneoplásicas (ASCUS, LSIL, HSIL) o sospechosas por parte del servicio de ginecología y la coinfección mixta entre VPH-AR/BR, incluyendo las infecciones por el VPH-AR o VPH-BR y la trascendencia clínica de dichos hallazgos.
PoblaciónSe evaluaron retrospectivamente 996 citologías remitidas entre noviembre de 2008 y diciembre de 2011 de pacientes entre 16 y 86 años de edad. Nos hemos limitado a una población de estudio perteneciente a un hospital monográfico de cáncer no perteneciente a cribado poblacional de rutina y teniendo en cuenta la divergencia de edad incluida en el estudio.
Examen ginecológicoSe realizaron citologías de todas las pacientes. Se extendieron 3 portaobjetos de 3 muestras: vagina, exocérvix y endocérvix. Se tiñeron con la técnica de Papanicolaou. Además de ser recogido exudado endocervical con cepillo para estudios virales.
Los resultados de la citología se clasificaron en:
- -
ASC: células escamosas atípicas. Estas se dividieron según Bethesda en células escamosas atípicas de significado incierto (ASCUS) y células escamosas atípicas que no pueden excluirse de una anormalidad intraepitelial escamosa de alto grado (ASC-H), células glandulares atípicas (AGC), adenocarcinoma endocervical in situ (AIS), LSIL (CIN 1), HSIL (CIN 2 y CIN 3) y carcinoma escamoso (CCS, in situ o invasivo). Decidimos estudiar ASCUS, LSIL y HSIL.
De cada paciente se extrajo una muestra de células cervicales que fueron introducidas en un medio de transporte (Digene Cervical Sample®). La detección se realizó mediante captura de híbridos test Hybrid Capture II® (DIGENE, Gaithersburg, EE. UU.) siguiendo las instrucciones del fabricante. Esta técnica se basa en la hibridación molecular del ADN viral con una sonda de ARN cuya reacción se detecta mediante quimioluminiscencia. El kit consta de 2 sondas: sonda de alto riesgo con 13 genotipos (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 y 68) y sonda de bajo riesgo (tipos 6, 11, 42, 43 y 44). La luminosidad se determina en unidades relativas de la luz (URL) y se considera positiva cuando las URL son iguales o superiores a la media de los 3 controles internos (1 pg/ml de ADN de VPH). La intensidad lumínica es directamente proporcional a la carga viral leve (URL: 1-9,99: negativo), moderada (URL: 10-99,99: negativo) y alta (URL ≥ 100: positivo).
Análisis estadísticoLas mediciones se realizaron sobre 541 muestras positivas para VPH-AR/BR. Las variables a estudio fueron: edad, tipo de lesión (diagnóstico patológico), VPH-BR, VPH-AR y coinfección de ambos grupos. De estas variables solo la edad es presumiblemente continua; por tanto, el análisis utiliza las herramientas del análisis de factores categóricos para obtener conclusiones adecuadas. De modo análogo al caso univariado, un resumen básico de la información de un grupo de 2 o más variables consiste en la distribución conjunta de frecuencias de las mismas, la cual se basa en el recuento del número de casos (frecuencias) que presentan las distintas combinaciones de valores que, a nivel empírico, se hayan dado para esas variables. Las modalidades de una distribución conjunta representarán, no los valores de una variable concreta, sino todas las posibles combinaciones de los valores de las variables que se consideren excepto aquellas combinaciones que no se hayan presentado a nivel empírico y que, por tanto, no tiene sentido incluir en la distribución de frecuencias. Sin embargo, como se verá en breve, en este caso no es necesario considerar un análisis de correspondencia múltiple, pues la naturaleza de los objetivos no lo hace necesario. El manejo de categorías también hace innecesario hacer pruebas de normalidad multivariada15.
ResultadosDurante el periodo de noviembre de 2008 a diciembre de 2011, se han realizado 996 determinaciones de VPH-AR/BR y se hallaron 541 VPH positivos (alto, bajo o ambos) procedentes de citologías en medio líquido de 541 pacientes distintas. La edad media fue de 41 años (16-86, DE ± 11,65) (fig. 1).
Del total de las citologías en medio líquido positivas para VPH-AR/BR o VPH-AR o VPH-BR, desde anatomía patológica 146 fueron consideradas normales, 274 ASCUS, 4 inflamación, 18 HSIL y 96 LSIL (tabla 1).
El número total de coinfecciones mixtas (VPR-AR/BR) en muestras normales, ASCUS, inflamación, HSIL y LSIL de VPH-AR/BR fue de 37, 100, 1, 3 y 29 respectivamente. El total de lesiones normales, ASCUS, inflamación, HSIL y LSIL sin coinfección mixta fue de 109, 174, 3,15 y 67 respectivamente (tabla 1).
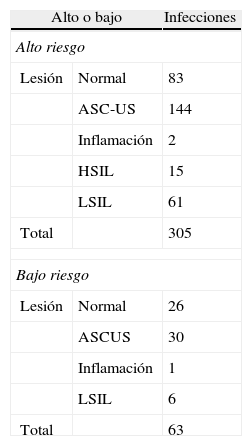
Las citologías positivas por VPH-AR+ exclusivamente en lesiones caracterizadas normales, ASCUS, inflamación, HSIL y LSIL fue de 83, 144, 2, 15 y 61 respectivamente (tabla 2) y las positivas por VPH-BR+ exclusivamente en lesiones normales, ASCUS, inflamación y LSIL fue de 26, 30, 1 y 6 respectivamente. En este grupo no hubo ninguna lesión HSIL (tabla 2.1).
Análisis estadístico de las lesiones en conjunto
| Porcentajes | Frecuencias observadas | ||||||
| Coinfección % | Coinfección | ||||||
| 0 | 1 | 0 | 1 | ||||
| T | 0 | 64,7 | 30,7 | 98,4 | 350 | 166 | 526 |
| 1 | 3,7 | 0,9 | 4,6 | 20 | 5 | 25 | |
| Totales | 68,4 | 31,6 | 370 | 171 | 541 | ||
0 si tipo de lesión es normal, ASCUS o LSIL
1 si tipo de lesión es cualquier otro
T=0 si tipo de lesión es normal, ASCUS o LSIL1 si tipo de lesión es cualquier otro
Se categoriza Presencia de coinfección: C= 0 (sin coinfección) y C=1 (coinfección).
A=0 si tipo de lesión es ASCUS1 si tipo de lesión es cualquier otro
Se obtiene mediante el test chi-cuadrado p = 0,201. Por lo tanto, el tipo de lesión para este caso particular pudiera no tener relación con la presencia de coinfección con un 95% de confiabilidad (tabla 1).
Análisis estadístico de las lesiones por separadoEn vista de que el test anterior rechaza las conjeturas de dependencia conjuntas, se analiza cada una de las lesiones por separado. Se repite entonces el procedimiento anterior pero considerando efectos específicos. Cabe destacar que la muestra tiene un tamaño suficiente para garantizar la validez de la mayoría de test no paramétricos sin necesidad de correcciones por continuidad.
Lesiones de células escamosas atípicas de significado incierto y otro tipo de lesionesSe utiliza el test chi-cuadrado y se obtiene entonces un valor p = 0,0132, esto implica que, puesto que el valor de p es menor que 0,05, se puede rechazar la hipótesis de que A y C son independientes con un nivel de confianza del 95%. Por lo tanto, la presencia de lesiones ASCUS está relacionada con la presencia de coinfección con un 95% de confiabilidad. Se muestra a continuación un diagrama de barras que relaciona la interacción entre los factores (tabla 2 y fig. 2).
Lesiones normalesSe utiliza el test chi-cuadrado y se obtiene entonces un valor p = 0,06. Esto implica que, puesto que el valor de p es mayor que 0,05 que no se puede rechazar la hipótesis de que N y C son independientes con un nivel de confianza del 95%. Por lo tanto, el tipo de lesión normal para un caso particular pudiera no tener relación con la presencia de coinfección con un 95% de confiabilidad (tabla 3 y tabla 3.1).
Se utiliza el test chi-cuadrado y se obtiene entonces un valor p = 0,745. Esto implica que, puesto que el valor de p es mayor que 0,05 no se puede rechazar la hipótesis de que L y C son independientes con un nivel de confianza del 95%. Por lo tanto, el tipo de lesión LSIL para un caso particular pudiera no tener relación con la presencia de coinfección con un 95% de confiabilidad (tabla 4).
Para determinar la relación entre la presencia de lesiones ASCUS y la edad y si el paciente tiene alto o bajo riesgo, se plantea el siguiente tratamiento16: Considérese el factor A como está definido en las secciones anteriores, se desea determinar si hay una relación estadísticamente significativa entre los 2 niveles de A con la edad (E) y con el riesgo. Teniendo en cuenta que el riesgo es un conjunto de 2 variables categóricas (AR, BR) se plantea una regresión logística resumida en la tabla 5.
Como el valor de p de la tabla ANOVA es menor que 0,05, existe una relación estadísticamente significativa entre las variables, con un nivel de confianza del 95%. Además, el valor de p para los residuos es menor que 0,05, indicando que el modelo es significativamente peor que el mejor modelo posible para estos datos con un nivel de confianza del 95%.
En la figura 3 se aprecia la distribución logística: la probabilidad de sufrir la lesión ASCUS en función de la edad.
Desenlace clínico en lesiones con infección por virus del papiloma humano de bajo riesgo exclusivamenteDe un total de 63 pacientes infectados por VPH-BR exclusivamente 22 casos de ellos presentaron displasia a los 5 años sin desarrollo de carcinoma.
DiscusiónEl objetivo fundamental del cribado de VPH en un hospital oncológico es prioritario. La detección de VPH de alto y bajo riesgo en todo tipo de lesiones con carácter preneoplásico o lesiones histopatológicas de bajo riesgo desde el punto de vista microbiológico es fundamental, principalmente para el diseño de vacunas.
El diagnóstico viral de ambos grupos puede ser interesante. La presencia de las infecciones múltiples o coinfecciones por VPH de alto-bajo riesgo en multitud de lesiones (HSIL, LSIL, ASCUS) puede ser interpretado de múltiples maneras, aunque también es cierto que muchas de estas infecciones podrían haber sido transitorias o asintomáticas y con una duración variable.
En un estudio se describió como el aclaramiento de VPH-AR se relacionaba directamente con la regresión de las lesiones citológicas17 y en otro estudio, del mismo autor, se analiza pormenorizadamente caso a caso y se demuestra que la persistencia de la infección era un requisito indispensable para el desarrollo tumoral (CIN3)18.
Con motivo de los métodos moleculares, la Food and Drug Administration (FDA) autorizó varios métodos para el cribado de VPH. Esta misma organización consideró que la detección de VPH-AR/BR mediante hibridación era adecuada y estaba bien estandarizada, al igual que otros métodos moleculares, cumpliendo por igual las mismas perspectivas. Según estas autoridades, la detección del VPH-AR/BR tiene una mayor sensibilidad que la citología y un más elevado valor predictivo negativo (VPN).
Los métodos de cribado en la población normal son necesarios y la programación de inicio de la vacunación debe ser implantada por cada país según las necesidades. Nuestro estudio está basado en pacientes que clínicamente están siendo estudiadas por sospecha tumoral, consideración que debemos tener en cuenta, dado que no es una población normal. Dicho propósito, es altamente interesante para estudio de coinfecciones mixtas en lesiones precancerosas.
Las estrategias de diagnóstico son múltiples y exclusivas en cada grupo de estudio, principalmente si se plantea en población oncológica.
Muñoz et al.19 clasificaron los tipos oncogénicos, y multitud de autores hablaron de la relevancia clínica de sus resultados. Nuestro grupo ha intentado aclarar el protagonismo que tienen las infecciones mixtas de VPH-AR/BR en lesiones de cuello de útero de significado dudoso y de bajo riesgo oncológico.
Otros estudios han evaluado el uso de diferentes técnicas de cribado del VPH como herramienta inicial, principalmente en lesiones de significado incierto y lesiones de bajo grado20.
Actualmente la importancia clínica de las infecciones mixtas o coinfecciones no está bien aclarada, aunque existen estudios donde se localizan infecciones mixtas en lesiones cervicales de alto grado (HSIL)21. En dicho contexto las infecciones mixtas o coinfecciones por VPH-AR/BR reflejan mayor tolerabilidad inmunológica, con asociación múltiple de otras infecciones o reinfecciones. Este hecho nos puede ayudar a sospechar una persistencia de la infección y la progresión de las lesiones.
La Asociación Americana de Colposcopia y Patología Cervical22 deja claras las pautas de actuación en cada uno de los casos e interpreta los resultados virológicos con cautela. Nuestro grupo afirma, teniendo en cuenta estas premisas, que la presencia de VPH-BR solo y exclusivamente no es altamente preocupante, aunque nuestros datos pueden justificar el uso o la consideración de estudio de VPH-BR en determinadas circunstancias. Esto no justifica el uso como cribado de VPH de alto y bajo riesgo en población normal, pero sí crea incertidumbre en población con alta sospecha tumoral, independientemente de las estrategias implementadas en cada comunidad o centro.
Creemos que el papel de las coinfecciones o infecciones mixtas en enfermedad tumoral de cérvix es una entidad clara a considerar y podemos afirmar su importancia en el diagnóstico del VPH-AR, así como el estudio del genotipado23 en pacientes con alta sospecha tumoral o en centros oncológicos como el nuestro.
Lamentablemente, en la actualidad, hay una constante persistencia en comparar otros métodos moleculares con la captura de híbridos, quizá más sensibles o específicos que el nuestro24, pero no podemos obviar el protagonismo que desempeñan las coinfecciones mixtas del VPH-AR/BR en nuestra serie de pacientes que nuestro grupo ha pretendido analizar, objetivando que, en sensu lato, aún quedan lagunas científicas, en el campo de la virología, por dilucidar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.