El bloqueo cardíaco congénito (BCC) es una entidad poco frecuente que se produce por la lesión del tejido de conducción cardíaco, con una alteración secundaria de la transmisión de los impulsos auriculares a los ventrículos. Se puede asociar a cardiopatías estructurales y a enfermedades autoinmunes como el lupus eritematoso sistémico o a la presencia de autoanticuerpos anti-Ro y anti-La. El diagnóstico prenatal se realiza mediante ecografía y ecocardiografía al objetivar una bradicardia fetal mantenida; ambas técnicas permiten asimismo el seguimiento y la valoración de finalización de la gestación ante la presencia de signos de deterioro hemodinámico.
El tratamiento médico intraútero se efectúa con fármacos inotrópicos y corticoides y una vez finalizada la gestación la terapia definitiva generalmente será la implantación de un marcapasos.
Presentamos el caso de una gestante de 26 semanas que acude a urgencias por dolor abdominal. Durante la exploración se objetiva un latido fetal anómalo confirmando la existencia de un BCC. Como único hallazgo analítico materno alterado se encuentra la presencia de anticuerpos de origen autoinmune ANA y anti Ro positivos.
Congenital heart block is a rare anomaly produced by an injury to the specialized cardiac conducting tissue, with secondary alterations in the transmission of stimuli from the atria to the ventricles. This defect can be associated with structural heart disease and maternal autoimmune diseases such as systemic lupus erythematosus syndrome or the presence of anti-Ro and anti-La autoantibodies. Prenatal diagnosis is given by echocardiography, which shows persistent fetal bradycardia, and allows detection of fetal hemodynamic deterioration, requiring finalization of pregnancy.
Intrauterine therapy consists of sympathomimetics and steroid agents and a pacemaker can be implanted in the newborn as a definitive treatment at the end of the pregnancy.
We report the case of an asymptomatic mother at week 26 of pregnancy who presented to the emergency department with abdominal pain. On examination, an anomalous fetal heart rate was detected and congenital heart block was confirmed. The only abnormal result of maternal blood test was the presence of positive anti-nuclear antibodies and anti-Ro autoantibodies.
El bloqueo auriculoventricular (BAV) completo congénito se produce por una lesión prenatal del tejido de conducción cardiaco que conlleva una alteración en la transmisión de los impulsos auriculares a los ventrículos1.
Su incidencia varía entre 1/2.500 a 1/20.000 recién nacidos vivos1–3 según las series.
En función de su etiopatogenia el BAV se clasifica en la práctica en 2 grandes grupos1:
- 1.
Asociado a anomalías cardiacas estructurales (25-50%), siendo las más frecuentes el canal auriculoventricular, el isomerismo, y las anomalías conotruncales (transposición de grandes vasos corregida)1.
- 2.
Asociado a enfermedad autoinmune, clínica o subclínica (45-50%), en la que el sistema de conducción es normal hasta que se ve sometido a una reacción inflamatoria y fibrosis irreversible por la existencia de anticuerpos maternos anti-Ro (SS-A) y/o anti-La1 (SS-B) (anticuerpos dirigidos a los componentes del complejo ribonucleoproteico SSA-Ro o SSB-La4).
A propósito de este caso clínico realizamos una revisión de esta patología, de los estudios indicados una vez establecido el diagnóstico, así como las controversias existentes en el manejo, tratamiento e indicaciones de profilaxis en gestaciones posteriores.
Caso clínicoPrimigesta de 38 años que acude al servicio de urgencias obstétricas a las 26+3 semanas de gestación por dolor abdominal inespecífico de 24 horas de evolución. Percibe movimientos fetales y no refiere clínica infecciosa los últimos días ni otros síntomas a destacar. Controles obstétricos ambulatorios previos dentro de la normalidad.
Gestación conseguida mediante inseminación artificial y sin otros antecedentes médicos ni quirúrgicos de interés.
La exploración abdominal y obstétrica es normal, y a la auscultación del latido fetal se evidencia la existencia de una bradicardia. En el registro cardiotocográfico externo es imposible captar el latido fetal de forma armónica por lo que se decide realizar un estudio ecográfico.
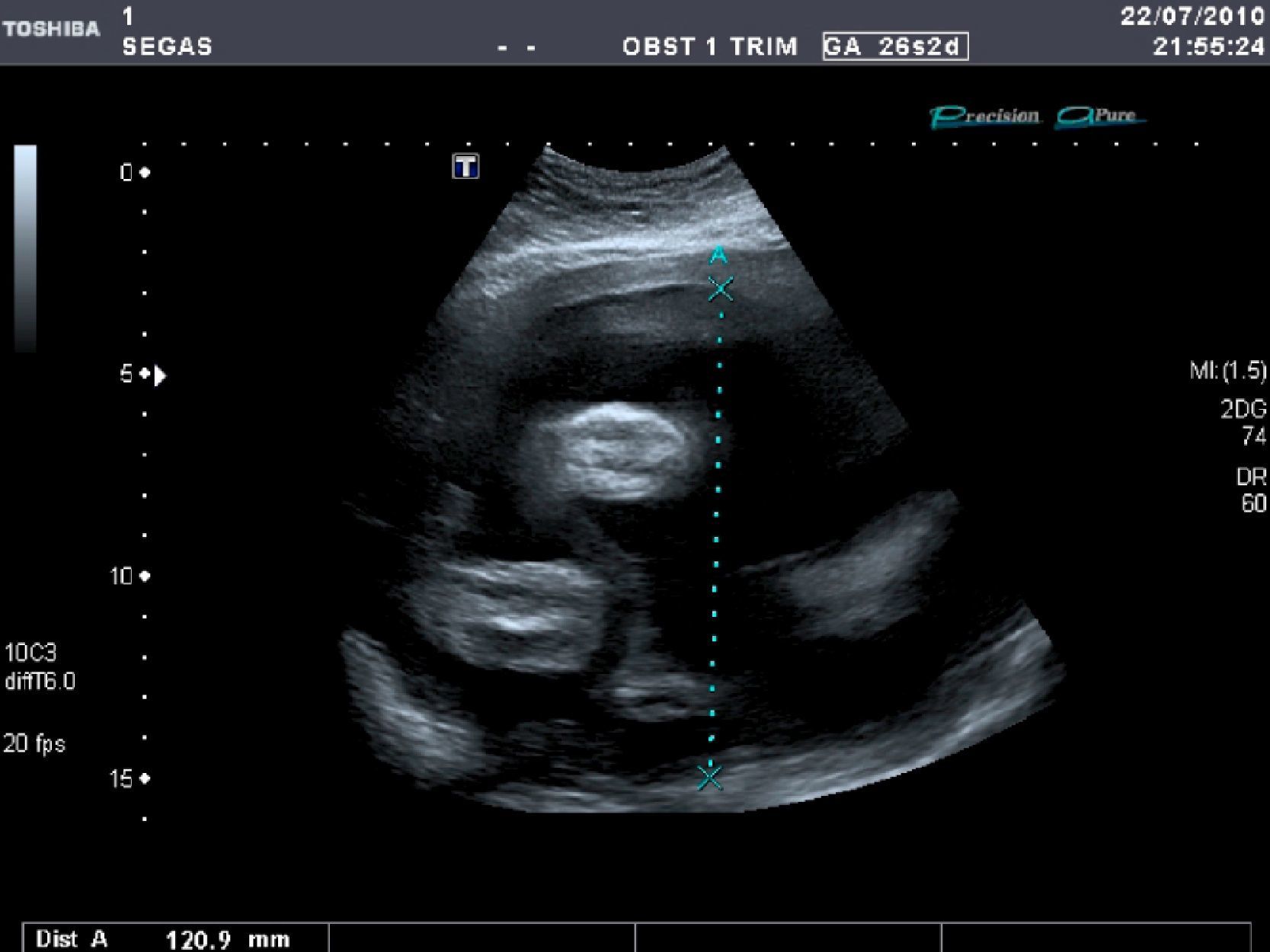
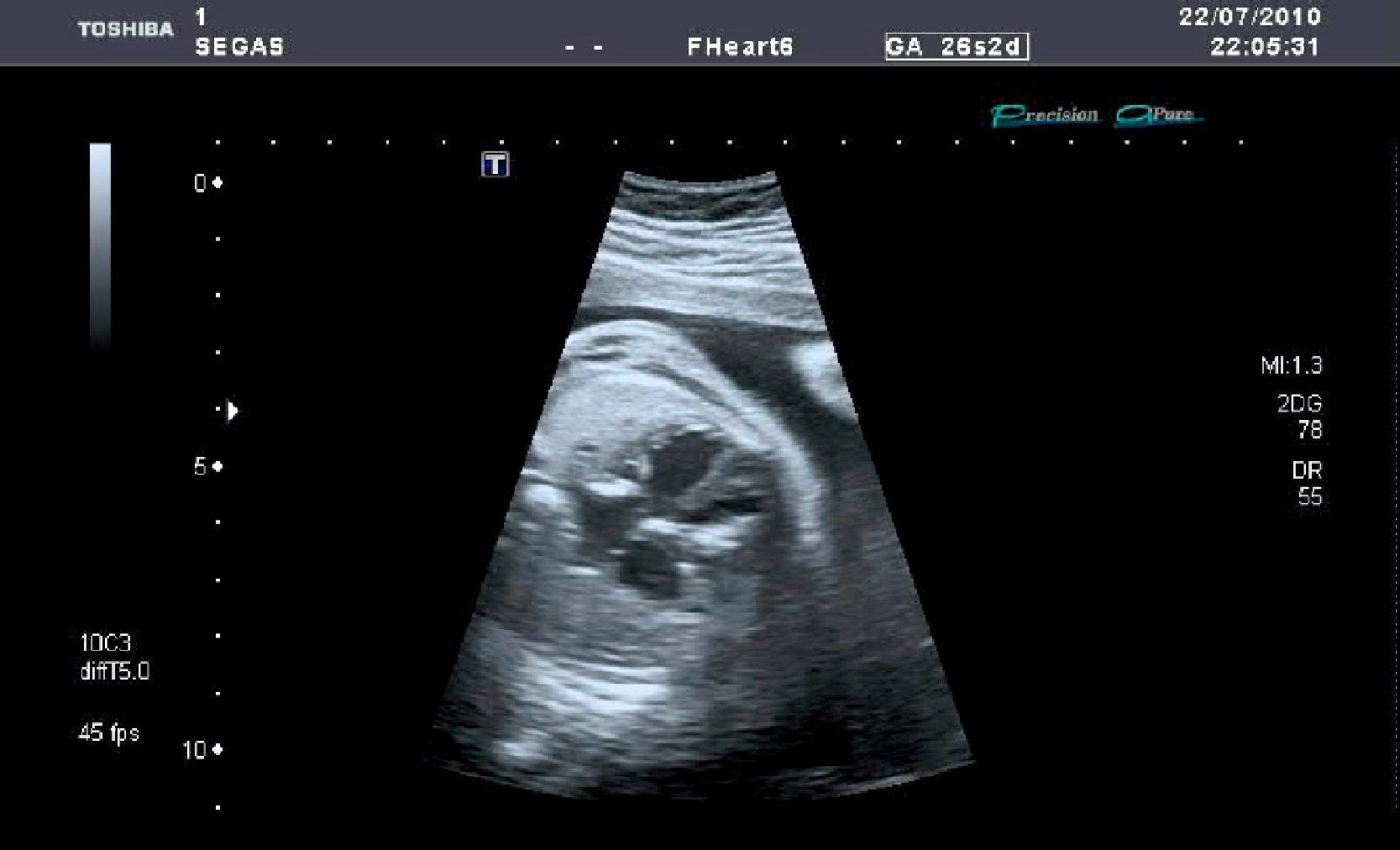
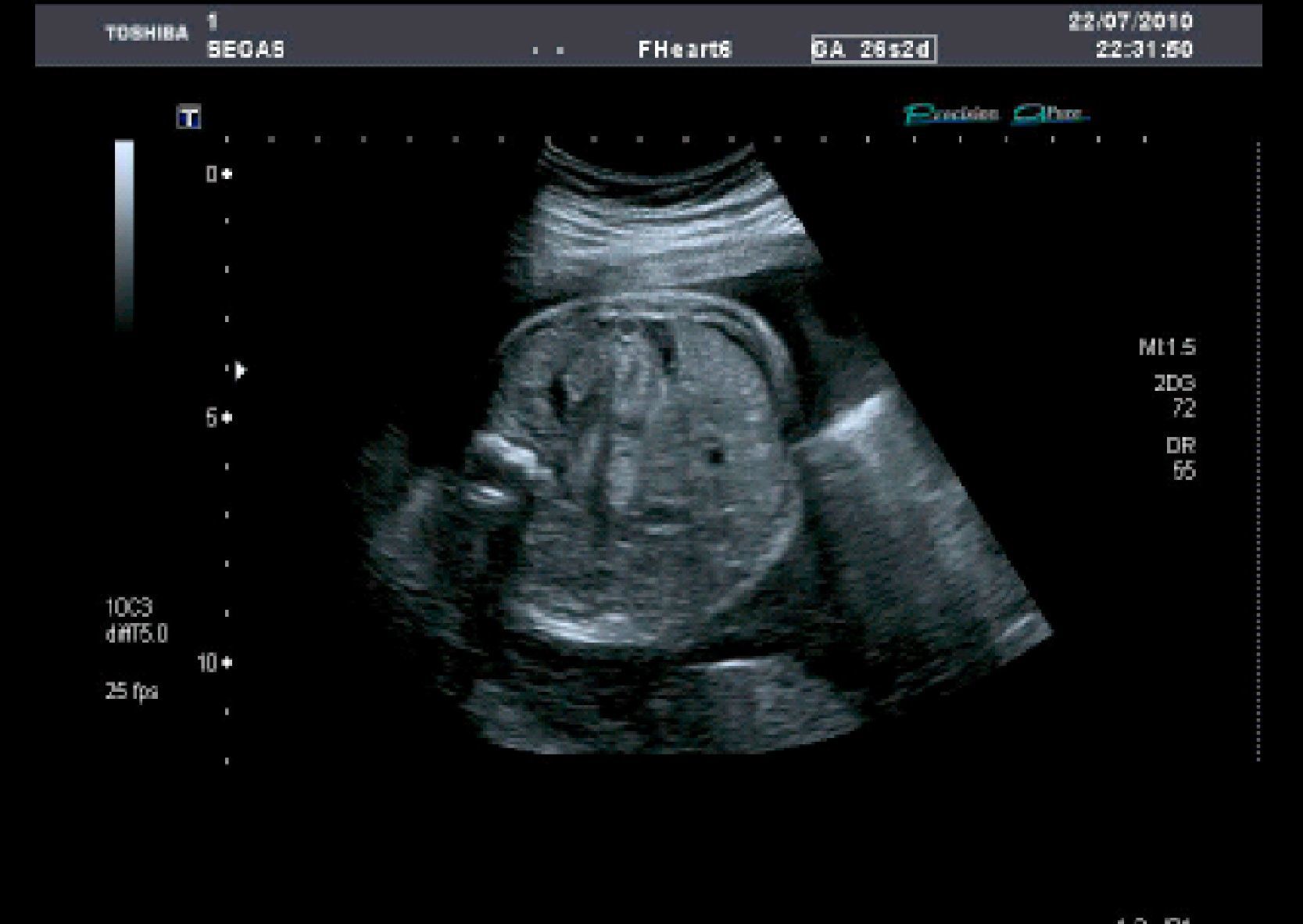
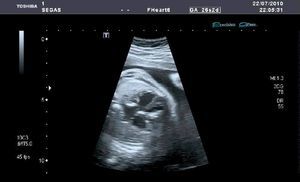
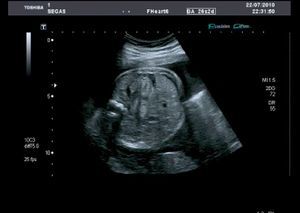
La ecografía efectuada (en modo B, tiempo real, mediante una sonda abdominal de 6MHz y con técnica de alta definición) permite objetivar un feto único en situación longitudinal y presentación cefálica, una ecobiometría fetal correspondiente a una edad gestacional de 26 semanas+4 días (+- 13 días), placenta normoinserta compatible con madurez grado I - II de Grannum, cordón umbilical de 3 vasos y con índice de líquido amniótico (técnica de cuadrantes de Phelan) de 25cm (hidramnios leve) (fig. 1). Feto varón con morfología dentro de la normalidad excepto una cardiomegalia simétrica de las 4 cavidades con normoinserción de las válvulas AV, cruce de salida de grandes vasos con diámetros similares en raíz de aorta y pulmonar y frecuencia cardiaca fetal de 48 latido por minuto (lpm). A nivel subvalvular tricuspídeo, imagen hiperecogénica de unos 8mm, móvil, sólida; otra de similares características de unos 6mm a nivel de la válvula mitral, ambas sugestivas de tumoraciones sólidas compatibles con coágulos o mixomas en el contexto de bloqueo aurículo-ventricular (fig. 2).
Se aprecia también un discreto derrame pericárdico y ascitis incipiente (fig. 3) que recorta la silueta hepática fetal.
El estudio hemodinámico refleja un doppler arteria umbilical con ausencia de flujo diastólico y doppler del Ductus Venoso con incremento del índice de pulsatilidad.
Se interpreta esta situación como de alto riego en un feto con bradicardia e hidrops con inicio de descompensación hemodinámica, por lo que se informa del pronóstico fetal incierto y se contacta con el centro de cardiología fetal/infantil de referencia para valoración y completar el estudio ecocardiográfico (Servicio de Cardiología Infantil del Complexo Hospitalario de A Coruña - CHUAC). Se confirma BAV Completo con frecuencia ventricular de 49 lpm y frecuencia auricular de136 lpm, datos de repercusión hemodinámica (estasis venoso umbilical) y birrefringencia tricuspídea con afectación del aparato subvalvular. La contractilidad de vi es aceptable a pesar de la disfunción diastólica biventricular y un pequeño derrame pericárdico, sin otros hallazgos ecocardiográficos estructurales. Dado que la etiología más frecuente de BAV completo aislado es la enfermedad autoinmune o la miocarditis, se inicia tratamiento con corticoides (dexametasona 8mg/24 horas y omeprazol 20mg/24 horas) con evaluación ecográfica en una semana para valorar la respuesta al tratamiento.
Los análisis efectuados en nuestro hospital resultaron normales (serologías para toxoplasma, rubéola, coxackie, echovirus, parvovirus, citomegalovirus, virus de Epstein-Barn, y virus de herpes simple: negativas) excepto el aumento de la titulación de ANA y Anti-Ro: ANAs positivo con título 1/80 (patrón mixto) (normal hasta1/16) y Anti-Ro 80,4 (normal hasta 25) con Anti-La negativo. Se inician controles semanales alternos en la consulta de embarazo de riesgo de nuestro hospital y en el servicio de cardiología pediátrica del CHUAC manteniendo la misma dosis de corticoides.
A las 3 semanas del diagnóstico persiste una frecuencia ventricular de 48 lpm y existen datos de insuficiencia cardíaca fetal leve-moderada por lo que se añade tratamiento betasimpáticomimético oral (ritodrine) a dosis de 40mg/24h.
A las 2 semanas de iniciar la pauta de tratamiento combinado mejora la situación hemodinámica fetal desapareciendo el hidramnios, el derrame pericárdico y la ascitis a pesar se seguir manteniendo una frecuencia auricular de 140 lpm y la ventricular de 49 lpm.
A partir de las 32-33 semanas de gestación se ralentiza progresivamente el crecimiento fetal manteniendo percentiles de peso en rango bajo de la normalidad, por lo que se inicia pauta descendente de la corticoterapia oral a las 36 semanas continuando con el ritodrine, y se programa cesárea a las 38+1 semanas de gestación extrayendo un recién nacido varón de 2.315 g de peso y Apgar 7/8.
El recién nacido ingresa en neonatología para implantación de marcapasos endovenoso transitorio y posterior inserción de marcapasos epicárdico unicameral definitivo una semana después del nacimiento.
En la actualidad, permanece estable y continúa con controles ambulatorios en la unidad de cardiología pediátrica.
DiscusiónEl caso que presentamos es de una primigesta con anti-Ro positivo clínicamente asintomática y con feto con BAVC aislado, por lo que profundizaremos en esta causa etiológica.
El 90% de las madres de hijos afectados tienen anti-Ro+ y el 80% tienen anti-La+ Estos son autoanticuerpos (Ac) IgG que atraviesan la placenta desde las 16 semanas de gestación y penetran en la circulación fetal alcanzando los tejidos fetales, uniéndose al Ag- Ro y Ag-La cardíacos, afectando al miocardio y al tejido de conducción y produciendo inflamación (miocarditis), arritmogénesis y posteriormente fibrosis. Todo ello justifica la lesión cardíaca estructural e irreversible1,3,5, tan severa que hasta en un 10-15% de la descendencia afectada puede desarrollar cardiomiopatía con riesgo vital6. La mujer puede estar asintomática en el momento del nacimiento del hijo afecto, pero en el 30-60% de los casos desarrollará la enfermedad autoinmune2,3,5 incluso años después del parto1. Los Ac anti-SSA/Ro no se consideran dañinos para el corazón adulto7.
En la actualidad se han definido como factores de riesgo para BCC:
- 1.
El diagnóstico previo de BCC en algún miembro de la descendencia
- 2.
Presencia de títulos elevados de Ac anti-Ro en suero materno (superiores a 1:16)
- 3.
Presencia de Ac anti-Ro+(SS-A) acompañados de Ac anti-La (SS-B) en suero materno.
- 4.
Presencia de ciertos haplotipos HLA (HLA-DR3)1 que facilitan la síntesis de Ag Ro (por sí misma no es causa única de BCC1).
Se realiza con ecografía, con Doppler pulsado o modo M1, que permite corroborar la existencia de una bradicardia fetal (frecuencias sostenidas inferiores a 120 lpm), con disociación de la sincronía de la contractilidad auricular y ventricular6. En casos graves, el bloqueo se acompaña de signos de insuficiencia cardíaca: ascitis, derrame pericárdico, hidrops, polihidramnios y finalmente muerte fetal1.
El seguimiento se realiza también con ecografía, que nos permite la valoración del estado hemodinámico fetal y un manejo perinatal óptimo1.
Tratamiento médico fetalNo existen guías clínicas establecidas, pero el tratamiento debería estar orientado a la reducción de la repuesta inflamatoria generalizada y a la prevención de la fibrosis6.
Los corticoides favorecen la maduración pulmonar fetal y contribuyen a disminuir el nivel de anticuerpos maternos, reduciendo el componente inflamatorio originado por el mecanismo inmunológico1,2. La dosis, duración del tratamiento y tipo de corticoide no están establecidas. Los esteroides fluorados (dexametasona y betametasona) permanecen activos en la circulación fetal2 y pueden aumentar significativamente la supervivencia en fetos con BCC completo7.
- •
Los simpaticomiméticos como el Ritodrine pueden incrementar la frecuencia cardíaca en el 15-50% de los casos, aunque no restauran la coordinación de la conducción AV2.
- •
La plasmaféresis es capaz de disminuir significativamente los títulos de Ac maternos, pero no se ha utilizado independientemente de los corticoides2.
El BCC no condiciona la conducta obstétrica en el momento del parto, salvo en casos de sufrimiento fetal agudo, hidrops o insuficiencia cardiaca congestiva, en los que estaría indicada la finalización mediante cesárea.
El control del bienestar fetal intraparto se realiza con pulsioximetría o control gasométrico seriado de feto1. El parto debería ser en un centro de nivel III.
PrevenciónDesde la perspectiva clínica hay una clara necesidad en la búsqueda de un marcador temprano del BCC. Se investigó la anormalidad del intervalo PR, la regurgitación tricuspídea y la hiperrefringencia atrial, sin poder establecer su utilidad real4. La auscultación fetal cada 15 días desde las 16 semanas de gestación en mujeres con factores de riesgo permite iniciar precozmente la corticoterapia en situaciones de bloqueo para evitar que la lesión en las fibras de conducción sea irreversible.
Consejo preconcepcionalEn las pacientes con anticuerpos anti-Ro y/o anti-La es determinante valorar el riesgo fetal de presentar BCC:
- -
mujer con Ac anti-SSA/Ro: 2%6,
- -
mujer con Ac anti-SSA/Ro y anti-SSB/La: 5%,
- -
mujer con un hijo afecto previamente de BCC o lupus neonatal: 20%2,5–8.
Las madres con Ac anti-Ro tienen riesgo de tener un niño afecto de síndrome de lupus neonatal, cuyas manifestaciones sistémicas generalmente se resuelven sin secuelas excepto el bloqueo cardíaco, que puede ser permanente y requerir la implantación de un marcapasos en aproximadamente el 67% de los casos7.
Se han barajado varias alternativas de tratamiento profiláctico en gestantes de riesgo6 como la plasmaféresis, los esteroides fluorados, inmunosupresores (azatioprina) o la gammaglobulina con administración antes de las 20-22 semanas, pero ninguno de ellos ha demostrado una eficacia tal que justifique su costo o los efectos adversos presentados (pendiente de resultados de estudios prospectivos con inmunoglobulinas)5.
Morbilidad y mortalidadLa tasa de mortalidad en el BCC es similar en los casos con Ac anti-Ro/La positivos o negativos (33,3 vs 27,8%)5 y tiene lugar principalmente intraútero y en los primeros meses de vida, estimándose entre un 16 y un 19%4,6. Entre los supervivientes afectos, hasta el 67% necesitarán un marcapasos permanente antes de la vida adulta4,6.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.