El tamoxifeno es un modulador selectivo de los receptores estrogénicos, utilizado con la intención de reducir las tasas de recurrencia y mortalidad de pacientes con cáncer de mama y receptores hormonales positivos. A nivel de ovario y endometrio actúa como agonista estrogénico por lo que no está exento de efectos secundarios. Presentamos un caso clínico de una paciente con cáncer de mama, premenopáusica hasta el inicio del tratamiento, que desarrolló tumoraciones anexiales complejas que obligaron a indicar una laparoscopia diagnóstica y a descartar un nuevo proceso oncológico a nivel de ambos ovarios. La paciente, además, presentaba como antecedentes un trasplante renal por nefropatía y tratamiento inmunosupresor. Hemos revisado la bibliografía al respecto valorando las posibles asociaciones entre dichos procesos.
Tamoxifen is a selective modulator of estrogen receptors and is used to reduce recurrence and mortality rates in breast cancer patients with positive hormone receptors. This drug acts as an estrogen receptor agonist in the ovaries and endometrium and can produce some adverse effects. We report the case of a breast cancer patient, who was premenopausal until the beginning of the treatment and who developed bilateral complex adnexal cysts, requiring a diagnostic laparoscopy to exclude a new oncologic process in the ovaries. The patient had previously received a kidney transplant for nephropathy and immunosuppressive therapy. We review the literature on the topic and evaluate the possible associations between these processes.
El tamoxifeno es un modulador selectivo de los receptores estrogénicos que muestra actividad antiestrogénica en el tejido mamario y actúa como agonista estrogénico en otras localizaciones como el endometrio y el ovario, favoreciendo el desarrollo de pólipos, hiperplasia e incluso cáncer a nivel endometrial y la formación de quistes a nivel ovárico1. No obstante, el tamoxifeno es ampliamente utilizado como hormonoterapia adyuvante en el cáncer de mama con receptores hormonales positivos, tanto en mujeres premenopaúsicas como posmenopaúsicas, ya que reduce las tasas de recurrencia y mortalidad1.
La incidencia de cáncer en pacientes trasplantadas renales es mayor que en la población general, siendo el riesgo de padecer cáncer de mama en estas pacientes similar al de aquellas mujeres 20-30 años mayores que la población no trasplantada. Las terapias inmunosupresoras que reciben son la principal causa del aumento de cáncer e infecciones en este grupo de pacientes.
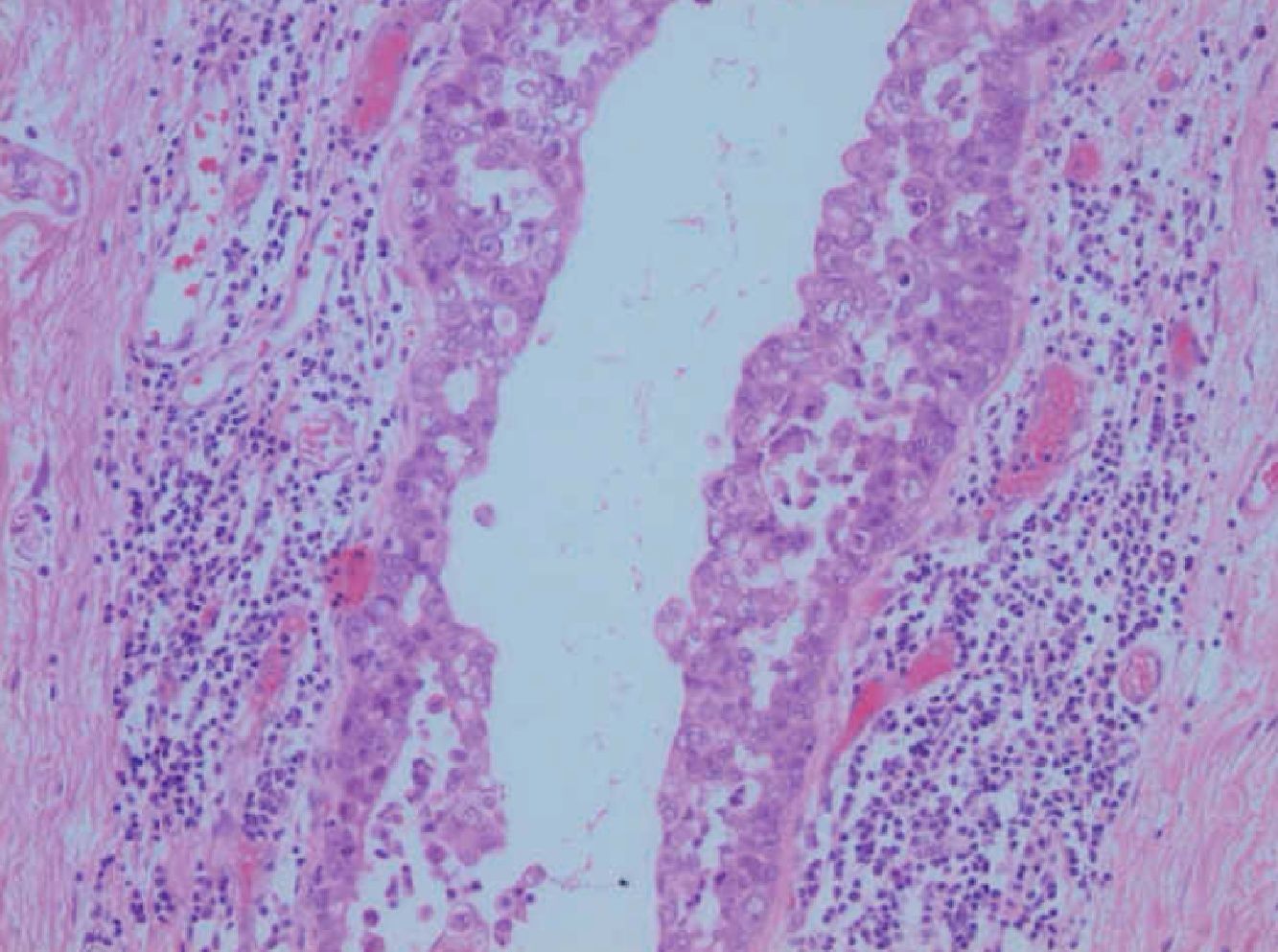
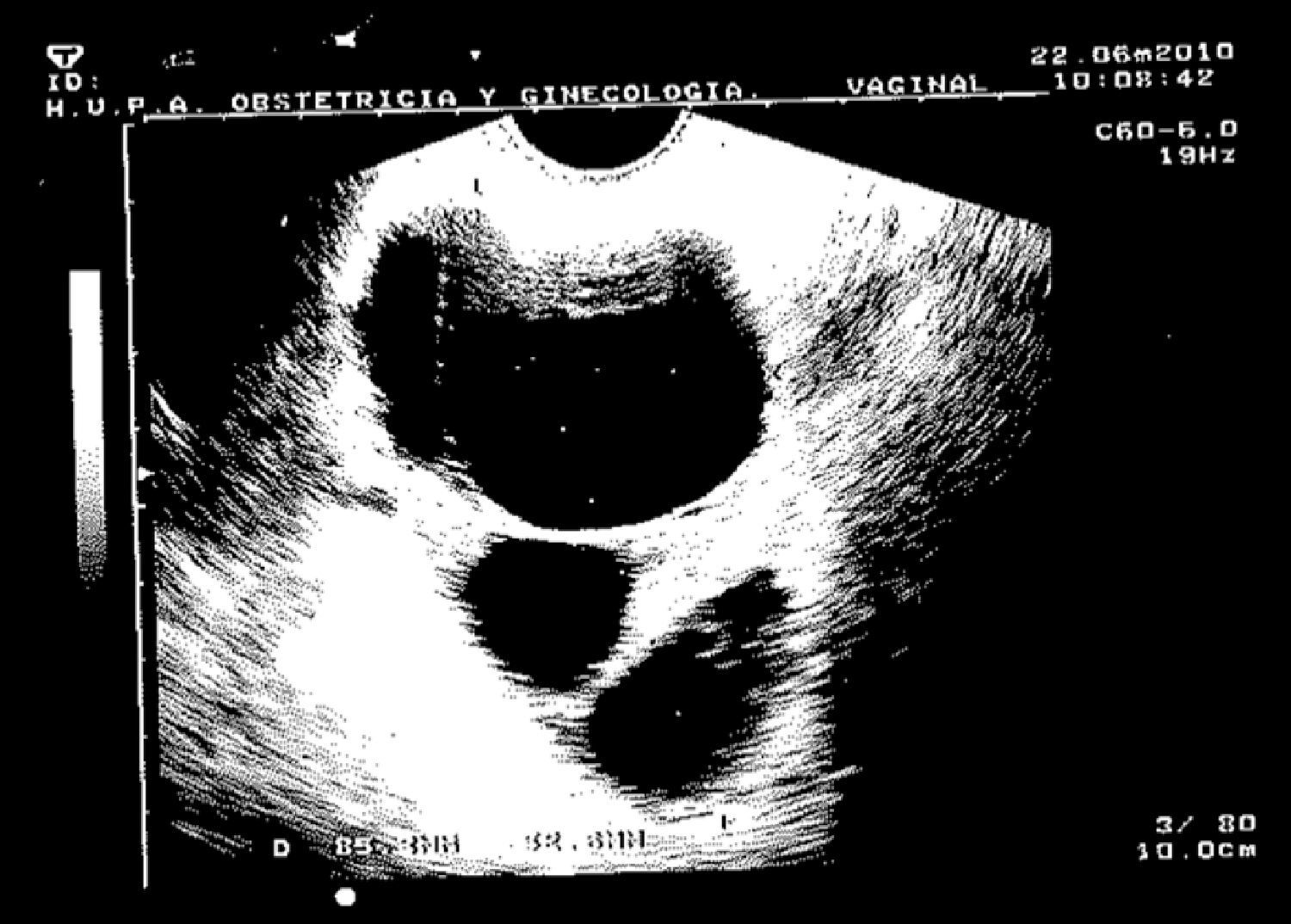
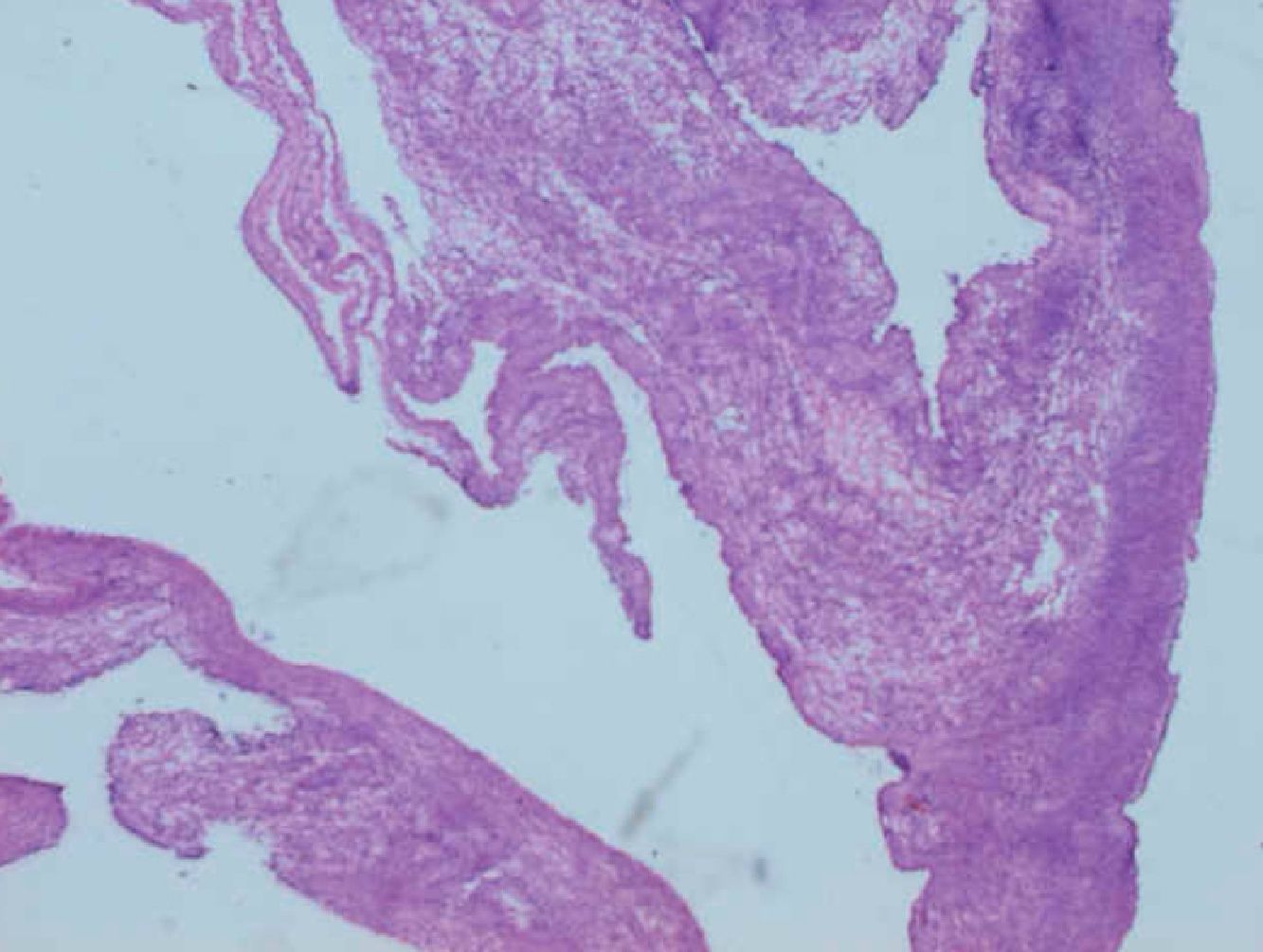
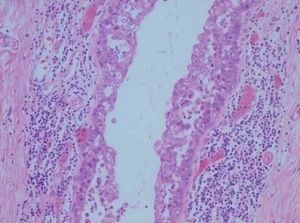
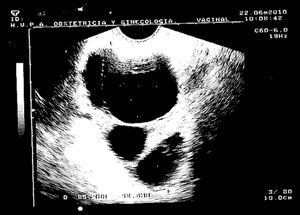
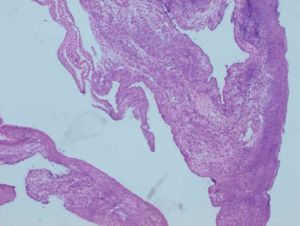
Caso clínicoPaciente de 45 años que fue remitida a consulta de Ginecología del Hospital Príncipe de Asturias por presentar microcalcificaciones extensas sospechosas de malignidad en cuadrante inferoexterno de mama derecha, en agosto de 2009. Como antecedentes personales fue sometida a transplante renal en 1995 por nefropatía intersticial, y posteriormente realizó tratamiento crónico con inmunosupresores. Entre sus antecedentes ginecológicos encontramos miomectomía, tipo menstrual 4/28 y nuligesta. En septiembre se realizó biopsia dirigida por arpón de dichas calcificaciones que se diagnosticaron anatomopatológicamente de carcinoma intraductal (CID) grado iii, de 15mm que alcanzó bordes quirúrgicos. Ante el diagnóstico de un CID extenso (fig. 1) y con bordes afectos, se indicó una mastectomía total simple de mama derecha y reconstrucción inmediata con prótesis junto con biopsia selectiva de ganglio centinela (BSGC). La BSGC fue informada de negativa para malignidad. El estudio inmunohistoquímico reveló positividad del 70% para receptores de estrógenos y progesterona y ki 67 del 15%. Tras presentar el caso en el Comité de tumores se decidió ofertar tratamiento hormonal adyuvante con tamoxifeno. En la primera revisión, abril de 2010, a los 6 meses de la cirugía, la paciente refirió amenorrea sin clínica climatérica, en la exploración ginecológica, se objetivó un discreto aumento de tamaño de los ovarios que fue confirmado mediante el estudio ecográfico. En la ecografía transvaginal se detectaron tumoraciones anexiales bilaterales de 35mm y 67mm respectivamente, de aspecto funcional. Se solicitaron marcadores tumorales (CEA, Ca 125, Ca 19,9) que resultaron normales. Tras 2 meses, se reexploró a la paciente y se constató el crecimiento de ambas tumoraciones anexiales, (fig. 2) con tamaños de 105mm y 73mm respectivamente, de aspecto complejo y endometrio de aspecto irregular ligeramente engrosado. Ante dichos hallazgos, se indicó laparoscopia (LPS) diagnóstico-terapeútica y retirada de tamoxifeno. En la LPS diagnóstica se objetivaron 2 tumoraciones anexiales sin características quirúrgicas de malignidad, se realizó toma de citología peritoneal, anexectomía bilateral, extracción de piezas quirúrgicas intrasaco endoscópico y biopsia intraoperatoria que fue informada de benignidad, junto con histeroscopia y biopsia en el mismo acto quirúrgico. El estudio anatomopatológico en diferido estableció el diagnóstico de quiste simple (fig. 3) en ambos ovarios, ambas trompas sin alteraciones relevantes y en la biopsia de endometrio hiperplasia simple endometrial. Actualmente, recibe tratamiento inmunosupresor y acude a revisiones ginecológicas. Se ha realizado ecografía de control confirmándose un endometrio lineal de 2mm y biopsia ambulatoria de control con diagnóstico de endometrio atrófico.
DiscusiónActualmente, la hormonoterapia adyuvante en el cáncer de mama se recomienda en todas las pacientes en las que los tumores muestran signos de hormonosensibilidad, es decir, la presencia de cualquier nivel de receptores hormonales detectable. En casos de CID hormonosensible se recomienda la hormonoterapia con tamoxifeno durante 5 años ya que ha demostrado reducir el riesgo de recurrencia de tumor en la mama ipsilateral y de la aparición de cáncer en la mama contralateral. La relación riesgo-beneficio del tamoxifeno varía con la edad y resulta más favorable en mujeres premenopáusicas2,3.
Aunque la hormonoterapia con tamoxifeno es ampliamente utilizada en la clínica habitual porque evita la progresión de la enfermedad, la experiencia revela efectos secundarios relevantes a nivel endometrial y ovárico. Se ha demostrado que el tamoxifeno favorece la aparición de quistes ováricos, sobre todo en pacientes premenopaúsicas, tras la toma del mismo durante más de 3 meses1,4–6. Se ha observado que el tamoxifeno induce una esteroidogénesis masiva a nivel ovárico que produce niveles suprafisiológicos de 17β- Estradiol, y que lo hace actuando directamente en el ovario ya que las cifras de FSH y LH suelen ser normales. Esta acción directa sobre los ovarios puede ser la causa de la aparición de quistes en los mismos, produciéndose una estimulación excesiva de folículos ováricos y por tanto niveles elevados de estradiol y múltiples ovulaciones. Este efecto del tamoxifeno suele producirse en ovarios capaces de responder al mismo, sobre todo, en pacientes premenopaúsicas que no hayan recibido altas dosis de quimioterapia. La mayoría de casos presentes en la literatura suelen ser quistes ováricos asintomáticos y de aspecto ecográfico funcional4,5. A nivel endometrial, el tamoxifeno estimula la proliferación del mismo incrementando el riesgo de pólipos, hiperplasia y carcinoma endometrial entre 2-4 veces el riesgo de aquellas pacientes que no lo reciben. El riesgo de este aumenta en pacientes posmenopaúsicas, se incrementa con la dosis acumulada y la duración del tratamiento1,6.
Por estos efectos adversos descritos, todas las pacientes tratadas con tamoxifeno han de someterse a un control ginecológico. En casos en los que aparezcan quistes ováricos, la discontinuación del tratamiento con tamoxifeno y/o la administración de agonistas de la GnRH junto con seguimiento ecográfico son las conductas a tomar en la mayoría de estas pacientes, reservando la cirugía a aquellas que presentan quistes persistentes, bilaterales, de gran tamaño o complejidad. Siendo datos de complejidad las alteraciones morfológicas como quistes multiloculados, excrecencia papilar o elementos sólidos, junto con alteraciones en la ecografía doppler color con flujos vasculares con un índice de resistencia <0,4 y/o índice de pulsatilidad <14,5.
En los pacientes con trasplante renal, como es nuestro caso, o en tratamiento con diálisis, la aparición de cáncer está favorecida por el estado urémico crónico y la exposición a inmunosupresores. La incidencia de cáncer en estos pacientes está incrementada, siendo el riesgo de aparición de los tumores más comunes, entre ellos el cáncer de ovario, tres veces el riesgo de la población general7–9. En cuanto al cáncer de mama, el riesgo se asemeja al riesgo de las mujeres de la población general 20-30 años mayores10, por lo que sería interesante el estudio de la incidencia, tratamiento y supervivencia del cáncer de mama en dicha población de trasplantados renales para así establecer un correcto método de screening.
La tasa de supervivencia en estos pacientes tras la aparición de cáncer, excluyendo los carcinomas cutáneos, es del 38% a los 5 años, respecto al 82,5% de la población no transplantada7,8.
Los fármacos inmunosupresores inhabilitan la capacidad del sistema inmune de eliminar células transformadas que desarrollarán un tumor y además tienen efecto oncogénico directo, como se ha objetivado en pacientes tratados con ciclosporina. En pacientes en tratamiento con inmunosupresores y quimioterapia, el tratamiento y ajuste de dosis es todavía hoy un auténtico dilema, plantear reducir la dosis de los primeros para limitar la mielosupresión y la toxicidad farmacológica, puede suponer por contrapartida un aumento del riesgo de rechazo al órgano transplantado, se requieren más estudios que puedan aportar nuevas alternativas a situaciones tan particulares10.
La existencia de un trasplante renal obliga según la bibliografía a un screening más precoz y continuado en dichas pacientes, dado que, como ya hemos comentado, el estado inmunosupresor puede favorecer la aparición de diversos cánceres, entre ellos debemos considerar por su frecuencia, el de mama y el de ovario.
Cuando coexisten en la misma paciente un estado inmunosupresor, con la toma de tamoxifeno, el seguimiento debe ser especialmente cuidadoso y si aparecen nuevos procesos tumorales deben practicarse todas las pruebas diagnosticas pertinentes que ayuden a descartar la presencia de otra neoplasia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.