El carcinosarcoma ovárico, también conocido como tumor maligno mixto mesodérmico o tumor mülleriano, es el menos frecuente y el más complejo de tratar. Representa del uno al 4% de todos los tumores ováricos. No hay muchos estudios aleatorizados al respecto, así como tampoco grandes ensayos clínicos. Su tratamiento se basa en publicaciones de casos, estudio de series retrospectivas o extrapolaicones del tratamiento aplicado en otras tumoraciones con un proceso patológico similar en otras localizaciones. A continuación se presenta un caso clínico que los autores de este artículo diagnosticaron y trataron, y que esperan pueda contribuir a ampliar la experiencia en este tipo de tumores.
Carcinosarcoma of the ovary, also known as malignant mixed mesodermal or Müllerian tumors, are the least frequent and most complex ovarian neoplasms to treat. These tumors account for 1–4% of all ovarian masses. There are few randomized studies or large clinical trials. Therefore, management is based on case reports, series of retrospective studies, or extrapolations from neoplasms with similar characteristics in other locations. We present a case of carcinosarcoma of the ovary diagnosed and treated in our department with a view to increasing the experience reported with this type of tumor.
Las neoplasias primarias ováricas son la causa de la mayor parte de las muertes por neoplasias genitales en mujeres.
Los tumores más frecuentes son las neoplasias de estirpe epitelial (NEO); sin embargo, en el ovario pueden desarrollarse otros tipos de neoplasias, como los tumores de la granulosa, del estroma, de los cordones sexuales y los carcinosarcomas.
Los carcinosarcomas ováricos (CSO) se pueden denominar también tumores malignos mixtos mesodérmicos o tumores malignos mixtos müllerianos, y son las neoplasias ováricas menos frecuentes y más complejas de tratar. Representan del uno al 4% de todos los tumores ováricos.
No se dispone de muchos estudios aleatorizados y es difícil esperar que se realicen ensayos clínicos a gran escala, por lo que el tratamiento se realiza a partir de publicaciones de casos, series retrospectivas o extrapolaciones de neoplasias de proceso patológico similar en otras localizaciones.
Caso clínicoEn septiembre de 2006 acude a la consulta de oncología una mujer de 49 años sin antecedentes personales de interés, con diagnóstico de carcinosarcoma ovárico pT1CN0M0 estadio ic, tras histerectomía, doble anexectomía y linfadenectomía de cadenas ilíacas primitiva, presacra ilíaca interna derecha y presacra ilíaca interna izquierda.
Se le realizaron estudios tras encontrar una masa ovárica derecha en el examen ginecológico habitual.
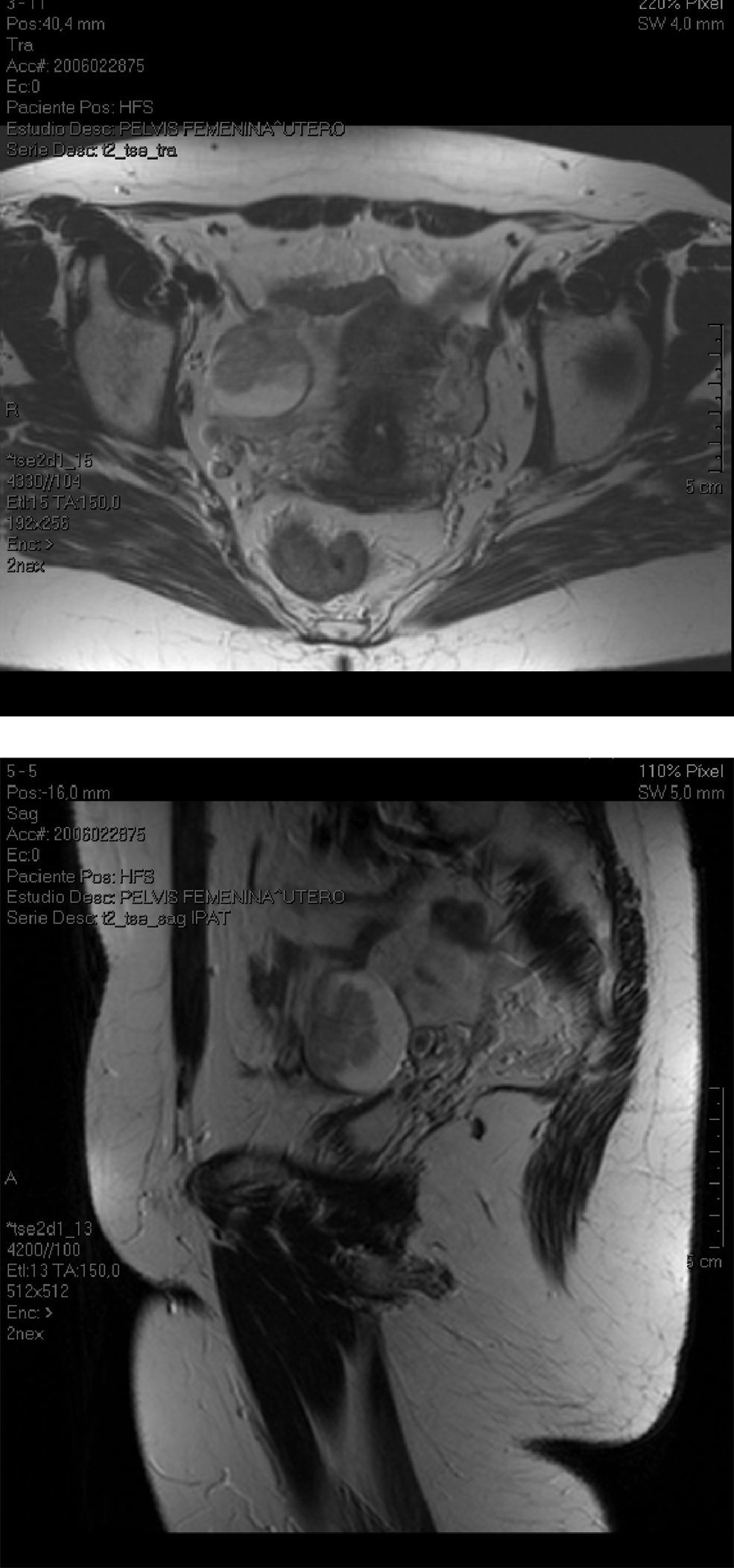
Previamente a la intervención, se habían realizado varios estudios, entre éstos, una resonancia magnética pélvica el 6 de junio de 2006, en la que se observó una lesión de componente quístico, con una clara porción sólida, vegetante, abigarrada, que crecía hacia el interior de la lesión (fig. 1). Los diámetros de la lesión eran de 4×4×3,5cm, ésta se presentaba dependiente del ovario derecho y demostraba la existencia de neoplasia primaria ovárica. Los ganglios bilaterales eran visibles y, aunque no aparecían claramente aumentados de tamaño, no se descartó su afectación. La visualización del ovario izquierdo era mala.
También se había realizado una tomografía por emisión de positrones con tomografía computarizada (TC) el 27 de junio de 2006. Su resultado mostró una masa dependiente del ovario derecho, con características de malignidad y con afectación únicamente local. Una TC de abdomen y pelvis, realizada el 4 del agosto de 2006, no mostró signos de extensión a distancia.
La analítica general con marcador tumoral monoclonal del cáncer de ovario (CA125) no presentó alteraciones reseñables y fue de 20,2U/ml (rango de 0 a 35).
La cirugía se realizó el 13 de julio de 2006; el resultado anatomopatológico fue el siguiente:
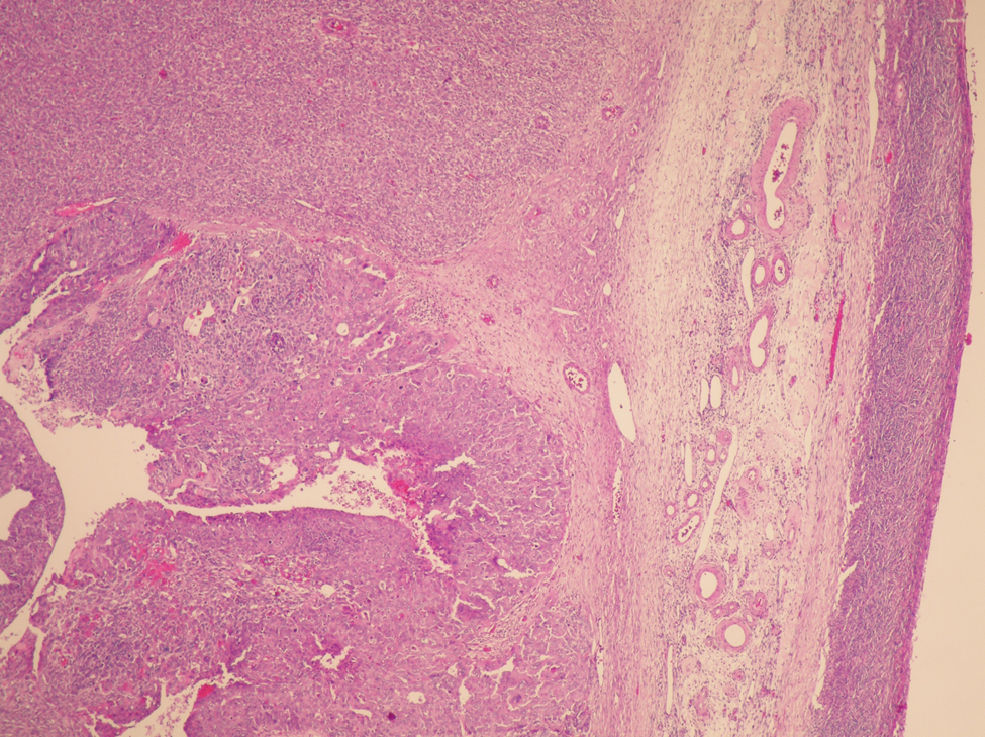
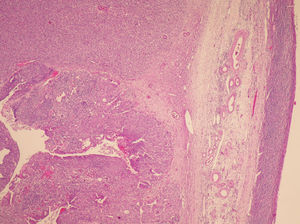
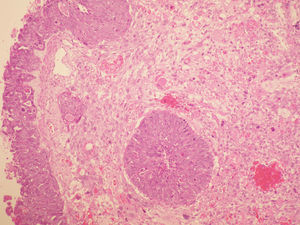
La anatomía patológica (figs. 2 y 3) del anexo derecho (macroscópica) fue un ovario aumentado de tamaño, con superficie nodular de 4,5×4,5×3cm que a los cortes seriados mostraba una cavidad quística sin líquido, ocupada por una tumoración blancoamarillenta aumentada de consistencia que, focalmente, mostraba una superficie papilar dura. No se observaron focos macroscópicos de necrosis ni de hemorragia.
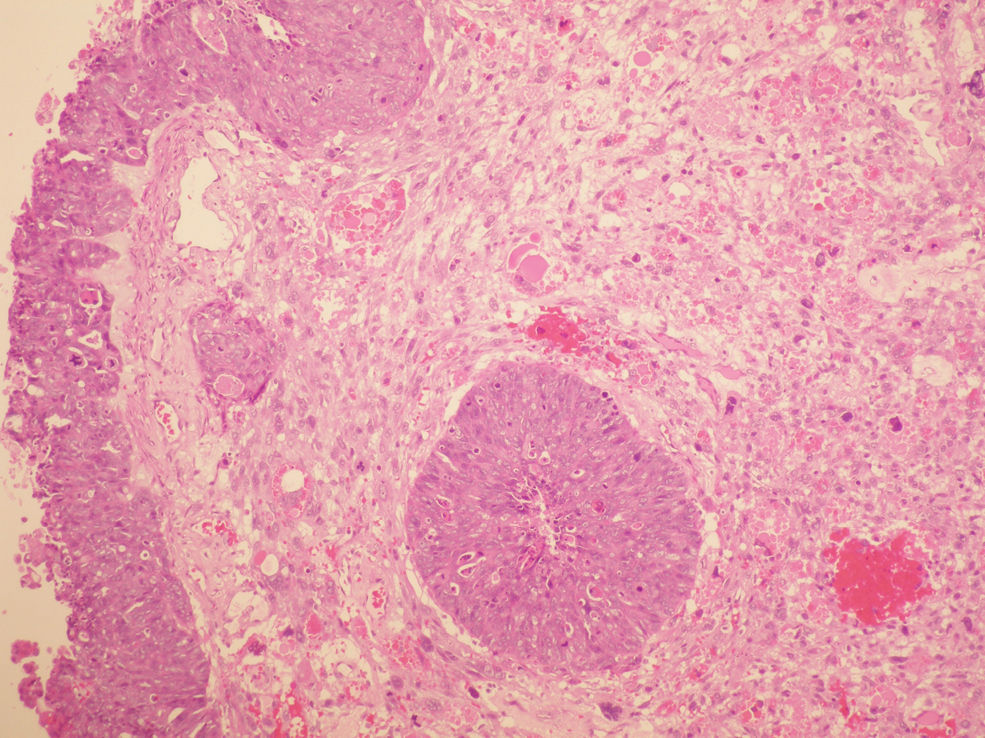
La anatomía patológica del anexo derecho (microscópica) fue un tumor maligno escasamente diferenciado que presentaba 2 componentes: mesenquimal y epitelial. El componente epitelial mostraba un patrón sólido indiferenciado (el más frecuente), papilar y de tipo endometrioide, constituido por células con núcleos hipercromáticos, con pleomorfismo marcado y apoptosis frecuente, amplios focos de necrosis y actividad mitótica elevada con frecuentes mitosis atípicas. El componente mesenquimal mostraba áreas de tipo fibrosarcoma, histiocitoma fibroso maligno y sarcoma de alto grado. El tumor infiltraba masivamente todo el ovario con imágenes que sugerían invasión vascular; el ovario contralateral mostraba implantes en una serosa y pequeña glándula subepitelial con marcada atipia.
El resto de la muestra remitida mostró un cérvix con metaplasia escamosa y focos de inflamación crónica, endometrio atrófico, pero no hubo otros hallazgos de interés. Se aisló un total de 5 ganglios linfáticos con extensa sustitución adiposa, sin signos de infiltración neoplásica.
La anatomía patológica de la cavidad abdominal (epiplón, peritoneo, posible implante peritoneal, apéndice cecal, adenopatías, lavado) no presentó células malignas.
La patología se remitió para su revisión a un centro de referencia, donde se confirmó el diagnóstico.
Se comezó tratamiento quimioterapéutico: tras la finalización de la cirugía, se envió a la mujer a la consulta de oncología y, tras su valoración, se propuso iniciar la quimioterapia con esquema carboplatino 7AUC con una dosis de taxol de 225mg/m2 cada 21 días hasta completar 6 ciclos.
La mujer inició la quimioterapia el 28 de septiembre de 2006 y la finalizó el 29 de enero de 2007. Como toxicidad más reseñable, presentó alopecia grado 3, neutropenia grado 3 (que motivaron retrasos en la administración de los ciclos, por lo que se requirió soporte con factores estimulantes de colonias de granulocitos) y toxicidad digestiva grado 2, motivos por los que la dosis total administrada se redujo en un 25% en los ciclos quinto y sexto.
Durante los ciclos de quimioterapia se realizaron analíticas el día previo del ciclo (incluido el CA 125) y el marcador no mostró cifras por encima de 11,6 en ninguna determinación.
En marzo de 2007 se realizó control con anamnesis, exploración física, estudio radiológico con TC y analítico, incluido el CA 125; no se encontraron alteraciones que indicaran recaída de su enfermedad.
Revisión de la literatura médicaPresentación clínica e historia naturalLa mayoría de los casos se producen en mujeres con edades comprendidas entre la sexta y la séptima década de vida1,2.
La estadificación se realiza de manera similar a la de las neoplasias de ovario (según la Federación Internacional de Ginecología y Obstetricia [FIGO])3; sin embargo, suelen diagnosticarse con estadios más avanzados (iii, iv)4 y con peor índice en la escala de Karnofsky.
El CA 1251,3 está generalmente elevado, por lo que este marcador no es útil en la diferenciación entre los CSO y las NEO. Sin embargo, el CA 125 no se ha validado para los CSO, a pesar de que podría ser útil en el seguimiento.
Contrariamente a los sarcomas (que habitualmente metastatizan en los pulmones) los CSO se comportan de manera similar a las NEO5.
Al compararlos por estadio, el pronóstico parece ser peor para los CSO. Sin embargo, no se dispone de datos concluyentes.
En las series más amplias (n=47)4, el 72% de las mujeres había presentado recaídas a los 10,5 meses y, virtualmente, todas presentaron recaídas tras 2 años. La supervivencia media fue de 16 meses (24 a 36 meses en las mujeres con NEO).
En estos trabajos, la supervivencia fue mayor en las mujeres con cirugía citorreductiva completa (CRC). Este factor fue el factor pronóstico más relevante, así como los valores bajos del CA 125 y el hecho de haber recibido quimioterapia con platinos.
Anatomía patológicaLos CSO son tumores complejos, con elementos de carcinoma y de sarcoma. El diagnóstico puede realizarse habitualmente con microscopia óptica. Los tumores que presentan únicamente elementos sarcomatoides se clasifican como sarcomas ováricos, y probablemente deban tratarse como el resto de los sarcomas. Ocasionalmente, puede confirmarse el diagnóstico y requerir técnicas de inmunohistoquímica, particularmente en caso de tumores escasamente diferenciados. Típicamente, el componente epitelial es positivo para citoqueratinas (CK) y es rara su positividad para vimentina; esta última es altamente positiva en el componente sarcomatoide6. Una positividad para CK7 y una negatividad para CK20 indicarían estirpe mülleriana. Ocasionalmente, el perfil inmunohistoquímico puede superponerse al de los otros tumores epiteliales del tracto genital femenino7.
En ocasiones, el antígeno CD34 puede ser útil para la diferenciación con sarcomas epitelioides, dado que estos últimos expresan fuertemente CD348.
CirugíaEl papel de la CRC no ha sido evaluado de manera prospectiva en los CSO. En un trabajo retrospectivo reciente, que incluye a 31 mujeres9 con estadios iiic según la FIGO, la CRC se asoció a una mayor supervivencia. En otro estudio1, las mujeres con CRC y estadio III tuvieron mayor supervivencia (14,8 frente a 3,1 meses; p>0,001). Por otro lado, se ha indicado que las complicaciones postoperatorias podrían ser más importantes dado que las lesiones metastásicas tienden a ser friables y hemorrágicas3.
En la experiencia del grupo de Eisenhauer et al10 se pudo realizar una CRC únicamente en el 68% de las mujeres en estadios III o IV.
En este trabajo, la supervivencia media de las mujeres con CRC óptima fue de 84 meses frente a 37 en las que no se realizó una CRC.
La mayor supervivencia comunicada ha sido la que publicaron Molk et al11 en 10 mujeres con CRC completa y tratamiento adyuvante.
Tratamiento quimioterapéutico (tabla 1)Rutledge et al9 han revisado el papel en los CSO de las quimioterapias que incluyen platinos y demostraron unas respuestas globales del 68% para los tratamientos con platino y del 23% para los tratamientos sin platino.
| Quimioterapia | Estadios | Respuestas (%) | Supervivencia | |
| MSKCC 2007 | Platinos con taxanos | III/IV | 63 | 43 meses |
| GOG 2000 | Cisplatino con ifosfamida | 54 | ||
| Ifosfamida | III/IV | 36 | ||
| Homesley 2007 | Ifosfamida con paclitaxel | III/IV | 45 | 13,5 meses |
| Ifosfamida | 29 | 8,4 meses |
GOG: Gynecologic Oncology Group; MSKCC: Memorial Sloan-Kettering Cancer Center.
La mayoría de los expertos opinan que los platinos son un componente integral de la quimioterapia de primera línea para estas mujeres, mientras que el tratamiento óptimo en combinación no está claramente definido. Otro agente activo en este contexto es la ifosfamida12.
Otros grupos, como el de Duska et al12, trataron a mujeres (n=28) con platinos y taxanos, y reportaron una tasa de respuesta global del 72% con una supervivencia global de 27,1 meses.
1. Experiencia del Memorial Sloan Kettering Cancer Center
El grupo de Leisr del Memorial Sloan Kettering13, ha comunicado su experiencia con 30 mujeres tratadas entre 1991 y 2005. Veinticuatro mujeres estaban diagnosticadas con estadios iii, 5 mujeres con estadios iv y una mujer con estadio ii. Todas ellas entraron en programa de CRC. Al 57% se le realizó citorreducción a menos de 1cm. Veintiocho mujeres recibieron quimioterapia tras la cirugía, y 2 mujeres recibieron quimioterapia antes de la cirugía.
Veinticuatro mujeres siguieron tratamiento quimioterapéutico con carboplatino y paclitaxel, 3 mujeres con carboplatino y docetaxel, y 3 mujeres con cisplatino y paclitaxel. Doce mujeres tuvieron respuestas clasificadas como completas, 7 tuvieron respuestas clasificadas como parciales, 2 mujeres presentaron enfermedad estable y 9 mujeres (30%) presentaron progresión de su enfermedad. La tasa de respuesta global fue del 63%.
El intervalo libre a la progresión de las mujeres con respuesta fue de 12 meses. Con un seguimiento medio de 23 meses, la supervivencia global fue de 43 meses.
La supervivencia media a 3 y 5 años fue del 53 y del 30%, respectivamente.
2. Estudio del Gynecologic Oncology Group14
En este estudio del Gynecologic Oncology Group (GOG), se aleatorizaron las mujeres que irían a quimioterapia con ifosfamida asociada o no a cisplatino; esto con la intención de cuestionar si la combinación podía ser superior a la monoterapia. La ifosfamida se administró en dosis de 1,5g/m2/día durante 5 días cada 3 semanas y el cisplatino se administró en dosis de 20mg/m2/día durante uno a 5 días cada 3 semanas.
Se aleatorizaron 224 mujeres; 30 de ellas no fueron elegibles. Hubo 6 muertes atribuibles a la quimioterapia en el grupo de cisplatino. Los datos de supervivencia libre de progresión favorecieron al grupo con cisplatino, pero a cambio de una mayor toxicidad hematológica, neuropática y del sistema nervioso central.
Dados los resultados, no se consideró que estuviese justificado el uso de la combinación de cisplatino con ifosfamida.
3. Esquema con ifosfamida y paclitaxel
Homesley et al15 aleatorizaron 214 mujeres con enfermedad medible en estadios iii y iv (de las que 179 fueron evaluables), distribuidas en 2 grupos de 91 y 88 mujeres, respectivamente.
En el primer grupo, las mujeres recibieron tratamiento con ifosfamida en dosis de 2gr/m2/día durante uno a 3 días; en el segundo grupo, las mujeres recibieron tratamiento con ifosfamida en dosis de 1,6gr/m2/día durante uno a 3 días junto con una dosis de 135mg/m2 de paclitaxel en un día.
La tasa de respuesta se estableció en el 29% en el grupo con monoterapia y en el 45% en el grupo con quimioterapia de combinación. El intervalo libre a la progresión fue de 3,6 meses en el grupo de ifosfamida frente a 5,8 meses en el grupo de combinación. La supervivencia media en el grupo de monoterapia fue de 8,4 meses frente a 13,5 meses en el grupo de quimioterapia de combinación. Hubo un 31% de reducción del riesgo relativo de muerte, y un 29% de reducción de la progresión en el grupo de poliquimioterapia con respecto al grupo de monoterapia cuando se estratificaron las mujeres por su índice en la escala de Karnofsky.
Las toxicidades se consideraron tratables; la más relevante fue la neutropenia (57 mujeres de 88 en el grupo de monoterapia presentaron neutropenia grado 3 o 4, y 38 mujeres de 86 presentaron neutropenia en el grupo de combinación), seguida por anemia, que se encontró en grado 4 en 13 mujeres.
4. Adyuvancia
A pesar de que dentro de algunos estudios previamente comentados se han incluido mujeres con estadios i y ii, no se dispone de trabajos aleatorizados o estudios que comparen diversas pautas de quimioterapia. Dentro del contexto de la adyuvancia, destaca el estudio del GOG16, en el que se incluye un total de 76 mujeres, 69 de ellas evaluables, en estadios i y ii.
Las mujeres recibieron quimioterapia con ifosfamida en dosis de 1,5gr/m2/día durante uno a 5 días y cisplatino en dosis de 20mg/m2/día durante uno a 5 días cada 3 semanas en 3 ciclos. Posteriormente, las dosis se redujeron un 20% debido a mielotoxicidad. Cincuenta mujeres presentaban estadios i y 15 mujeres (23%) presentaban estadios ii.
El intervalo libre a la progresión y la supervivencia global fueron del 69 y del 82% a los 24 meses, y del 54 y del 52% a los 84 meses. La supervivencia global fue del 62% a los 5 años.
En este trabajo se describieron recaídas pélvicas frecuentes.
Discusión y conclusionesEl CSO no es una enfermedad frecuente y en el momento actual no se dispone de estudios que permitan instituir una pauta clara de tratamiento y seguimiento.
A la hora de establecer una actitud terapéutica global, se debe tener en cuenta la historia natural del CSO más concordante con el curso clínico de las NEO y considerar las opiniones de expertos17,18, según las cuales los CSO podrían ser catalogados dentro de las NEO, así como el impacto previamente comentado de la cirugía reglada de las NEO ováricas en el CSO.
De acuerdo con todos estos factores, se puede recomendar que las mujeres reciban inicialmente intervención siguiendo el modelo y las indicaciones de las NEO ováricas, es decir, con CRC.
El impacto de la quimioterapia en la supervivencia dentro de los estadios más avanzados que ofrecen los esquemas de quimioterapia en combinación con platinos, taxanos o ifosfamida, permite considerar como óptimo el hecho de que se incluya el uso de platinos con su asociación a taxanos como prioridad, tal y como es habitual en NEO.
Los estudios en estadios tempranos son escasos; el estudio del GOG16 no es aleatorizado y otros trabajos, como el de Rutledge9 o el de Duska12, han incluido en sus análisis a mujeres con estadios i y ii. A pesar de la escasez de datos, también pueden recomendarse las mismas pautas de quimioterapia utilizadas en estadios avanzados, así como implicar a las mujeres en la toma de la decisión final.
En cuanto al seguimiento que debe realizarse en estas mujeres, no se dispone de estudios adecuados para estandarizarlo, por lo que puede valorarse la realización de estudios de imagen y determinaciones del CA 125, como se acostumbra en NEO.