Los espermatozoides deben ser seleccionados antes de los procedimientos de reproducción asistida con el fin de seleccionar los mejores. El objetivo de este trabajo es comparar el efecto de la selección mediante gradiente de densidad y swim-up sobre el índice de fragmentación del ADN y el potencial de membrana mitocondrial de los espermatozoides humanos.
Materiales y métodosSe evaluaron los parámetros seminales convencionales y funcionales (potencial de membrana mitocondrial e integridad de la membrana plasmática) en espermatozoides seleccionados mediante gradiente de densidad y swim-up en 14 muestras seminales.
ResultadosLas muestras seleccionadas tenían menor número de espermatozoides recuperados comparadas con la muestra inicial: fue menor en el caso del swim-up respecto al gradiente. En contraste, se observó un incremento en la movilidad progresiva frente a la muestra inicial, sin diferencia estadística entre ambas metodologías. De otro lado, la técnica swim-up evidenció una disminución en el número de espermatozoides móviles no progresivos, aunque la técnica de gradiente permitió mejor recuperación de espermatozoides móviles seleccionados totales. Finalmente, se evidenció un incremento en el porcentaje de células con potencial de membrana mitocondrial alto y un menor índice de fragmentación del ADN.
ConclusiónEl presente estudio permitió evidenciar que la técnica de selección espermática de swim-up permite recuperar espermatozoides de mejor calidad, con mayor potencial de membrana espermática y menor fragmentación del ADN. Por lo tanto, se recomienda usar esta metodología previamente a una inseminación artificial o una fecundación in vitro.
To select good-quality sperm for assisted reproductive technology procedures, the best spermatozoa should be elicited. The aim of this study is to compare the impact of sperm selection on human sperm DNA fragmentation and mitochondrial membrane potential by means of density gradient and swim-up techniques.
Materials and methodsConventional and functional semen parameters (mitochondrial membrane potential and plasma membrane integrity) in sperm selected by density gradient and swim-up techniques in 14 semen samples were evaluated.
ResultsIn the selected neat semen samples, the number of sperm recovered was lower using swim-up as compared to density gradients. By contrast, an increase in progressive motility was observed compared with the initial sample, with no statistically significant difference between both techniques. On the other hand, the swim-up technique was shown to decrease the amount of non-progressive motile sperm recovered, whereas the density gradient technique allowed for a better recovery of the total motile sperm selected. Finally, an increase in the proportion of cells with higher mitochondrial membrane potential and lower DNA fragmentation index was observed.
ConclusionThe results of this study demonstrate that sperm selection using the swim-up technique allows for better-quality sperm to be recovered, with a higher sperm cell membrane potential and lower DNA fragmentation. The use of this method is therefore recommended prior to artificial insemination or in vitro fertilisation procedures.
Aproximadamente el 15% de las parejas que desean tener un hijo no logran el embarazo después de un año de tener relaciones sexuales sin anticoncepción; el factor masculino es responsable como factor único en cerca del 20% de las parejas infértiles y hasta en un 50% como factor asociado al femenino1.
En 1952 el ginecólogo Darío Sierra Londoño publicó en la revista Antioquia Médica el artículo de opinión titulado «El factor masculino en esterilidad»2, en el cual da la importancia y responsabilidad que el hombre merece como contribuyente en la infertilidad. Sin embargo, hoy, después de más de 64 años, aún existe en la mayoría de los hombres un temor a realizarse un análisis seminal con el fin de valorar su capacidad fecundante3-5.
En la mayoría de los casos en la práctica clínica, si el factor masculino está alterado se define por el hallazgo de alguna anormalidad en el espermograma6 y con certeza solo se puede hablar de infertilidad cuando se encuentra azoospermia. No obstante, es posible que otros factores masculinos influyan más que solo el número, la movilidad y la morfología espermática, debido a que existen hombres diagnosticados con infertilidad aun cuando sus parámetros seminales están por encima del límite inferior de referencia propuesto por la Organización Mundial de la Salud (OMS) en su «Manual para el análisis seminal de 2010»7-9.
La infertilidad de origen inexplicado ha abierto puertas a la investigación no solo de los factores femeninos involucrados sino también a profundizar en los masculinos, debido a que los parámetros seminales convencionales, que se difunden desde 1980 gracias a los esfuerzos de la OMS, no predicen con certeza ni la fertilidad del hombre7-9 ni el resultado de los procedimientos de reproducción asistida. El espermograma es, hasta la fecha, la única y mejor herramienta para evaluar el potencial fértil del hombre10, sin embargo, en los últimos años se han postulado pruebas funcionales espermáticas como herramientas importantes en la valoración del factor masculino3,11.
De otro lado, durante los procedimientos de reproducción asistida se requiere seleccionar los mejores espermatozoides, por lo que la técnica ideal para obtener este propósito debe ser confiable, rápida, no tóxica y rentable económicamente. La idea es seleccionar los mejores espermatozoides a través de la eliminación del plasma seminal y la separación de los espermatozoides móviles de los inmóviles, de los leucocitos, de las células germinales y de los detritos que pueden estar presentes en el líquido seminal. Las 2metodologías más ampliamente usadas son la selección mediante gradientes de diferente densidad y la técnica de selección basada en la capacidad de movimiento progresivo de los espermatozoides conocida como swim-up12.
Ambas técnicas de separación espermática seleccionan los espermatozoides con la mejor movilidad, lo cual se ha correlacionado con una mejor morfología espermática. Sin embargo, existen algunos parámetros funcionales —como la integridad del ADN espermático y el potencial de membrana mitocondrial— que permiten realizar una evaluación más precisa de las características funcionales de los espermatozoides seleccionados que les permitirán no solo fecundar al oocito sino la formación del nuevo embrión y poder llegar a un embarazo a término3,13.
El resultado del daño en la cromatina espermática y en el potencial de membrana mitocondrial no se logran evaluar en el análisis convencional previo a la realización de la fertilización in vitro o de la inseminación artificial.
Las pruebas comúnmente estudiadas para evaluar la integridad del ADN son la evaluación de la estructura de la cromatina coloreando con naranja de acridina (SCSA), la prueba TUNEL, el ensayo COMETA y la prueba de dispersión de la cromatina5,14. Los espermatozoides de los hombres fértiles con parámetros seminales normales usualmente tienen altos niveles de integridad del ADN, mientras que los hombres infértiles con parámetros seminales anormales tienen espermatozoides con alteración en la integridad del ADN4,5,11,15,16.
Por otro lado, el potencial de membrana mitocondrial permite evaluar la calidad de las mitocondrias —organelas encargadas de producir la energía para el movimiento de los espermatozoides— movimiento necesario en su viaje en busca del oocito. Durante este, los espermatozoides humanos sufren el proceso de capacitación espermática, evento indispensable para la fecundación y que se ha relacionado con cambios en el potencial de membrana mitocondrial16,17.
Un estudio publicado recientemente demostró variaciones en el potencial de membrana mitocondrial en respuesta al proceso de capacitación in vitro y demostró que existen diferentes poblaciones espermáticas en el eyaculado humano. Esto señala que evaluar el potencial de membrana mitocondrial permite entender mejor qué población de espermatozoides tiene mayor influencia sobre el proceso reproductivo y permite dar un mejor pronóstico acerca de la probabilidad de embarazos4,5,15,18. Inclusive, se ha determinado que las subpoblaciones de espermatozoides que cuentan con un potencial de membrana mitocondrial alto tienen mayor potencial fecundante17.
Aunque se han publicado varios estudios sobre la eficacia de la evaluación de ambos parametros funcionales espermáticos3,4,10,15,16, no existe una clara evidencia para recomendar alguno de ellos antes de un procedimiento de reproducción asistida, con desenlaces clínicos y de laboratorio.
Aunque ambos parámetros mejoran mediante la selección de los espermatozoides con las técnicas de selección espermática, no están exentos de riesgo, debido a que los períodos de centrifugación pueden aumentar la producción de especies reactivas del oxígeno, que son las principales causantes del daño en la cromatina y de las alteraciones de la mitocondria espermática19.
Por lo tanto, el objetivo de este trabajo es comparar el efecto de 2técnicas de selección espermática, gradiente de densidad y swim-up, sobre el índice de fragmentación del ADN y el potencial de membrana mitocondrial de los espermatozoides humanos.
Materiales y métodosObtención y procesamiento de las muestras seminalesSe analizaron los eyaculados de 14 voluntarios aparentemente sanos (30,4 años±2,7 años) que consultaron al Instituto de Fertilidad Humana InSer y al Grupo Reproducción de la Facultad de Medicina de la Universidad de Antioquia. Ninguno de los individuos reportó cirugías relacionadas con el tracto reproductivo ni consumo de antioxidantes o sustancias que mejoren o alteren la calidad espermática.
Las muestras seminales se recolectaron por masturbación en recipientes estériles después de un período de abstinencia sexual de entre 2 y 6 días.
Análisis seminal convencionalSe realizó la evaluación de los parámetros convencionales (volumen, pH, apariencia, viscosidad del semen, concentración, concentración total, movilidad, viabilidad y morfología espermática) de acuerdo con las directrices de la OMS7-9 después que el proceso de licuefacción estaba completo. La concentración de espermatozoides se determinó usando una cámara de Makler (Sefi Medical Instruments, Haifa, Israel)20 y la morfología de los espermatozoides se analizó siguiendo los criterios estrictos de Kruger21. Las muestras de semen con leucocitospermia (>1×106 leucocitos/mL) fueron excluidas.
Selección espermáticaPara la selección de los espermatozoides móviles progresivos se utilizó el método de gradiente de densidad discontinua. Brevemente, para la técnica de gradiente (PureSperm 40/80, Nidacon, Suiza o All Grad 45/90 LifeGlobal) (ALLgrad Wash®, Life Global, Turkey) se siguieron las instrucciones del fabricante, con algunas modificaciones. Se adicionaron a un tubo cónico sin mezclarse, 1.000μL del gradiente de mayor densidad, 1.000μL del gradiente de menor densidad y entre 800 y 1.000μL de la muestra total de semen. Posteriormente, se centrifugó a 300g por 15 min, se retiró el sobrenadante y se resuspendió el botón en 1mL de PBS. Inmediatamente, de la suspensión de espermatozoides seleccionados se tomaron el número de alícuotas necesarias para cuantificar los parámetros funcionales espermáticos.
De otro lado, para la técnica de swim-up, entre 0,5 y 1mL de semen fue depositado en el fondo de un tubo, se adicionó en la superficie 0,6mL de medio Ham F10 o sperm preparation medium, que fue incubado durante 30 a 45 min con un grado de inclinación de 45° aproximadamente; después, el sobrenadante fue colectado. Se evaluó la movilidad, la concentración, el potencial de membrana mitocondrial y la integridad de la cromatina de los espermatozoides recuperados.
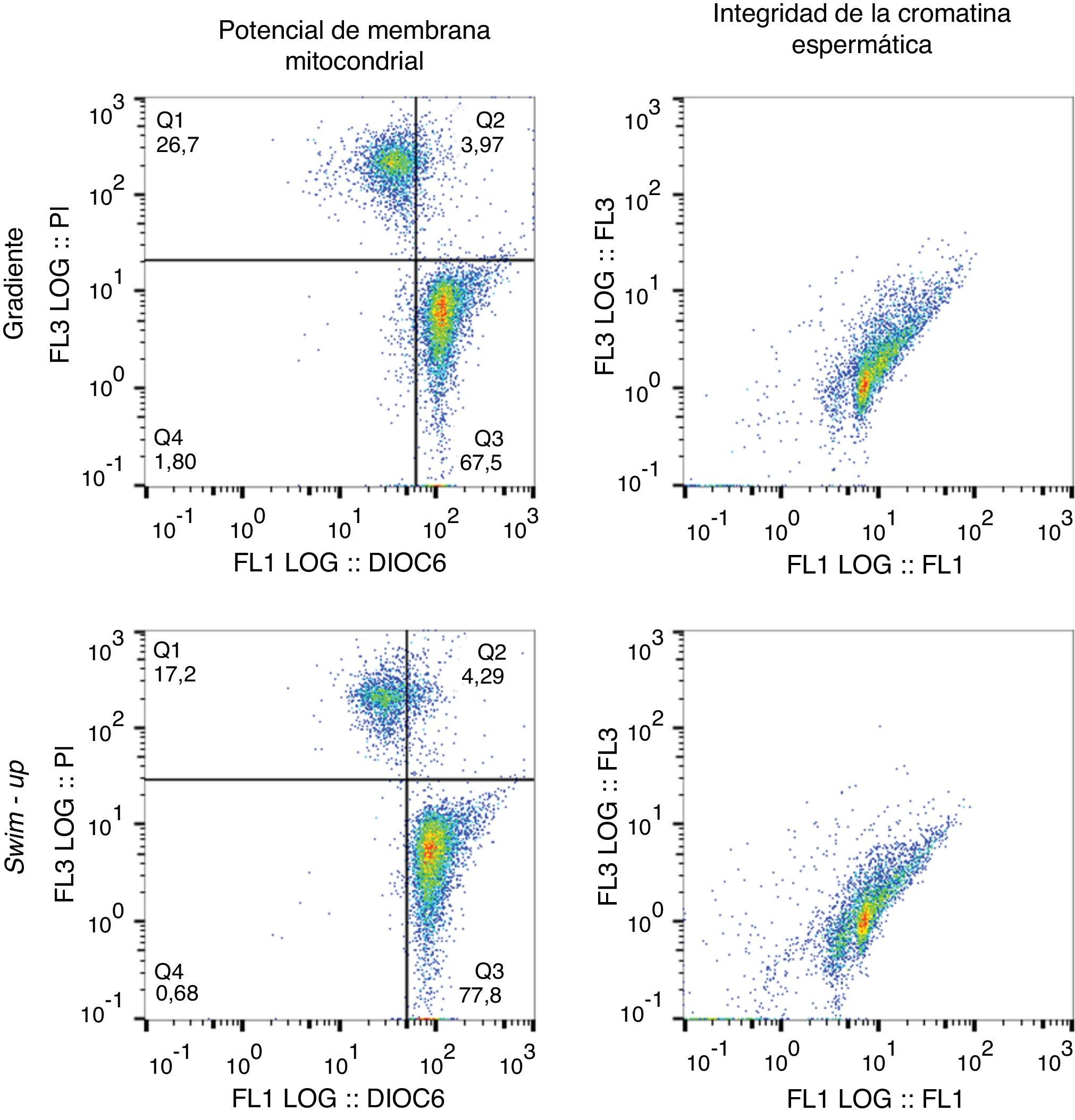
Evaluación de los parámetros funcionalesLa detección del potencial de membrana mitocondrial y la integridad de la cromatina espermática se llevaron a cabo en el citómetro de flujo Epics XL (Becton Dickinson, CA, EE. UU.), con una longitud de onda de excitación de 488nm suministrada por un láser de argón. Las mediciones de dispersión frontal y de dispersión lateral se utilizaron para seleccionar la población de espermatozoides que analizar y excluir los detritos y agregados que producen efectos indeseados en la fluorescencia general. Un total de 10.000 eventos fueron obtenidos por prueba y todos los datos fueron analizados posteriormente usando el programa FlowJo 7.6.2 (FlowJo LLC, OR, EE. UU.).
Detección del potencial de membrana mitocondrial espermáticaLa alícuota tomada de los espermatozoides seleccionados se incubó con yoduro de propidio (IP, 0,25mg/mL, Molecular Probes®Inc, OR, EE. UU.) y 3,3’dihexi-loxacarbocianina (DIOC6, 10 nM, Molecular Probes®) a 37°C/30 min; posteriormente se centrifugó la muestra a 300g/5 min con el fin de hacer un lavado. El botón fue resuspendido en PBS y se realizó la lectura en el citómetro de flujo.
Detección de la integridad de la cromatina espermáticaLa alícuota de espermatozoides seleccionados (con una concentración>5×106 espermatozoides/mL), se diluyó en buffer TNE (TRIS-HCl, NaCl, EDTA, disódica, pH: 7,4). Justo antes de leer la muestra en el citómetro de flujo, se le adicionaron 400μL de solución detergente ácida (HCl, NaCl, Tritón X-100, pH: 1,2) y 30 s después se adicionó la solución del colorante naranja de acridina (Sigma-Aldrich, St Louis, MO, EE. UU., 0,006mg/mL) (CoulterEpics XL - BeckmanCoulter, CA, USA), y se realizó la lectura en el citómetro de flujo.
Análisis estadísticoLas comparaciones se realizaron usando la prueba de Mann-Whitney, los datos fueron analizados utilizando el programa estadístico Prism 5.0 (GraphPad, San Diego, CA, EE. UU.) y un valor de p < 0,05 fue considerado significativo. Los datos que siguieron una distribución normal se expresan como la media±error desviación estándar (DE) y los que no, como mediana y rango.
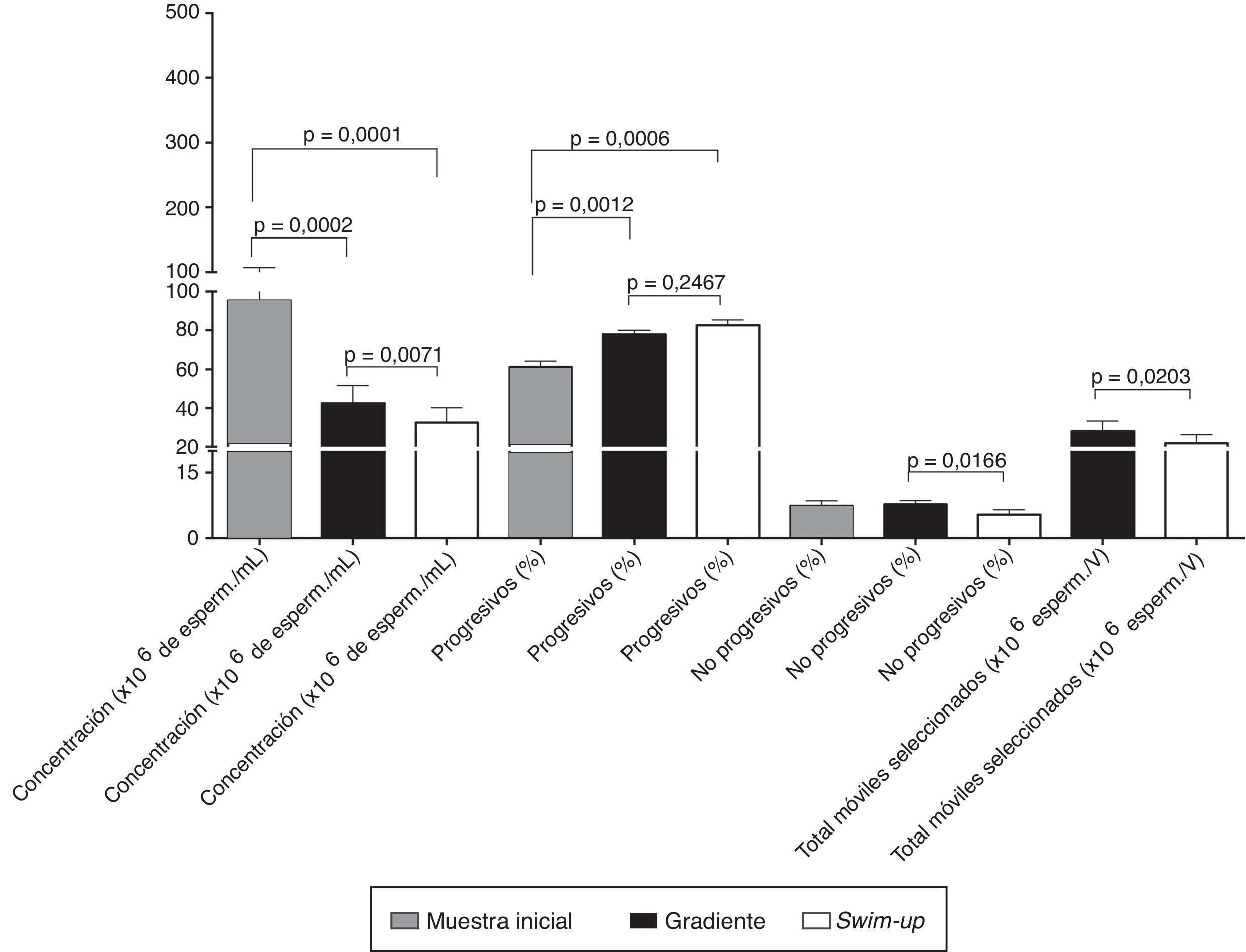
ResultadosLos 14 hombres que participaron en este estudio presentaron valores para los parámetros seminales convencionales de pH 8±0,1, volumen 3,8±0,3mL, concentración 95,4±11,8×106/mL, número total de espermatozoides 337,9±44,3×106/eyaculado, movilidad progresiva 61,3±7,2% y movilidad no progresiva 7,4±1,2% (fig. 1).
Parámetros seminales pre- y postselección. Valores para concentración y movilidad espermática de espermatozoides frescos (muestra inicial sin seleccionar) y seleccionados por swim-up o gradiente de densidad.
Esperm.: espermatozoides; V: volumen de resuspensión de los espermatozoides seleccionados.
Las muestras seleccionadas mediante ambas metodologías disminuyeron (p<0,001) el número de espermatozoides recuperados comparados con la muestra inicial: fue menor en el caso del swim-up respecto al gradiente (32,5±7,7×106 y 42,5±9,2×106/mL respectivamente; p=0,0071). En contraste, se observó un incremento en la movilidad progresiva frente a la muestra inicial a 77,9±2% mediante gradiente (p=0,0012) y a 82,6±2,8% al usar el swim-up como metodología (p=0,0006), aunque sin diferencia estadística entre ambas metodologías. De otro lado, y siendo mejor la técnica swim-up, se observó una disminución en el número de espermatozoides móviles no progresivos (p=0,0166). Finalmente, el total de espermatozoides móviles seleccionados fue mejor por la técnica de gradiente (28,1×106) respecto a las muestras seleccionadas mediante swim-up (21,9×106; p=0,0203) (fig. 1).
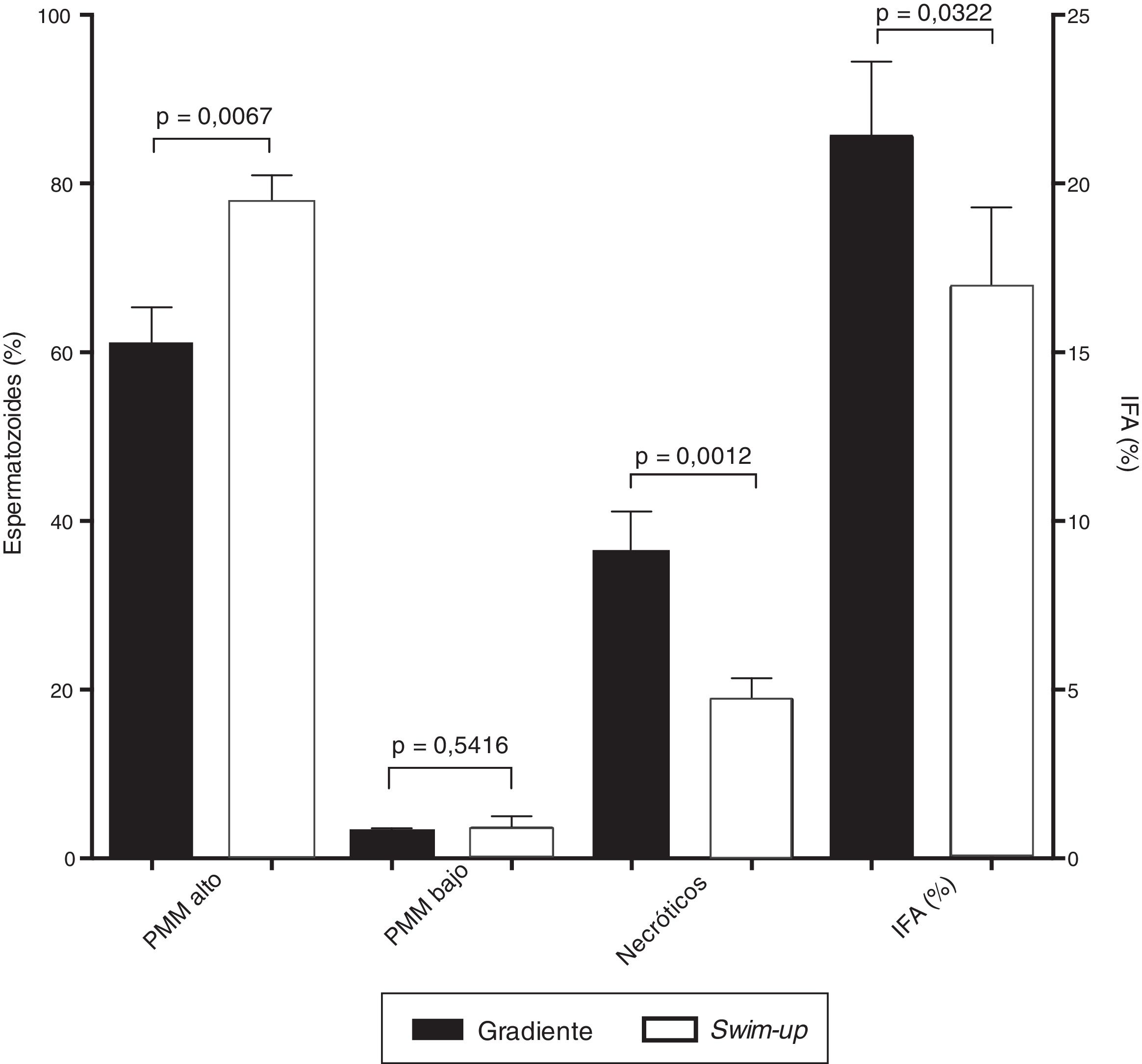
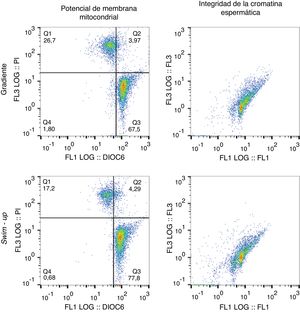
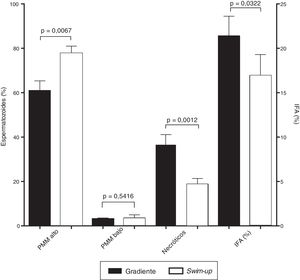
En cuanto a las pruebas funcionales, durante el análisis del potencial de membrana mitocondrial (fig. 2) se evidenció un incremento en el porcentaje de células con potencial de membrana mitocondrial alto y una disminución en el porcentaje de células muertas recuperadas mediante la técnica de swim-up respecto a las recuperadas mediante gradiente (77,7±3,3 vs. 60,9±4,4%; p=0,0067 y 18,8±2,6 vs. 36,8±4,4%; p=0,0012, respectivamente, fig. 3). Adicionalmente, la técnica de swim-up permitió recuperar espermatozoides con menor índice de fragmentación del ADN (16,9±2,4%) que la metodología de gradiente (21,4±2,2%; p=0,0322, fig. 3).
Citografías representativas de la evaluación del potencial de membrana mitocondrial (PMM) y de la integridad de la cromatina espermática mediante citometría de flujo. Espermatozoides seleccionados mediante swim-up o gradiente de densidad. Subpoblaciones para el PMM en las citografías: Q1 y Q2 (espermatozoides necróticos); Q3 (espermatozoides con PMM alto); Q4 (espermatozoides con PMM bajo).
IFA: índice de fragmentación del ADN espermático.
Potencial de membrana mitocondrial e integridad del ADN espermático según el método de selección. Valores para el potencial de membrana mitocondrial (PMM), los espermatozoides necróticos y el índice de fragmentación del ADN espermático (IFA) en espermatozoides seleccionados por swim-up y por gradiente de densidad.
En el presente estudio se evaluó la calidad espermática después de someter la muestra de semen a los métodos de selección espermática de gradiente de densidad y de swim-up, los cuales se utilizan durante la preparación de una muestra de semen tanto para una inseminación artificial como para una fecundación in vitro. Debido a que no es posible comparar con una misma muestra los desenlaces clínicos de ningún tratamiento, se tomó como desenlace el índice de fragmentación de ADN y el potencial de membrana de espermatozoides, ya que estos 2parámetros han demostrado correlacionarse positivamente con los éxitos en los tratamientos de reproducción asistida.
Al evaluar las muestras después de ser sometidas al gradiente de densidad y al swim-up, se evidenció que ambas mejoraban el porcentaje de movilidad respecto a la muestra inicial19, sin embargo, la técnica de gradiente fue superior cuando se evaluaron la totalidad de los espermatozoides móviles recuperados (28,1×106 vs. 21,9×106; p = 0,020, fig. 1), como ha sido previamente reportado22-24.
Las pruebas funcionales evidenciaron un mejor potencial de membrana mitocondrial y una menor fragmentación del ADN de los espermatozoides susceptibles de ser utilizados en el tratamiento (fig. 3).
Con este estudio es difícil asegurar que la técnica de swim-up es la más indicada antes de la realización de una inseminación artificial o una fertilización in vitro, debido a que los desenlaces no son clínicos; sin embargo, los desenlaces estudiados están relacionados con las tasas de éxito de ambas técnicas de reproducción asistida.
En conclusión, el presente estudio permite postular que la selección espermática mediante swim-up recupera espermatozoides de mejor calidad, con mayor potencial de membrana espermática y menor fragmentación del ADN19, aunque existen trabajos en los cuales se postula que no se puede proponer un método ideal por obvias razones biológicas22. Por lo tanto, en nuestro caso específico y con el fin de recuperar mejores espermatozoides previamente a una inseminación artificial o una fecundación in vitro se recomienda la selección espermática con técnica de swim-up.
FinanciaciónEste trabajo fue financiado por la Estrategia de Sostenibilidad, Grupo Reproducción, de la Universidad de Antioquia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.