La vitamina D es importante para el mantenimiento de la masa ósea, y en los últimos años su deficiencia se ha vinculado con enfermedades cardiovasculares, metabólicas, gineco-obstétricas, oncológicas, infecciosas, e incluso con alteraciones reproductivas. El propósito de esta revisión narrativa de la literatura fue entender el papel de la vitaminaD sobre la salud sexual y reproductiva masculina y la fertilidad.
La vitamina D tiene un papel importante durante la maduración de los espermatozoides, en la protección del ADN espermático, así como en la movilidad y la reacción acrosomal espermática. Adicionalmente la vitaminaD participa indirectamente tanto en la disfunción eréctil como en la eyaculación precoz, ayudando a controlar los factores de riesgo asociados como las enfermedades cardiovasculares y algunas afecciones psicológicas (estrés, depresión y ansiedad). Por lo tanto, son necesarios nuevos trabajos que permitan considerar la implementación de suplementos de vitaminaD para el mejoramiento de la salud sexual y reproductiva masculina.
Vitamin D is an essential molecule for the maintenance of bone mass. In the last years, its deficiency has been linked to cardiovascular, metabolic, gynaecological-obstetric, oncological, and infectious diseases, as well as with reproductive disorders. The aim of this narrative literature review was to understand the role of vitaminD on male reproduction and sexual health and fertility.
Vitamin D has a vital role during the maturation of sperm, and in the protection of DNA integrity, such as sperm motility and acrosome reaction. VitaminD also participates indirectly in both erectile dysfunction and premature ejaculation, helping to control associated risk factors such as cardiovascular diseases, and some psychological conditions (stress, depression, and anxiety). Therefore, more studies are needed to considerer the implementation of vitaminD supplements in order to improve male sexual and reproductive health.
La vitamina D (VD) ha pasado de ser reconocida por sus efectos como vitamina, a ser una prohormona con efectos en distintos tejidos y procesos fisiológicos1, no exclusivamente relacionada con el equilibrio fosfocálcico y el metabolismo mineral y óseo, sino participando en múltiples procesos celulares como la secreción y el efecto de la insulina, la función endotelial, la regulación del sistema renina-angiotensina-aldosterona, el control del ciclo celular, la apoptosis, la autotolerancia inmunológica e incluso la efectividad de la acción del sistema inmune ante algunas infecciones1.
A pesar de estas importantes funciones, generalmente no se reconoce el valor necesario a la prevalencia de la insuficiencia y la deficiencia de la VD en la población, debido seguramente a que se ignoran las situaciones de riesgo con las cuales se podría asociar: pérdida de la densidad ósea desencadenando osteoporosis y fracturas, diabetes, hipertensión, cáncer, enfermedades cardiovasculares, mantenimiento de la inmunidad natural, y algunas enfermedades autoinmunes como esclerosis múltiple2.
Se ha establecido que los niveles óptimos de VD están entre 32 y 40ng/ml; concentraciones entre 21 y 29ng/ml son insuficiencia y niveles menores de 20ng/ml son considerados deficiencia de la vitamina3. Específicamente, en Estados Unidos, para mediados de la década del 2000 existía en adultos una prevalencia de alrededor del 42% de deficiencia, con mayor proporción en las personas de raza negra (82%) e hispanos (63%)4, mientras que en los niños se encontró una prevalencia de alrededor del 9% de deficiencia y del 61% de insuficiencia5. Pocos alimentos cuentan naturalmente con esta vitamina; las mejores fuentes van desde el salmón (360μg por cada 100g) hasta el atún, la caballa y las sardinas (238-345μg por cada 100g), entre otros alimentos2.
El objetivo de esta revisión narrativa de la literatura es entender y dar a conocer el papel fundamental que cumple la VD sobre la salud sexual y reproductiva masculina y la fertilidad.
GeneralidadesLa insuficiencia de VD es considerado un problema en todo el mundo. Alrededor de mil millones de personas la padecen, y existe evidencia que demuestra una disminución en la media de VD poblacional y, por lo tanto, un incremento en su deficiencia6.
Se considera que las personas que tienen exposición al sol sin protección presentan niveles suficientes de VD, aunque algunos estudios demuestran lo contrario7,8. La hipovitaminosisD en países de regiones tropicales, incluyendo Colombia, puede presentarse por causas como la falta de exposición a la luz solar, bajo consumo de alimentos ricos en VD (lácteos, vegetales, proteínas animales y comida de mar), presencia de síndrome metabólico, uso excesivo de protectores solares, además de la raza y del envejecimiento9 (a mayor edad mayor cantidad de VD es recomendada por día: los bebés requieren alrededor de 400 unidades internacionales (IU), los adultos 600UI y los mayores de 71años necesitan al menos 800UI), información que permitiría explicar la situación de deficiencia en la población como la colombiana con mayor riesgo de padecer la deficiencia: mestiza y afrodescendiente10.
Se han reportado múltiples funciones de la VD relacionadas con la reproducción humana por dos vías principalmente: a)la vía genómica, que actúa mediante la unión al receptor de VD (VDR) y es la principal responsable de la protección de las células contra el daño del ADN, inducción de ciclo celular, detección y bloqueo de la proliferación celular, mayor tasa de la apoptosis y estimulación de la diferenciación; y b)por la vía rápida o no genómica, que generalmente se limita a la protección del ADN contra el daño inducido por la luz ultravioleta11.
Adicionalmente, se ha evidenciado la expresión del VDR en células de próstata, de testículo, en células de Sertoli y en espermatozoides maduros12,13, e incluso la expresión de enzimas que metabolizan la vitamina en testículos humanos, tracto eyaculatorio y espermatozoides maduros, lo cual permite postular un posible papel de la VD tanto durante la espermatogénesis como en la maduración de los espermatozoides14. Incluso se ha sugerido que la unión de la VD y el VDR podría tener un papel importante en los procesos celulares en los cuales el calcio está involucrado: movilidad, capacitación y reacción acrosomal espermática15.
Algunos estudios determinan que la VD modula el flujo de colesterol, la fosforilación de los residuos de tirosina y treonina en proteínas específicas y mejora la supervivencia de los espermatozoides16. Jensen et al.17 evaluaron la expresión de la enzima CYP24A1, la cual actúa sobre la VD inactiva regulando su disponibilidad celular, y encontraron que bajos niveles de esta enzima están asociados a hombres subfértiles. Por otra parte, se ha documentado un papel importante de la VD en reducir los radicales libres de oxígeno (ROS) protegiendo el ADN de lesiones, y por lo tanto evitando alteraciones de la calidad seminal18.
Varios estudios han demostrado un efecto negativo de la deficiencia de VD en relación con la calidad seminal y el número de embarazos. La inseminación artificial en ratas con espermatozoides provenientes de animales con deficiencia de VD fue un 70% menos eficiente respecto a ratas con niveles normales de VD19, y un 40% más baja al utilizar espermatozoides de ratas normocalcémicas con deficiencia de VD, por lo que la deficiencia de VD está asociada a bajas concentraciones espermáticos y disminución de la fertilidad en ratas20. Además, en humanos se ha observado asociación entre la disfunción eréctil (DE)21 y la eyaculación precoz (EP) con el metabolismo de la VD22.
Metabolismo de la vitamina DEl colecalciferol (vitamina D3) desempeña funciones importantes durante la mineralización del hueso y el metabolismo del calcio, y se obtiene a partir de la ingesta de alimentos (10%) y por la producción interna en la epidermis cuando el 7-dehidrocolesterol23, gracias al contacto de la piel con la luz ultravioleta producida por la luz solar, genera previtaminaD3, la cual posteriormente por isomerización térmica no enzimática se convierte en vitaminaD324.
El metabolismo de la VD está compuesto por tres reacciones celulares importantes: la 25-hidroxilación, la 1α-hidroxilación y la 24-hidroxilación, las cuales se llevan a cabo con las oxidasas de función mixta (CYP) del citocromo P450, en el retículo endoplasmático (CYP2R1) o en las mitocondrias (CYP27A1, CYP27B1 y CYP24A1)25.
Se ha establecido que la fuente principal de 25-hidroxivitaminaD3 (25OHD, hidroxicolecalciferol o calcidiol), forma circulante en sangre, es el hígado, al cual llega por medio de la proteína de unión a VD (DBP) para ser posteriormente hidroxilada en los hepatocitos26. Se postula que la CYP2R1 es fundamental en la hidroxilación, ya que los individuos con mutaciones homocigotas en este gen presentan síntomas clínicos y niveles biológicos compatibles con deficiencia de VD25.
Finalmente, la enzima 24-hidroxilasa regula los niveles de 1,25-dihidroxivitaminaD3 en tejidos blancos acelerando su transformación hacia 1,24,25 trihidroxivitaminaD3 y a la forma inactiva (ácido calcitroico), la cual finalmente se excreta por vía urinaria. La enzima 24-hidroxilasa también tiene la capacidad de hidroxilar la 25-hidroxivitaminaD3 para estructurar la 24,25-dihidroxivitaminaD3, disminuyendo los niveles de 25-hidroxivitaminaD3 disponibles para la 1α-hidroxilación23,24.
Vitamina D en la reproducción masculinaLas oxidasas de función mixta son enzimas metabolizantes de VD, y hasta la fecha se había limitado a que su función se daba exclusivamente en el hígado y en el riñón. Sin embargo, estas enzimas están presentes en otros tejidos, incluyendo los órganos del sistema reproductivo masculino: testículos, epidídimo, vesícula seminal, próstata, e incluso en los espermatozoides humanos, donde se expresan las enzimas metabolizantes de VD y los VDR14, hasta el punto de postular que la expresión de CYP24A1 en la pieza intermedia podría ser un posible biomarcador de calidad seminal17.
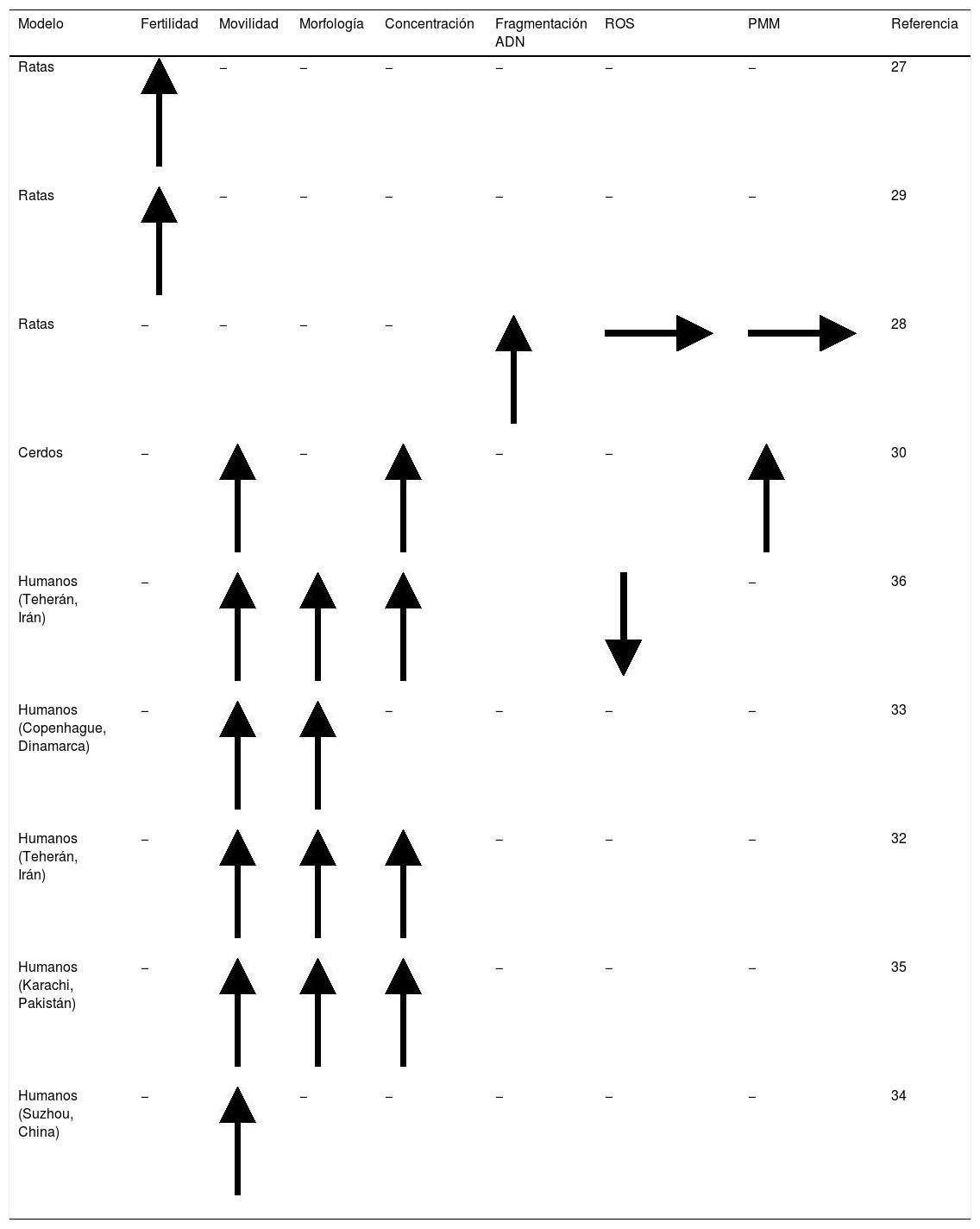
La primera evidencia sobre la asociación entre la VD y la fertilidad fue realizada en ratas con deficiencia de VD, que si bien tuvieron la capacidad de reproducirse, presentaron un 50% menos de gestaciones respecto al grupo control; además, el número de hijos postinseminación se redujo en más del 70% en la camada de hembras que fueron inseminadas con los espermatozoides del grupo de ratas con deficiencia de VD27, lo cual se explicaría por la alteración en el ADN espermático, como fue recientemente demostrado28.
Años más tarde se reportó que la capacidad reproductiva de las ratas podría restaurarse mediante la implementación de suplementos de calcio, lo cual sugería que la infertilidad o el deterioro de la fertilidad en estas ratas se debía a su estado de hipocalcemia, un efecto colateral de la deficiencia de VD29.
Resultados similares se han reportado en otros modelos. Yan Lin et al.30 estimaron el efecto de los suplementos dietarios de vitaminaD3 en cerdos, demostrando que el grupo con mayor suplementación (4.000IU/kg durante 4meses) presentaba mejor movilidad y concentración espermática, un incremento en la producción de hormonas y mayor expresión de algunos genes (VDR, VD 25-hidroxilasa, 25-hidroxivitaminaD3-1α-hidroxilasa, enzima inactivante de la VD y citocromo P450), lo cual permite postular que el deterioro de la fertilidad, la movilidad disminuida de los espermatozoides y la producción anormal de testosterona tienen un estrecho vínculo con los niveles de VD31.
De otro lado, algunos estudios en humanos han evidenciado una relación entre la VD y la reproducción masculina (tabla 1). En 2009, en Teherán, se compararon los niveles de VD en suero de hombres diagnosticados como infértiles y hombres fértiles (con hijos menores de 5años de edad), encontrando que los hombres con mayores niveles de VD tenían mejor calidad seminal32. Posteriormente, en 2011, al analizar 300 hombres daneses se demostró una relación positiva entre los valores de 25OHD y la movilidad espermática, la cual podría ser explicada por un aumento en el calcio intracelular en los espermatozoides33. En 2016, un estudio en China no reportó diferencias en las concentraciones séricas de VD entre hombres fértiles respecto a los infértiles, aunque sí era menor en hombres que presentaban alguna alteración seminal (oligospermia, astenospermia, oligoastenospermia y azoospermia) respecto a los niveles de la vitamina en hombres fértiles, por lo que postularon que los bajos niveles de VD podrían representar un factor de riesgo para la calidad seminal, especialmente en hombres infértiles34. Por otro lado, en Pakistán, en 2018, al analizar 313 individuos de una clínica de fertilidad se encontró que los niveles de VD eran mayores en los hombres con parámetros seminales normales respecto a los que presentaban parámetros seminales anormales35. Finalmente, un estudio en 2018 en Teherán correlacionó positivamente la movilidad espermática tanto en individuos normozoospérmicos como en oligoastenoteratozoospérmicos con la concentración sérica de VD; así mismo reportaron que la morfología normal en el grupo de normozoospérmicos se correlaciona positivamente con los niveles de VD36.
Relación entre la vitamina D y los parámetros seminales
| Modelo | Fertilidad | Movilidad | Morfología | Concentración | Fragmentación ADN | ROS | PMM | Referencia |
|---|---|---|---|---|---|---|---|---|
| Ratas | − | − | − | − | − | − | 27 | |
| Ratas | − | − | − | − | − | − | 29 | |
| Ratas | − | − | − | − | 28 | |||
| Cerdos | − | − | − | − | 30 | |||
| Humanos (Teherán, Irán) | − | − | 36 | |||||
| Humanos (Copenhague, Dinamarca) | − | − | − | − | − | 33 | ||
| Humanos (Teherán, Irán) | − | − | − | − | 32 | |||
| Humanos (Karachi, Pakistán) | − | − | − | − | 35 | |||
| Humanos (Suzhou, China) | − | − | − | − | − | − | 34 |
PMM: potencial de membrana mitocondrial; ROS: radicales libres de oxígeno.
Flecha hacia arriba: aumenta; flecha horizontal: se mantiene; flecha hacia abajo: disminuye; −: no se evaluó.
La DE es la incapacidad de presentar una erección lo suficientemente rígida como para mantener las relaciones sexuales, y se puede originar a partir de múltiples causas, como la obesidad, la diabetes mellitus (DM), la enfermedad pulmonar obstructiva crónica, además de influir algunas enfermedades sistémicas, factores psicogenéticos y enfermedades cardiovasculares, endocrinas y neurológicas37. La forma más severa de la enfermedad afecta al 2% de los hombres entre los 20 y los 40años, y se incrementa al 50% en hombres mayores de 75años38.
Además, se ha postulado que la deficiencia de VD es un factor de riesgo para padecer diabetes, fallo cardíaco y enfermedades cardiovasculares arterioscleróticas37, factores de riesgo para padecer DE; incluso se ha reportado que la prevalencia de DE, clasificada mediante el índice internacional de la función eréctil (IIEF-5) con un puntaje menor de 26, fue de alrededor del 6% en hombres con niveles normales de VD (>30ng/ml), mientras que en hombres con deficiencia (<20ng/ml) o insuficiencia (20-30ng/ml) fue del 25 al 40%39.
Dado que los niveles de VD se han vinculado con las enfermedades vasculares, mientras que la DE es una señal temprana de enfermedad vascular, se hace fácil asociar que los valores bajos de VD pueden contribuir al desarrollo de la DE37. Los hombres diabéticos tienen entre 3 y 4veces más probabilidad de presentar DE que los hombres no diabéticos, aunque se ha observado que los pacientes diabéticos que no padecen DE tienen mayores niveles de VD sérica40.
La VD induce la expresión de óxido nítrico (ON) sintasa en células endoteliales, resultando en el aumento de este vasodilatador, el cual cumple un papel fundamental en la fisiología de la erección al relajar el músculo liso y permitir el flujo de sangre, lo que explicaría un posible mecanismo fisiológico que liga la deficiencia de VD con la DE37.
De otro lado, la hipertensión, en especial la presión sistólica, es un trastorno vascular, además de un potente predictor de enfermedades cardiovasculares y uno de los factores de riesgo en accidentes cerebrovasculares, y a su vez también un factor de riesgo importante para padecer DE, la cual afecta a alrededor del 70% de los hombres con hipertensión41. La VD puede suprimir la hipertensión regulando el sistema renina-angiotensina, debido a que la VD es un potente supresor endocrino de la biosíntesis de renina por medio de la activación de angiotensina; en contraste, se ha demostrado que la deficiencia de VD estimula la expresión de renina en ratones normales aumentando la presión sanguínea42.
La inflamación del endotelio vascular es una reacción al daño tisular que se manifiesta con enrojecimiento, dolor, hinchazón, ardor y sensibilidad, y es una respuesta primaria en la protección de una lesión, y en estos casos las funciones del endotelio se ven afectadas generando estrés oxidativo43. La proteínaC reactiva (PCR) es el principal marcador de inflamación: disminuye los niveles de ON promueve el daño vascular, y se ha demostrado que se encuentra significativamente más alta en pacientes que padecen DE que en los que no la padecen44, al igual que se ha asociado positivamente con los niveles de VD45.
Finalmente, otras enfermedades y condiciones no vasculares que se han asociado con la DE y a su vez con la deficiencia de VD son el Alzheimer46,47, la enfermedad renal crónica48,49, la depresión50,51, los traumas y las fracturas52,53, el síndrome metabólico54,55, la esclerosis múltiple56,57, la obesidad58,59, el Parkinson60,61 y el tabaquismo62,63.
Vitamina D y eyaculación precozLa EP, definida como la pérdida del control del momento de la eyaculación con una mínima estimulación sexual antes o durante un corto periodo de tiempo después de la penetración y antes de que la persona lo desee, afecta del 20 al 30% de los hombres, con un alto impacto emocional en el bienestar y en la calidad de vida general de los hombres y de su pareja22.
Algunos estudios reportaron que la deficiencia de VD está asociada con otros comportamientos relacionados con la ansiedad y otros trastornos psicológicos64,65 además de la DE, como hipertiroidismo, prostatitis crónica, drogas recreacionales, síndrome metabólico y enfermedad de Parkinson22. La producción de ON y la ON sintasa por parte de la VD activada37 podría ser otro mecanismo para explicar esta relación, debido a que el ON es una molécula importante en el sistema nervioso simpático, al igual que la serotonina, y ambos juegan un papel relevante en la eyaculación66.
Uno de los primeros estudios que relacionó la VD y la EP reportó que el tratamiento en ratas neonatas con colecalciferol afectaba la eyaculación en la edad adulta67.
En 2018, en El Cairo (Egipto), al evaluar a 80 hombres, de los cuales 40 padecían EP primaria y los otros 40 eran controles, asociaron los niveles de VD con presentar EP primaria y con el tiempo de latencia de eyaculación intravaginal68.
En otro estudio, realizado en Estambul (Turquía) en 2019, tras evaluar a 97 voluntarios con EP adquirida y a 64 hombres sanos se demostró que los valores bajos de VD están asociados con la EP adquirida, y se propone que la suplementación con VD podría ser un tratamiento para mejorar los efectos de esta alteración22.
ConclusiónEn esta revisión se evidencia la importancia de la VD en la salud sexual y reproductiva masculina y cómo su deficiencia puede inducir trastornos endocrinos en hombres que eventualmente afectan a la fertilidad. Aunque diferentes estudios tanto in vivo como in vitro demuestran el papel y la importancia que tiene la VD en relación con la reproducción, se requieren nuevos trabajos que permitan fortalecer esta idea y aportar nueva información al debate de los beneficios de la implementación de suplementos de VD en relación con la salud reproductiva, incluyendo la infertilidad.
FinanciaciónMMV participó en el programa Talento Joven e Impacto regional - Minciencias.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.