La adenomiosis es una enfermedad ginecológica benigna que afecta entre el 20-35% de las mujeres en edad fértil. Sus síntomas incluyen sangrado uterino anormal, dolor pélvico e infertilidad, los cuales generan una disminución en la calidad de vida de las pacientes. El objetivo de esta revisión es actualizar «el conocimiento» que existe sobre la enfermedad, hasta ahora poco conocida, haciendo énfasis en la etiopatogenia, el diagnóstico y el manejo. Como conclusión, la adenomiosis está recibiendo más atención en las últimas décadas. Actualmente, gracias a la introducción de técnicas de imagen precisas, se ha convertido en una entidad clínica con la posibilidad de un diagnóstico prequirúrgico. El impacto de la adenomiosis en el dolor, sangrado e infertilidad, y su consecuente disminución en la calidad de vida de estas pacientes hace necesario el desarrollo de pautas de diagnóstico temprano y manejo multidisciplinar.
Adenomyosis is a benign gynaecological disease that affects between 20-35% of women of reproductive age. Its symptoms include abnormal uterine bleeding, pelvic pain, and infertility, and can lead to a decrease in the quality of life of these patients. The objective of this review is to update «the knowledge» that exists about the disease, until now little known, with emphasis on its etiopathogenesis, diagnosis, and management. In conclusion, adenomyosis is receiving more attention in recent decades. Nowadays, thanks to the introduction of precise imaging techniques, it has become a clinical entity with the possibility of a pre-surgical diagnosis. The impact of adenomyosis on pain, bleeding and infertility, and its consequent decrease in quality of life of these patients makes it necessary to develop guidelines for early diagnosis and multidisciplinary management.
La adenomiosis (AD) es una enfermedad ginecológica benigna hormonodependiente que se caracteriza por la existencia de glándulas y estroma endometriales en el espesor del miometrio, junto con la hiperplasia y la hipertrofia de fibras musculares lisas de este último1.
La AD afecta entre el 20-35% de las mujeres en edad fértil, aunque en algunas series se habla de hasta el 70% de los especímenes de histerectomías2. Entre los factores predisponentes, se hallan la multiparidad y el antecedente de cirugías previas uterinas.
Las presentaciones clásicas de la AD incluyen sangrado uterino anormal (SUA), dolor pélvico que puede manifestarse como dismenorrea, dolor pélvico crónico no cíclico y dispareunia e infertilidad3. Estos síntomas podrían generar una disminución en el bienestar físico, mental y social de estas pacientes, resultando en una disminución de la calidad de vida4,5.
Estos síntomas no son específicos de la AD, y pueden parecer normales para algunos pacientes y médicos o pueden ser signos de otra condición ginecológica o no ginecológica, como la endometriosis, los miomas uterinos o el síndrome de colon irritable. Esto explica por qué la AD es comúnmente no diagnosticada o diagnosticada con un retraso significativo.
Convencionalmente, el diagnóstico de AD se basaba en hallazgos clínicos y patológicos posterior a la histerectomía; sin embargo, actualmente otros métodos diagnósticos como la ecografía transvaginal (ETV) y la resonancia magnética nuclear (RMN) han demostrado ser métodos de diagnóstico precisos y no invasivos en la detección de esta enfermedad6.
El tratamiento dependerá de factores como la edad, la clínica y el deseo genésico de la paciente, pero en general se pueden dividir en: tratamiento médico, procedimientos quirúrgicos, radiológicos o ecográficos, o combinación de los mismos7.
EtiopatogeniaEn la AD, las glándulas y el estroma endometrial en el miometrio parecen inducir hipertrofia e hiperplasia en el miometrio circundante. Esto da como resultado un «agrandamiento difuso del útero», sin embargo, muchas mujeres tienen áreas pequeñas de enfermedad difusa que solo son evidentes a nivel microscópico, y otras tienen áreas bien circunscritas llamadas adenomiomas que radiológicamente son similares a los leiomiomas.
La etiopatogénesis de la AD es todavía desconocida. Se han propuesto 2 teorías principales para explicar el origen de la AD8. La teoría de la invaginación postula que la AD es el resultado de la invaginación del endometrio basal en el miometrio debido un trauma endometrial que ocurre durante una cirugía uterina como en las cesáreas. Se produce la activación del mecanismo denominado Tissue Injury and Repair (TIAR). Este fenómeno junto con una posible alteración de la inmunidad subyacente y un estado de hiperestrogenismo contribuirían a la formación de AD. Se han demostrado polimorfismos en genes que causan el aumento de estrógenos y la disminución de su metabolismo9,10. Por otro lado, al haber una disminución de la expresión de la enzima 17-ß-hidroxiesteroide deshidrogenasa tipo 2, disminuye la conversión de estradiol en su forma menos potente, la estrona11.
La segunda teoría establece que la AD deriva de una metaplasia de novo a partir de células embriológicas müllerianas pluripotenciales o diferenciación de células madre adultas12,13. Se han reportado casos de AD confirmada en la pared uterina muscular rudimentaria en pacientes con síndrome de Rokitansky-Küster-Hauser (ausencia funcional de endometrio)14 que apoyarían esta teoría.
Epidemiología y factores de riesgoHistóricamente, el diagnóstico de AD se ha realizado a partir de los análisis histológicos en piezas de histerectomía, por lo que su incidencia no se ha establecido con precisión. Sin embargo, se ha demostrado que afecta entre el 20 y el 30% de la población femenina2. La AD es más frecuente en mujeres perimenopáusicas entre la cuarta y quinta décadas de la vida, mientras que entre el 5 y el 25% de los casos se observan en pacientes menores de 39 años. Los datos de prevalencia, por lo tanto, oscilan entre el 5 y el 70% dependiendo de los estudios, y este amplio rango se debe a la falta de criterios de diagnóstico estándar15.
Los factores de riesgo clásicos para la AD son la exposición a los estrógenos (menarquia temprana, ciclos menstruales cortos, índice de masa corporal elevado, el uso de tamoxifeno) y la multiparidad16. También se relaciona con el antecedente de cirugía uterina previa. Sin embargo, en pacientes más jóvenes puede observarse la presencia de AD sin los factores de riesgo mencionados; en estas pacientes se ha visto una estrecha asociación con otras enfermedades como la endometriosis17.
Manifestaciones clínicas de la adenomiosisEl 30% de las pacientes con AD son asintomáticas18. Los síntomas asociados con la AD son dolor pélvico (en forma de dismenorrea, dispareunia y dolor pélvico crónico), SUA e infertilidad. El SUA afecta hasta el 60% de las pacientes con AD. McCausland19 encontró una correlación estadísticamente significativa al cuantificar el SUA y la profundidad de la enfermedad. El SUA es debido al aumento de la contractilidad del miometrio a lo largo del ciclo menstrual, el aumento de la superficie endometrial, la vascularización y el flujo sanguíneo20,21. La dismenorrea afecta al 79% de las pacientes con AD22. El origen de la dismenorrea en pacientes con AD aún no está bien establecido, pero se postula que puede ser secundaria al aumento de la producción de prostaglandinas en el tejido adenomiótico23. La hiperperistalsis, así como el aumento en la expresión de receptores de oxitocina podrían contribuir a la severidad de la dismenorrea24.
En menor frecuencia que el SUA y el dolor pélvico, se ha reportado sintomatología urinaria como manifestación de la AD. Li et al. demostraron que pacientes con AD presentan micciones más frecuentes, nicturia, urgencia y tenesmo25.
Algunos autores sugieren que la gravedad y la frecuencia de los síntomas se suele correlacionar con la gravedad y la profundidad de la AD a nivel ecográfico26.
Existen enfermedades concomitantes con sintomatología similar que pueden enmascarar la relación causal entre la AD y los síntomas, como la endometriosis y los miomas uterinos. La incidencia de AD como enfermedad aislada no está clara y algunos estudios reportan una asociación entre el 38 y 64% de los casos27.
DiagnósticoEl diagnóstico definitivo de la AD tradicionalmente se realizaba mediante evaluación histológica de los especímenes de histerectomías; sin embargo, el uso de técnicas de imagen actuales ha mostrado una excelente correlación entre los hallazgos histológicos y de imágenes28.
- •
Anamnesis y exploración física. Se ha de realizar una correcta historia clínica y examen físico. El patrón de sangrado menstrual, así como el dolor pélvico con o sin sintomatología compresiva pueden orientar al diagnóstico. El tacto vaginal durante la exploración física, puede evidenciar agrandamiento del útero (en el 30% de las pacientes) y sensibilidad uterina20.
- •
RMN. La RMN ha demostrado ser un método preciso y no invasivo en la detección de esta enfermedad6, con una sensibilidad y una especificidad entre el 78 y el 88%29. Las secuencias en T2 y en cortes sagitales demuestran mejor la anatomía del útero y, en especial, de la zona de unión.
- •
ETV. La ETV ha ganado territorio en los últimos años llegando a ser comparable a la RMN30. En un reciente metaanálisis29, la sensibilidad y la especificidad de la ETV-2D para el diagnóstico de AD fue del 83,8 y 63,9%, respectivamente. En cuanto a la ETV-3D, la sensibilidad y la especificidad fue del 88,9 y 56,0%, respectivamente. En este estudio, se concluyó que la ETV-3D no mejoró la precisión diagnóstica de la AD comparado con la ETV-2D. En el año 2015, Van Den Bosch et al., definieron los criterios diagnósticos ecográficos para la AD31 (tabla 1); sin embargo, a día de hoy no hay consenso acerca del mejor criterio o combinación de estos para el diagnóstico ecográfico de la AD. Por otra parte, la ETV con doppler color ha demostrado ser una herramienta diagnóstica con una alta sensibilidad y especificidad para la diferenciación entre la AD y los miomas uterinos (95,6 y 3,4%, respectivamente).
Tabla 1.Criterios diagnósticos ecográficos para la adenomiosis
Criterios 1 Útero globuloso aumentado de tamaño 2 Quistes miometriales (áreas anecoicas redondas de 1 a 7 mm) 3 Áreas de miometrio heterogéneo 4 Paredes miometriales asimétricas 5 Estrías lineales hipoecoicas 6 Líneas subendometriales anecoicas 7 Unión endometrio miometrial (junctional zone) irregular 8 Unión endometrio miometrial (junctional zone) interrumpida Fuente: adaptado de Van Den Bosch T31.
- •
La histeroscopia es una técnica quirúrgica en la cual se puede obtener un diagnóstico histológico de AD a partir de biopsias dirigidas, sin embargo no es una técnica diagnóstica en la práctica clínica habitual, ya que, además de ser una técnica invasiva, solo diagnosticará formas de AD focales o difusas «superficiales»32.
En resumen, actualmente la ETV se considera el método diagnóstico de primera línea28, ya que, además de su alta sensibilidad y especificidad, tiene la ventaja de ser realizada por el propio ginecólogo, y tiene un bajo coste.
ClasificaciónEl primer intento de clasificar la enfermedad fue en 1972 por Bird et al. basada en histología: clasificaba la AD en 3 grados según la profundidad; sin embargo, no tenía en cuenta la extensión, la ubicación ni el tamaño uterino33. Una segunda clasificación, basada en la RMN34, utilizaba el engrosamiento de la junctional zone (JZ) y se propusieron 3 categorías: JZ entre 8 y 12mm, JZ>12mm y adenomiomas descritos como masas miometriales con márgenes indefinidos.
Posteriormente, se utilizó la localización introduciendo el concepto de que el miometrio interno y externo podrían estar infiltrados independientemente y que podrían reflejar 2 orígenes diferentes de la enfermedad35.
En el año 2014, Grimbizis et al.36 propusieron una clasificación en la que categorizaba la AD en grupos: difusa, focal (incluyendo adenomiomas), adenomiomas polipoideos y otros.
Los parámetros potencialmente importantes que deben tenerse en cuenta al clasificar la enfermedad son: el tipo (difusa, focal) con el componente predominante (glandular, muscular o quístico), la zona miometrial (interno o externo) y la localización (anterior o posterior).
El 2019 Van den Bosch et al., publicaron una nueva clasificación más completa, teniendo en cuenta todos los parámetros comentados y agregando la extensión de la misma: leve (25% del miometrio total), moderada (25-50% del miometrio total) y severa (>50% del miometrio total)37. Sin embargo, en la actualidad, la clasificación que más se utiliza continúa siendo la de Grimbizis et al.36.
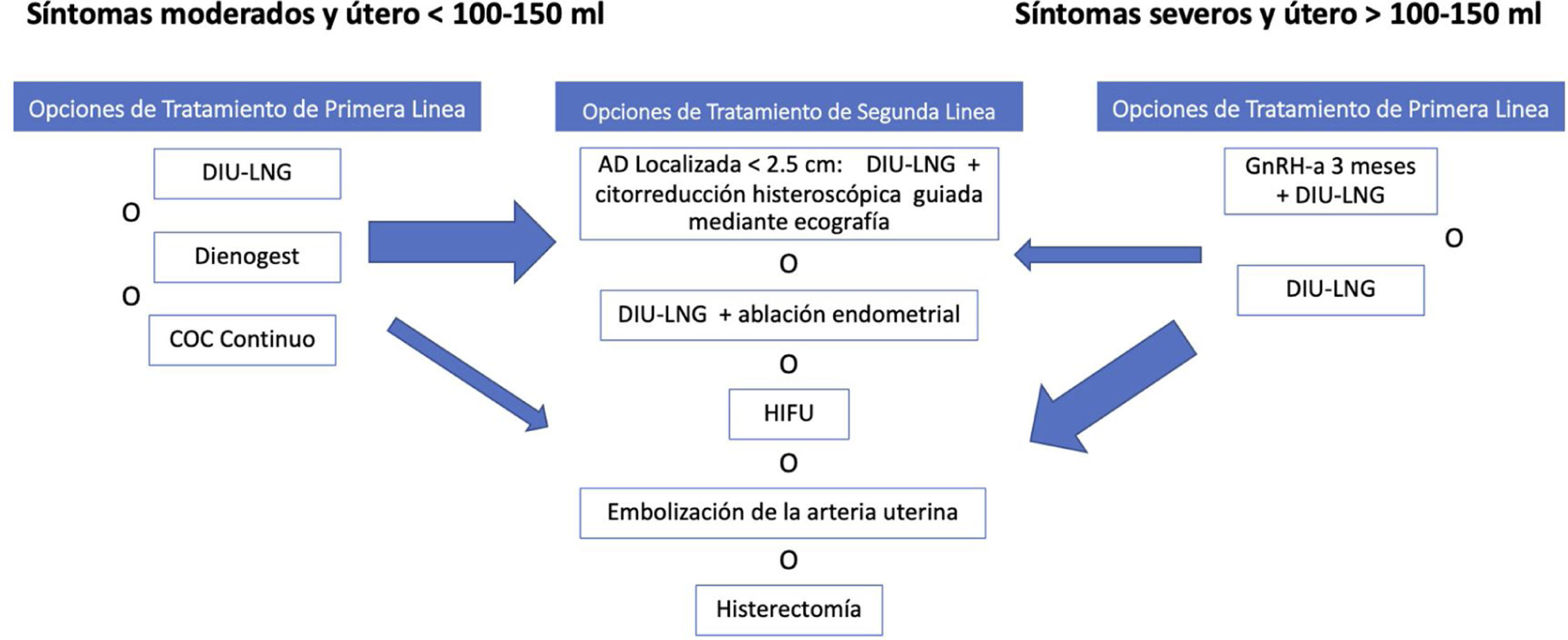
TratamientoLa histerectomía ha sido tradicionalmente el tratamiento de elección en mujeres con AD que no desean preservar la fertilidad y aceptan la cirugía38. Sin embargo, durante los últimos años han surgido numerosas opciones de tratamiento quirúrgico conservador y de tratamiento no quirúrgico (tratamiento hormonal y mínimamente invasivo) eficaces en muchos casos; por ello, actualmente la primera opción será el tratamiento médico y si este no fuera eficaz, se recomienda realizar un tratamiento más invasivo (fig. 1).
Resumen de las posibilidades de tratamiento para la adenomiosis.
cm: centímetros; COC: contraceptivos orales combinados; DIU-LNG: dispositivo intrauterino de levonorgestrel; GnRH-a: análogos de la hormona liberadora de gonadotropina; HIFU: ultrasonido focalizado de alta intensidad; ml: mililitros.
Fuente: adaptado de Dueholm M38.
La AD se caracteriza por un aumento de los niveles de estrógeno, aumento de la actividad de la aromatasa y de la resistencia a la progesterona con inflamación persistente. El objetivo del tratamiento médico es reducir la producción endógena de estrógeno e inducir la diferenciación endometrial con progestágenos30.
Dentro de los tratamientos hormonales se incluyen los anticonceptivos orales combinados (COC). Tienen un efecto progestágeno fuerte sobre el endometrio y la esteroidogénesis ovárica. Se ha reportado un buen control de los síntomas en dos tercios de las pacientes38.
El uso del dispositivo intrauterino de levonorgestrel (DIU-LNG) se asocia a decidualización del endometrio y la disminución de sangrado, también se piensa que actúa directamente sobre los depósitos adenomióticos39. Un estudio randomizado mostró que los COC y el DIU-LNG disminuían el dolor y el sangrado, pero el DIU-LNG producía mayor reducción en ambos parámetros40.
Los progestágenos disminuyen el volumen del sangrado debido a la decidualización y la atrofia endometrial. En la AD ha sido estudiado específicamente el Dienogest®, una progesterona oral sintética selectiva que combina de manera única las propiedades farmacológicas de la progesterona y un derivado de la 19-norprogestina, ofreciendo un efecto beneficioso local sobre el tejido endometrial41.
Los análogos de la hormona liberadora de gonadotropina (GnRH) suprimen la función ovárica e inducen a un estado de hipoestrogenismo. Los análogos de la GnRH suprimen la reacción inflamatoria en los tejidos, la angiogénesis y la proliferación celular en pacientes con AD, endometriosis y miomas uterinos42,43. El tratamiento con terapia add-back se realiza para evitar pérdida de densidad ósea y/o cuando la paciente presenta síntomas vasomotores severos. Sin embargo, existe una falta de estudios a largo plazo que validen esta opción de tratamiento38.
Otras opciones de tratamiento médico, menos utilizadas debido a sus efectos adversos, son el danazol y los inhibidores de la aromatasa. Los moduladores selectivos de los receptores de progesterona como el acetato de ulipristal, podría ser un tratamiento eficaz para AD sintomática44.
En cuanto a las alternativas no quirúrgicas mínimamente invasivas, la embolización selectiva de la arteria uterina (EAU) ha demostrado eficacia en los casos de AD con SUA y dismenorrea en seguimiento a medio-largo plazo. La tasa media de éxito reportada según estudios es entorno al 67% de los pacientes38.
La ablación por ultrasonido focalizado guiado por resonancia magnética (MRgFUS) invasiva también ha demostrado ser una técnica efectiva y segura. En una revisión reciente, la tasa de éxito a 12 meses de seguimiento fue del 88%45. La monitorización de la imagen puede ser realizada mediante ultrasonido de alta resolución (USgFUS) o por RMN (Magnetic Resonance guided Focused Ultrasound Surgery [MRgFUS]).
Finalmente, dentro de las alternativas no quirúrgicas mínimamente invasivas, la ablación por radiofrecuencia guiada por ultrasonido se ha utilizado con buenos resultados en los últimos años. Un estudio demostró una reducción del volumen uterino de un 41,2% a los 12 meses del tratamiento, y una disminución significativa de los síntomas severos46.
En cuanto a la cirugía conservadora de la AD, los estudios disponibles siguen siendo escasos y los beneficios discutibles, aunque pueden ser útiles en pacientes no candidatas a recibir tratamiento médico a largo plazo47,48. Así mismo, un alto porcentaje de pacientes con AD se asocia a enfermedad concomitante como la endometriosis y los miomas, que pueden interferir en los resultados de la cirugía conservadora.
Las principales técnicas de cirugía de preservación uterina utilizadas para el tratamiento de la AD incluyen el tratamiento histeroscópico, la ablación/resección endometrial y la cirugía citorreductora. No todos los tipos de AD pueden tratarse por histeroscopia; la ablación/resección endometrial se utiliza comúnmente cuando el tratamiento médico no permite el control de los síntomas, aunque no está indicado en mujeres que desean concebir y hoy en día su uso es controvertido. La cirugía citorreductora se utiliza excepcionalmente en la AD difusa cuando el tratamiento médico no es eficaz y la paciente desea conservar el útero. También podría utilizarse en casos de AD focal en los que se puede extirpar la lesión por completo38.
ConclusiónLa AD es una enfermedad ginecológica crónica frecuente que está recibiendo más atención en las últimas décadas. Actualmente gracias a la introducción de técnicas de imagen precisas, se ha convertido en una entidad clínica con la posibilidad de un diagnóstico prequirúrgico. El impacto de la AD en el dolor, el sangrado, la infertilidad y su consecuente disminución en la calidad de vida en estas pacientes hace necesario el desarrollo de pautas de diagnóstico temprano y manejo multidisciplinar. Se necesitan estudios con grandes tamaños muestrales para poder avanzar en nuestro conocimiento sobre la enfermedad, así como los diferentes tipos y su impacto clínico.
FinanciaciónLa presente revisión no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses