INTRODUCCION
La diabetes mellitus es un grupo de enfermedades metabólicas caracterizada por hiperglucemia como consecuencia de un defecto en la secreción de insulina, la acción de ésta o por ambas1. La diabetes ocupa el tercero y el octavo lugares de mortalidad en el mundo.
La hiperglucemia crónica se asocia con daño en diferentes tejidos y órganos; los grupos épsilon-amino de la lisina y el extremo terminal libre de las pro teínas están glucosilados sin participación de las en zimas y producen alteraciones en: retina, riñones, sistema nervioso periférico, corazón, vasos sanguíneos y placenta, órgano fetal cuya función es el intercambio fetomaterno; diferentes investigadores piensan que se debe considerar a la diabetes como una vasculopatía2.
La diabetes gestacional se define como un grado de intolerancia a la glucosa, se puede diagnosticar desde la primera consulta prenatal1. El embarazo tiene un efecto diabetógeno, con resistencia a la insulina e incremento de las células beta de los islotes de Langerhans del páncreas. La resistencia a la insulina se presenta durante el segundo trimestre.
La secreción placentaria de hormonas, como progesterona, cortisol, lactógeno placentario, prolactina y hormona de crecimiento, contribuye a la resistencia a la insulina, lo que asegura el aporte de glucosa al feto a través de la placenta.
En la diabetes gestacional hay un incremento en la secreción de insulina durante la primera fase, regulada por un mecanismo compensador, el decremento índica el deterioro funcional de las células beta.
Xiang et al describieron que las mujeres latinoamericanas tienen incremento en la resistencia a la insulina, al paso de glucosa y su producción, con reducción del 67% de las células beta. Hay células autoinmunitarias aisladas y prevalencia de anticuerpos celulares, entre el 1,6 y el 38%, y de la carboxilasa y autoanticuerpos para la insulina y el ácido glutámico.
Algunas pacientes desarrollan una forma autoinmunitaria de diabetes tardía. En el 5% de los casos la incapacidad de las células beta obedece a un defecto en la compensación a la resistencia a la insulina por mutación de la glucocinasa3.
El diagnóstico es indispensable para iniciar el tratamiento, que incluye terapia nutricional, administración de insulina y sobrevida del feto. Las complicaciones maternas incrementan la morbimortalidad perinatal, las cesáreas y la hipertensión arterial crónica. El control adecuado mejora esta situación.
El deterioro en la tolerancia a la glucosa ocurre durante el tercer trimestre de la gestación y conlleva un embarazo de alto riesgo; al elaborar la historia clínica son importantes los antecedentes familiares de diabetes mellitus y gestacional, obesidad y glucosuria, es útil determinar las concentraciones de hemoglobina glucosilada (HbA1c), integrada por compuestos estables y glúcidos.
La hemoglobina A (forma adulta de la hemoglobina) tiene un componente: la hemoglobina A1, que se origina cuando la glucosa modifica a la primera, su concentración se eleva en los glóbulos rojos; la glucosilación afecta poco a su función. Los anticuerpos monoclonales específicos permiten la dosificación cuantitativa de HbA1c, el valor normal es del 6% e indica la eficacia del tratamiento. Cuando la diabetes está controlada y la concentración de glucosa es < 10 mmol o 180 mg/dl, el valor es del 9%; cuando el control es inadecuado, es superior al 9%4.
Caldeyro-Barcia et al5, Carrera Macía6 y Dexeus7 enfatizaron que durante el sufrimiento fetal crónico la reserva fetal de oxígeno decrece a valores críticos. Las contracciones uterinas inducidas, semejantes a las del trabajo de parto, producen dips tipo II, cuya etiología es la hipoxia fetal. Cuando la placenta y la reserva fetal de oxígeno son normales, la reducción temporal del flujo sanguíneo en el espacio intervelloso no produce caídas de la PO2 por debajo de valores críticos y la frecuencia cardíaca fetal (FCF) no se altera.
Bieniarz et al8 describieron la causa del sufrimiento fetal crónico como la disminución del intercambio feto-materno en pacientes con enfermedades como toxemia gravídica tardía, diabetes mellitus, hipertensión arterial crónica, etc., y las que repercutan en el funcionamiento normal de la placenta.
Iffy y Kaminetzky9 aseveraron: el feto de una mujer diabética puede morir súbitamente en el tercer trimestre o durante el trabajo de parto. Los hallazgos patológicos se relacionan con hiperglucemia e hiperinsulinemia y con hipoxia crónica leve (hoy denominada hipoxia crónica fetal) y tiene similitud con la eritroblastosis fetal debida a isoinmunización al factor Rh.
Queenan10 propuso que las pacientes diabéticas de clase A, con antecedente de muertes fetales e hipertensión o quienes requieren insulina, necesitan de un cardiotocograma.
Rosenn11 valoró las diferentes pruebas fetales antenatales en embarazadas con diabetes mellitus. El objetivo fue diagnosticar las alteraciones en la FCF, para intervenir oportunamente. Los estudios en modelos animales mostraron que cuando hay riesgo de hipoxia por hiperglucemia e hiperinsulinemia, se produce incremento en el consumo de oxígeno fetal. Si el perfil biofísico está alterado, el control de la glucemia evita la muerte fetal.
En Suecia, durante un año, se estudió una muestra de 3.958 pacientes con diabetes gestacional, se compararon la edad del embarazo y la paridad con un grupo testigo. La tasa de mortalidad fetal entre grupos no fue significativa.
Kjos et al publicaron un artículo acerca de la vigilancia y su valor predictivo anteparto en embarazadas diabéticas. La muestra fue de 1.400 pacientes, en el 13% no estaban preparadas para el estudio, hubo 2 muertes fetales de 36 a 38 semanas; una semana después las pacientes preparadas se sometieron al estudio.
Las pacientes con diabetes gestacional no complicada, tratadas sólo con dieta, no utilizaron la prueba antenatal antes de la semana 40, realizaron las pruebas sin estrés 2 veces por semana a partir de la semana 34, y las pacientes con diabetes gestacional complicada fueron tratadas con insulina.
Johnson et al, en pacientes con diabetes gestacional, utilizaron el perfil biofísico para el estudio antenatal, la muestra fue de 188 y no hubo fallecimientos; en pacientes no tranquilizadas la tasa de nacimientos fue del 2,7%.
Fuentes y Chez, en pacientes con diabetes pregestacional controlada que requirieron insulina, analizaron la supervivencia fetal antenatal, no hubo afección microvascular, hipertensión o fetopatía crónica. La muestra fue de 491, se analizaron 7 estudios de embarazadas: prueba sin estrés; en combinación con estrés; perfil biofísico del feto solo o en combinación, una o 2 veces por semana. En 17 (3,5%), el estudio fue anormal, se indujo el trabajo de parto y se realizó operación cesárea, en 7 (1,4%) hubo muerte fetal.
En el grupo con diabetes gestacional no complicada, durante la cuadragésima semana, se controló a las pacientes con dieta, que no tuvo efecto en el feto y no requirieron estudio antenatal.
En pacientes no controladas o las que recibieron tratamiento con insulina, el riesgo se incrementó, requirieron control y estudio antenatal durante el tercer trimestre.
En el grupo con diabetes gestacional grave el riesgo aumentó, recibieron insulina y se controló la glucemia. El perfil biofísico y la concentración normal de glucosa fueron excelentes indicadores del bienestar fetal.
El ultrasonido y la medición de la circunferencia abdominal en las semanas 29 a 33 sirvieron para diagnosticar fetos con hiperinsulinemia, las madres requirieron insulina. La vida del feto está en peligro cuando la hiperglucemia se asocia con factores adversos. La prueba sin estrés está indicada a partir de la semana 32 en pacientes tratadas con insulina, cerca de término y con régimen dietético adecuado.
Johnson et al utilizaron el perfil biofísico fetal para pronosticar la sobrevida antenatal, lo efectuaron una vez por semana a partir de la semana 32 con dieta controlada y 2 veces por semana a partir de la semana 32 en pacientes tratadas con insulina.
Langer no encontró diferencia en pacientes tratadas con dieta o con insulina. En aquellas con diabetes gestacional registró los movimientos fetales 2 veces al día durante el tercer trimestre y la prueba sin estrés una vez por semana a partir de las semanas 33 a 34 hasta el parto. Las mujeres sin complicaciones se sometieron a pruebas sin estrés una vez por semana desde la semana 28 hasta el parto o entre las semanas 38 y 39.
Jovanovic-Peterson y Peterson et al12, en pacientes con diabetes gestacional, determinaron el valor y la seguridad de un programa de aptitud cardiovascular y la tolerancia a la glucosa. Durante el tercer trimestre utilizaron 5 máquinas para ejercicio aeróbico, determinaron que el ejercicio de las extremidades inferiores estimuló la contractilidad uterina; 10 mujeres con el antecedente de intolerancia a la glucosa efectuaron ejercicio con las extremidades superiores y recibieron terapia de dieta, y a 10 con diabetes gestacional se las trató sólo con dieta.
La media ± desviación estándar (DE) de la hemoglobina glucosilada después de 6 semanas fue de 4,87 ± 0,34 mmol en el grupo con dieta frente a 3,89 ± 0,37 mmol en el grupo con dieta más ejercicio. La media posglucosa en el primer grupo fue de 10,40 ± 0,16 frente a 5,9 ± 1,1 mmol en el segundo grupo, en éste el resultado fue mejor y no se utilizó insulina.
Bung et al13 determinaron, en una muestra de 41 pacientes con diabetes gestacional, la eficacia de un programa de ejercicios que normalizó la tolerancia a la glucosa. De 21 pacientes, 17 completaron el programa, mantuvieron la normoglucemia y no requirieron insulina. En los grupos problema y control se compararon las complicaciones maternas y neonatales, la diferencia no fue significativa.
Decherney y Pernoll14 describieron que el riesgo de morbimortalidad es mayor en embarazadas con control de la glucemia deficiente, feto macrosómico o con polihidramnios. En la semana 32, se debe efectuar pruebas sin esfuerzo, o con esfuerzo, cada 2 semanas, y vigilar a las pacientes no controladas, con enfermedad vascular o con antecedente de tabaquismo.
Danforth15 afirma que la monitorización de la FCF y la prueba de tolerancia del feto a las contracciones uterinas están indicadas a partir de la semana 32 para determinar la reserva fetal de oxígeno.
Benson y Pernoll16 afirmaron que para valorar el estado físico del feto, en la semana 27, se debe practicar la prueba sin estrés, el perfil biofísico o el cardiotocograma. La variabilidad en la FCF y la velocidad arterial máxima sistólica umbilical son indicadores de la homeostasis cardiovascular fetal.
De ahí el interés en determinar el valor de la FCF, entre las semanas 23 y 37 de gestación, en pacientes con diagnóstico de diabetes pregestacional y gestacional, al ingreso y egreso del hospital.
MATERIAL Y MÉTODOS
El diseño fue abierto, prospectivo, comparativo y exploratorio. La muestra quedó integrada por 30 pacientes divididas en 2 grupos: grupo 1, con diabetes pregestacional y grupo 2, con diabetes gestacional.
1. En el grupo 1 (n = 15), la edad de las pacientes tuvo un rango de 20-46 años con una media ± DE de 29,87 ± 6,76 años. La edad de la gestación tuvo un rango de 23,3-37,2 semanas, con una media ± DE de 31,853 ± 4,056 semanas.
2. En el grupo 2 (n = 15), la edad tuvo un rango de 18-44 años con una media ± DE de 30,60 ± 8,48 años. La edad de la gestación tuvo un rango de 25-36 semanas, con una media ± DE de 32,53 ± 3,55 semanas.
Al iniciar los registros, a las pacientes se les tomó una muestra de sangre venosa para determinar la concentración de HbA1c. Se controló la presión arterial, el pulso, la temperatura y la frecuencia respiratoria, además se midieron la circunferencia abdominal, la altura uterina y se auscultaron los latidos fetales.
Se practicaron los análisis de laboratorio siguientes: biometría hemática, HbA1c, química sanguínea, uranálisis, electrolitos séricos, exudado cervicovaginal.
Para los registros de contractilidad uterina y FCF, se utilizó un cardiotocógrafo HP modelo 1350, serie 50 XM. En las primeras 24 h del ingreso de la paciente se le practicó un registro. El cardiotocograma se repitió dentro de las 24 h del egreso (alta). En esta investigación la paciente fue su testigo. Los registros tuvieron una duración de 2 h.
Criterios para inclusión
Se incluyó a las pacientes con: a) edad de 18-46 años; b) con diagnóstico de diabetes pregestacional o gestacional; c) edad de la gestación de 23-37 semanas; d) la única enfermedad cosiderada fue la diabetes, sin control prenatal y con desequilibrio metabólico, y candidatas a tratamiento con insulina, y e) aquellas que durante el control prenatal presentaron desequilibrio metabólico.
Criterios para exclusión
Fueron criterios de exclusión: a) hipertensión arterial; b) transgresión y/o desequilibrio dietético; c) toxemia (preeclampsia); d) hipertensión arterial o enfermedad vascular hipertensiva crónica; e) enfermedad sistémica grave; f) infección en vías urinarias; g) nefropatía diabética, y h) antecedente de tabaquismo y/o alcoholismo.
Las pacientes fueron atendidas en el servicio de oftalmología.
El estado físico de los recién nacidos se valoró de acuerdo con la prueba de Apgar durante los minutos 1 y 5; se les pesó y determinó la talla.
Todos los estudios fueron longitudinales.
Para el análisis estadístico se utilizó el programa SPSS y la prueba de la t de Student por parejas ordenadas de datos.
RESULTADOS
Para determinar la FCF se analizaron: la FCF basal, los ascensos transitorios o aceleraciones, las oscilaciones rítmicas y los dips tipos I y II.
Ascensos transitorios o aceleraciones
Se definen como un incremento en la FCF basal, con una amplitud de 15 latidos, con una duración de por lo menos 15 s y el papel avanzando a una velocidad de 3 cm/min17.
Los dips son caídas transitorias de la FCF originadas por una contracción uterina5.
Se efectuó el análisis comparativo de la FCF basal intragrupos en pacientes con diabetes pregestacional y gestacional.
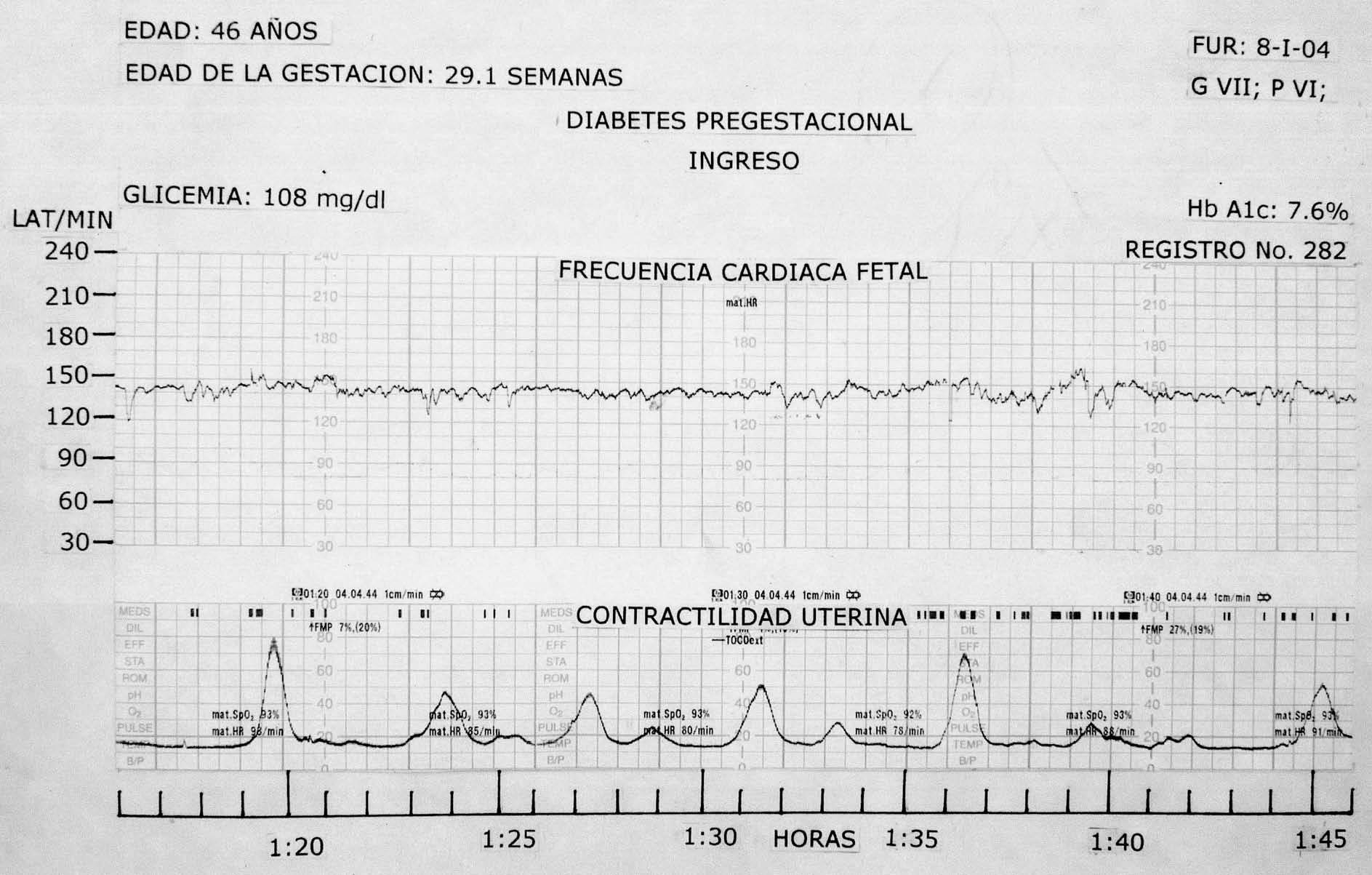
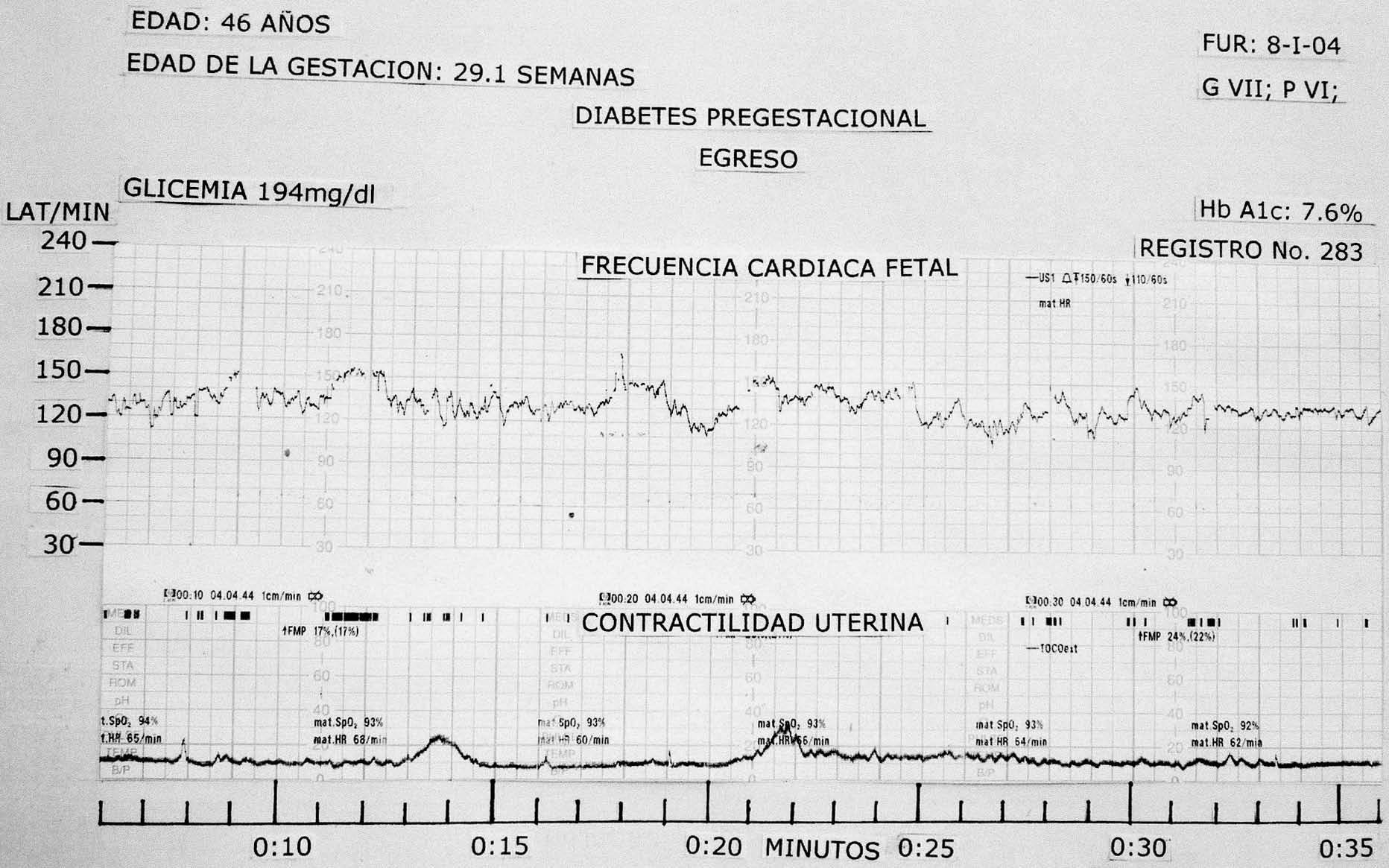
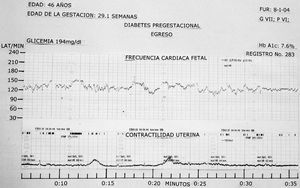
Grupo 1: al ingreso, el valor de la media ± DE de la FCF fue de 147,48 ± 11,28 lat/min, y al egreso, fue de 143,35 ± 10,62 lat/min; p < 0,000; la diferencia entre medias fue significativa (fig. 1).
Fig. 1. La frecuencia cardíaca fetal basal se mantuvo estable, en la segunda mitad se observan ascensos transitorios de mediana amplitud.
Fig. 2. La amplitud de los ascensos transitorios se incrementó, y se aproximó al valor normal de 24,81 latidos.
Grupo 2: al ingreso, la media ± DE de la FCF fue de 143,94 ± 6,73 lat/min (fig. 2), y al egreso, fue de 142,26 + 7,32 lat/min; p < 0,000; la diferencia entre medias fue significativa (tabla I).
Se comparó la FCF basal entre grupos en pacientes con diabetes pregestacional y gestacional al ingreso. En el primer grupo, la media ± DE fue de 147,06 ± 11,29 lat/min, y en el segundo, de 143,36 ± 7,16 lat/min; p < 0,000; la diferencia entre medias fue significativa (tabla II).
Un análisis semejante se practicó al egreso de las pacientes: en el grupo 1, la media ± DE fue de 143,99 ± 6,73 lat/min, y en el grupo 2, de 142,26 ± 7,32 lat/min; p < 0,000; la diferencia entre medias fue significativa (tabla III).
Se determinó y confrontó el valor de la amplitud de los ascensos transitorios o aceleraciones intragrupo. En el grupo 1, al ingreso, el valor de la amplitud fue de 23,72 ± 9,26 latidos, y al egreso, de 24,56 ± 8,52 latidos; la diferencia entre medias no fue significativa (fig. 3). En el grupo 2, al ingreso, el valor de la amplitud fue de 20,75 ± 8,38 latidos, y al egreso, de 22,19 ± 7,66 latidos; la diferencia entre medias no fue significativa (tabla IV y fig. 4).
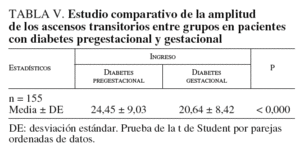
Durante el ingreso se comparó la amplitud de los ascensos transitorios entre grupos, en pacientes con diabetes pregestacional y gestacional. En el grupo 1, la media ± DE fue de 24,45 ± 9,03 latidos, y en el grupo 2, de 20,75 ± 8,38 latidos; p < 0,000; la diferencia entre medias fue significativa (tabla V).
Un análisis semejante se efectuó durante el egreso de las pacientes. En el grupo 1, la media ± DE fue de 24,56 ± 8,52 latidos, y en el grupo 2, de 21,46 ± 7,77 latidos; p < 0,003; la diferencia entre medias fue significativa (tabla VI).
Una paciente con diagnóstico de diabetes pregestacional (egreso) presentó 2 dips tipo II de mediana amplitud (fig. 4).
Glucemia
En el grupo 1, al ingreso, la glucosa tuvo un rango de 75-176 mg/dl, con una media ± DE de 119,27 ± 29,50 mg/dl, y al egreso fue de 63-194 mg/dl, con una media ± DE de 112,20 ± 44,84 mg/dl.
En el grupo 2, al ingreso, la glucosa tuvo un rango de 84-342 mg/dl, con una media ± DE de 139,07 ± 63,92 mg/dl, y al egreso, el rango fue de 63-176 mg/dl, con una media ± DE de 119,50 ± 29,84 mg/dl.
Hemoglobina glucosilada
Se obtuvieron los valores siguientes: en el grupo 1, al ingreso, la HbA1c tuvo un rango de 5-12%, con una media ± DE de 7,46 ± 1,83%, y al egreso, el rango fue de 4,9-11,2%, con una media ± DE de 7,354 + 1,673%. En el grupo 2, al ingreso, la HbA1c tuvo un rango de 5,7-13,3%, con una media ± DE de 7,533 ± 2,016%, y al egreso, el rango fue de 8-10%, con una media ± DE de 6,68 ± 1,10%.
El resto de los análisis de laboratorio no mostraron cambios significativos.
Recién nacidos
Grupo 1: el parto de las 15 pacientes se atendió en el hospital, en 2 fue eutócico y en 13 se practicó operación cesárea, estuvo indicada en 5 pacientes por FCF con patrón no reactivo; FCF con patrón no reactivo y diabetes descompensada; presentación compuesta; situación transversa; presentación pelviana; desprendimiento prematuro de placenta normoinserta; cuello no favorable para inducción; enfermedad vascular hipertensiva y preeclampsia grave.
Catorce productos nacieron vivos, el peso tuvo un rango de 1.900-4.315 g, con una media de 3.106 ± 640,97 g. La talla tuvo un rango de 43-53 cm, con una media de 49,40 ± 2,92 cm.
Se utilizó la prueba de Apgar para valorar el vigor de los recién nacidos, 12 eran vigorosos, la calificación en el primer minuto tuvo un rango de 7-8; 2 productos nacieron deprimidos con calificaciones de 2 y 6. En el quinto minuto 13 recién nacidos eran vigorosos, con rango de 8-9; el recién nacido que en el primer minuto tuvo calificación de 2 se mantuvo deprimido, en el quinto minuto la calificación fue 5.
Grupo 2: de las 15 pacientes, el parto de 3 no se atendió en el hospital, en 3 el parto fue eutócico y en 9 se practicó operación cesárea, estuvo indicada en 4 pacientes por FCF con patrón no reactivo; trombosis del seno longitudinal; preeclampsia grave; eclampsia y polihidramnios; cuello no favorable para inducción y miomatosis uterina; obesidad mórbida y producto macrosómico. En uno de los productos se diagnosticó FCF con patrón no reactivo, se practicó operación cesárea y se extrajo muerto.
En los recién nacidos el peso tuvo un rango de 2.630-4.420 g, con una media de 3.320,45 ± 565,70 g. La talla tuvo un rango de 46-53 cm, con una media de 49,27 ± 2,30 cm.
La calificación de Apgar en el primer minuto tuvo un rango de 7-9, y en el quinto minuto, de 8-9.
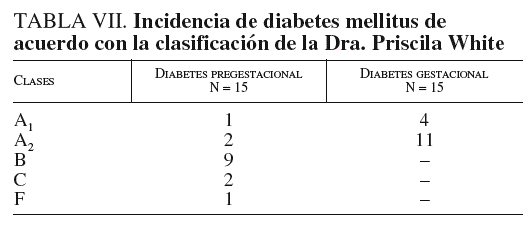
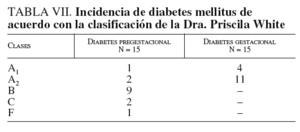
De acuerdo con la clasificación de diabetes de la Dra. Priscilla White, en el grupo con diabetes pregestacional predominó la clase B y en el de diabetes gestacional, la clase A2 (tabla VII).
DISCUSION
Se planeó que las pacientes del grupo con diabetes pregestacional se dividieran en 2 subgrupos, de acuerdo con la valoración del servicio de oftalmología: a) pacientes con microangiopatía; se incluiría a aquellas con diagnóstico de retinopatía diabética; se infirió que la placenta presentaría esta afección, y b) con macroangiopatía; se incluiría a pacientes sin retinopatía. Ninguna presentó alteraciones.
Diferentes investigadores afirmaron que los fetos de embarazadas diabéticas sufren de hipoxia crónica leve9. Buescher et al18 propusieron el concepto de hipoxia crónica fetal, la que se genera cuando hay baja saturación de oxígeno fetal en la sangre que circula por las vellosidades coriales, influida por la reducción en la permeabilidad placentaria a los gases respiratorios y baja saturación de oxígeno en la sangre del espacio intervelloso5.
Al comparar los valores de la FCF basal entre los grupos de diabetes pregestacional y diabetes gestacional, en el primero, la FCF estuvo más alta con 4 latidos, las causas probables fueron el tiempo de evolución de la diabetes, la vasculopatía placentaria, el edema de las vellosidades coriales8 y la hipoxia crónica fetal. El corazón está regulado por 2 mecanismos: el cardioestimulador y el cardioinhibidor, en ambos hay equilibrio. El primero se desencadena cuando la hipoxia es ligera, se estimula el simpático y la depleción de noradrenalina da como resultado cardioaceleración19.
Se comparó la FCF entre grupos al ingreso de las pacientes, en el primero, la FCF estuvo más alta con 4 latidos, ya se mencionaron las causas.
Al egreso de las pacientes, el descenso de la FCF en ambos grupos fue mínimo, quizá influyó la mejoría del cuadro clínico; sin embargo, la diferencia fue significativa.
Al analizar en el primer grupo la amplitud de los ascensos transitorios durante el ingreso y el egreso, la amplitud se mantuvo en el rango normal 24,41-24,56 latidos; el valor normal es de 24,81 latidos20.
Para el análisis estadístico se utilizó la prueba de la t de Student por parejas ordenadas de datos. La prueba tiene consistencia, al ordenar las parejas de datos los grupos deben ser del mismo tamaño, ésta es la razón por la cual en las tablas se observan algunos cambios en la muestra, la media y la DE.
La determinación de la HbA1c informa acerca de la ingesta y la eficacia del tratamiento. La glucosilación en los glóbulos rojos es continua y su valor indica la concentración de glucosa a la que estuvo expuesta la célula durante sus 120 días de vida y la cifra que predominó durante las semanas previas al análisis.
Al comparar en ambos grupos los valores de la glucemia durante el ingreso y el egreso, ésta decreció 7 y 20 mg/dl, respectivamente. Las concentraciones de la HbA1c se mantuvieron en el rango normal, con excepción de una paciente con diabetes gestacional que al ingreso alcanzó el 13,3%. En la diabetes compensada, el valor es del 6 al 9% y la zona de peligro, del 12 al 14%4.
Se clasificó a los recién nacidos por su peso en hipotróficos, eutróficos e hipertróficos, esta variable guarda relación con factores demográficos, antropométricos, metabólicos maternos y paternos. El peso materno antes del embarazo y su incremento durante la gestación se correlacionan con el peso del producto; la talla, la edad materna y la paridad se asocian con incremento en el peso del neonato.
Sparks describió la influencia de los factores genéticos en la masa magra y el «matroambiente»; al evaluar la composición corporal del neonato es posible predecir la morbilidad en el período neonatal y ulterior.
En los fetos macrosómicos el tejido adiposo es excesivo, durante el período expulsivo hay riesgo de distocia y traumatismo, hipoglucemia neonatal, obesidad durante la infancia y diabetes tipo 2 en la adolescencia.
El estado nutricional materno influye en el crecimiento fetal, la falta de nutrientes en los primeros meses es causa de anemia, embarazo pretérmino y productos hipotróficos; la carencia durante el último trimestre ocasiona el 9% de pérdida de peso en el recién nacido. Las alteraciones en el «matroambiente» afectan al crecimiento a largo plazo y conllevan obesidad y enfermedades cardiovasculares21.
Thompson et al describieron que, en partos subsecuentes, la paridad produce de 100 a 150 g de incremento en el peso del recién nacido, el efecto disminuye al aumentar el número de partos.
La concentración de glucosa materna y el crecimiento del feto se relacionan; la sensibilidad de la glucosa a la insulina antes de la concepción se asocia con aumento en la masa libre de grasa del neonato y con la paridad. El incremento en el número de partos y la edad disminuyen la sensibilidad a la insulina.
Knopp et al determinaron que el peso neonatal está asociado con los triglicéridos y ácidos grasos libres que cruzan la placenta al final del embarazo.
Ogburn et al, en una oveja preñada, demostraron que altas concentraciones de ácidos grasos libres inhiben la lipólisis y aumentan el depósito de grasa.
Kleigman et al compararon 2 grupos de pacientes: obesas y delgadas. Los hijos de madres obesas tuvieron alto peso al nacer, incremento en el tamaño de los pliegues cutáneos y alta concentración de ácidos grasos libres.
CONCLUSIONES
En el grupo de pacientes con diabetes pregestacional la FCF y la amplitud de los ascensos transitorios fueron mayores que en el segundo grupo, probablemente influyeron el tiempo de evolución de la diabetes, la vasculopatía placentaria y el edema de las vellosidades coriales, y la hipoxia crónica fetal.
En ambos grupos los valores de la FCF disminuyeron después del tratamiento, probablemente influyó la mejoría del cuadro clínico, ninguno alcanzó el valor normal de 135 lat/min.
Las concentraciones de glucemia y hemoglobina glucosilada decrecieron después del tratamiento en ambos grupos.
La indicación de cesárea en 11 pacientes tuvo como fundamento el cardiotocograma. El cardiotocograma debe practicarse a partir de la semana 25 de gestación, con duración aproximada de 45 min. La vigilancia de la FCF en pacientes con diabetes pregestacional y diabetes gestacional mediante el cardiotocograma disminuye la morbimortalidad fetal.