Comparar las concentraciones de factor de necrosis tumoral alfa (FNT-alfa) en pacientes con preeclampsia y embarazadas normotensas sanas.
Material y métodoSe seleccionó un total de 100 pacientes. Se incluyeron a 50 pacientes preeclámpticas como los casos (grupo A) y un grupo control que fue seleccionado por tener una edad y un índice de masa corporal similares al grupo de estudio, y consistió en 50 embarazadas sanas (grupo B). Las muestras de sangre para la determinación de FNT-alfa se recolectaron en todas las pacientes antes del parto e inmediatamente después del diagnóstico en el grupo de casos.
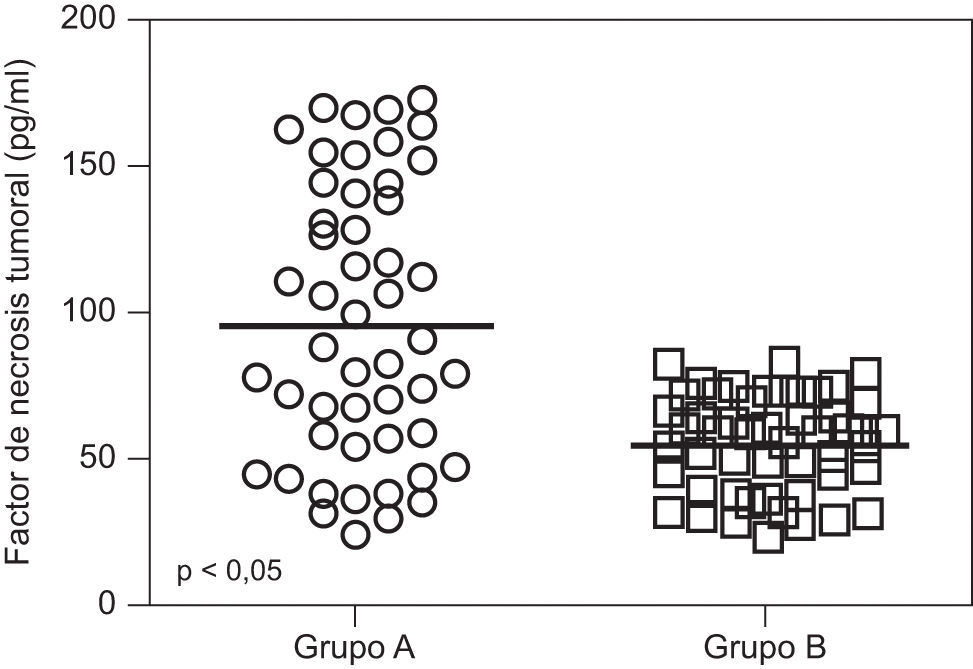
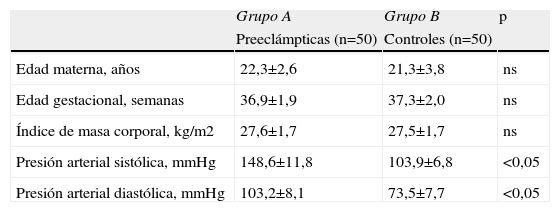
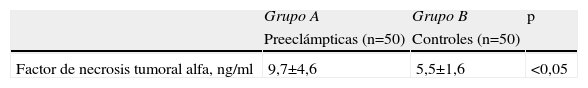
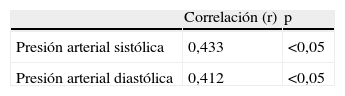
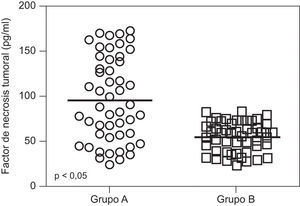
ResultadosNo se encontraron diferencias significativas con relación a la edad materna, edad gestacional e índice de masa corporal al momento de la toma de la muestra (p=ns). Se observaron diferencias estadísticamente significativas entre los grupos en los valores promedio de presión arterial sistólica y diastólica (p<0,05). Se encontraron diferencias estadísticamente significativa en las concentraciones de FNT-alfa entre las pacientes en el grupo A (9,7±4,6pg/ml) y las pacientes del grupo B (5,5±1,6pg/ml; p<0,05) y se observó una correlación moderada, positiva y significativa con los valores de presión arterial sistólica (r=0,433; p<0,05) y diastólica (r=0,412; p<0,05).
ConclusionesLas preeclámpticas presentaron concentraciones significativamente más altas de FNT-alfa al compararlas con embarazadas normotensas sanas.
To compare tumor necrosis factor-alpha concentrations in patients with preeclampsia and healthy normotensive pregnant women.
Material And MethodsOne hundred patients were selected. Fifty preeclamptic patients were selected as cases (group A) and 50 healthy pregnant women with a similar age and body mass index to patients in group A were selected as controls (group B). Blood samples for tumor necrosis factor-alpha determination were collected in all patients before labor and immediately after diagnosis in the study group.
ResultsThere were no significant differences in maternal age, gestational age or body mass index at sample collection (p=ns). Statistically significant differences were found between groups in mean values of systolic and diastolic blood pressure (p<0.05). Significant differences were found in tumor necrosis factor-alpha concentrations in group A (9.7±4.6pg/ml) and patients in group B (5.5±1.6pg/ml; p<0.05), and a moderate, positive and significant correlation was found with mean systolic (r=0.433; p<0.05) and diastolic (r=0.412; p<0.05) blood pressure.
ConclusionsTumor necrosis factor-alpha concentrations were significantly higher in preeclamptic patients than in healthy normotensive pregnant women.
La preeclampsia es una enfermedad multisistémica caracterizada por una alteración endotelial difusa, incremento de la resistencia vascular periférica, alteraciones de la coagulación, estrés oxidativo, dislipidemia y aumento de las citokinas producidas por los leucocitos1.
Se han propuesto diferentes hipótesis para explicar la fisiopatología de la preeclampsia: isquemia placentaria, alteraciones de las lipoproteínas plasmáticas, mala adaptación inmune y factores genéticos2. La hipótesis de la mala adaptación inmune sugiere que la preeclampsia es causada por la inadecuada regulación de la respuesta inmune Th2 materna, lo cual lleva a un aumento de la dañina inmunidad Th13,4. Se ha propuesto que la disfunción endotelial observada en la preeclampsia puede ser parte de una activación incontrolada y excesiva de la respuesta inflamatoria materna al embarazo. La respuesta inflamatoria inmune generalizada que ocurre en la preeclampsia es secundaria al aumento de las concentraciones de citokinas circulantes5.
Las citokinas son mediadores proteicos solubles involucrados en la respuesta inmune, reacciones inflamatorias, control de la respuesta inmune materna y desarrollo fetoplacentario6. El factor de necrosis tumoral alfa (FNT-alfa), inicialmente llamado caquectina, es un inmunoestimulante y mediador de la inflamación, capaz de promover algunos factores de crecimiento. Lo producen los macrófagos, las células T citotóxicas, la placenta y los tejidos deciduales7. Ejercer función en la implantación es capaz de modular la invasión del trofoblasto al útero, inhibir in vitro la síntesis de ADN y la proliferación celular del trofoblasto8–10. El FNT-alfa es detectable por inmunotinciones en los extremos proliferativos de las vellosidades, en el citotrofoblasto intersticial (aunque no en las células gigantes multinucleadas) y en el trofoblasto que penetra a las arterias espirales11. Además, está involucrado en el mecanismo de parto12. Su concentración plasmática en embarazadas muestra importantes variaciones interindividuales y dependientes de la edad de gestación; se ha descrito un aumento paralelo en el segundo trimestre y luego disminuye13. Diferentes datos sugieren que el FNT-alfa contribuye a las alteraciones endoteliales y a la dislipidemia que caracterizan la fisiopatología de la preeclampsia.
El objetivo de la investigación fue comparar las concentraciones del FNT-alfa en pacientes con preeclampsia y embarazadas normotensas sanas.
MétodoSe seleccionó un total de 100 pacientes. Se incluyeron 50 pacientes preeclámpticas como los casos (grupo A) y un grupo control seleccionado por tener edad e índice de masa corporal similares al grupo de estudio que consistió en 50 embarazadas normotensas sanas (grupo B). Todas las pacientes eran primigestas. El comité de ética del hospital aprobó el estudio.
La preeclampsia se definió como la presión arterial sistólica de 140mmHg o más, o presión arterial diastólica de 90mmHg o más, confirmada por 6h o más de diferencia, mientras que la proteinuria se definió como 300mg o más de proteína en una muestra de 24h, o 1–2 cruces de proteinuria en un examen cualitativo después de las 20 semanas de gestación.
Los criterios de exclusión fueron antecedentes de enfermedad hipertensiva preexistente (antes de las 20 semanas), enfermedad cardiaca o renal, diabetes mellitus, habito tabáquico, embarazo múltiple y tratamiento con medicamentos que puedan alterar las concentraciones de FNT-alfa.
Las muestras de sangre (10ml) se recolectaron en todas las pacientes antes del parto e inmediatamente después del diagnóstico en el grupo de casos de la vena antecubital y se las dejo coagular a temperatura ambiente. Posteriormente fueron centrifugadas a 4500g por 10min a los 30min de tomada la muestra y almacenadas posteriormente a −80°C. Se utilizó una prueba de inmunoabsorbencia ligada a enzima para la medición cuantitativa del FNT-alfa en cada muestra. Todas las mediciones fueron hechas por duplicado y el promedio de las 2 mediciones fue el resultado final. La sensibilidad fue de 3,5pg/ml. El coeficiente de variación intra e inter-ensayo fue menor del 5%.
Los valores obtenidos se presentaron como promedio±desviación estándar. La prueba t de Student para muestras no relacionadas se utilizó para el análisis de los grupos y comparar las variables continuas. Los coeficientes de correlación entre el FNT-alfa y la presión arterial sistólica y diastólica se evaluaron usando la prueba de Pearson. La precisión del FNT-alfa para el diagnóstico de preeclampsia se presenta en función de sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo y precisión. Se utilizó el análisis receptor-operador para determinar el mejor valor de corte. Se consideró p<0,05 como estadísticamente significativa.
ResultadosLas características generales de los 2 grupos de pacientes se muestran en la tabla 1. No se encontraron diferencias significativas con relación a la edad materna, edad gestacional e Índice de masa corporal al momento de la toma de la muestra (p=ns). Se observaron diferencias estadísticamente significativas entre los grupos en los valores promedio de presión arterial sistólica y diastólica (p<0,05).
Caracteristicas generales
| Grupo A | Grupo B | p | |
| Preeclámpticas (n=50) | Controles (n=50) | ||
| Edad materna, años | 22,3±2,6 | 21,3±3,8 | ns |
| Edad gestacional, semanas | 36,9±1,9 | 37,3±2,0 | ns |
| Índice de masa corporal, kg/m2 | 27,6±1,7 | 27,5±1,7 | ns |
| Presión arterial sistólica, mmHg | 148,6±11,8 | 103,9±6,8 | <0,05 |
| Presión arterial diastólica, mmHg | 103,2±8,1 | 73,5±7,7 | <0,05 |
En la tabla 2 se muestran los valores promedio de FNT-alfa. Se encontraron diferencias estadísticamente significativa entre las pacientes en el grupo de estudio (9,7±4,6pg/ml) y las pacientes del grupo control (5,5±1,6pg/ml; p<0,05; figura 1).
Al realizar la correlación entre las concentraciones de FNT-alfa y los valores de presión arterial (tabla 3), se observó una correlación moderada, positiva y significativa con los valores de presión arterial sistólica (r=0,433; p<0,05) y con los valores de presión arterial diastólica (r=0,412; p<0,05).
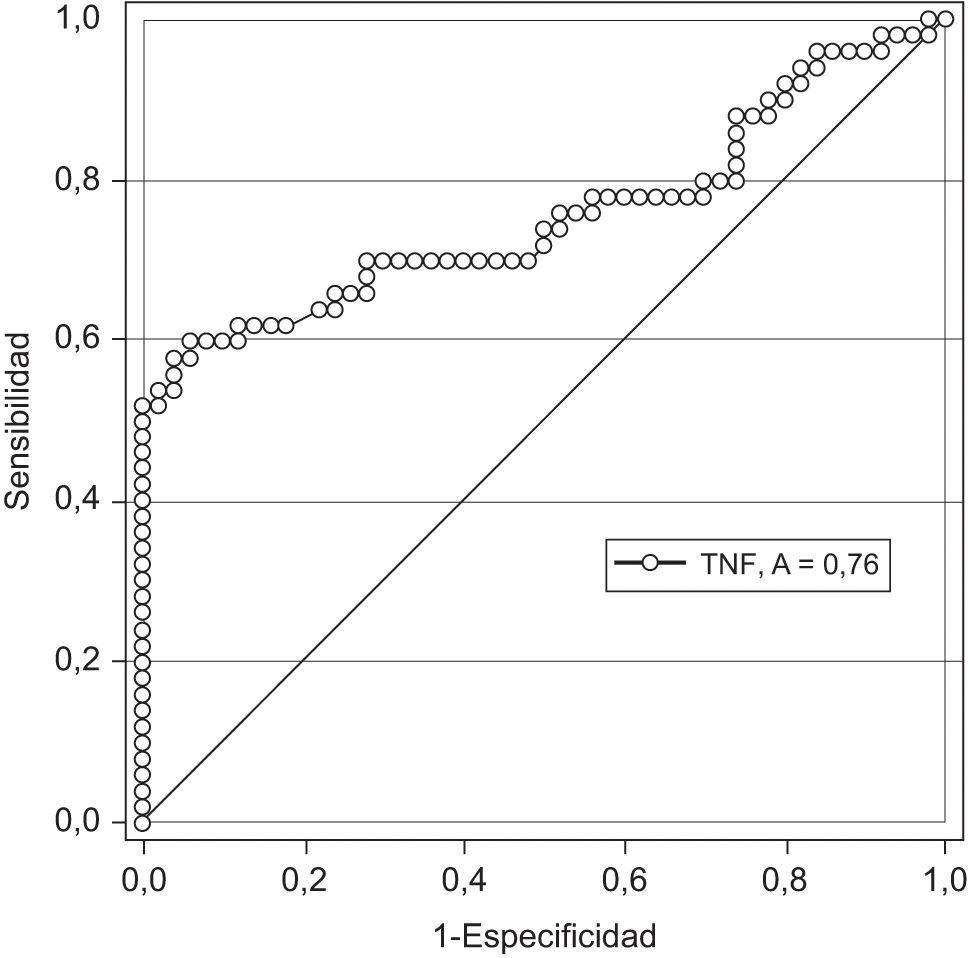
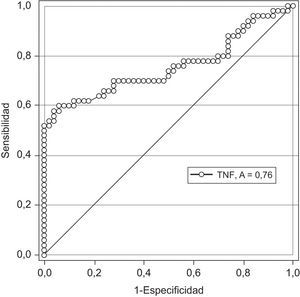
En la figura 2 se muestra la curva receptor operador para la precisión del FNT-alfa para el diagnóstico de preeclampsia. Un valor de corte de 6,0pg/ml tienen una sensibilidad 59,0%, especificidad 64,0%, valor predictivo positivo 72,0% y valor predictivo negativo 50,0% con una exactitud diagnóstica de 61,5%.
DiscusiónEn el presente estudio, las pacientes con preeclampsia presentaron concentraciones significativamente más altas de FNT-alfa en comparación con embarazadas normotensas sanas. La elevación de esta citokina es fundamental para el desarrollo tanto de la preeclampsia como de otras condiciones del embarazo, como el aborto, parto pretérmino y la restricción del crecimiento intrauterino11,12.
En mujeres sanas, se piensa que el FNT-alfa modula el crecimiento e invasión del trofoblasto en las arterias espirales8. Este factor puede contribuir a la invasión placentaria anormal, daño de las células endoteliales y estrés oxidativo4,10,14. Puede estimular la producción del interleucina (IL)-6, debido a que esta inhibe la liberación del factor de necrosis15. Hay opiniones contradictorias en cuanto a una posible relación entre FNT circulante y la preeclampsia. Kupferminc et al8 han encontrado que los valores plasmáticos de la citokina, cuantificados por inmunoanálisis, son más fácilmente detectables y tienen concentraciones superiores en preeclámpticas, que en las embarazadas normales. Durante el parto, las cifras fueron superiores en preeclámpticas, tanto en plasma como en líquido amniótico, pero se igualan entre 20–24h después. Al igual que lo reportado en esta investigación, Visser et al16 reportaron concentraciones elevadas de FNT-alfa bioactivo en plasma de preeclámpticas. Schiff et al17, por el contrario, no encontraron diferencias significativas en las concentraciones de FNT-alfa de pacientes con preeclámpticas y controles, pero reportan que los valores de la citokina son inferiores, tanto en plasma fetal como materno, cuando existe restricción intrauterina del crecimiento del feto de causa indeterminada.
Se ha descrito la presencia de concentraciones elevadas de FNT-alfa en el suero de embarazadas del primer trimestre que, más tarde, desarrollaron cuadro clínico de la hipertensión durante el embarazo18. Vince et al6 reportaron concentraciones altas de IL-6, FNT-alfa y sus receptores, concentraciones que fueron superiores en las pacientes con trombocitopenia. Las concentraciones plasmáticas de los receptores del FNT-alfa, pueden ser un marcador clínico mejor que la misma citokina19.
La placenta hipóxica parece ser la fuente de cantidades por encima de lo normal del FNT-alfa. En los embarazos normales, es necesario que el trofoblasto extravelloso exprese la proteína HLA-G, a fin de modular negativamente la formación de esta citokina20, cuya producción exagerada pudiera conducir al aborto, así como limitar la invasión trofoblástica. La supresión de la formación del factor, tiene importancia la espermina, que a su vez, requiere de la presencia de fetuína21. En la preeclampsia, no se expresa la proteína HLA-G en el trofoblasto extravelloso22, por lo que se puede pensar en la presencia de un incremento del FNT-alfa. La hipoxia placentaria, en condiciones experimentales, estimula la secreción de citokinas proinflamatorias. La capacidad de responder a la hipoxia con una mayor secreción de IL-1 y FNT-alfa, pertenece principalmente a las vellosidades placentarias.
La fuente de la producción excesiva de FNT-alfa en la preeclampsia es desconocida, puede tener su origen en los monocitos, los neutrófilos o la placenta misma. Ambas clases de monocitos están activados en la preeclampsia23. Uno de los posibles mecanismos es que en la preeclampsia uno o más factores derivados de la placenta estimulan los monocitos y/o los neutrófilos para producir el factor, el cual a su vez, causa las alteraciones subyacentes en el síndrome materno. La producción por la placenta puede tener algún papel fisiológico o patológico, ya que el sinciciotrofoblasto de la placenta normal contiene ARN mensajero del factor y factor biológicamente activo6,24.
El FNT-alfa puede causar daño tisular, mediante la acción de proteasas, colagenasas o fosfolipasa A2, o a través de radicales de oxígeno25. La afección de las células endoteliales lleva a alteraciones locales del flujo sanguíneo, obstrucción de vasos y aumento de la permeabilidad del endotelio, elementos señalados como característicos de la secreción patológica de esta citokina25,26. Entre sus acciones también figuran la facilitación de la actividad procoagulante, por inducción del factor tisular de células endoteliales y supresión de la activación de la proteína C, y la liberación de sustancias vasopresoras, como la endotelina-127 y el factor de crecimiento derivado de plaquetas28. Todas estas alteraciones son compatibles con lo que sucede en la preeclampsia. Ejerce acciones sobre la activación plaquetaria que, desde temprano, en fases preclínicas, tiene la preeclampsia. Añadir esta sustancia al plasma rico en plaquetas, antes de la prueba de ADP, resulta en disminución de la agregación en las muestras de no gestantes y de gestantes no complicadas, pero no en las preeclámpticas29.
Dentro de este esquema del mecanismo de la enfermedad, las citokinas actúan a distintos niveles. Se conoce que, el FNT-alfa y la IL-1 inducen la lipólisis en las células grasas30. Las dos sustancias, más la IL-6, promueven la síntesis de novo de ácidos grasos en el hígado, y sin la última, actúan negativamente sobre la oxidación hepática de los ácidos grasos y la cetogénesis30,31. El FNT-alfa y la IL-6, además, disminuyen la actividad de la lipasa lipoproteíca, y empeoran la remoción de la circulación de lipoproteínas ricas en triglicéridos32. Algunos productos de la oxidación de lipoproteínas de baja densidad, inducen la liberación de IL-1beta por las células mononucleares sanguíneas33.
Se concluye que las preeclámpticas presentaron concentraciones significativamente más altas del FNT-alfa al compararlo con embarazadas normotensas sanas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.