Comparar el diámetro transverso del timo fetal en el segundo trimestre en mujeres que desarrollan preeclampsia con embarazadas normales.
Materiales y métodosLa investigación se realizó en 241 embarazadas entre 17-20 semanas que acudieron a la consulta Pre-natal en el Hospital Central «Dr. Urquinaona», Maracaibo, Venezuela. El diámetro del timo fue visualizado y medido en un corte transverso del tórax del feto. Los casos fueron 94 embarazadas, las cuales desarrollaron preeclampsia (grupo A), 147 embarazadas fueron consideradas como controles (grupo B).
ResultadosNo se encontraron diferencias estadísticamente significativas en la edad materna, edad gestacional y presión arterial sistólica y diastólica al momento de la realización de la ecografía (p=ns). La edad gestacional al momento del diagnóstico de preeclampsia en el grupo A fue de 34,8±1,1 semanas. Se encontraron diferencias estadísticamente significativas en los valores del diámetro transversal del timo entre las pacientes del grupo A (16,9±0,6 milímetros) y las pacientes del grupo B (17,8±0,4 milímetros; p<0,0001). Un valor de corte de 17,5 milímetros presentó un valor bajo la curva de 0,89 y tuvo una sensibilidad de 62,5%, especificidad de 87,6%, valor predictivo positivo de 85,1% y valor predictivo negativo de 67,3%.
ConclusiónExiste disminución en el diámetro transversal del timo fetal en el segundo trimestre en los fetos de las embarazadas que posteriormente desarrollan preeclampsia.
To compare the transverse diameter of the foetal thymus in the second trimester of pregnancy in women who developed preeclampsia versus normal pregnant women.
Material and methodsThe study was conducted in 241 women between 17 and 20 weeks of pregnancy who attended the antenatal unit at the Dr. Urquinaona Central Hospital in Maracaibo, Venezuela. The diameter of the thymus was visualized and measured in a transverse view of the foetal thorax. Cases consisted of 94 pregnant women who developed preeclampsia (group A) and controls consisted of 147 pregnant women (group B).
ResultsNo significant differences were found in maternal age, gestational age, or systolic and diastolic blood pressure at ultrasound evaluation (p=ns). Gestational age at diagnosis of preeclampsia in group A was 34.8±1.1 weeks. The transverse diameter of the thymus significantly differed between patients in group A (16.9±0.6 millimetres) and patients in group B (17.8±0.4 millimetres; p<0.0001). A cut-off value of 17.5 millimetres had an area under curve of 0.89, sensitivity of 62.5%, specificity of 87.6%, positive predictive value of 85.1%, and negative predictive value of 67.3%.
ConclusionThe transverse diameter of the foetal thymus is reduced in the second trimester in the foetuses of pregnant women who later develop preeclampsia.
La preeclampsia es una complicación del embarazo con riesgos bien documentados tanto para el feto como para la madre1. Aunque la hipertensión y la proteinuria son hallazgos fundamentales en el diagnóstico clínico de la preeclampsia, estos son fenómenos tardíos en un proceso patogénico largo y multifactorial. Un hecho fundamental para este proceso es la compleja interacción entre los tejidos maternos, fetales y placentarios, que involucra tanto mecanismos inmunológicos como endocrinos, lo que lleva a una respuesta inflamatoria sistémica materna2,3. En la preeclampsiaexisten 2 principales hallazgos. Primero generalmente existen signos de alteración del proceso normal de placentación. Segundo, es frecuente un aumento en la respuesta inflamatoria, incluyendo activación endotelial sistémica, que conlleva a disfunción multiorgánica como resultado final3. La principal disfunción inmunológica está asociada con amplios cambios en la composición de linfocitos T maternos4.
El timo se origina en forma bilateral del tercer y cuarto bolsillo faríngeo como 2 divertículos endodérmicos en forma de botella. Durante la sexta semana de desarrollo, estos divertículos tímicos se extienden en forma lateral y posterior hacia el mesodermo que lo rodea y el mesénquima derivado de las crestas neurales que se encuentra por delante de la aorta ventral5. Estos divertículos finalmente se fusionan en su posición final en el mediastino anterosuperior durante la octava semana de desarrollo, donde se encuentran los elementos derivados de las 3 láminas germinales6,7. Para la décima semana de desarrollo, las células linfoides hematopoyéticas del hígado y la médula ósea migran y son agregadas al timo, produciendo una glándula lobulada con folículos linfoides5,8. La diferenciación posterior en corteza y médula se completa entre las 14 y las 16 semanas7.
El papel del timo como órgano inmune fue descrito en 1961 después de demostrar que cuando era removido quirúrgicamente en ratones de 3 días de nacidos, los animales presentaban concentraciones deficientes de linfocitos conocidos como células T de acuerdo a su órgano de origen9. Se ha descrito, más recientemente, el papel del timo en la maduración de las células T y reconocimiento de las células T de antígenos extraños por receptores de superficie específicos a combinaciones de complejos de péptidos y antígenos de histocompatibilidad que se originan a través de rearreglos genéticos durante la maduración del timocito9,10.
Con el avance de la tecnología de ecografía el estudio prenatal del tamaño del timo se ha vuelto posible en un gran número de fetos y se han generado tablas con valores normales con el diámetro transversal y perímetro del timo11. Varios estudios han demostrado que la involución del timo, determinado por ecografía es una parte integral de la respuesta inflamatoria fetal a un ambiente materno hostil en diversas patologías obstétricas12 y se ha descrito la disminución en el tamaño del timo fetal en la preeclampsia tanto en el segundo como en el tercer trimestre13,14. Más aún, durante el periodo prenatal, el tamaño del timo se ha correlacionado con la salida de células T y el número de células T CD41 y CD45RA115, abriendo la posibilidad de hacer que las mediciones del timo fetal sean una herramienta de pesquisa en respuesta a la activación de la vía del estrés mediado por sustancias inflamatorias y corticosteroides endógenos.
El objetivo de la investigación fue comparar el diámetro transverso del timo fetal en el segundo trimestre en mujeres que desarrollan preeclampsia con embarazadas normales.
Materiales y métodosLa presente investigación fue prospectiva y se realizó en embarazadas en las que se pudo realizar la evaluación ecográfica del feto entre 17-20 semanas que acudieron a la consulta Pre-natal en el Hospital Central «Dr. Urquinaona», Maracaibo, Venezuela. El protocolo de estudio fue aprobado por el Comité de Ética del Hospital y se obtuvo consentimiento por escrito de todas las pacientes.
La preeclampsia se definió como la presión arterial sistólica de 140mm de Hg o más, o presión arterial diastólica de 90mm de Hg o más, confirmada por 6h o más de diferencia, mientras que la proteinuria se definió como 300mg o más de proteína en una muestra de 24h, o 1-2 cruces de proteinuria en un examen cualitativo después de las 20 semanas de gestación16. La presión sanguínea se midió en posición sentada después de 15 minutos de descanso. Solo mujeres previamente sanas fueron incluidas en la investigación. En forma específica, fueron excluidas las mujeres con hipertensión crónica, enfermedad renal, diabetes pre o gestacional o con embarazos múltiples. Los controles consistieron en mujeres sanas con embarazos sin complicaciones con edades similares a la población de estudio en edad (±1 año) que fueron seleccionadas en forma continua. Para aumentar la sensibilidad de la prueba se decidió seleccionar 3 controles por cada 2 casos seleccionados.
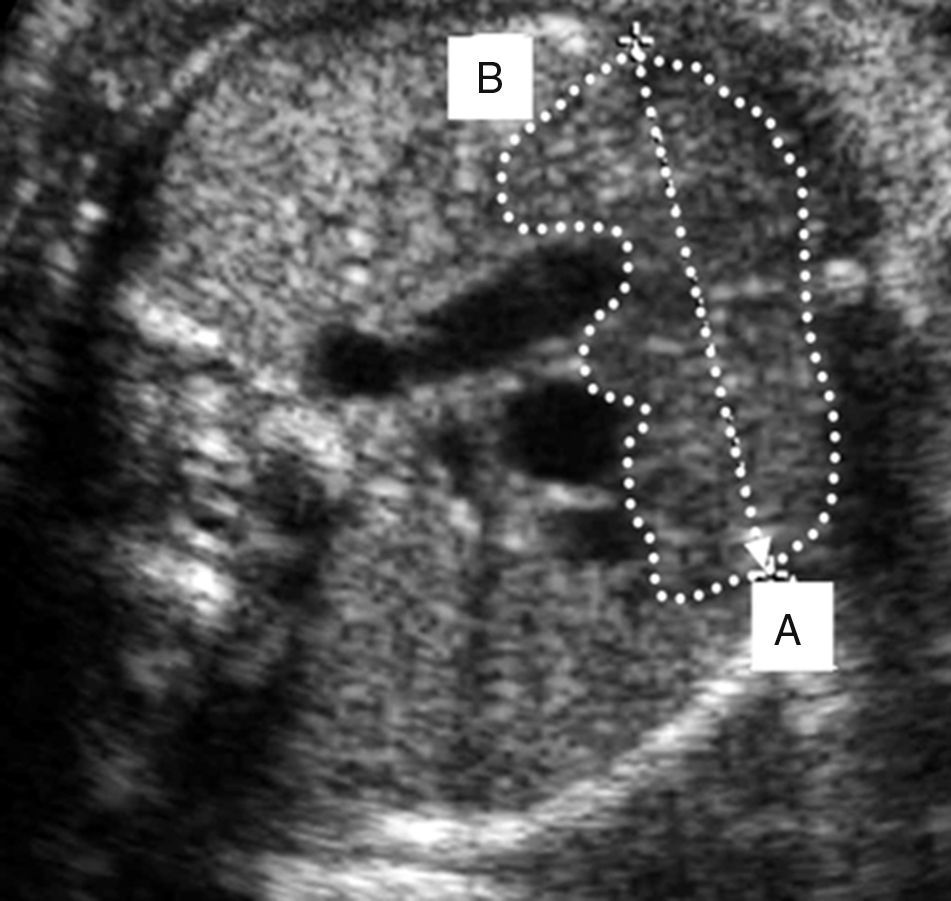
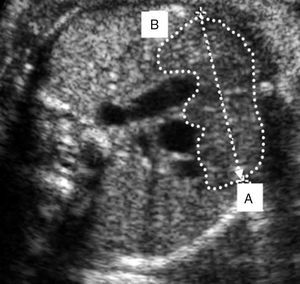
El diámetro transversal del timo fue visualizado y medido en un corte transverso del tórax del feto entre el esternón y los grandes vasos del corazón (la visión de los 3 vasos: arteria pulmonar, aorta y vena cava superior con la tráquea a la derecha de los vasos) y entre ambos pulmones (fig. 1). El timo aparece como una estructura oval y homogénea en el mediastino anterior, compuesto por 2 lóbulos conectados11. La ecografía fue realizada con un equipo General Electric Logiq® Pro 3 en tiempo real por un único examinador utilizando un transductor abdominal de 4-8MHz. Cada medición del diámetro transverso (determinado por una línea perpendicular que conectaba al esternón y la columna vertebral al haz de ultrasonido) del timo fue repetida 3 veces con un intervalo de 5 minutos entre mediciones en cada feto y se determinó el diámetro promedio. También se evaluaron el resto de las mediciones biométricas fetales usando las funciones de medición del ecógrafo. La información clínica de las pacientes evaluadas fue recolectada por uno de los investigadores que desconocía el resultado de la evaluación ecográfica.
Los valores obtenidos se presentaron como promedio±desviación estándar. Se utilizó la prueba de Kolmogorov-Smirnov para comprobar la distribución normal de los datos (p>0,05). La prueba de la t de Student para muestras no relacionadas se utilizó para el análisis de los grupos y para comparar las variables continuas. La precisión de las mediciones del timo para la predicción del desarrollo de preeclampsia se presenta en función de sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo. Se utilizó el análisis operador-receptor para determinar el mejor valor de corte. Se consideró p<0,05 como estadísticamente significativa.
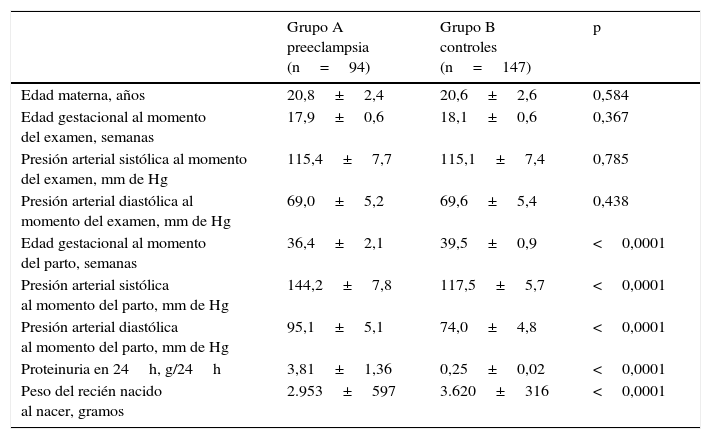
ResultadosSe obtuvo los resultados de las mediciones de 241 pacientes, de las cuales 94 embarazadas desarrollaron preeclampsia (grupo A) y 147 embarazadas fueron consideradas como controles (grupo B). Las características generales de los 2 grupos de embarazadas se muestran en la tabla 1. No se encontraron diferencias estadísticamente significativas en la edad materna, edad gestacional y presión arterial sistólica y diastólica al momento de la realización de la ecografía (p=ns). La edad gestacional al momento del diagnóstico de preeclampsia en el grupo A fue de 34,8±1,1 semanas. Sí se observaron diferencias estadísticamente significativas en la edad gestacional al momento del parto, presión arterial sistólica y diastólica al momento del parto, proteinuria en 24h y peso del recién nacido al nacer entre los 2 grupos de embarazadas (<0,0001).
Características generales
| Grupo A preeclampsia (n=94) | Grupo B controles (n=147) | p | |
|---|---|---|---|
| Edad materna, años | 20,8±2,4 | 20,6±2,6 | 0,584 |
| Edad gestacional al momento del examen, semanas | 17,9±0,6 | 18,1±0,6 | 0,367 |
| Presión arterial sistólica al momento del examen, mm de Hg | 115,4±7,7 | 115,1±7,4 | 0,785 |
| Presión arterial diastólica al momento del examen, mm de Hg | 69,0±5,2 | 69,6±5,4 | 0,438 |
| Edad gestacional al momento del parto, semanas | 36,4±2,1 | 39,5±0,9 | <0,0001 |
| Presión arterial sistólica al momento del parto, mm de Hg | 144,2±7,8 | 117,5±5,7 | <0,0001 |
| Presión arterial diastólica al momento del parto, mm de Hg | 95,1±5,1 | 74,0±4,8 | <0,0001 |
| Proteinuria en 24h, g/24h | 3,81±1,36 | 0,25±0,02 | <0,0001 |
| Peso del recién nacido al nacer, gramos | 2.953±597 | 3.620±316 | <0,0001 |
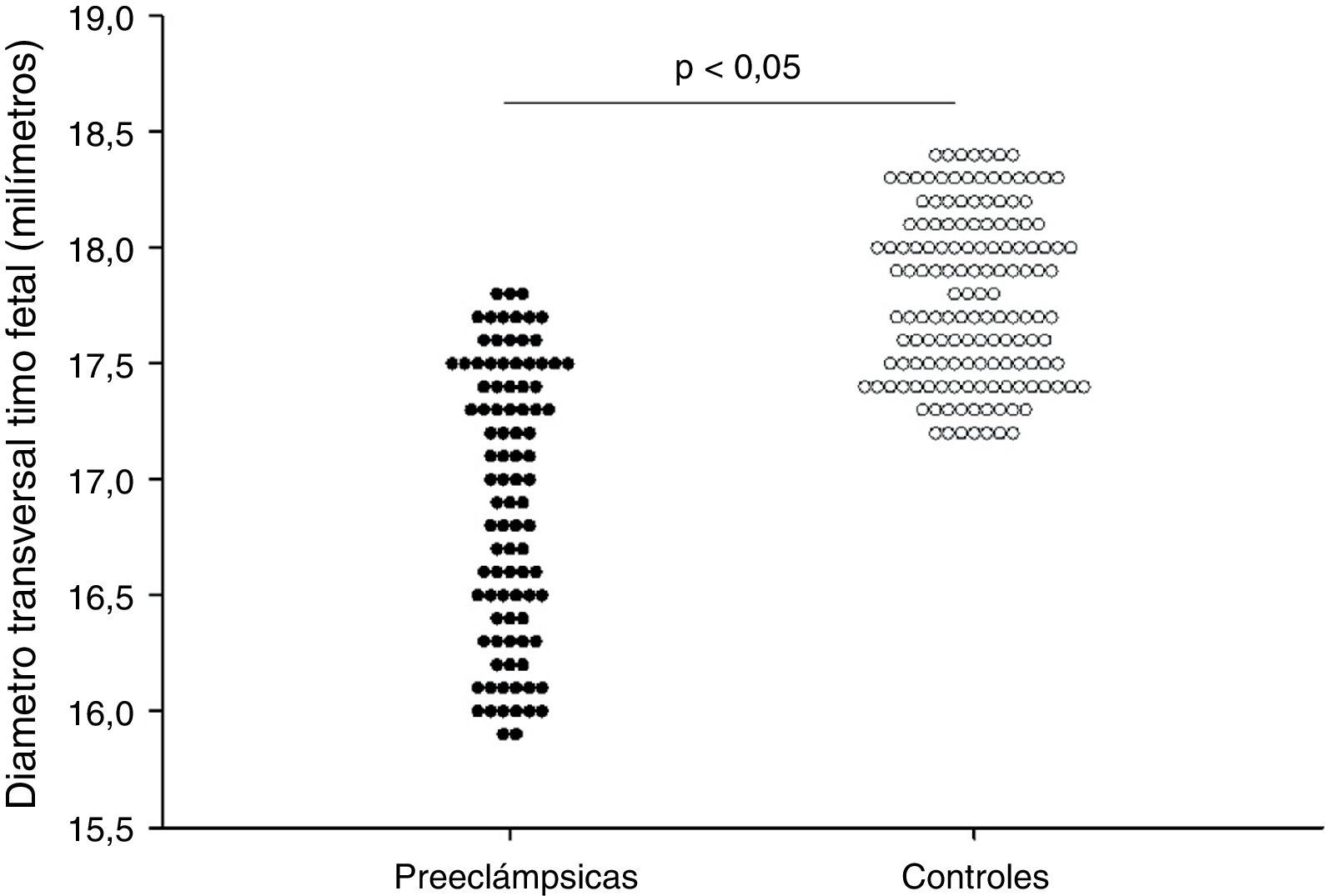
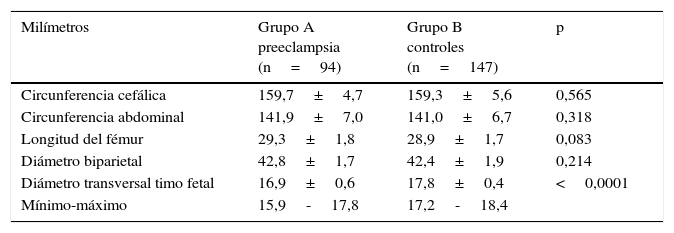
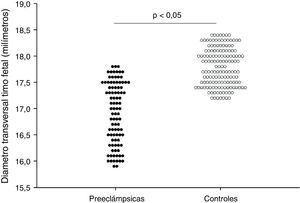
En la tabla 2 y la figura 2 se muestran los valores de las mediciones biométricas fetales y el diámetro transversal del timo. No se encontraron diferencias entre los grupos en los valores de circunferencia cefálica, circunferencia fetal, longitud del fémur y diámetro bi-parietal entre los 2 grupos (p=ns). Se observaron diferencias estadísticamente significativas en el diámetro transversal del timo entre las pacientes del grupo A (16,9±0,6 milímetros) y las pacientes del grupo B (17,8±0,4 milímetros; p<0,0001).
Mediciones biométricas fetales y diámetro del timo fetal en el segundo trimestre en mujeres que posteriormente desarrollaron preeclampsia comparado con embarazadas controles
| Milímetros | Grupo A preeclampsia (n=94) | Grupo B controles (n=147) | p |
|---|---|---|---|
| Circunferencia cefálica | 159,7±4,7 | 159,3±5,6 | 0,565 |
| Circunferencia abdominal | 141,9±7,0 | 141,0±6,7 | 0,318 |
| Longitud del fémur | 29,3±1,8 | 28,9±1,7 | 0,083 |
| Diámetro biparietal | 42,8±1,7 | 42,4±1,9 | 0,214 |
| Diámetro transversal timo fetal | 16,9±0,6 | 17,8±0,4 | <0,0001 |
| Mínimo-máximo | 15,9-17,8 | 17,2-18,4 |
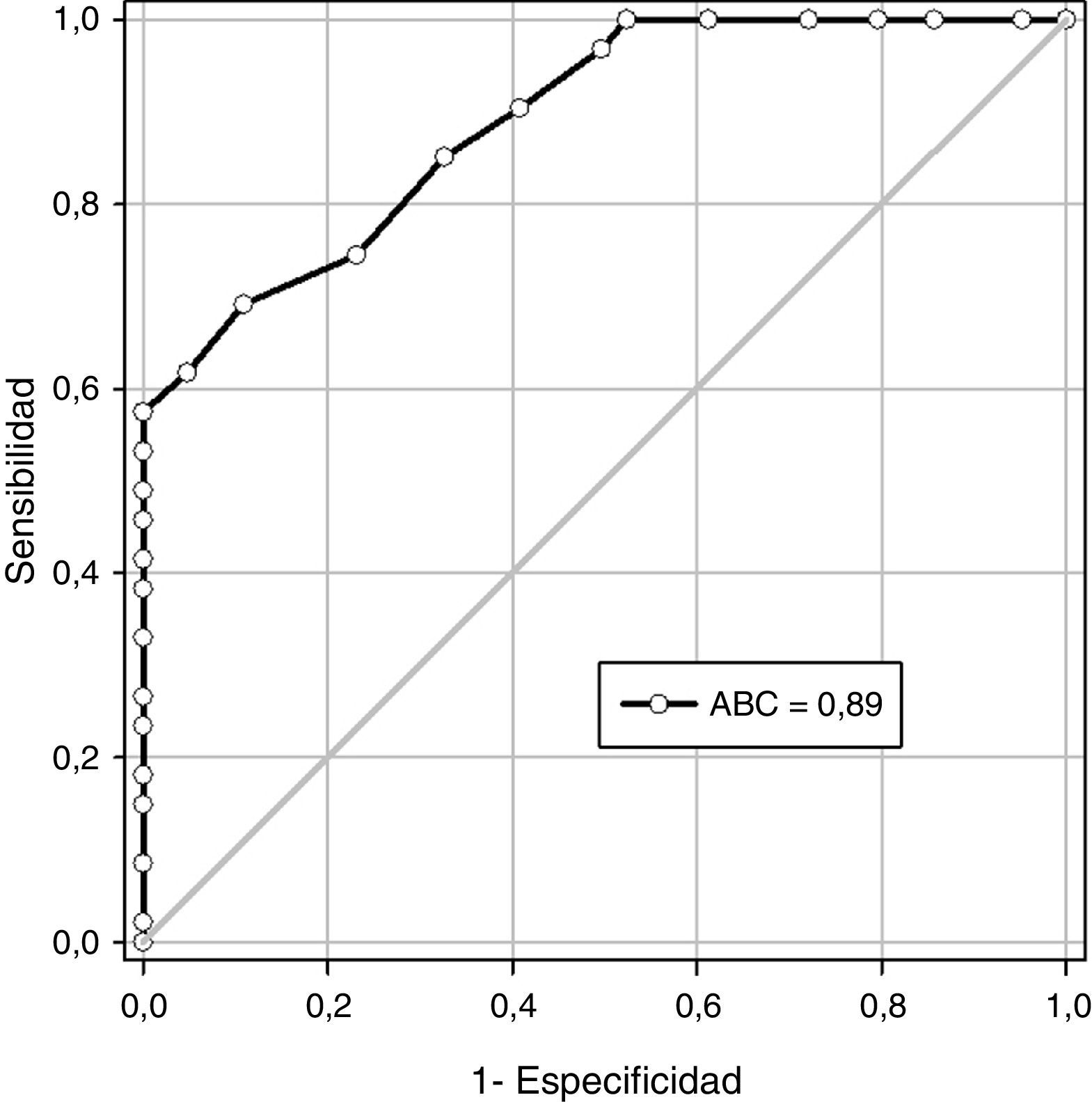
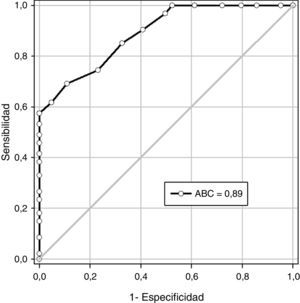
En la figura 3 se muestra la curva operador-receptor para la precisión del diámetro transversal del timo en la predicción de la preeclampsia. Un valor de corte de 17,5 milímetros presentó un valor bajo la curva de 0,89 y tuvo una sensibilidad de 62,5% (intervalo de confianza de 95% [IC 95%]; 53,5-70,8), especificidad de 87,6% (IC 95%; 80,1-93,1), valor predictivo positivo de 85,1% (IC 95%; 76,3-91,6) y valor predictivo negativo de 67,3% (IC95%; 59,1-74,8).
DiscusiónLos resultados de la presente investigación aportan evidencia de una disminución en el diámetro transversal del timo fetal en el segundo trimestre en embarazadas que posteriormente desarrolla preeclampsia.
Las mediciones del tamaño del timo han demostrado ser de utilidad clínica en varias patologías obstétricas. Aunque no se realizan de forma rutinaria en el ultrasonido fetal, la evaluación ecográfica del timo puede ser importante para la detección de hipoplasia. Esto es especialmente relevante en el diagnóstico prenatal del síndrome de DiGeorge, en el cual los defectos en el desarrollo tercer y cuarto bolsillo faríngeo llevan a malformaciones cardiacas y faciales, inmunodeficiencia celular secundaria a un timo ausente o hipoplásico e hipocalcemia debida a aplasia paratiroidea17. De Felice et al.18 demostraron una asociación significativa entre la marcada disminución del tamaño del timo al nacer y la corioamnionitis subclínica. El menor tamaño del timo correspondió a hallazgos histológicos de una disminución significativa de los linfocitos en el timo, tanto en la corteza como en la médula. También describieron modificaciones morfológicas en el timo de fetos con corioamnionitis histológica y en los recién nacidos con sepsis, confirmando que la morfología del timo es altamente susceptible al estrés inducido por la infección, aún en el feto19. Posteriormente, De Felice et al.20 también evaluaron si los timos pequeños al nacer podrían predecir la displasia broncopulmonar en recién nacidos con muy bajo peso al nacer. Se observó la presencia de un timo muy pequeño en 94% de los recién nacidos con displasia broncopulmonar comparado con 3% de los recién nacidos sin la patología21.
Mohamed et al.14 encontraron que las pacientes con preeclampsia presentaban valores promedio de diámetro y perímetro de timo fetal en el tercer trimestre menores que los controles sanos. Eviston et al.13 fueron los primeros en demostrar que los timos fetales de embarazadas que desarrollaban preeclampsia presentaban diámetros significativamente menores comparado con controles sanos (16,2±0,4 milímetros comparado con 18,3±0,2 milímetros; p<0,001), lo que sugiere que el crecimiento del timo fetal disminuye antes de la aparición clínica de la preeclampsia y precede a cualquier anomalía fetal descrita o cambios inmunológicos asociados a la preeclampsia. Los datos de la investigación confirman los hallazgos de investigaciones previas y demuestran una alta sensibilidad y valor predictivo negativo de esta prueba, lo cual significa que los fetos con valores inferiores a 17,5 milímetros en el diámetro transversal del timo puede ser un factor indicador de riesgo para el desarrollo de preeclampsia. De acuerdo a los resultados, un timo pequeño tiene un valor predictivo positivo de 85% y debería incrementar la sospecha clínica de desarrollo de preeclampsia, lo cual debe ser confirmado con pruebas adicionales y estudios a gran escala.
La presente investigación fue realizada para establecer la utilidad pronóstica de diámetros transversales del timo del feto en desarrollo para que puede aplicarse en forma fácil en la práctica ecográfica cotidiana. Aunque Zalel et al.11 han reportado el perímetro del timo en el feto en desarrollo, esta determinación puede ser difícil y laboriosa de medir, debido a que el parámetro completo del timo no siempre está bien definido. Sin duda, la medición del diámetro transverso es más sencilla que la del perímetro debido a que la interfase con los pulmones, que demarcan los márgenes laterales del timo, está bien definida en la mayoría de los casos.
Los cambios en el timo fetal en la preeclampsia pueden ser un evento primario como efecto directo de la patogénesis de la enfermedad. Las teorías actuales de la mala adaptación inmune en la preeclampsia sostienen que la disfunción inmune materna lleva a rechazo del feto semialogénico22; sin embargo, la inmunidad fetal en la preeclampsia es poco conocida. Debido a que el timo es un componente crítico de la tolerancia inmune, los cambios en el timo fetal en el embarazo temprano pueden influir la susceptibilidad materna a la preeclampsia13.
La involución del timo parece ser el resultado de la muerte celular dirigida por genes del timo junto con disminución de la proliferación y alteraciones en el microambiente de la glándula23. La hipoxia del timo, secundaria a insuficiencia placentaria, es un mecanismo pasivo potencial para la involución; sin embargo, el timo normalmente es hipóxico y el incremento de la oxigenación inhibe en forma paradójica el crecimiento24. Los mecanismos por los cuales esto ocurre parecen actuar a través de una vía neuroendocrina. Se ha descrito la involución en animales adrenelectomizados, sugiriendo un papel crítico del eje hipotálamo–hipófisis–suprarrenal en este proceso25. Se conoce que el cortisol induce apoptosis en los timocitos corticales26. En la preeclampsia, la expresión y la actividad enzimática de la 11β-hidroxiesteroide deshidrogenasa tipo 2 está disminuida27 y las concentraciones de cortisol en cordón umbilical son de 3-4 veces más altas en las preeclámpsicas. La enzima es dependiente del oxígeno y el incremento de su actividad enzimática ocurre a las 10-12 semanas, por lo que es posible que la disminución de la actividad enzimática incremente la exposición fetal al cortisol materno28.
La evidencia indica que la activación relacionada con el estrés del eje puede ser mediada por citosinas proinflamatorias y productos de los macrófagos activados29,30. Se ha descrito una disminución significativa en los linfocitos tímicos después de la exposición a interleucina 1α y 1β29, y se ha demostrado que la administración de interleucina 1β a ratas embarazadas activa el eje en las madres y reducen el peso del timo tanto en la madre como en el feto30. Es por lo tanto razonable que los mediadores de inflamación generados por el feto o la madre pueden activar el eje hipotalámico–hipófisis–suprarrenal que llevan a los cambios observados en el timo.
La medición ecográfica del diámetro transverso del timo para la predicción de preeclampsia parece útil debido a que es un método simple y no invasivo. Las referencias anatómicas utilizadas (el mediastino anterior y la «visión de los 3 vasos») pueden ser identificadas por cualquier examinador calificado y llevar a la identificación del tiempo por la mayoría de los ecografistas. En estudios previos la precisión de la evaluación ecográfica fue del 99% de los casos y no se pudo determinar en pacientes obesas o algunas condiciones fetales (anomalías en la anatomía intra-torácica, cardiomegalia, hernia diafragmática, lesiones quísticas pulmonares, hidrotórax y derrame pleural), lo cual enfatiza la simplicidad del método. Más aún, en estudios previos se ha demostrado una baja variabilidad intraobservador (3%) y alta reproductibilidad (98%), confirmando la precisión del examen ecográfico11.
ConclusiónLos hallazgos de la presente investigación permiten concluir que existe disminución en el diámetro transversal del timo fetal en el segundo trimestre en los fetos de las embarazadas que posteriormente desarrollan preeclampsia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.