El contacto de los espermatozoides con algunas especies bacterianas y sus factores solubles tiene un efecto negativo en la calidad seminal, alterando la función reproductiva del hombre. El objetivo de este trabajo fue determinar el efecto de 2 bacterias enteropatógenas (Escherichia coli [E. coli] y Enterococcus faecalis [E. faecalis]) y sus factores solubles sobre la calidad espermática.
MetodologíaLas cepas bacterianas de E. coli sensible y resistente a ampicilina/sulbactam y piperacilina/tazobactam, las cepas de E. faecalis sensible y resistente a gentamicina y estreptomicina de alto nivel, además de los factores solubles producto del metabolismo bacteriano de cada cepa, se incubaron con las muestras de semen de voluntarios. Posteriormente, se cuantificó la movilidad por microscopia y los parámetros funcionales espermáticos (potencial de membrana mitocondrial, integridad de la membrana, detección de especies reactivas del oxígeno e índice de fragmentación del ADN) por citometría de flujo.
ResultadosLas cepas de E. coli, E. faecalis y los factores solubles de su metabolismo alteran la movilidad espermática y algunos de los parámetros funcionales evaluados luego de 3 h de incubación con los espermatozoides humanos, sin que estos cambios sean estadísticamente significativos.
ConclusiónLa interacción de las bacterias E. coli y E. faecalis o los factores solubles producto de su metabolismo con los espermatozoides humanos alteran la calidad seminal, por lo que se debe evaluar el impacto de las infecciones urogenitales por estos microorganismos en la fertilidad masculina.
Interactions between sperm and bacteria or soluble factors have a negative effect on semen quality and male fertility. The aim of this study was to determine the effect of 2 enteropathogenic bacteria (Escherichia coli [E. coli] and Enterococcus faecalis [E. faecalis]) and their soluble factors on sperm quality.
MethodologyE. coli-sensitive and -resistant strains to ampicillin/sulbactam and piperacillin/tazobactam, E. faecalis-sensitive and -resistant strains to gentamicin and high level streptomycin and soluble factors produced by bacterial metabolism of each strain were incubated with semen samples from volunteers. Subsequently, motility was quantified by light microscopy and sperm function parameters (mitochondrial membrane potential, membrane integrity, reactive oxygen species, and chromatin integrity) by flow cytometry.
ResultsE. coli and E. faecalis strains and their soluble factors altered sperm motility and some of the sperm function parameters evaluated after 3h of incubation with human sperm but these changes were not statistically significant.
ConclusionSemen quality is affected by the interaction between E. coli and E. faecalis or their soluble factors. Therefore, there is a need to assess the impact of urogenital infections by these microorganisms on male fertility.
La infección del tracto urogenital masculino y la inflamación de las glándulas accesorias debida a la presencia de los microorganismos así como de la bacteriospermia, definida como la presencia de especies bacterianas en el fluido seminal, han sido relacionadas con la infertilidad masculina1,2. La presencia de especies bacterianas o de los factores solubles que puedan liberarse al medio (producto de su metabolismo) inducen una serie de eventos deletéreos de la función espermática3, desencadenando infertilidad asociada a infecciones del tracto reproductivo masculino4–8.
Aunque algunos autores no encuentran relación entre la bacteriospermia y la infertilidad masculina9, otros proponen caracterizar y evaluar las infecciones asintomáticas en el tracto urinario y las glándulas accesorias, debido a un efecto negativo sobre la calidad seminal1,10,11. Recientemente, nuestro grupo reportó la presencia de especies bacterianas como Escherichia coli (E. coli) y Enterococcus faecalis (E. faecalis) y Staphylococcus spp. en muestras seminales de hombres, inclusive fértiles, asintomáticos para infecciones urogenitales12.
E. coli es una bacteria gramnegativa implicada en diversos procesos que afectan el tracto reproductivo masculino como prostatitis, uretritis y epididimitis, y ejerce un efecto adverso sobre la movilidad espermática por su interacción directa con el espermatozoide mediada por las fimbrias bacterianas, induciendo aglutinación espermática13.
De otro lado, E. faecalis es una bacteria grampositiva, hace parte de la microbiota intestinal al igual que E. coli, está implicada en diversos procesos infecciosos como endocarditis14, bacteriemia15 y sepsis16, produce el 5% de las infecciones urinarias no complicadas17 y tiene resistencia natural a las cefalosporinas debido a que produce β-lactamasas. El tratamiento para infecciones enterocócicas es difícil debido a la creciente resistencia a los antibióticos, la cual puede ser transferida entre las diferentes cepas de E. faecalis a través de elementos genéticos móviles18,19.
El objetivo del presente estudio fue determinar el efecto de las cepas E. coli sensible y resistente a ampicilina/sulbactam y piperacilina/tazobactam, E. faecalis sensible y resistente a gentamicina y estreptomicina de alto nivel y los factores solubles (producto del metabolismo bacteriano de cada cepa) sobre la movilidad y la función espermática.
Materiales y métodosCepas bacterianasSe emplearon las cepas: a) E. coli sensible (ATCC 35218) y resistente (ATCC 25922) a los antibióticos ampicilina/sulbactam y piperacilina/tazobactam; y b) E. faecalis sensible (ATCC 51299) y resistente (ATCC 29212) a gentamicina y estreptomicina de alto nivel. Las cepas empleadas fueron cultivadas en agar nutritivo a 37°C/24 h.
Obtención de los factores solublesLos factores solubles de las 4 cepas de bacterias se obtuvieron incubando durante 30 min un inóculo de cada bacteria a una concentración de 0,5 McFarland en solución salina. Posteriormente, el medio se centrifugó a 600g/10 min, se recolectó el sobrenadante y se filtró empleando una membrana bacteriológica de 0,2μm (Advantec Industries, China), se alicuotó en cámara de bioseguridad y se almacenó a −20°C hasta su uso. Para evitar cambios en los factores solubles relacionados con la temperatura, una alícuota nueva fue empleada en cada ensayo.
Muestras de semenSe emplearon 42 muestras de semen de voluntarios aparentemente sanos, mayores de 18 años con parámetros seminales iguales o superiores a los límites inferiores de referencia establecidos por la Organización Mundial de la Salud (OMS)20,21. Las muestras de semen fueron colectadas por masturbación en un recipiente estéril, después de una abstinencia sexual de 3 a 5 días. A cada muestra de semen se le determinaron los parámetros seminales convencionales: volumen, movilidad, viabilidad20 y concentración espermática, usando la cámara de Makler (Sefi-Medical Instruments, Israel)22.
Evaluación del efecto de las bacterias y de los factores solubles producto de su metabolismo sobre la movilidad espermática y los parámetros funcionales espermáticosAntes de cada ensayo se preparó un inóculo de cada una de las bacterias en PBS (Gibco®, NY, EE. UU.) a una concentración 0,5 McFarland y se atemperaron las alícuotas requeridas de los factores solubles previamente preparados. Posteriormente, se incubaron los espermatozoides con las bacterias o los factores solubles producto del metabolismo bacteriano en proporción 1 a 1 (60μL de semen y 60μL de factores solubles) durante 3 h a 37°C, se determinó el efecto sobre la movilidad espermática después de 30 min, 1, 2 y 3 h de incubación. Los resultados son expresados como el porcentaje de cambio en la movilidad posterior a la normalización respecto a la muestra control. El control empleado en cada ensayo consistió en la evaluación de una alícuota de la muestra de semen sin tratamiento.
De otro lado, después de incubar una alícuota de 150μL de semen con las bacterias o los factores solubles durante 3 h a 37°C en proporción 1 a 1, se evaluaron los parámetros funcionales: potencial de membrana mitocondrial (PMM), integridad de la membrana plasmática, lipoperoxidación de la membrana, fragmentación de la cromatina, detección temprana de apoptosis y producción intracelular de especies reactivas de oxígeno mediante citometría de flujo (Coulter Epics XL, Beckman Coulter, CA, EE. UU.), analizando entre 5.000 y 10.000 espermatozoides, de acuerdo con las características consignadas en la tabla 13,6,8,23.
Pruebas funcionales y fluorocromos
| Prueba | Reactivos para la tinción | Referencias |
|---|---|---|
| Potencial de membrana mitocondrial | Ioduro de propidio (IP, 0,25mg/mL, Molecular Probes® Inc, OR, EE. UU.) y 3,3’dihexiloxacarbocianina (DIOC6, 10 nM Molecular Probes®) | 11,24 |
| Integridad de la membrana plasmática | IP (concentración final 0,25mg/mL) y Sybr 14 (LIVE/DEAD® Sperm Viability Kit, Molecular Probes® 1μM) | 11,24 |
| Especies reactivas del oxígeno | Di-acetato de 2′,7′ diclorofluoresceína (DCFH-DA, 1μM Sigma-Aldrich, St Louis, MO, EE. UU.) e IP (0,25mg/mL) | 11,24 |
| Índice de fragmentación del ADN | Naranja de acridina (NA, 0,006mg/mL Sigma-Aldrich, St Louis, MO, EE. UU.) | 11,24,25 |
Los resultados de las citometrías de flujo de cada parámetro funcional fueron graficados y procesados utilizando los programas WinMDI 2.9 (The Scripps Research Institute, La Jolla, CA, EE. UU.) y FlowJo 7.6 (Tree Star, Inc. Oregón, EE. UU.). En este estudio se aplicó estadística descriptiva (mediana y rango intercuartil). Los resultados obtenidos se analizaron con estadística no paramétrica utilizando la prueba Wilcoxon, considerando significación estadística un p<0,05. Se utilizó el programa GraphPad Prism 5 (Graphpad, CA, EE. UU.).
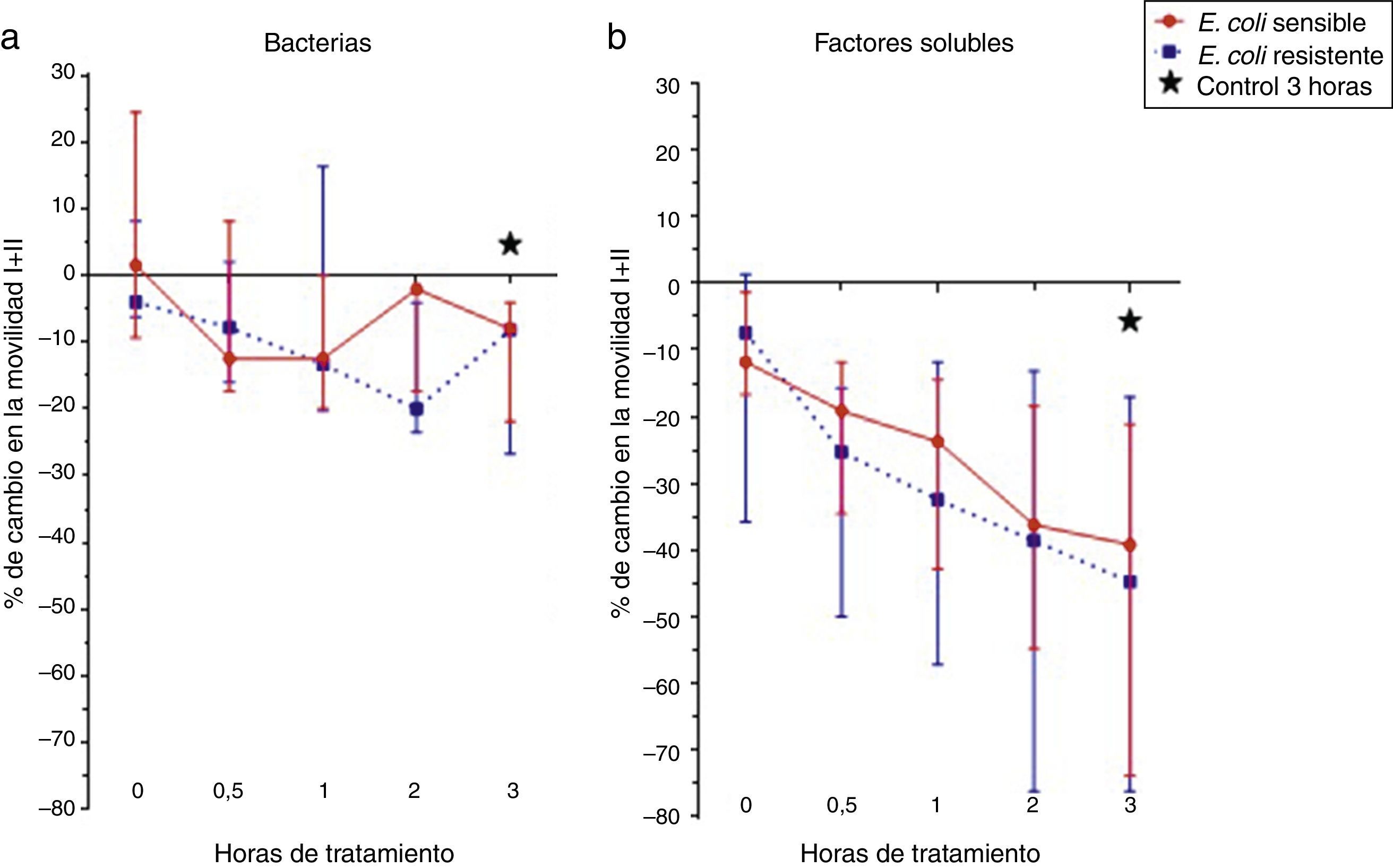
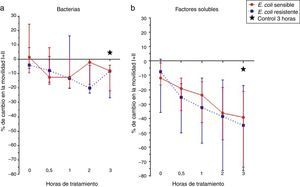
ResultadosEl efecto de las cepas de E. coli sensible y resistente a los antibióticos ampicilina/sulbactam y piperacilina/tazobactam y los factores solubles de su metabolismo sobre la movilidad espermática se observan en la figura 1. La cepa de E. coli resistente a ampicilina/sulbactam y piperacilina/tazobactam disminuyó transitoriamente la movilidad espermática en un 20% y la cepa sensible solo logró una reducción máxima del 10% (fig. 1a). Los factores solubles lograron una disminución de la movilidad espermática de 35 y 40% en la movilidad de la cepa sensible y resistente a ampicilina/sulbactam y piperacilina/tazobactam, respectivamente (fig. 1b); sin embargo, los cambios no fueron estadísticamente significativos.
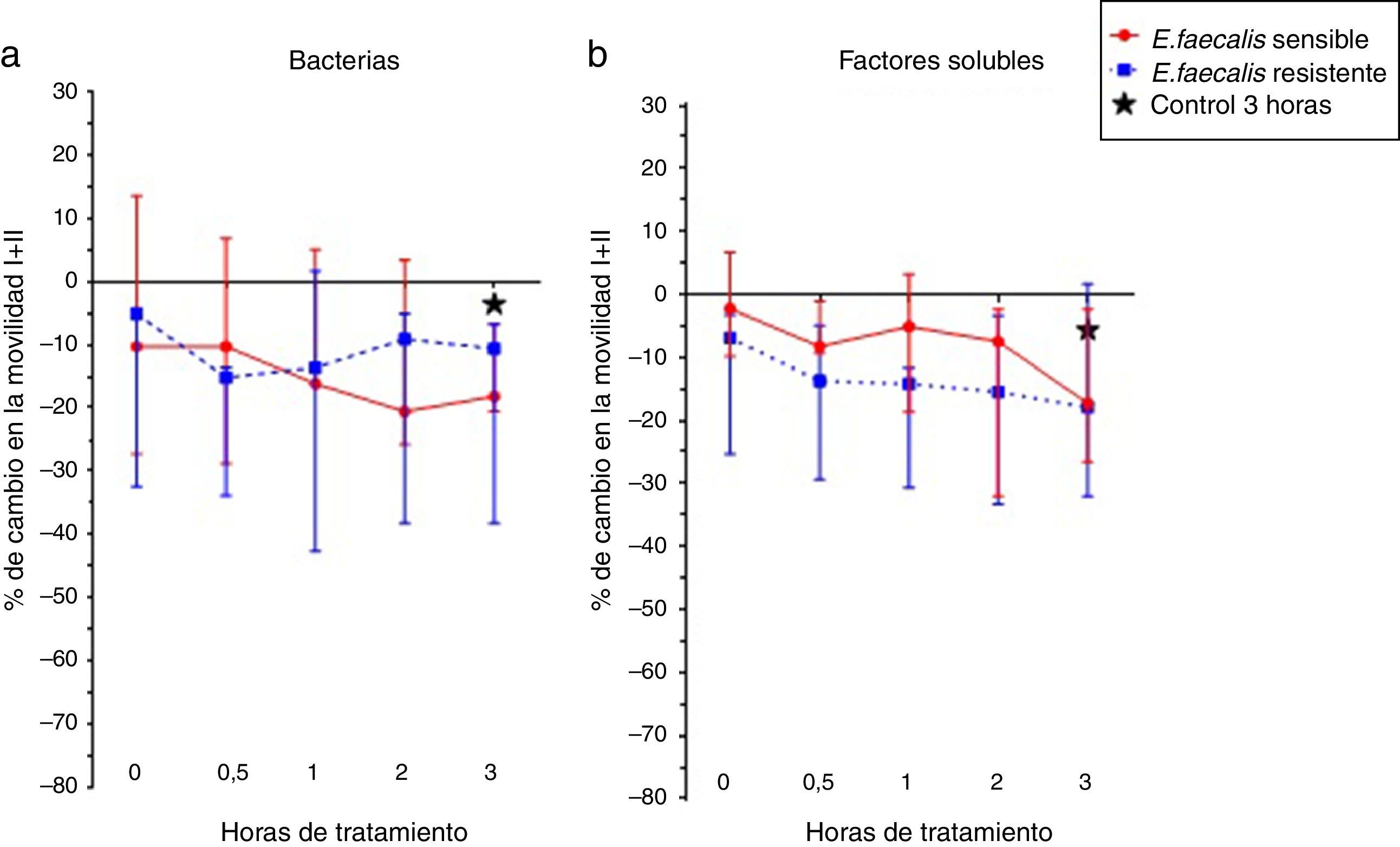
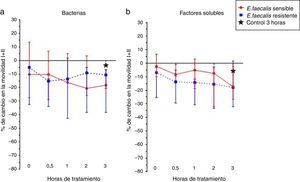
Al incubar los espermatozoides humanos con las cepas de E. faecalis sensible y resistente a gentamicina y estreptomicina de alto nivel, y los factores solubles producto de su metabolismo, se observa que la cepa sensible a los antibióticos previamente mencionados disminuyó la movilidad espermática en un 10% más que la cepa resistente (fig. 2a). Los factores solubles afectaron la movilidad espermática en un 20% con respecto al control (fig. 2b), contrario a lo sucedido en E. coli, los factores solubles de E. faecalis afectaron la movilidad espermática comparado con las cepas bacterianas.
Finalmente, se observó que los factores solubles producto del metabolismo de las cepas de E. coli sensible y resistente a ampicilina/sulbactam y piperacilina/tazobactam tienen un mayor efecto negativo sobre la movilidad espermática que las bacterias o que las cepas y los factores solubles de E. faecalis, aunque ninguno de estos cambios fue estadísticamente significativo.
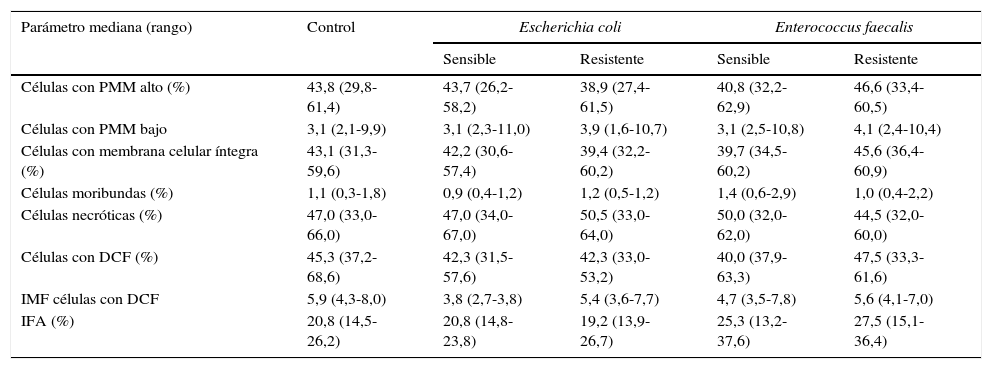
Para correlacionar los efectos sobre la movilidad observados al incubar los espermatozoides con las cepas y los factores solubles producto del metabolismo bacteriano de E. coli y E. faecalis, se evaluaron los parámetros espermáticos funcionales. Aunque no hay diferencias estadísticamente significativas en ninguno de los parámetros evaluados, la cepa de E. coli resistente a ampicilina/sulbactam y piperacilina/tazobactam aumenta en un 25,8% el porcentaje de células con PMM bajo y la cepa sensible disminuye en un 18,2% y en un 35,6% el porcentaje de células moribundas y la producción de especies reactivas del oxígeno con respecto al control. Por su parte, la cepa de E. faecalis resistente a gentamicina y estreptomicina de alto nivel aumenta en un 32,2% el porcentaje de células con PMM bajo y el IFA; la cepa sensible aumenta en un 27,3% y en un 21,2% el porcentaje de células moribundas y el IFA, respectivamente, y reduce en un 20,3% la producción de especies reactivas del oxígeno con respecto al control (tabla 2).
Efecto de la incubación in vitro de las cepas de E. coli sensible y resistente a ampicilina/sulbactam y piperacilina/tazobactam y E. faecalis sensible y resistente a gentamicina y estreptomicina de alto nivel sobre los parámetros espermáticos funcionales
| Parámetro mediana (rango) | Control | Escherichia coli | Enterococcus faecalis | ||
|---|---|---|---|---|---|
| Sensible | Resistente | Sensible | Resistente | ||
| Células con PMM alto (%) | 43,8 (29,8-61,4) | 43,7 (26,2-58,2) | 38,9 (27,4-61,5) | 40,8 (32,2-62,9) | 46,6 (33,4-60,5) |
| Células con PMM bajo | 3,1 (2,1-9,9) | 3,1 (2,3-11,0) | 3,9 (1,6-10,7) | 3,1 (2,5-10,8) | 4,1 (2,4-10,4) |
| Células con membrana celular íntegra (%) | 43,1 (31,3-59,6) | 42,2 (30,6-57,4) | 39,4 (32,2-60,2) | 39,7 (34,5-60,2) | 45,6 (36,4-60,9) |
| Células moribundas (%) | 1,1 (0,3-1,8) | 0,9 (0,4-1,2) | 1,2 (0,5-1,2) | 1,4 (0,6-2,9) | 1,0 (0,4-2,2) |
| Células necróticas (%) | 47,0 (33,0-66,0) | 47,0 (34,0-67,0) | 50,5 (33,0-64,0) | 50,0 (32,0-62,0) | 44,5 (32,0-60,0) |
| Células con DCF (%) | 45,3 (37,2-68,6) | 42,3 (31,5-57,6) | 42,3 (33,0-53,2) | 40,0 (37,9-63,3) | 47,5 (33,3-61,6) |
| IMF células con DCF | 5,9 (4,3-8,0) | 3,8 (2,7-3,8) | 5,4 (3,6-7,7) | 4,7 (3,5-7,8) | 5,6 (4,1-7,0) |
| IFA (%) | 20,8 (14,5-26,2) | 20,8 (14,8-23,8) | 19,2 (13,9-26,7) | 25,3 (13,2-37,6) | 27,5 (15,1-36,4) |
DCF: diclorofluoresceína; IFA: índice de fragmentación del ADN; IMF: intensidad media de fluorescencia; PMM: potencial de membrana mitocondrial.
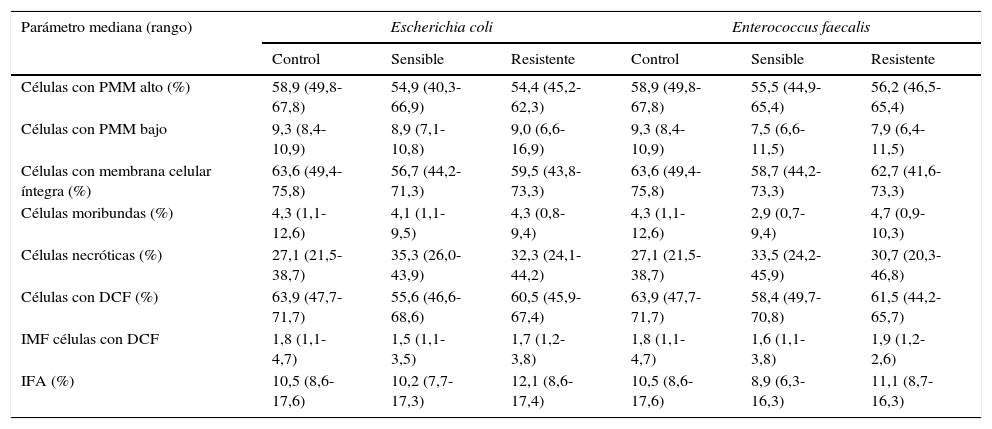
Con respecto a los parámetros funcionales de los espermatozoides incubados con los factores solubles producto del metabolismo bacteriano de E. coli y E. faecalis, observamos que los factores solubles producto del metabolismo de E. coli resistente a ampicilina/sulbactam y piperacilina/tazobactam aumentan en un 19,2% y un 15, 6% el porcentaje de células necróticas y el IFA, respectivamente. Los factores de la cepa sensible a dichos antibióticos aumentan el porcentaje de células necróticas en un 30,3% y disminuyen en un 19,2% la producción de especies reactivas del oxígeno con respecto al control. Los factores solubles de la cepa de E. faecalis resistente a gentamicina y estreptomicina de alto nivel disminuyen en un 14,6% el porcentaje de células con PMM bajo con respecto al control; los factores solubles provenientes de la cepa sensible incrementan el porcentaje de células necróticas en un 23,8% y reducen en un 19,5, 30,6 y 15,1% el porcentaje de células con PMM bajo, de células moribundas y el IFA, respectivamente, frente a la muestra control (tabla 3).
Efecto de la incubación in vitro de los factores solubles de E. coli sensible y resistente a ampicilina/sulbactam y piperacilina/tazobactam y E. faecalis sensible y resistente a gentamicina y estreptomicina de alto nivel sobre los parámetros espermáticos funcionales
| Parámetro mediana (rango) | Escherichia coli | Enterococcus faecalis | ||||
|---|---|---|---|---|---|---|
| Control | Sensible | Resistente | Control | Sensible | Resistente | |
| Células con PMM alto (%) | 58,9 (49,8-67,8) | 54,9 (40,3-66,9) | 54,4 (45,2-62,3) | 58,9 (49,8-67,8) | 55,5 (44,9-65,4) | 56,2 (46,5-65,4) |
| Células con PMM bajo | 9,3 (8,4-10,9) | 8,9 (7,1-10,8) | 9,0 (6,6-16,9) | 9,3 (8,4-10,9) | 7,5 (6,6-11,5) | 7,9 (6,4-11,5) |
| Células con membrana celular íntegra (%) | 63,6 (49,4-75,8) | 56,7 (44,2-71,3) | 59,5 (43,8-73,3) | 63,6 (49,4-75,8) | 58,7 (44,2-73,3) | 62,7 (41,6-73,3) |
| Células moribundas (%) | 4,3 (1,1-12,6) | 4,1 (1,1-9,5) | 4,3 (0,8-9,4) | 4,3 (1,1-12,6) | 2,9 (0,7-9,4) | 4,7 (0,9-10,3) |
| Células necróticas (%) | 27,1 (21,5-38,7) | 35,3 (26,0-43,9) | 32,3 (24,1-44,2) | 27,1 (21,5-38,7) | 33,5 (24,2-45,9) | 30,7 (20,3-46,8) |
| Células con DCF (%) | 63,9 (47,7-71,7) | 55,6 (46,6-68,6) | 60,5 (45,9-67,4) | 63,9 (47,7-71,7) | 58,4 (49,7-70,8) | 61,5 (44,2-65,7) |
| IMF células con DCF | 1,8 (1,1-4,7) | 1,5 (1,1-3,5) | 1,7 (1,2-3,8) | 1,8 (1,1-4,7) | 1,6 (1,1-3,8) | 1,9 (1,2-2,6) |
| IFA (%) | 10,5 (8,6-17,6) | 10,2 (7,7-17,3) | 12,1 (8,6-17,4) | 10,5 (8,6-17,6) | 8,9 (6,3-16,3) | 11,1 (8,7-16,3) |
IFA: índice de fragmentación del ADN; PMM: potencial de membrana mitocondrial.
Estudios previos han demostrado que las infecciones urogenitales masculinas disminuyen la calidad seminal y pueden causar problemas de fertilidad ocasionados por la interacción entre los espermatozoides y las bacterias o los productos solubles de su metabolismo4,7,24, generando cambios perceptibles en el espermograma como el deterioro de la movilidad y de la viabilidad en los espermatozoides, hasta otras alteraciones funcionales en parámetros como el potencial de membrana mitocondrial, la liberación de especies reactivas del oxígeno, la integridad de la membrana y la fragmentación del ADN.
En este estudio se evaluó el efecto de las bacterias E. coli sensible y resistente a ampicilina/sulbactam y piperacilina/tazobactam, E. faecalis sensible y resistente a gentamicina y estreptomicina de alto nivel y sus factores solubles producto del metabolismo bacteriano sobre la movilidad y los parámetros espermáticos previamente mencionados. Ambas bacterias y sus factores solubles causan un efecto negativo en la calidad seminal en términos de movilidad y parámetros funcionales in vitro: el mayor efecto adverso sobre la movilidad fue el observado con los factores solubles producto del metabolismo bacteriano de E. coli, especialmente la cepa resistente a ampicilina/sulbactam y piperacilina/tazobactam.
El efecto de E. coli sobre la movilidad espermática se ha asociado con la capacidad que tiene la bacteria de interactuar con los espermatozoides por medio de sus fimbrias, causando aglutinación y severas alteraciones morfológicas en la célula espermática13; sin embargo, el mayor efecto sobre la movilidad lo observamos al incubar los espermatozoides con los productos o factores solubles de la bacteria, similar a lo reportado por Barbonetti et al.4.
Existen diversas toxinas que pueden estar presentes en los factores solubles producto del metabolismo bacteriano que probablemente puedan afectar la calidad espermática, incluso después de muertas las bacterias. En el caso de E. coli, se ha reportado que la α-hemolisina, implicada en la pérdida de la movilidad espermática25,26, además, afecta la membrana mitocondrial, efecto generado por el incremento en el calcio intracelular tanto en las células epiteliales del tracto urinario como en las células inmunes y también se ha reportado que la toxina shiga like induce la vesiculación de la membrana celular, fragmentación del ADN y condensación de la cromatina27. Otros componentes de la pared bacteriana como los lipopolisacáridos y fragmentos de proteoglicanos pueden unirse a los espermatozoides directamente, causando efectos tóxicos28. En el caso de E. faecalis no se han descrito toxinas específicas ni factores de virulencia relevantes para la calidad seminal, sin embargo, la hemolisina mediada por plásmidos28 podría estar implicada en los efectos observados.
Schulz et al.7 han reportado deterioro en el potencial de membrana mitocondrial, la viabilidad y la movilidad al incubar los espermatozoides humanos con E. coli o sus factores solubles, pero, al contrario de lo observado en este estudio, el efecto negativo sobre la calidad seminal fue mayor al incubar la bacteria con los espermatozoides.
E. coli y E. faecalis se han descrito como patógenos frecuentes del tracto reproductivo masculino, incluso se han reportado en el semen de individuos asintomáticos para infecciones urogenitales3; sin embargo, estudios que evalúan la presencia de microorganismos en el tracto urogenital masculino mediante PCR cuantitativa, afirman que E. coli está presente en el semen en poca concentración, pero, por su fácil y rápido crecimiento en los cultivos y métodos diagnósticos tradicionalmente empleados, pueden impedir el crecimiento de otros gérmenes29, por lo que se considera que microorganismos como U. urealyticum, N. gonorrhoeae, C. trachomatis, M. hominis, C. albicas y T. vaginalis pueden tener mayor impacto sobre las alteraciones espermáticas de movilidad, función mitocondrial e integridad del ADN30.
Durante las observaciones microscópicas realizadas para determinar la movilidad espermática, se observó que las cepas de E. coli pueden generar aglutinación de los espermatozoides, similar a lo reportado por Liu et al.31. Aunque no se encontraron cambios estadísticamente significativos en los parámetros seminales convencionales y funcionales evaluados, se observan importantes disminuciones en los parámetros espermáticos que alcanzan hasta el 40% de afectación de los parámetros seminales, especialmente en la movilidad y en el daño del ADN, resultados acordes con otros autores como Borovkova et al.32.
El papel de las bacterias en la fertilidad seminal sigue siendo un tema controversial, especialmente en la calidad seminal. Se ha descrito que algunas bacterias que infectan la próstata pueden agruparse formando cúmulos o biofilms, lo que incrementa su resistencia a antibióticos33; sin embargo, se requieren otros estudios que permitan identificar aquellos microorganismos que puedan colonizar el semen sin causar daño a los espermatozoides, debido a que las concentraciones bacterianas en semen parecen superar en la mayoría de los casos al número de células espermáticas presentes en el eyaculado y pueden provenir de sitios anatómicos como la uretra, la vejiga o el surco coronario30.
La relevancia de estudiar el efecto de bacterias resistentes a algunos antibióticos y comparar su efecto con cepas sensibles radica en la alta frecuencia con la que falla el tratamiento contra agentes infecciosos urogenitales, tal y como es el caso de los genes de resistencia a tetraciclina, los cuales están ampliamente distribuidos en las infecciones bacterianas urogenitales33.
En conclusión, el contacto de los espermatozoides con las bacterias E. coli y E. faecalis o sus factores solubles afectan la calidad espermática y, por ende, pueden afectar la función reproductiva, incluso no es necesaria la viabilidad bacteriana para que el detrimento de la calidad seminal continúe, por lo que el tratamiento con antibióticos no siempre mejora la calidad seminal inmediatamente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo fue financiado por Colciencias (111556933373) y por la Estrategia de Sostenibilidad 2014-2015, Grupo Reproducción, de la Universidad de Antioquia. Jenniffer Puerta Suárez fue Joven Investigadora de Colciencias.