El valsartán es un fármaco antagonista de los receptores de angiotensina II, ampliamente utilizado en el tratamiento de la hipertensión arterial. Durante la gestación, su empleo se ha relacionado con hipoplasia pulmonar fetal, oligohidramnios, retraso del crecimiento fetal e hipoplasia ósea en la calota.
Caso clínicoPaciente de 44 años, hipertensa crónica en tratamiento con valsartán que consulta por test de gestación positivo tras varios meses de amenorrea. En la primera evaluación en urgencias se confirma la gestación con una biometría acorde a 26 semanas y un oligohidramnios severo. Se retira valsartán y se instaura tratamiento con alfa-metildopa. En la revisión posterior se detecta anhidramnios, la morfología renal impresiona como riñón displásico y se evidencia el alto riesgo de hipoplasia pulmonar. En la semana 33, la paciente ingresa por amenaza de parto prematuro. Se produce un parto espontáneo con feto mujer de 2.520g que se traslada a la unidad de cuidados intensivos neonatal. A las 8h de vida se produce el óbito por fracaso respiratorio y renal.
ConclusiónPodemos concluir que el abandono del tratamiento con dicho fármaco debe ser inmediato al conocerse el embarazo, aunque los efectos secundarios pueden ser irreversibles, induciendo así la muerte fetal.
Valsartan is an angiotensin II receptor antagonist that is widely employed in the treatment of hypertension. The use of this drug in pregnancy has been related to fetal lung hypoplasia, oligohydramnios, delayed fetal development, and calvarial hypoplasia.
Case reportA 44-year-old woman with chronic hypertension treated with valsartan consulted due to a positive pregnancy test after several months of amenorrhea. In the first emergency evaluation, pregnancy was confirmed, with fetal biometric findings showing appropriate growth and severe oligohydramnios. Valsartan was withdrawn and treatment with α-methyl-dopa was initiated. At the next visit, anhydramnios was detected, renal morphology showed renal dysplasia and there was a high risk of lung hypoplasia. At 33 weeks, the patient was admitted to hospital due to risk of premature delivery. A female infant, weighing 2520g, was delivered vaginally at 33 weeks and was moved to the neonatal intensive care unit. After 8h, the infant died from respiratory and renal failure.
ConclusionValsartan treatment should be discontinued immediately when pregnancy is identified, although the adverse effects may be irreversible and can even provoke fetal death.
El sistema renina-angiotensina (SRA) está directamente implicado en el control de la presión arterial y del equilibrio electrolítico, por lo que su bloqueo constituye una de las posibilidades terapéuticas en la hipertensión arterial. Hoy en día se dispone de fármacos que antagonizan selectivamente los receptores AT1 para la angiotensina (ARA) II, entre los que se encuentran valsartán, irbesartán y candesartán.
Desafortunadamente, desde su introducción, el uso de estos antihipertensivos ha coincidido con gestaciones incipientes y/o avanzadas, recogiéndose en la bibliografía casos con oligohidramnios, retraso del crecimiento fetal, hipoplasia pulmonar, contracturas musculares e hipoplasia ósea de los huesos de la calota1.
Caso clínicoPaciente de 44 años de edad, con antecedentes personales de hipertensión arterial crónica en tratamiento con valsartán y diabetes controlada con insulina. Historia obstétrica previa de 3 embarazos, 1 aborto, 2 partos eutócicos y 2 hijos vivos.
Acude al servicio de urgencias por primera vez en febrero de 2008 por cefalea tras haberse realizado un test de gestación con resultado positivo, puesto que previamente desconocía su estado gravídico. Se suspende el tratamiento con valsartán, se pauta alfa-metildopa y se deriva a la unidad de medicina fetal para su estudio. En la primera exploración realizada se aprecia una biometría fetal con un patrón de crecimiento adecuado con un peso fetal estimado de 1.130g (percentil 93). Existe anhidramnios que dificulta la valoración de la anatomía, aunque se visualizan ambos riñones aumentados de tamaño y con una corteza renal hiperrefringente; no se logra visualizar la vejiga. Hay una arteria umbilical única, pero no hay otros marcadores ecográficos de cromosomopatía ni defectos estructurales evidenciables. El estudio Doppler uteroplacentario y fetal es normal. Se descarta la rotura prematura de membranas mediante una prueba rápida de tira reactiva de inmunocromatografía de un paso.
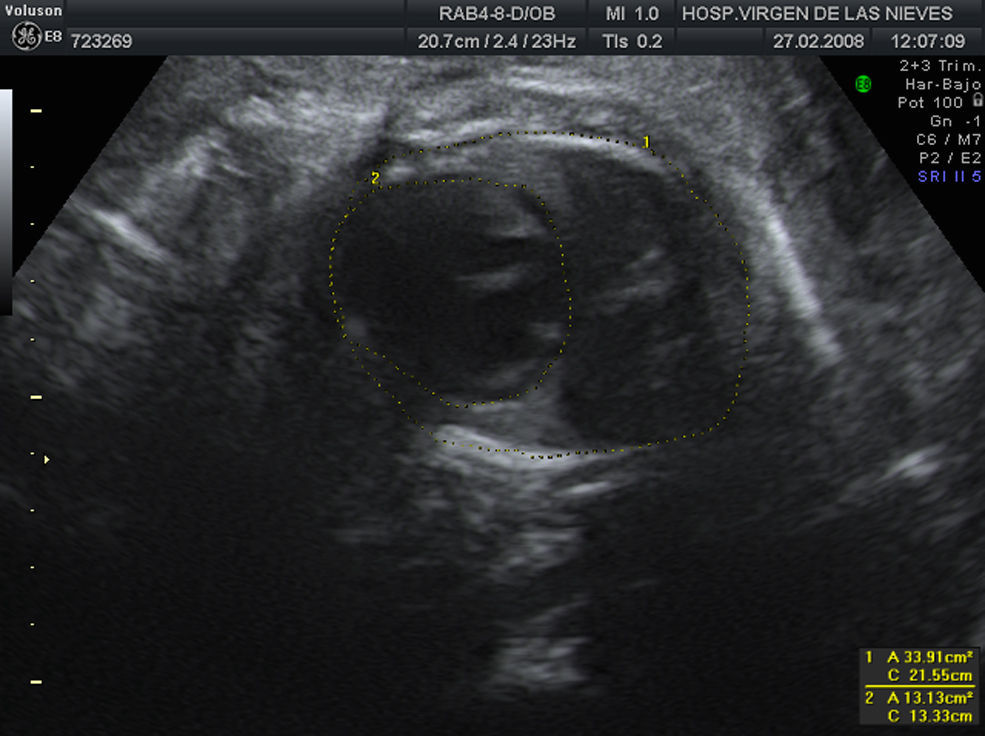
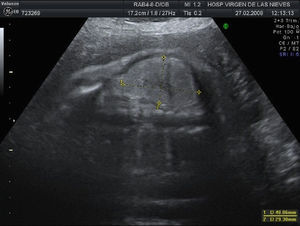
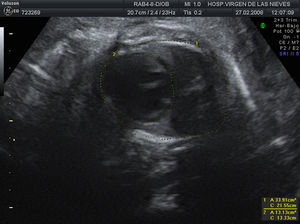
La siguiente revisión se realiza en 2 semanas. El crecimiento fetal y el estudio Doppler continúan siendo adecuados. No hay variación en el volumen de líquido amniótico, apreciándose anhidramnios. Los riñones continúan con un aspecto displásico y no se consigue visualizar la vejiga (fig. 1). Hay un tórax estrecho con signos de hipoplasia pulmonar medida mediante una lung-to-head ratio de 0,7 (fig. 2). Ante dichos hallazgos, se informa a la paciente de un daño renal probablemente irreversible y del riesgo de hipoplasia pulmonar.
En la semana de gestación 33 la paciente es ingresada por presentar dinámica y modificación cervical. Se inicia tratamiento tocolítico y se administra pauta de corticoides para maduración pulmonar. La paciente, informada de la evolución del proceso, solicita suspender medidas tocolíticas. Finalmente, se produce un parto espontáneo con un feto mujer de 2.520g, puntuación en test de Apgar de 5/8 y gasometría del cordón umbilical normal (pH en arteria: 7,23 y pH en vena: 7,28).
Al nacimiento, la recién nacida presenta esfuerzo respiratorio inicial débil y tono muscular aceptable. El examen pediátrico general no muestra alteraciones anatómicas destacables.
Es trasladada a la unidad de cuidados intensivos de neonatología, donde se continúa con ventilación mecánica iniciada en la sala de partos. Durante las primeras horas de ingreso desarrolla acidosis respiratoria severa, que no responde al tratamiento. Recibe dosis de surfactante. Se realiza radiografía de tórax que muestra patrón pulmonar patológico con áreas de condensación grosera e hipoventilación generalizada. Se encuentra en anuria desde su ingreso. A las 8h de vida, con fracaso respiratorio sin respuesta al tratamiento, se produce parada cardiorrespiratoria que conduce al exitus. La necropsia es ofertada a los padres que la deniegan.
DiscusiónEl SRA en general y la ARA-II en particular son necesarios para el desarrollo normal del riñón fetal. Se conoce que las alteraciones en el gen de la ARA ocasionan anomalías en la histología renal del feto, incluyendo una pérdida de la maduración glomerular y marcadas lesiones de la corteza renal2. El receptor AT1 está ampliamente expresado en el riñón fetal regulando de manera específica el desarrollo tisular, y la ARA-II y la renina tienen un importante papel en la angiogénesis. El SRA es, además, un importante regulador de la circulación umbilical y placentaria e igualmente de la presión sanguínea fetal3.
El valsartán bloquea la secreción de aldosterona y el efecto vasoconstrictor de la ARA-II mediante un bloqueo selectivo de la unión de la ARA-II al receptor AT1. Por tanto, la combinación del efecto isquémico sobre el riñón en desarrollo debido a la hipotensión fetal y a la disminución de la presión de perfusión glomerular y el efecto directo sobre la nefrogénesis y angiogénesis renal podrían explicar las consecuencias de la exposición intrauterina a fármacos como el valsartán4.
En la embriogénesis normal, el glomérulo primitivo aparece aproximadamente en la octava o novena semana de gestación, y la función tubular comienza después de la semana catorce, continuando la nefrogénesis hasta las semanas 34–36 de gestación. Por ello, el efecto teratogénico de medicamentos como el valsartán es debido a exposiciones prolongadas hasta períodos avanzados del embarazo.
En torno a la semana 20, la orina fetal constituye sobre el 90% del líquido amniótico. Ésta es probablemente la razón por la que el oligohidramnios no es observado con el tratamiento materno de ARA-II durante la primera mitad del embarazo5.
Por otro lado, para el normal desarrollo del pulmón fetal es fundamental un adecuado volumen de líquido amniótico, y la hipoplasia pulmonar puede ocurrir como resultado del oligohidramnios. Aunque su mecanismo no es del todo bien conocido, se ha propuesto que pudiera deberse a la compresión de la pared costal del feto con la consecuente reducción del espacio para el desarrollo pulmonar y la restricción de los movimientos respiratorios6.
Existen teorías de cómo el tratamiento con inhibidores de los receptores AT1 causan la hipoplasia ósea, siendo el oligohidramnios y la hipotensión fetal los que ocasionan una deficiente perfusión de los tejidos. Las membranas óseas del feto están altamente vascularizadas y requieren alta tensión de oxígeno7. El descenso de la presión sanguínea fetal causado por la reducción de la actividad del SRA puede ocasionar el bajo aporte de oxígeno a los tejidos, alterando la mineralización y la osificación de los huesos. En el caso descrito no se hallaron alteraciones ecográficas sugerentes de hipoplasia ósea.
La teratogenicidad de este grupo de medicamentos está demostrada, siendo el principal punto de discusión sobre el fármaco la potencial reversibilidad de sus efectos secundarios y, si ésta se produce, cuál sería la semana de gestación límite para el abandono del fármaco. Sobre dicha reversibilidad de los efectos tóxicos del fármaco se encuentran opiniones enfrentadas. Los casos publicados parecen indicar que con el abandono precoz, dentro del primer trimestre, los efectos teratogénicos son mínimos8, siendo el mantenimiento más allá del segundo trimestre lo que ocasiona secuelas irreversibles y potencialmente letales para el feto9. Este umbral crítico para el abandono del fármaco, el cual disminuiría notablemente los efectos secundarios, podría encontrarse entre las semanas 18–20 de gestación10.
Podemos concluir que, habiéndose demostrado la teratogenicidad del valsartán, el abandono de dicho fármaco debe ser inmediato al conocerse el estado de embarazo. En nuestro caso, donde el abandono se produjo en la semana 26, los efectos secundarios fueron irreversibles, induciendo así la muerte fetal.