INTRODUCCION
El acné noduloquístico crónico grave, o acné noduloquístico grave, es la forma grave del acné en la que los elementos noduloquísticos constituidos alrededor de los comedones foliculares se relacionan entre sí formando en el seno de la dermis «abundantes túneles», comparados a las madrigueras de los conejos, que se abren a la superficie cutánea por múltiples orificios, generalmente pigmentados1-3. Cuando se reabsorben dejan extensas cicatrices, con frecuencia de naturaleza queloidea. Afecta, el proceso, más a varones que a mujeres, y se localiza en mayor grado en el tronco que en la cara, que no suele estar muy afectada2-4. Se localiza, también, en espalda, hombros, glúteos y brazos.
La remisión espontánea se demora mucho tiempo. Este tipo de acné se observa, a veces, en casos raros, en el genotipo XYY (varones altos con retraso mental ligero y comportamiento agresivo) o en el síndrome de ovarios poliquísticos3.
No infrecuentemente, sobre todo en varones jóvenes de 13 a 17 años, evoluciona hacia la forma «acné fulminans», considerado éste como acné agudo febril ulcerativo con supuración concomitante (sustancia de tipo gelatinoso)2,3. Este cuadro de «acné fulminans» se acompaña de malestar, fatiga, fiebre, artralgias, leucocitosis y aumento de la velocidad de sedimentación globular3.
Las lesiones del acné noduloquístico grave son el resultado de la interacción compleja entre hormonas andrógenos y bacterias Propionibacterium acnes en las unidades pilosebáceas de los individuos con antecedentes genéticos apropiados3,5-7. Los andrógenos, cuya calidad y cantidad son normales, estimulan a que las glándulas sebáceas produzcan mayores cantidades de sebo, al tiempo que las bacterias que contienen lipasa transforman al lípido en ácidos grasos3,7.
El tratamiento específico es con isotretinoína, un retinoide sintético de excelente eficacia, en Dermatología, para la terapia de este proceso2,3,8-13.
La embriopatía malformativa por exposición a la isotretinoína fue descrita por vez primera en EE.UU. en 198314-18. Aportamos un caso de embriopatía malformativa grave consecutiva al uso de isotretinoína, por una paciente afectada de acné noduloquístico crónico grave.
CASO CLINICO
Mujer, estudiante de Filosofía y Letras, de 20 años de edad, en su primera gestación, sin antecedentes personales o familiares de interés, embarazo que cursó, al parecer, sin problemas, con normalidad, al haber sido controlada en otro Servicio.
En la semana 38+6 de amenorrea comienza con trabajo de parto, parto que tiene lugar por vía vaginal a las 4 h de su ingreso, y que transcurrió sin incidentes. Nace varón vivo de 295 g de peso, talla de 50 cm y Agar de 9 al min y 10 a los 5 min del nacimiento.
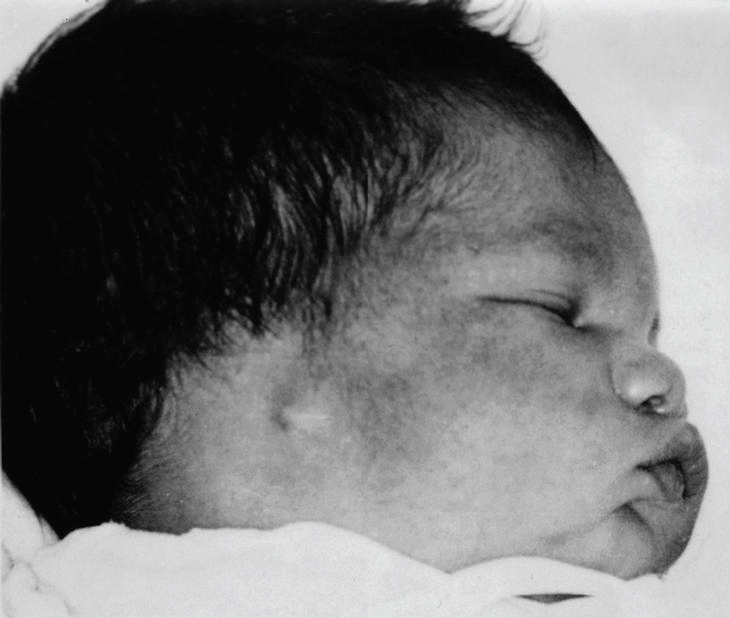
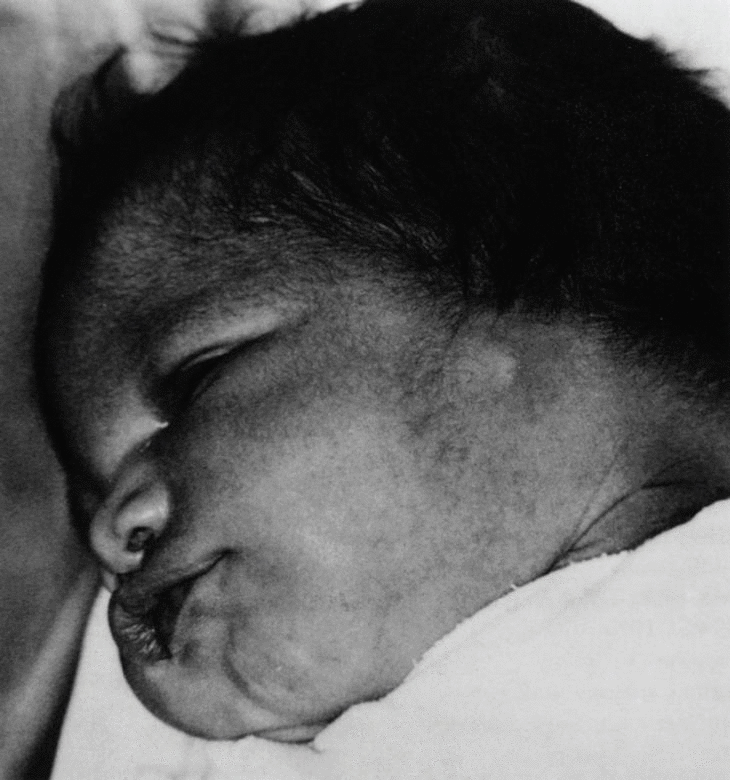
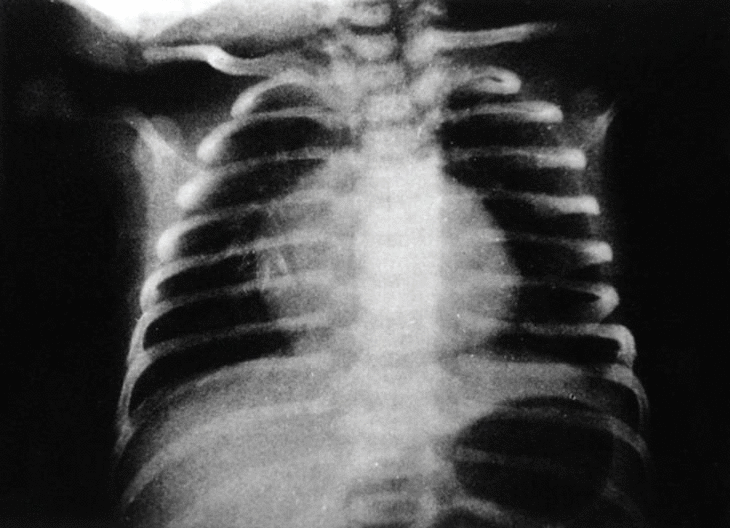
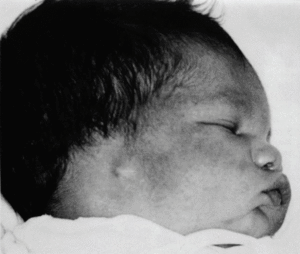
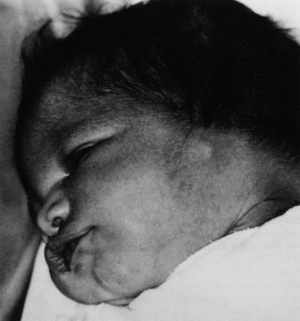
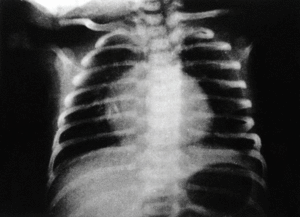
En el momento del nacimiento, se constata en el neonato una agensia bilateral del oído (pabellón y conducto auditivo externo) (figs. 1 y 2). El examen clínico del recién nacido pone de manifiesto, además, un soplo sistólico 3/6, un estado de hipotonía axial, una paresia facial periférica izquierda, una motilidad espontánea pobre y reflejos primarios mediocres (reflejo de Moro incompleto, reflejo de succión débil). No se observa ninguna otra malformación o anomalía craneofacial. En la radiografía anteroposterior de tórax se observa una silueta cardíaca globulosa, con un índice cardiotorácico normal y ausencia de opacidad tímica visible (fig. 3). La calcemia era normal.
Fig. 1. Perfil derecho.
Fig. 2. Perfil izquierdo.
Fig. 3. Radiografía anteroposterior de tórax al nacimiento.
Se verifica anamnesis a la madre, descubriéndose que ha estado sometida a tratamiento con isotretinoína, a la dosis de 30 mg/día, por un acné noduloquístico crónico grave. Dicho tratamiento se había iniciado un año y medio antes del parto, y había sido debidamente informada por el dermatólogo de los riesgos teratógenos graves ligados al uso de este medicamento, según consta en documento extendido por dicho facultativo. Debido a ello, la paciente asoció al tratamiento con isotretinoína un contraceptivo oral. No obstante, por causa que la paciente no explica, interrumpió el tratamiento hormonal contraceptivo a los 5 meses de iniciado, continuando la terapia con isotretinoína. En una revisión dermatológica, el facultativo la advierte, de nuevo, de los peligros teratógenos del producto, por lo que la paciente deja de tomar isotretinoína. Casualmente, investigando las fechas, la joven ya estaba embarazada, aproximadamente, 5-6 semanas de amenorrea.
Durante el control de su embarazo, según refiere en la anamnesis, no consultó ninguna vez con el dermatólogo, y no informó al médico de familia que le controló el embarazo, ni al obstetra que lo hizo en el momento del parto, de su proceso y tratamiento con isotretinoína.
El balance malformativo realizado en el neonato conllevó un examen tomodensitométrico del aparato auditivo en cortes milimétricos, que confirmaron la agenesia completa de los oídos que afectó a los pabellones y a los conductos auditivos externos, con displasia de la cadena de huesecillos derecha e integridad del oído medio izquierdo y del oído interno de ambos lados. La tomodensitometría cerebral era completamente normal. Se practicó ecografía cardíaca que reveló un ventrículo único con los grandes vasos bien ubicados, sin estenosis en la vía pulmonar, y un ductus arterial permeable. El examen oftalmológico, el electroencefalograma, las radiografías del esqueleto y la ecografía renal eran normales. Cariotipo normal: 46 XY. La calcemia, controlada con asiduidad en el curso de las primeras semanas, fue normal, así como la numeración y tipificación de las subpoblaciones linfocitarias T y B.
En resumen, el recién nacido presentaba la asociación de cardiopatía y malformaciones óticas, muy sugestiva y evocadora de una embriopatía por isotretinoína.
Debido a una marcada descompensación cardíaca, el niño fue remitido a un centro especializado donde se le practicó, en el día 17 de vida, una ligadura del canal arterial y un cerclaje de la arteria pulmonar. La revisión efectuada a los 3 meses no detectó la existencia de una eventual afectación encefálica, mediante exploración tomodensitométrica.
El handicap sensorial precisará una prótesis de conducción transósea, previa a las numerosas intervenciones correctoras sobre los pabellones auditivos y los conductos auditivos externos.
DISCUSION
Los retinoides naturales, vitamina A y sus derivados, son esenciales para el crecimiento celular en período de embriogenia e intervienen en los mecanismos de división y de diferenciación celular de los componentes epiteliales. La vitamina A es, pues, necesaria para el crecimiento, la reproducción y el mantenimiento de la vida19. El glucolípido retinolfosfatomanosa se encuentra en diversas membranas celulares, y la vitamina A desempeña un papel fundamental en la síntesis de las glucoproteínas. La importancia de estas últimas para todas las células implica que esta función de la vitamina es vital19. En todas sus funciones, se cree que la vitamina A actúa uniéndose a una proteína reguladora de la transcripción que controla la expresión de genes19.
Se conoce actualmente que la acción de diferenciación celular de la embriogenia es posible gracias a la unión de estos retinoides naturales con, al menos, una familia de receptores nucleares, que permiten una transcripción acumulativa de genes específicos del crecimiento celular17,20,21.
Además, estos retinoides inhiben el crecimiento de ciertas células cancerosas, y se utilizan en la prevención y el tratamiento de algunas leucemias. Los retinoides, los glucocorticoides y la hormona tiroidea inducen señales a través de la unión de una familia de receptores citoplasmáticos (superfamilia de receptores intracelulares o de receptores de hormonas esteroideas)22, que, en presencia del ligando, se desplazan al núcleo y se unen a secuencias específicas de ADN, denominadas elementos de respuesta, situadas dentro de las regiones promotoras o intensificadoras de la transcripción23. En algunos cánceres humanos se producen alteraciones en los receptores de hormonas esteroides. Por ejemplo, la translocación t en la leucemia promielocítica aguda genera un receptor * de ácido retinoico quimérico que tiene una distribución celular anormal y se asocia con una detención de la diferenciación de las células del tumor en la etapa promielocítica de desarrollo. Sin embargo, la administración de dosis farmacológicas de tretoinoíno (ácido todotransretinoico), un ligando para el receptor * de ácido retinoico, determina la localización nu clear normal del receptor e induce la diferenciación completa de las células del tumor23.
Los retinoides sintéticos, y en particular la isotretinoína, tienen una excelente eficacia, en Dermatología, para la terapia del acné noduloquístico crónico grave2,3,8-11,18, y, en Oncología, para el tratamiento de ciertos cánceres24,25. La isotretinoína, o ácido 13 cis retinoico, o ácido (2 Z, 4 E, 6 E, 8 E)-3,7-dimetil-9- (2, 6, 6-trimetil-1-ciclohexen-1-il)-2, 4, 6, 8 nonatetranoico, es un estereoisómero sintético del ácido todo transretinoico (tretinoíno), metabolito natural del retinol (vitamina A), presente normalmente en muy pequeñas cantidades en el organismo26. Su mecanismo de acción, administrado por vía oral, no se ha aclarado en su totalidad. No obstante, ha podido establecerse que la mejora en el cuadro clínico del acné noduloquístico grave se relaciona con la supresión, dependiente de la dosis, de la actividad de las glándulas sebáceas, y una reducción, histológicamente demostrada, del tamaño de dichas glándulas. Además, ha podido constatarse un efecto antiinflamatorio de la isotretinoína en la piel.
La indicación, teóricamente exclusiva, de la isotretinoína, está en el tratamiento de los acnés graves noduloquísticos y conglobata, rebeldes a los tratamientos clásicos2,3,9,10,12-14,25-28. Su eficacia en esta indicación sería del 70-90%, con una remisión prolongada al cesar el tratamiento2,25,28.
La concentración plasmática de isotretinoína puede predecirse en base a una farmacocinética lineal, en función del tiempo28-30. La isotretinoína se absorbe en el tracto gastrointestinal. Hacia las 3 h siguientes a la ingestión de una dosis consistente en dos tomas de 40 mg del producto, se obtienen las concentraciones plasmáticas máximas de 200-300 ng/ml. La constante de semieliminación terminal oscila entre 10 y 20 h. Con posologías a base de dos tomas diarias de 40 mg, las concentraciones propias del estado de equilibrio vienen a situarse en los 160 ng/ml, por promedio. El consumo de alimentos ricos en lípidos aumenta su biodisponibilidad. El principal metabolito de biotransformación en sangre es la 4-oxo-isotretinoína, cuya constante de semieliminación terminal es de 24 a 29 h. Tanto el fármaco inalterado como su principal metabolito se eliminan en forma conjugada, principalmente por la bilis. Otro metabolito, la tretinoína, ha sido detectada en sangre, en el hígado, en el riñón, corazón, cerebro y en la placenta de mujeres gestantes que habían tomado isotretinoína. La unión a proteínas de la isotretinoína es superior al 99%.
Se comienza con una dosis diaria de 0,5 mg/kg de peso. Cabe esperar que el acné se agrave transitoriamente al inicio del tratamiento. Tras 4 semanas deberá ajustarse la dosis de mantenimiento a las necesidades del paciente, fijándose entre 0,1 y 1,0 mg/1 kg de peso/día. El tratamiento dura, en general, 16 semanas. Armijo y Camacho2 recomiendan la siguiente pauta: dos semanas a 2 mg/kg/día y 14 semanas de 0,5 mg/kg/día (total = 16 semanas). Swerlick y Lawley31 señalan una dosis de 0,5 a 20 mg/kg/día, en una sola administración, durante 15 a 20 semanas.
Al evaluar los resultados de la terapia, deberá tenerse en cuenta con qué frecuencia continúa después de la interrupción del tratamiento. Por tanto, antes de reemprender éste, se dejará un intervalo de, al menos, 8 semanas.
Se deben cuantificar los lípidos sanguíneos antes del tratamiento3,31. En alrededor del 25% de los pacientes sometidos a terapia se incrementan significativamente los triglicéridos plasmáticos3,9,10,12. Se observa, también en el 15% de los pacientes, un aumento de las lipoproteínas de alta densidad y cerca del 7% manifiestan un aumento en las concentraciones de colesterol, lo que puede tener repercusiones sobre el riesgo cardíaco3. Los pacientes no deben tomar complejos vitamínicos que contengan vitamina A. Se han informado raros casos de hepatotoxicidad en forma de hepatitis clínica. Debe advertirse al paciente que se han informado casos de ceguera nocturna. También es posible que disminuya la tolerancia a las lentes de contacto durante y después del tratamiento. En la piel puede aparecer un exantema similar al eccema. Está contraindicado su uso simultáneo con tetraciclinas, por el peligro de aumento de la presión intracraneal. No tiene interacciones con los anticonceptivos orales.
Teratogenicidad: descripción de la embriopatía por isotretinoína
Sin embargo, estos análogos de síntesis de la vitamina A son teratógenos2,3,9-12,18,27,28,30-33.
El efecto teratógeno de estos productos es bien conocido en experimentación animal34-41, en los que se asocian de manera constante a malformaciones auriculares, así como a malformaciones de la cara y, a veces, anomalías cardíacas y cerebrales. En la rana Xenopus, el ácido retinoico se ha identificado como un morfógeno, una molécula de señalamiento endógeno que especifica el eje anteroposterior durante el desarrollo de las extremidades, y puede que también especifique el eje anteroposterior del sistema nervioso central40. En el ratón, su acción es similar a la de los productos del gen homeobox en cuanto que puede actuar como un morfógeno potencial en el primordio de los miembros41.
Antes de ocuparnos de la teragenicidad específica de la isotretinoína, señalemos que el etretionato, derivado sintético de la vitamina A, utilizado para tratar la soriasis grave, fármaco que tiene una vida media extremadamente larga permaneciendo en los tejidos adiposos durante varios meses y presumiblemente durante años, asociado al embarazo produce un significativo incremento del riesgo de malformaciones, incluyendo defectos del tubo neural, dismorfismo craneofacial y anomalías en el esqueleto. El tiempo durante el cual debe evitarse el embarazo tras un tratamiento discontinuo con etretionato, sigue siendo desconocido, debido a la variable excreción. Por esta razón, este fármaco está contraindicado en las mujeres embarazadas y en aquellas que pueden estarlo18,24.
Por su parte la tretinoína, s& oacute;lo utilizada de forma tópica en el acné agudo, no se asocia a malformaciones congénitas, debido presumiblemente a su bajo nivel de absorción18,42.
La embriopatía por isotretinoína comporta principalmente malformaciones del sistema nervioso central (hidro y microcefalia, malformación cerebelosa), del corazón (cardiopatías congénitas con predominio marcado de las lesiones de clase I)14,43-46 (tabla I) y del área craneofacial. Éstas afectan al oído externo (micropina, ausencia o disminución del conducto auditivo externo), fisura palatina, microftalmia, dismorfia facial (hipoplasia mandibular micrognatia), paladar hendido, anomalías del timo, deficiencia de paratohormona, etc.27,28,30,34-39,46,47. Estas malformaciones, se detallan junto a otras menos frecuentes, en la tabla II14,25-28,36,48-55.
Además, la isotretinoína puede inducir anomalías del comportamiento en ausencia de toda alteración malformativa. En niños de 5 años expuestos a isotretinoína durante el primer trimestre de vida intrauterina, e indemnes de toda malformación, se han encontrado hasta un 40% de déficit intelectuales26,28. El aspecto normal de la tomodensitometría encefálica posnatal no permite eliminar una afectación del sistema nervioso central. En cuanto a la ausencia de timo radiológicamente visible, ésta puede sugerir una afectación tímica sin consecuencia funcional detectable28.
Existe también un elevado riesgo, de hasta el 33%, de aborto espontáneo14,27,30,46. La mortalidad posnatal ligada a esta embriopatía es del 57%, esencialmente en razón de las alteraciones cerebrales y cardíacas14,28,30,46. El metabolito 4-oxo-isotretinoína parece ser más teratógeno que la isotretinoína28.
Para algunos este efecto teratógeno de la isotreti noína es dependiente de la dosis56, aunque según otros14,26,27 no se ha podido establecer ninguna relación entre la duración de la exposición a la isotreti noína o la dosis ingerida y el riesgo malformativo, y otros, como Ayme et al57 y Guzzo et al58 destacan que la exposición a dosis teratógeno de la isotretinoína parece, pues, independiente de la dosis58, por lo que es preciso considerar que toda exposición a ésta durante el primer trimestre del embarazo, cualquiera que sea la dosis y la duración, puede ser asociada a la aparición de malformaciones congénitas27,30,57-59. El riesgo malformativo varía, según los autores, del 23 al 45%26,27,60. Se ha evaluado la sensibilidad y la especificidad de las principales malformaciones que constituyen la embriopatía por isotretinoína61. La sensibilidad (proporción de niños expuestos que presentan la anomalía demostrada) varía del 20 al 70%, según sean las malformaciones aisladas o asociadas. La especificidad (proporción de niños malformados, sin haber estado expuestos, y sin presentar la anomalía relacionada) sería del 99 al 100%27,61.
El efecto teratógeno de la isotretinoína parece ser, incluso, más importante en los seres humanos que en los animales28,35. Igualmente, pueden observarse malformaciones congénitas que afectan al sistema inmunitario después de la exposición a la isotretinoína, puesto que, como se ha observado, se han descrito hipoplasias tímicas tanto en animales28,34-39,47 como en el hombre27,28,47,49.
No existe período crítico de exposición a la isotretinoína; el de las anomalías conotroncales es diferente del de las alteraciones cerebelosas, y la hidrocefalia parece poder aparecer cualquiera que sea el momento de la exposición14,26,28. En razón de la lenta eliminación de la isotretinoína y de su metabolito 4-oxo-isotretinoína, existe un riesgo manifiesto de afectación embrionaria malformativa en caso de gestación que sobreviene durante 1-2 meses después de abandonar el tratamiento2,3,27,28,30,33,62.
Embriogenia e isotretinoína
Dos posibles mecanismos pueden explicar la teratogenecidad de la isotretinoína28,30,56:
1. Por una parte, los derivados de la vitamina A serían responsables de una exageración del proceso de muerte celular durante la vida embrionaria, por aumento de la actividad enzimática lisosomial de las células.
2. Por otra parte, la vitamina A y sus derivados serían responsables de una disminución de la movilidad de las células mesenquimatosas, lo que conlleva una anomalía del tejido mesodérmico.
Las malformaciones descritas en la embriopatía por isotretinoína afecta o concierne a las estructuras que embriológicamente derivan de las crestas neurales del cerebro posterior o romboencéfalo14,25,27. La estructura metamérica de la placa ectodérmica, de la cual provienen las crestas neurales romboencefálicas, es actualmente conocida con el nombre de rombómeros. Éstos son igualmente las crestas neurales del rom boencéfalo que proporcionan los cuatro arcos branquiales. Existe una verdadera fragmentación de la región cervicofacial embrionaria en 4 metameras, constituida cada una por 2 rombómeros consecutivos, de un nervio branquial y del arco branquial correspondiente.
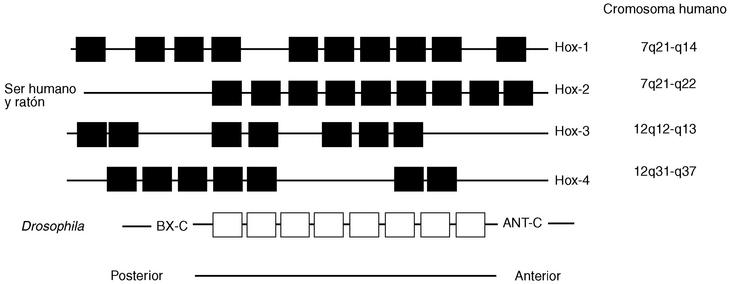
Es interesante observar que la embriopatía por isotretinoína, plural en malformaciones, constituyen una serie de síndromes en los que las manifestaciones clínicas ponen de manifiesto una anomalía del desarrollo de uno o varios niveles romboméricos. Así, las malformaciones tímicas o cardíacas recuerdan el síndrome de Di George (síndrome del 3.er y 4.o arcos branquiales, por insuficiencia de los rombómeros 6, 7 y 8)46,63,64; las malformaciones del oído externo recuerdan los síndromes del primer arco branquial27. La organización segmentaria de la región cervicofacial embrionaria y de los arcos branquiales está probablemente bajo la dependencia de los genes de desarrollo, los genes Hox65.
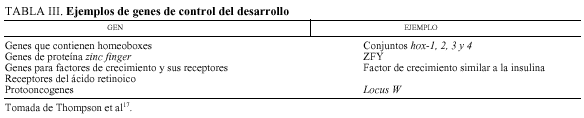
La búsqueda de los genes que controlan la embriogenia de los mamíferos utiliza varios procedimientos. En la estrategia más frecuente, los supuestos genes de desarrollo se buscan sobre la base de homologías con genes que se sabe que regulan el desarrollo en Drosophila, ratones u otros organismos experimentales17 (tabla III). Describiremos sólo, por interés en el tema, los genes homeobox, denominados así porque las mutaciones homeóticas en Drosophila, que cambian la identidad de segmentos corporales, se producen en genes que comparten una secuencia característica, el homeobox17.
Todos los genes homeobox contienen una región (el homeobox) que codifica un dominio de enlace de DNA de 60 aminoácidos. Las proteínas que contienen homeobox regulan la acción genética durante el desarrollo, o bien actúan como factores de transcripción específicos de tejido. Los genes homeobox se reconocieron por primera vez en los lugares de mutaciones en mutantes de desarrollo de Drosophila. La mutación de Drosophila, Antennapedia, que permite el desarrollo de una segunda pata, en lugar de una antena, es el prototipo de las mutaciones homeóticas17.
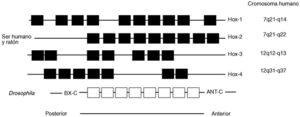
La mayor parte de los genes homeobox conocidos de ratón y seres humanos se organizan en cuatro conjuntos génicos en cromosomas diferentes, cada uno compuesto de una serie de genes ligados17,41,66,67 (fig. 4). Se supone que han evolucionado, como los genes de la globina, por duplicación y divergencia genética repetida. Como se observa, este ordenamiento de genes resulta muy similar a la secuencia de genes ligados que se encuentra en Drosophila, lo cual favorece la impresión de que los genes homeobox en los seres humanos, como sus correspondientes en la mosca de la fruta, son fundamentales para el desarrollo normal17.
Muchos genes homeobox comienzan a transcribirse en la gastrulación temprana y continúan expresándose durante la mitad de la gestación en tejidos segmentados. La mayor parte se expresan en el sistema nervioso central; muchos lo hacen también en somitas y sus derivados, y algunos se expresan en los primordios de los miembros y otras partes. Al menos en el conjunto Hox-2 (fig. 4) y posiblemente en otros, el área de expresión de cada gen homeobox se correlaciona con su localización cromosómica, y cada gen sucesivo se expresa en una zona con una localización más cercana al extremo anterior del embrión en desarrollo17,41,66,67.
Como decimos, la organización segmentaria de la región cervicofacial embrionaria y de los arcos branquiales está, con toda probabilidad, bajo la dependencia de los genes de desarrollo o genes Hox17,41,65-67 (fig. 4). Esta familia de genes ha sido identificada en numerosas especies animales, incluyendo los mamíferos. Las pruebas directas de la participación de los genes Hox en la organogenia y en la segmentación de romboencéfalo han sido suministradas por la inactivación experimental de ciertos genes Hox en la ratona: ciertas delecciones inducidas en genes (Hox-1-5) (fig. 4) en una prole de embriones de ratona produjeron un fenotipo próximo al síndrome de Di George. Incluso, la inactivación del gen Hox-1-6 provoca alteraciones en los derivados de las crestas neurales posteriores correspondientes a los rombómeros 6, 7 y 8 (parte posterior del cráneo, oído interno, medio y externo, alteraciones del 7.° al 10.° par craneal17,27.
La transcripción de los genes Hox está en sí misma sometida a una regulación (inducción-represión) reemplazada por el ácido retinoico. La transcripción de ciertos genes Hox está inducida por el ácido retinoico. La de otros genes Hox, de expresión más caudal sobre el romboencéfalo, puede por el contrario ser reprimida por esta misma sustancia. Una hipótesis sugestiva sería explicar el mecanismo de la embriopatía por isotretinoína por una interacción entre el ácido retinoico y los genes Hox, con la consecuencia de un fallo del desarrollo de una o varias unidades segmentarias consecutivas del romboencéfalo17,27,65..
In vivo, la inyección de vitamina A en el líquido amniótico, en el caso de las ratas, compromete la fusión normal del velo del paladar, participando así en la formación de fisura palatina68. La disminución del mesénquima después de la embriogenia puede explicar las hipoplasias de los miembros y las numerosas fisuras palatinas observadas tras la exposición, al comienzo de la gestación, a la isotretinoína69.
Como señalamos, la isotretinoína tiene una semivida plasmática de 10-20 h. Tanto la isotretinoína, como sus dos metabolitos principales, 4-oxo-isotretinoína y tretinoína, atraviesan la barrera placentaria de forma importante, como han puesto de manifiesto las dosificaciones efectuadas en extractos placentarios27,28,30,47,70. Estas dosificaciones son proporcionales o paralelas a las concentraciones sanguíneas de la madre. Algunos autores28,30,47 comentan que la ausencia de isotretinoína en el hígado fetal, o en otros órganos estudiados, sugiere que en el feto existe un metabolismo incrementado de isotretinoína y, subsiguientemente, una acumulación de sus metabolitos. Además, la ausencia de isotretinoína en el tejido cerebral fetal hace suponer que esta sustancia no atraviesa la barrera hematomeníngea, pero, por el contrario, los metabolitos sí son detectados en el cerebro28,30,47.
Un caso anterior presentado por nosotros3, de embriopatía por isotretinoína, era portador de una espina bífida con mielomeningocele, malformación descrita también por otros autores28,30,71-76, y parece que la apertura del tubo neural, aunque posible, no constituye una de las complicaciones habituales o clásicas a la exposición fetal a los retinoides14,28,35,47,48,51-56,76.
Prevención de la embriopatía por isotretinoína
Es, pues, la teratogenicidad el efecto adverso más grave e importante de la isotretinoína2,3,11,27,28,30-39,51-58,76. Dicho efecto teratogénico se manifiesta no sólo si el tratamiento coincide con un embarazo, sino incluso si éste surge varios meses después de haberse suspendido. El embarazo, es preciso subrayarlo, es una contraindicación absoluta para el uso de la isotretinoína. Ninguna mujer en edad de procrear debe ser sometida a un tratamiento con este fármaco sin antes tomar las debidas medidas contraceptivas. Las mujeres con potencial de procreación deben iniciar su tratamiento al inicio de un período menstrual normal, después de dar consentimiento informado, y de la obtención de una prueba de embarazo con resultados negativos, además de utilizar un método contraceptivo eficaz. Las pruebas de embarazo deben repetirse con periodicidad, recomendándose que sean mensuales. Algunos autores58 extreman sus recomendaciones hasta el punto de sugerir la práctica simultánea de dos formas de contracepción durante el tratamiento. Como quiera que un elevado número de pacientes con acné noduloquístico crónico grave, hasta el 40%, presentará una recaída2,3,13,27,77,78, es preciso extremar las precauciones y cuidados en los períodos de descanso, potencial e igualmente peligrosos, y repetir las mismas medidas cuando el tratamiento se reanude.
Fig. 4. Esquema de los conjuntos de gen homeobox en Drosophila y los genomas del ratón y ser humano. Los genomas de ratón y ser humano contienen estos cuatro conjuntos de genes homeobox. En Drosophila y mamíferos (al menos Hox-2-murina), existe una colinealidad estricta entre el origen génico en el cromosoma y la secuencia en la que los genes se expresan. Los genes en el extremo 5' (izquierda) del conjunto se expresan en la parte posterior del sistema nervioso y los del extremo 3' se expresan anteriormente. La organización molecular de los genes homeobox aún no está caracterizada por completo, y la nomenclatura está sujeta a cambio. (Thompson et al13, Kessel y Grus41, Grahma et al 66, McKusick67).
Autores franceses25-28,50 comentan, en sus respectivos informes, sobre las estrictas medidas que se utilizan para la prescripción de la isotretinoína. En EE.UU., la prevalencia relativamente débil del acné noduloquístico grave en la mujer contrasta con el número elevado de prescripciones de isotretinoína, lo que sugiere un respeto muy relativo a las indicaciones teóricas del fármaco26,27,48. La Federación de Dermatólogos Americanos ha constatado que más de dos tercios de las mujeres tomando isotretinoína durante el embarazo estaban ya gestantes en el momento del inicio del tratamiento, es decir, sin ninguna medida contraceptiva, y que, del tercio restante, un 50% utilizaba un método contraceptivo poco fiable14,16.
Es preciso, pues, insistir. Toda mujer en edad de procrear que precise isotretinoína, su uso debe ir precedido de una información precisa, clara y rigurosa sobre el poder teratógeno del medicamento, de un test de embarazo negativo, y, una vez iniciado el tratamiento, se deb e acompañar de una contracepción rigurosa y fiable, incluso en caso de antecedente de esterilidad, contracepción que debe iniciarse un mes antes del tratamiento y continuar, al menos, 2 meses, o incluso más, después de la supresión de éste. La firma de un consentimiento informado, por ejemplo, se exige en EE.UU. y Canadá16,25-27 y, como hemos señalado, la práctica de un test de embarazo mensual durante el tratamiento ha sido preconizado por el mismo laboratorio fabricante14,16,25,27. Por último, es importante señalar que el 30% de las mujeres que toman isotretinoína y están en edad de procrear tienen entre 13 y 19 años16,25,27,29: ¿se benefician todas ellas de una correcta y adecuada contracepción?
CONCLUSION
A pesar de todas estas medidas y precauciones, como vemos, las embriopatías por isotretinoína continúan observándose y publicándose, y la verdadera importancia del problema aún no es bien conocida. En efecto, si la incidencia de abortos espontáneos después de la exposición al fármaco se estima en un 20-30%, se ignora, por otra parte, el número de interrupciones voluntarias de embarazo motivadas por la exposición a este medicamento25,27,28,48,61. El diagnóstico prenatal de la embriopatía no es siempre posible (ceguera, sordera, afectación tímica, retraso mental, etc.). El diagnóstico prenatal, ciertamente, puede poner de manifiesto las anomalías cardíacas o encefálicas, pero, en opinión de algunos, no se puede considerar la interrupción del embarazo como una solución anodina y satisfactoria27,28.
La dosificación de las concentraciones plasmáticas en la mujer de isotretinoína y sus metabolitos, por el método de cromatografía líquida de alta sensibilidad29,80, parece extremadamente útil antes de autorizar un embarazo en una mujer con terapia previa con retinoides30.