INTRODUCCION
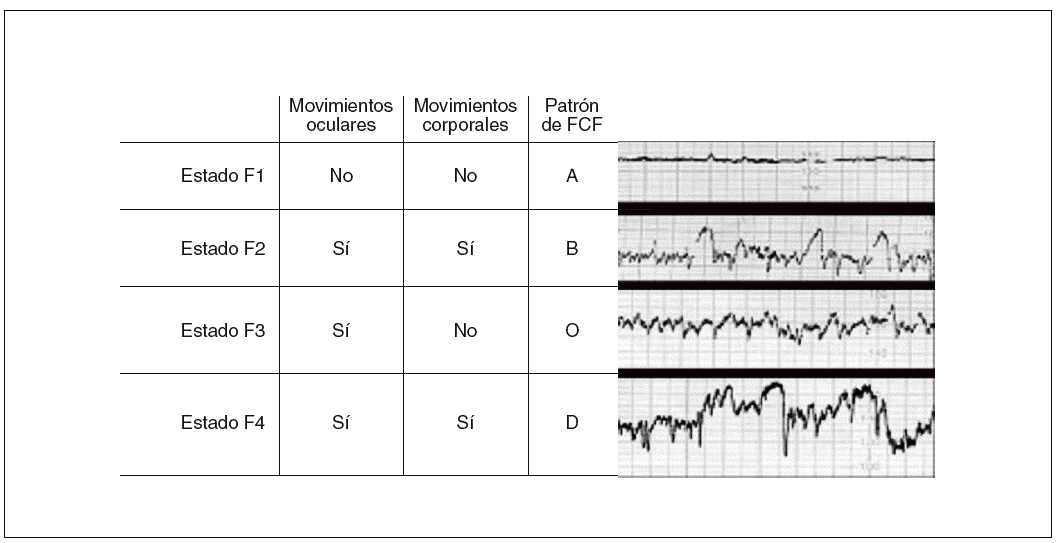
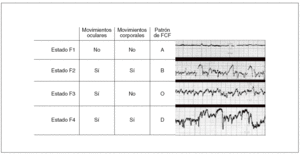
Las primeras referencias a la existencia de diferentes estados de comportamiento en la exploración neurológica del recién nacido (RN) fueron realizadas por Prechtl y Beintema1 en 1964 y su clasificación en 5 estados diferentes ha alcanzado una gran aceptación. Pero las variables que permitían describir estos diferentes estados en el RN no fueron fáciles de evaluar en el feto humano, dada la evidente dificultad para colocar electrodos en el córtex o en los ojos fetales. En 1982 Nijhuis et al2 definieron la existencia de 4 estados de comportamiento fetal, F1, F2, F3 y F4, análogos a 4 de los 5 revisados y descritos por Prechtl3 en neonatos, en 1974 (fig. 1).
Fig. 1. Descripción de los parámetros caracterizadores de los estados de comportamiento fetal.
Estado F1: sueño profundo; estado F2: sueño activo; estado F3: vigilia inactiva; estado F4: vigilia activa. FCF: frecuencia cardíaca fetal.
En el RN existe un estado 5 asociado al llanto, pero no hay evidencias sustanciales de que exista intraútero un estado similar de disforia o llanto. Por definición, un determinado estado está presente si se produce alguna de las combinaciones específicas de los parámetros que lo definen, si esta combinación permanece estable en el tiempo (al menos 3 min) y si las transiciones entre los diferentes estados ocurren en un tiempo inferior a 3 min. Los estados de comportamiento se establecen como tales en el feto humano entre las 36 y 38 semanas de gestación4,5. Antes de las 36 semanas de gestación hay una alternancia cíclica de las diferentes variables, pero estas combinaciones no son estables, y no pueden detectarse transiciones sincronizadas de un estado a otro. Estas combinaciones específicas se denominan «períodos de coincidencia», y no estados6,7.
La capacidad de un feto, o de un recién nacido, para presentar estados de comportamiento estables se relaciona con el grado de maduración y coordinación de su sistema nervioso.
Se ha señalado la posibilidad de que los hijos de madres diabéticas sufran alteraciones en el desarrollo y la maduración neurológicos, tanto durante el período neonatal como en etapas más avanzadas de la vida8.
Este trabajo tiene como principal objetivo comprobar si mediante el estudio de los estados de comportamiento fetal es posible detectar la existencia de variaciones neuroconductuales en los hijos de madres diabéticas durante la vida intrauterina, diferenciando dos grados de afección materna, la diabetes tipo 1 y la diabetes gestacional.
MATERIAL Y MÉTODO
Población
Se estudió una muestra constituida inicialmente por 60 gestantes, asistidas en la policlínica del Hospital Universitario de Canarias. En todos los casos se obtuvo el consentimiento de las pacientes para participar en el estudio, tras ser oportunamente informadas de sus protocolos y objetivos. La muestra se dividió en: grupo 1, control: gestantes que consultaban inmediatamente después de la inclusión de una paciente con diabetes tipo 1 en el grupo problema y que cumplían los criterios de selección (n = 20); grupo 2, gestantes con diabetes pregestacional tipo 1 (n = 20) y grupo 3: constituido por 20 gestantes con diabetes gestacional.
Fueron criterios de selección: gestación única, edad gestacional establecida mediante ecografía temprana y ausencia de hábitos tóxicos o de otra enfermedad asociada distinta de la diabetes. El grupo control se constituyó con gestantes con un embarazo fisiológico que cumpliesen estas condiciones.
Fue necesario excluir a 2 gestantes del grupo control considerado inicialmente porque la posición de la cabeza hizo imposible objetivar los movimientos oculares; este grupo quedó finalmente constituido por 18 pacientes. De las 20 gestantes con diabetes tipo 1, se excluyó a 6 por no cumplir los criterios establecidos: un embarazo gemelar, un caso con edad gestacional incierta, 3 casos de hipertensión previa o inducida por la gestación, 2 gestantes con hábitos tóxicos y un caso en el que no fue posible realizar una adecuada observación de los movimientos oculares. Finalmente, este grupo quedó constituido por 14 gestantes con diabetes tipo 1.
Fue necesario excluir a 5 gestantes del grupo 3, una de ellas porque el grosor del panículo adiposo abdominal dificultaba la visualización de los cristalinos fetales, 3 pacientes por la coexistencia de patología médica y un caso en el que la posición de la cabeza fetal no permitió realizar un seguimiento correcto de los movimientos oculares; este grupo quedó finalmente constituido por 15 pacientes con diabetes gestacional.
Únicamente 2 de las 14 gestantes con diabetes tipo 1 habían realizado consulta preconcepcional. El tiempo medio de evolución de la diabetes fue de 9 ± 8,41 años (1-23 años). En todos los casos se utilizaron terapias de insulina intensificadas con dosificaciones múltiples y autocontrol según los perfiles glucémicos obtenidos. Los valores medios de la hemoglobina glucosilada en el primer trimestre fueron 5,93 ± 1,01%; en el segundo trimestre, 5,48 ± 0,98%, y en el tercer trimestre, 5,38 ± 0,96%.
La diabetes gestacional se diagnosticó siguiendo los criterios recomendados en el Documento de Consenso de Diabetes y Embarazo de la Sociedad Española de Ginecología y Obstetricia y en la Guía Asistencial del Grupo Español para el Estudio de la Diabetes en el Embarazo9,10. Cinco de las 15 gestantes incluidas finalmente en este grupo requirieron insulinoterapia, y 10 fueron controladas con dieta y ejercicio. En 4 casos la diabetes gestacional se diagnosticó antes de las 24 semanas. Los niveles medios de hemoglobina glucosilada en el tercer trimestre fueron de 4,6 ± 0,71% en este grupo.
En el grupo control la edad media fue de 28,28 ± 5,62 años; en el grupo de gestantes con diabetes tipo 1, 29,00 ± 5,20 años, y el grupo de pacientes con diabetes gestacional, 31,87 ± 4,90 años. Las diferencias existentes no alcanzaron significación estadística.
El 61,11% de las gestantes del grupo control eran nulíparas y en el grupo 2, gestantes con diabetes tipo 1, lo eran el 71,42%, mientras que en el grupo de pacientes con diabetes gestacional, grupo 3, únicamente el 33,33% eran nulíparas, diferencias que no fueron significativas.
La edad gestacional en el momento del parto resultó estadísticamente diferente en la muestra estudiada (p < 0,007); fue menor en el grupo de gestantes con diabetes tipo 1 que en el control, 38,71 ± 1,38 frente a 40,22 ± 1,40 semanas. En el grupo de gestantes con diabetes gestacional la duración del embarazo fue de 39,53 ± 0,99 semanas. Este hecho está en relación con las características de la afección estudiada. Así se explica también la mayor incidencia de cesáreas, del 57,9%, registrada en el grupo 2, gestantes con diabetes tipo 1. En el grupo control la tasa de cesáreas fue del 26,3% y en el grupo 3, gestantes con diabetes gestacional, del 15,8% (p < 0,023).
El peso de los recién nacidos fue superior en el grupo de madres con diabetes tipo 1 (3.893,93 ± 505,06 g), aun cuando en este grupo la edad gesta cional en el parto fue inferior a la de los grupos 1 y 3, en que los pesos de los neonatos fueron, respecti vamente, 3.573,50 ± 436,13 y 3.499,00 ± 368,69 g (p < 0,35).
No existen diferencias significativas entre los 3 grupos estudiados en cuanto al valor de la prueba de Apgar al minuto o a los 5 min de vida.
Se demostró la existencia de diferencias significativas entre los grupos al considerar el valor del pH en la arteria umbilical, y el análisis a posteriori de los datos obtenidos muestra que estas diferencias tienen significado matemático, tanto cuando se compara el grupo con diabetes tipo 1 (pH 7,19) con el grupo con diabetes gestacional (pH 7,32) (p < 0,048), como cuando éstos se relacionan con el pH medio obtenido en el grupo control (pH 7,28), p < 0,035 y p < 0,045, respectivamente.
Metodología para el estudio de los estados de comportamiento
El estudio se realizó de forma transversal en el tiempo, dadas las condiciones asociadas a la afección estudiada, que en algunos casos condicionó la terminación electiva del embarazo, los requerimientos necesarios para que un estudio pudiera llevarse a cabo (posibilidad de visualizar los cristalinos de forma continua y prolongada) y la premisa de que lo llevase a cabo siempre el mismo observador. La edad gestacional mínima para el inicio se fijó en 36-37 semanas, realizándose cortes posteriores a las 38 y 39 semanas. El número de fetos valorados en cada uno de los pe ríodos diferenciados y en cada uno de los grupos de estudio se recoge en la figura 2.
Fig. 2. Número de estudios de estados de comportamiento realizados en cada grupo y edad gestacional a que se llevaron a cabo.
Todos los estudios fueron realizados entre las 9 y las 13 horas; el intervalo desde la última ingesta materna osciló entre 30 y 60 min. Las observaciones fueron practicadas en una habitación insonorizada, en un ambiente tranquilo, de forma ininterrumpida; la observación se prolongó durante un período útil de 60 min, y siempre fue realizada por el mismo investigador, que ignoraba a qué grupo pertenecía la gestante.
Se realizó la monitorización cardiotocográfica de la frecuencia cardíaca fetal (FCF) y de la actividad somática fetal, registrada simultáneamente de forma automática en el canal específico para actografía de un cardiotocógrafo Hewlett-Packard 50-A. Mediante ecografía se localizaron las órbitas oculares fetales para seguir los movimientos de uno o ambos cristalinos. Estos movimientos se señalizaron mediante un pulsador de eventos de forma sincronizada con las anteriores señales en el registro cardiotocográfico. En el canal de dinámica uterina se señalaron, además, los movimientos corporales fetales detectados ecográficamente. Las imágenes ecográficas obtenidas se registraron en soporte magnético, por si fuera necesaria una posterior reevaluación de éstas al cuantificar el tiempo consumido por los fetos en cada uno de los estados de comportamiento. Posteriormente, todos los registros fueron valorados por un mismo observador sin que se identificase el grupo de estudio al que pertenecía cada registro.
Los estados de comportamiento fetal se establecieron siguiendo los criterios de Nijhuis2, cuantificando el tiempo consumido por el feto en F1, F2, F3 y F4. Se denominó F5 a los períodos de incoordinación en los que las variables caracterizadoras de los estados no permitían establecer ningún estado concreto, estado de transición o incoordinación.
Parámetros analizados
Se realizó un estudio comparativo de los siguientes parámetros: tiempo durante el cual el feto mostró un patrón de FCF tipo A, B C o D de Nijhuis2, períodos de actividad ocular, tiempo consumido en cada uno de los diferentes estados de comportamiento, coincidencia o incoordinación. El valor de estos períodos, expresado en minutos, se obtuvo de la suma total de los diferentes intervalos en los que el feto mostró un determinado patrón de actividad a lo largo de los 60 min de cada observación. Se valoró también la capacidad del feto para establecer estados de comportamiento estables y la estabilidad de los estados de comportamiento, o número de cambios de estado, en cada estudio.
Estudio estadístico
Los resultados obtenidos se recogieron en una base de datos confeccionada con el programa Excel, y se analizaron con un programa de SPSS. Las pruebas utilizadas fueron: ANOVA de uno o más factores y comparaciones múltiples para la descripción de los parámetros caracterizadores de la muestra; análisis de la varianza para la evaluación de la existencia de diferencias entre los grupos al analizar las variables cuantitativas, y para el análisis a posteriori, en los casos en los que se detectaron diferencias, las pruebas de Tukey y de Newman-Keuls. Las variables cualitativas se estudiaron mediante la prueba de la *2. Se ha considerado como límite de significación estadística la obtención de un valor de p < 0,05.
RESULTADOS
Al considerar aisladamente el tiempo consumido por los fetos en mantener un patrón de FCF caracterizador de estado, A, B, C o D, observamos que la duración de éstos no ha diferido significativamente entre los 3 grupos estudiados. Hemos obtenido resultados similares al valorar la duración de los períodos de actividad ocular.
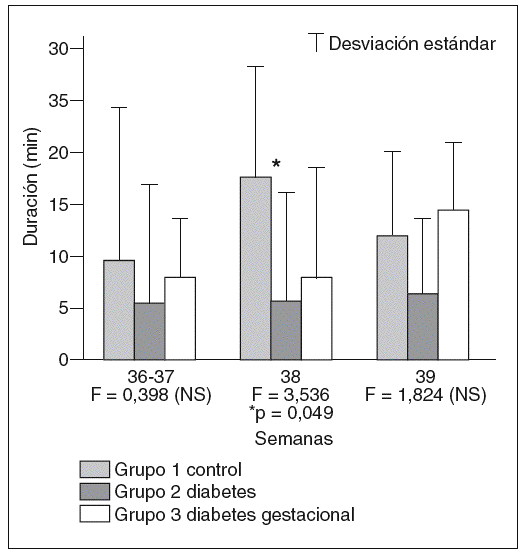
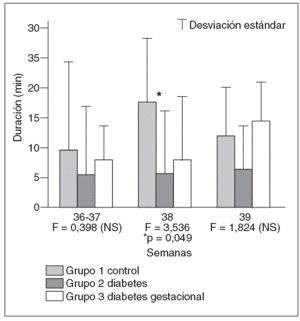
Al valorar conjuntamente movimientos oculares, actividad corporal y tipo de trazado de la FCF, se comprobó que el tiempo que permanecen los fetos en estado de sueño profundo F1 es menor en el grupo de madres con diabetes tipo 1 que en el control y el grupo de fetos hijos de madres con diabetes gestacional en todos los momentos considerados, aunque las diferencias únicamente resultan estadísticamente significativas al comparar la duración de este esta do de comportamiento entre el grupo control y el grupo de diabetes tipo 1 a las 38 semanas de gestación (fig. 3).
Fig. 3. Duración media, en minutos, de los períodos de sueño profundo o F1 en cada uno de los grupos en los tres momentos gestacionales en que fueron evaluados en el grupo control, grupo de gestantes con diabetes tipo 1 y en el grupo de pacientes con diabetes gestacional.
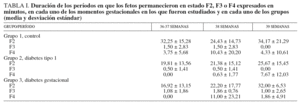
En la tabla I se recogen los valores numéricos correspondientes a cada grupo y edad gestacional al cuantificar el tiempo que permanecieron los fetos en un estado de comportamiento F2 (sueño activo), F3 (vigilia tranquila) o F4 (vigilia activa). Las diferencias existentes entre los 3 grupos al considerar estos parámetros no han resultado estadísticamente significativas en ninguno de los momentos gestacionales en que han sido estudiados.
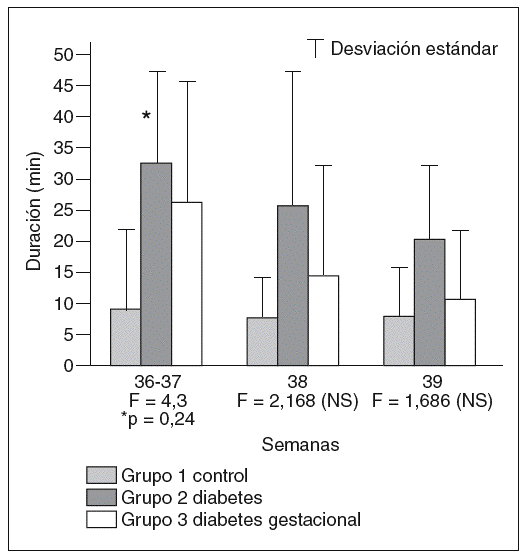
Al considerar el estado F5, situación en la que no es posible identificar la asociación de variables caracterizadoras de un estado, encontramos que el tiempo que permanecen los fetos en esta situación de transición o incoordinación es superior en el grupo de diabetes tipo 1 en todos los momentos diferenciados. Además, la observación de este estado de comportamiento transicional es también más frecuente en el grupo de fetos de hijos de madres con diabetes gestacional que en el grupo control, en todos los momentos estudiados. Sin embargo, las diferencias obtenidas sólo alcanzan significado estadístico al comparar a los fetos del grupo control con los del grupo de diabetes tipo 1 a las 36-37 semanas (fig. 4).
Fig. 4. Duración media, en minutos, de la permanencia de los fetos en estado en el que no es posible identificar la asociación de variables caracterizadoras de estado, equivalente a un estado de transición o incoordinación, estado F5.
En el estudio del grado de coordinación neurológica fetal, valorado en función de la capacidad del feto para establecer estados de comportamiento estables, se comprobó que ninguno de los fetos pertenecientes al grupo de gestantes con diabetes tipo 1 mostró esta capacidad a las 36-37 semanas, mientras que el 63,3% de los pertenecientes al grupo control y el 36,36% de los hijos de madres con diabetes gestacional sí consiguieron establecer estados de comportamiento estables (p < 0,006).
A las 38 semanas todos los fetos incluidos en el grupo control fueron capaces de establecer estados de comportamiento estables, mientras que únicamente el 25% de los pertenecientes al grupo de diabetes tipo 1 y el 60% de los del grupo de diabetes gestacional demostraron esta capacidad. Estas diferencias resultan estadísticamente significativas (p < 0,013).
A las 39 semanas, el 83,3% de los fetos pertenecientes al grupo control mostraron estados de comportamiento estables y el 71,4% de los hijos de madres con diabetes gestacional, mientras que sólo fueron capaces de demostrar esta capacidad el 33,3% de los hijos de madres con diabetes tipo 1, si bien estas diferencias ya no alcanzan significación matemática.
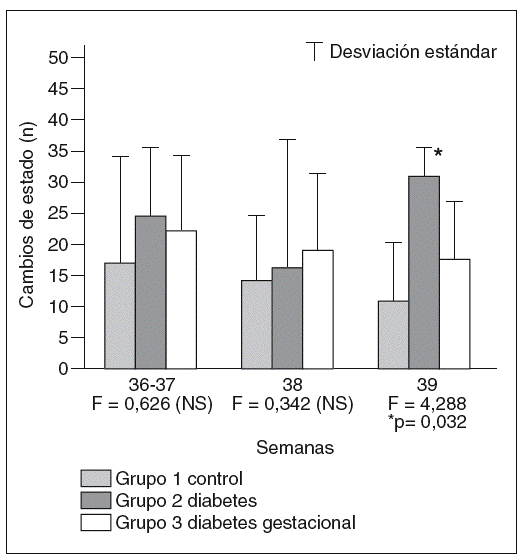
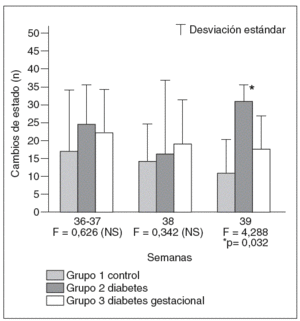
Se demostró la existencia de un mayor número de cambios de estado entre los hijos de madres diabéticas, tanto en el grupo con diabetes pregestacional, tipo 1, como en el grupo con diabetes gestacional, en todos los momentos considerados. No obstante, estas diferencias resultan únicamente significativas cuando se compara el grupo de diabetes tipo 1 con el grupo control a las 39 semanas de gestación (fig. 5).
Fig. 5. Número de cambios de estado en cada uno de los grupos a las diferentes edades gestacionales en las que han sido estudiados los estados de comportamiento fetal.
DISCUSION
En este estudio se ha comprobado la existencia de una alteración en el desarrollo neurológico en los fetos de las gestantes con diabetes tipo 1 con respecto a los controles, que se manifiesta por una menor duración de los períodos de sueño profundo, significativa a las 38 semanas, una prolongación de los estados de incoordinación, o transición, especialmente manifiesta a las 36-37 semanas, y un mayor número de cambios de estado, o inestabilidad conductual, significativo a las 39 semanas. Globalmente, la capacidad fetal para establecer o coordinar estados de comportamiento estables se ve alterada en los fetos de gestantes afectas de diabetes tipo 1 a las 36-37 y 38 semanas. Las características de los estados de comportamiento que mostraron los fetos de las gestantes con diabetes gestacional son similares a las de los fetos de madres con diabetes tipo 1, pero las diferencias demostradas respecto al grupo control no resultan estadísticamente significativas.
Son muy escasas las referencias en la literatura médica sobre los estados de comportamiento de los fetos de gestantes diabéticas, pero existen en cambio diferentes publicaciones sobre las características del desarrollo neuroconductual de estos niños. Hace más de 30 años que Schultte et al11-13 comprobaron la existencia de alteraciones en los estados de comportamiento de los recién nacidos hijos de madres diabéticas realizando estudios poligráficos en 14 niños nacidos de madres diabéticas, tanto con diabetes tipo 1 como gestacional, tratadas sólo con dieta o insulinizadas. Los electroencefalogramas mostraban una menor madurez neurológica al compararlos con los de niños control, y el comportamiento motor de una gran proporción de estos niños fue considerado como de hiper-excitabilidad. La muestra era pequeña y muy heterogénea, y desde entonces han mejorado de forma sustancial los tratamientos de las gestantes diabéticas y sus recién nacidos, pero, a pesar de ello, en nuestra serie hemos observado alteraciones similares en los estados de comportamiento de los fetos de madres con diabetes. Detectaron una menor duración de los períodos de sueño no REM, equivalentes a los períodos de sueño profundo F1 fetal, en los hijos de madres diabéticas que en los controles, observación coincidente con la que hemos establecido en nuestra serie durante el período de vida fetal. Comprobaron también la existencia de una prolongación de las fases de sueño REM, comparable al sueño activo F2 fetal, que no hemos podido demostrar en los fetos incluidos en nuestro estudio.
Mulder et al14 estudiaron los estados de comportamiento siguiendo los criterios de Nijhuis2, en una serie de 17 gestantes con diabetes tipo 1 estrictamente controladas con bombas de inyección automática de insulina. Su objetivo era demostrar que el control metabólico estricto evitaría la aparición de alteraciones en el desarrollo somático o neurológico fetal. Esta hipótesis no se confirmó, ya que encontraron una alteración en la emergencia de los estados de comportamiento en los fetos de las gestantes diabéticas al compararlos con los controles. La escasa duración del estado de sueño profundo F1 fue un hecho común en estos fetos. La incidencia del estado de comportamiento F2, o sueño activo, fue similar a la observada en los fetos controles. Nuestros resultados son superponibles en lo que respecta a la duración de los períodos en los que los fetos muestran un estado F1 o F2. Mulder et al14 no hacen mención específica de los estados de comportamiento F3 y F4 o estado de agitación. Sí refieren, sin embargo, un mayor número de transiciones asincrónicas, o de cambios de estado, también observado por nosotros. El efecto inmediato en que se traduce esta circunstancia es una prolongación de los períodos de incoordinación F5, que también hemos podido constatar en nuestra serie. Resultados similares habían obtenido Dierker et al15 al investigar la duración de los períodos de actividad y reposo fetal basándose únicamente en las características de la FCF y en la actividad corporal fetal.
Se podría especular que los hijos de madres diabéticas permanecen menos tiempo en estado de sueño profundo F1 que los fetos sanos buscando incrementar el consumo de energía en los períodos de vigilia, ante el excesivo aporte de sustrato al que se ven sometidos. Pero esta explicación es demasiado simplista cuando nos enfrentamos a una alteración metabólica tan sumamente compleja. Debe tenerse en cuenta que los valores de hemoglobina glucosilada se mantuvieron en límites normales en todos los casos (6-8,5%), circunstancia que también se dio en nuestra serie, al menos en el tercer trimestre de gestación.
Se ha comprobado la ausencia de correlación entre los valores de hemoglobina glucosilada y la macrosomía16,17. En nuestra serie, los hijos de gestantes con diabetes tipo 1 tuvieron un peso significativamente superior que los controles; también en la de Mulder14 el 30% de los niños mostró un peso situado por encima del percentil 90 a pesar de los excelentes perfiles metabólicos de sus madres. Los problemas surgidos en los embarazos de las gestantes diabéticas deben estar en relación con otros trastornos metabólicos más complejos que no se correlacionan directamente con las características de los perfiles glucémicos, tanto en lo que respecta a la presencia de macrosomía como a las alteraciones en los estados de comportamiento neurológico18.
Se ha referido la existencia de una correlación entre los niveles del factor de crecimiento análogo a la insulina 1 (IGF-1) y el crecimiento fetal, especialmente en los depósitos de tejido graso19. El incremento en los valores de IGF-1 se relaciona directamente con la presencia de macrosomía en los hijos de madres diabéticas, independientemente de los perfiles glucémicos de la gestante. Por otra parte, los IGF-2 se han relacionado con la formación de la glía, de manera que las modificaciones que experimentan los IGF-1, y principalmente los IGF-2, y sus proteínas transportadoras podrían relacionarse con las alteraciones que presentan los fetos de las gestantes con diabetes tipo 1 en la instauración de estados de comportamiento estables20.
Los resultados que hemos obtenido en el grupo de pacientes con diabetes gestacional sugieren que podría existir alteración en el desarrollo neurológico intrauterino de sus fetos. Las diferencias detectadas en este grupo con respecto al control al estudiar los estados de comportamiento fetal son similares y concordantes con las obtenidos en el grupo de fetos de gestantes con diabetes tipo 1, si bien en ninguna de las comparaciones establecidas las diferencias han alcanzado significación estadística, por lo que no podemos considerarlos concluyentes. No hemos encontrado en la literatura médica referencia alguna sobre los estados de comportamiento fetal en las gestantes con diabetes gestacional, salvo el estudio de Gazzolo et al21, quienes constatan una alteración en las características del comportamiento fetal en los hijos de madres con diabetes gestacional, pero realizan el estudio a las 27-32 semanas y entre las 33 y 36 semanas, edades gestacionales en las que todavía los fetos no han alcanzado la madurez suficiente para establecer estados de comportamiento estables.
Consideramos que esta posibilidad debe estudiarse mejor, valorando aquellos casos en los que la diabetes gestacional pueda ser una diabetes pregestacional no diagnosticada y la posible relación entre los perfiles glucémicos y las características de los estados de comportamiento fetal obtenidas.