Evaluar la frecuencia, las complicaciones y el pronóstico de la coagulopatía por consumo (CC) en un grupo de pacientes con hemorragias obstétricas graves en el periodo periparto.
Material y métodosEstudio retrospectivo y descriptivo, efectuado en 91 enfermas con CC sobre 247 pacientes con hemorragias obstétricas graves en el periodo periparto, ingresadas entre 1991 y 2008 en la División de Cuidados Intensivos de la Clínica y Maternidad Suizo Argentina.
ResultadosEl shock se presentó en 110 enfermas y afectó a más de la mitad de los casos con desgarros cervicovaginales y rupturas uterinas. 61 gestantes con shock presentaron CC, 12 de ellas con sangrado múltiple, confirmando el diagnóstico de coagulación intravascular diseminada. En el grupo sin shock (n=137) el número de casos con CC (n=30) fue menor (p<0,05). El fallo multiorgánico se vinculó con la presencia de shock hemorrágico y CC, resultando las complicaciones más frecuentes el distrés pulmonar y la insuficiencia renal aguda. Todas las puérperas sobrevivieron sin secuelas.
ConclusionesLa prevalencia de la CC en las pacientes con hemorragias obstétricas graves resultó mayor que la observada en la población general de enfermos en estado crítico. La presencia de shock en el curso de una hemorragia obstétrica grave origina CC en más de la mitad de los casos y, en ocasiones, se asocia con daño orgánico. La prevención del shock hemorrágico no evitó la CC en el 21% de las enfermas. La supervivencia materna fue óptima.
To evaluate the frequency, complications and outcomes of consumptive coagulopathy (CC) in patients with severe obstetric hemorrhage in the peripartum period.
Material and methodsOf 247 patients with severe obstetric hemorrhage in the peripartum period admitted to the Intensive Care Division of Clínica y Maternidad Suizo, Argentina, between 1991 and 2008, we performed a retrospective and descriptive study of 91 patients with CC.
ResultsShock occurred in 110 patients and affected more than half of the patients with cervical and vaginal tears and uterine rupture. Shock developed in 61 pregnant women with CC. Of these, 12 showed multiple bleeding, confirming the diagnosis of disseminated intravascular coagulation. In the group without shock (n=137), the number of patient with CC (n=30) was lower (p<0.05). Multiple organ failure was associated with the presence of hemorrhagic shock and CC, the most frequent complications being respiratory distress and acute renal failure. All the puerperal women survived without sequelae.
ConclusionsThe prevalence of CC in patients with severe obstetric hemorrhage was higher than that observed in the general population of critically ill patients. The presence of shock in the course of a severe obstetric hemorrhage causes CC in more than half of affected patients and sometimes is associated with organ failure. Prevention of hemorrhagic shock did not prevent CC in 21% of the patients. Maternal survival was optimal.
Las hemorragias obstétricas y las complicaciones derivadas de las mismas representan una de las causas más frecuentes de morbimortalidad materna en el mundo. La exacta incidencia de la coagulopatía en el curso de las hemorragias obstétricas graves no se encuentra debidamente establecida1. El objetivo del presente trabajo fue evaluar la frecuencia, las complicaciones y el pronóstico de la coagulopatía por consumo (CC) en un grupo de pacientes sin y con shock secundario a hemorragias en el periodo periparto, que fueron asistidas en una única institución en el transcurso de los últimos diecisiete años.
Material y métodosSobre un total de 89.014 nacimientos, se estudiaron 247 pacientes ingresadas en la División de Cuidados Intensivos de la Clínica y Maternidad Suizo Argentina por presentar hemorragias graves de origen obstétrico durante el periodo comprendido entre marzo de 1991 y febrero de 2008. Las pérdidas hemáticas fueron estimadas en más de 1.000ml, iniciándose en la mayor parte de los casos dentro de las 2h previas al parto, en el periodo de alumbramiento o durante el puerperio precoz. Se consideró la existencia de hemorragia exanguinante en aquellos casos con pérdidas cuyo monto estimado a través del volumen recogido en recipientes y compresas superó los 4.000ml, con requerimiento de transfusiones iguales o mayores de 10 unidades de glóbulos rojos durante el parto u operación cesárea y dentro de las primeras 6h del puerperio y caída del hematocrito mayor de 10 puntos. Se registraron el número de embarazos, la duración promedio del periodo gestacional y la etiología del sangrado. El shock fue definido como la existencia de tensión arterial sistólica menor de 80mmHg durante mas de quince minutos, frecuencia cardiaca mayor de 100 por minuto, oligoanuria, deterioro del estado de la conciencia (obnubilación, estupor) y alteraciones en la perfusión tisular (frialdad en las extremidades, palidez, enlentecimiento en el retorno capilar). Confirmado el diagnóstico, se colocaron dos o más venopunturas con cánulas de calibre 14 o 16 en vasos periféricos y se comenzó la reposición de la volemia con Ringer lactato o solución salina normal 50ml/kg peso en 15–20min, que representó una cantidad de 3.000ml aproximadamente. Luego se asoció una infusión de poligelina o almidones de bajo peso molecular (coloides) en proporción 1:3 con respecto a los cristaloides y se inició la reposición con glóbulos rojos desplasmatizados mientras continuó el aporte de cristaloides y coloides de acuerdo con la condición clínica de la enferma. Con pérdidas estimadas superiores a media volemia, se repuso plasma fresco congelado (PFC) a razón de 20ml/kg peso. Valores de fibrinógeno menores de 100mg/dl se corrigieron con 1 unidad de crioprecipitados (CrPr) por cada 10kg de peso. Se implementaron las medidas necesarias para conservar la temperatura corporal, mediante mantas térmicas y entibiando las soluciones parenterales. En todos los casos, se incrementó la fracción inspirada de oxígeno con el fin de optimizar la disponibilidad del mismo a nivel tisular. Durante el periodo con sangrado se efectuaron estudios de coagulación cada 30min aproximadamente y hasta su normalización. Se diagnosticó CC en aquellas pacientes con plaquetopenia menor de 150K/μl (VN 150–425K/μl), tiempo de protrombina menor de 70% (método coagulométrico, VN 70–120%), tiempo parcial de tromboplastina activada mayor de 40s (método coagulométrico, VN 25–45s), concentración de fibrinógeno menor de 160mg/dl (método Clauss, VN en el embarazo 400–650mg/dl) y productos de degradación del fibrinógeno mayores de 8pg/dl (método aglutinación de partículas de látex, VN menor de 5pg/dl). La asociación de CC con sangrado múltiple confirmó el diagnóstico de coagulación intravascular diseminada (CID). Se consideró la existencia de insuficiencia renal aguda ante la presencia de oliguria menor de 400ml/día con creatininemia > 1,2mg/dl (VN en el embarazo 0,4–0,8mg/dl). La existencia de síndrome de dificultad respiratoria aguda del adulto se estableció tomando como base criterios ya definidos: disnea, hipoxemia, rales pulmonares e infiltrados alveolares bilaterales en la radiografía, con ecocardiografía sin evidencias de disfunción ventricular izquierda. La disfunción hepática se definió por la presencia de bilirrubinemia directa mayor de 0,5mg/dl (VN 0,10–0,50mg/dl) y transaminasa glutámico pirúvico mayor de 37UI/l (VN 15–37UI/l). Se registraron otras complicaciones observadas durante el puerperio y la mortalidad materna.
Las variables continuas fueron representadas como media±desvío estándar y estudiadas mediante el análisis de varianza univariado. Se efectuaron comparaciones entre grupos por medio del cálculo de las oportunidades relativas (odds ratio) y los intervalos de confianza del 95% y se consideró significativa una p< 0,05.
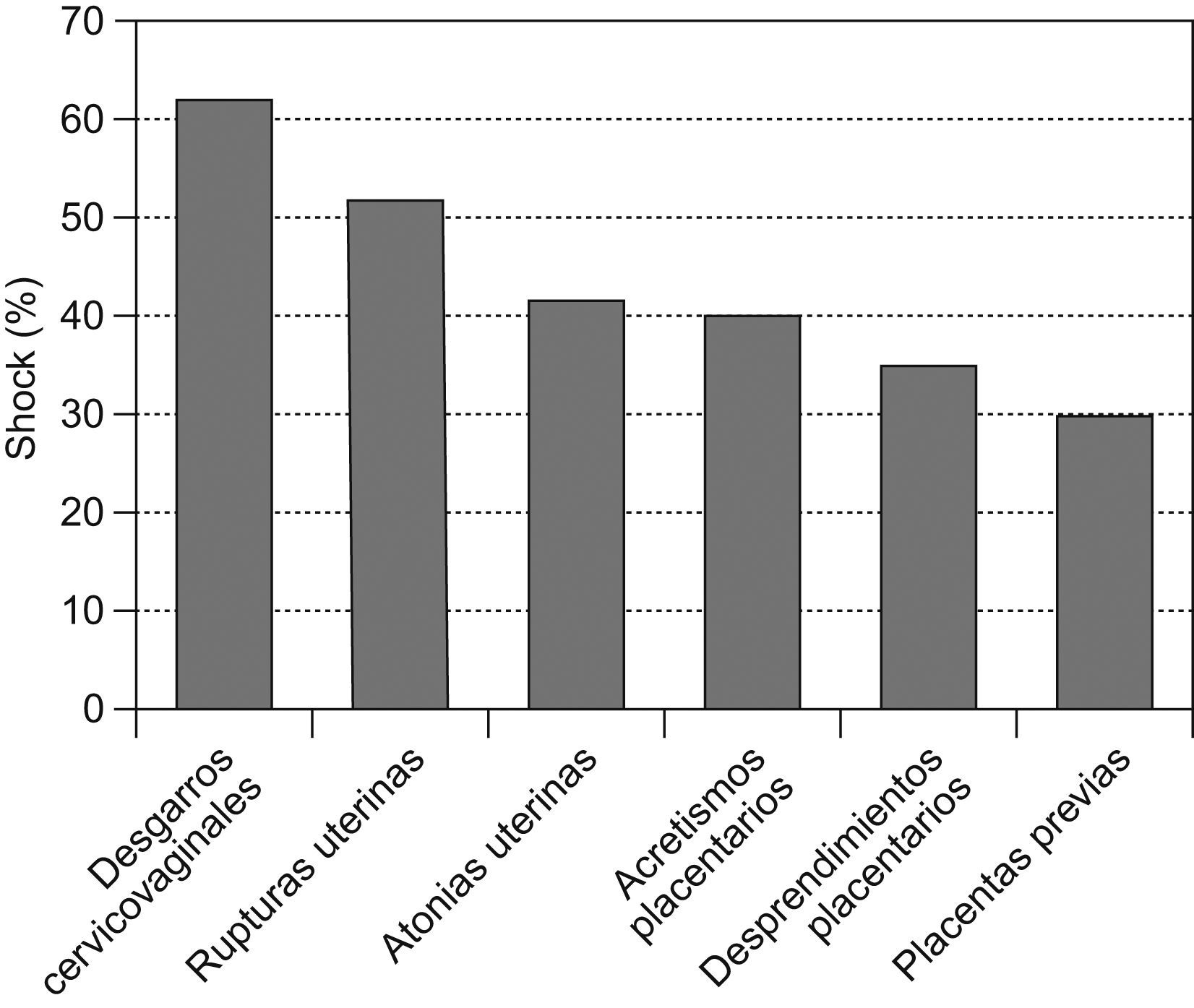
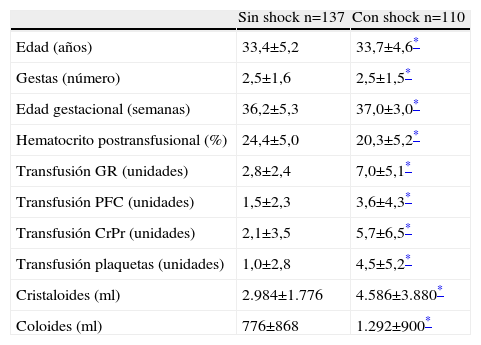
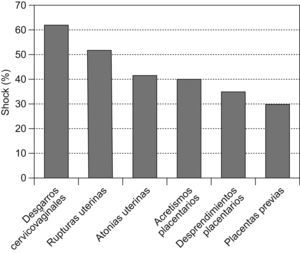
ResultadosEn nuestra institución, las hemorragias obstétricas graves ingresadas en el área de cuidados intensivos presentaron una prevalencia de 2,7/1.000 nacimientos. Sobre 247 casos con hemorragias obstétricas graves, 110 pacientes (44%) presentaron shock hemorrágico y fueron comparadas con otro grupo sin shock conformado por las 137 enfermas restantes, no existiendo entre ambos diferencias en cuanto a los valores promedios de edad, número de embarazos y edad gestacional (tabla 1). En la figura 1 se representó la prevalencia del shock según las diversas etiologías, que superó en más de la mitad los casos con desgarros cervicovaginales y rupturas uterinas. 25 enfermas presentaron hemorragias exanguinantes y recibieron transfusiones masivas. Este último subgrupo fue analizado y comentado en una publicación reciente2. Las enfermas con shock fueron transfundidas con mayor número de unidades de glóbulos rojos que aquellas sin shock. Asimismo, la reposición de la volemia durante el periodo intra-operatorio con soluciones de cristaloides y poligelina representó un volumen mayor que el requerido en el grupo sin shock (tabla 1), si bien el número insuficiente de casos no permitió obtener diferencias estadísticamente significativas. En 11 casos con shock, se complementó el tratamiento luego de la expansión de la volemia con infusión de dopamina hasta estabilizar la tensión arterial sistólica en 90mmHg o más.
Comparación de diversos parámetros (media±desvío estándar) entre los grupos de pacientes con y sin shock hemorrágico
| Sin shock n=137 | Con shock n=110 | |
| Edad (años) | 33,4±5,2 | 33,7±4,6* |
| Gestas (número) | 2,5±1,6 | 2,5±1,5* |
| Edad gestacional (semanas) | 36,2±5,3 | 37,0±3,0* |
| Hematocrito postransfusional (%) | 24,4±5,0 | 20,3±5,2* |
| Transfusión GR (unidades) | 2,8±2,4 | 7,0±5,1* |
| Transfusión PFC (unidades) | 1,5±2,3 | 3,6±4,3* |
| Transfusión CrPr (unidades) | 2,1±3,5 | 5,7±6,5* |
| Transfusión plaquetas (unidades) | 1,0±2,8 | 4,5±5,2* |
| Cristaloides (ml) | 2.984±1.776 | 4.586±3.880* |
| Coloides (ml) | 776±868 | 1.292±900* |
CrPr: crioprecipitados; GR: glóbulos rojos; PFC: plasma fresco congelado.
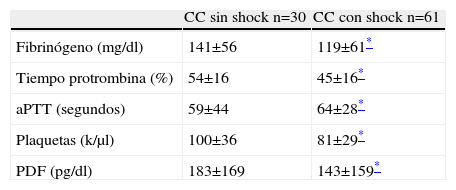
El aporte de hemoderivados en las pacientes sin shock fue menor y respondió a la necesidad de prevenir con PFC la coagulopatía dilucional o para corregir defectos parciales de los factores de coagulación o plaquetopenia (tabla 1). 61 enfermas cursaron con CC (55%) vinculado con shock hemorrágico. Entre ellas, 12 pacientes presentaron sangrados múltiples que confirmaron la presencia de CID (tabla 2). El deterioro de la coagulación evidenciado a través de las pruebas realizadas fue similar entre las enfermas con y sin shock (tabla 3). Los valores de fibrinógeno y PDF en las muestras iniciales pusieron en evidencia la existencia de una respuesta fibrinolítica precoz e intensa (tabla 3).
Morbilidad en los grupos de pacientes con y sin shock hemorrágico
| Con shock | Sin shock | Odds Ratio | |
| n=110 | n=137 | Intervalo de confianza del 95% | |
| CC (pacientes) | 61 (55%) | 30 (21%) | 4,4402 (2,5551–7,7156)* |
| CID (pacientes) | 12 (11%) | 1 (0,7%) | 16,6531(2,13–130,2028)* |
| DO (número de órganos) | 26 | 1 | 42,0952 (5,6078–315,9883)* |
CC: coagulopatía por consumo; CID: coagulación intravascular diseminada; DO: disfunción orgánica.
Estudios de coagulación en pacientes con coagulopatía por consumo con y sin shock hemorrágico
| CC sin shock n=30 | CC con shock n=61 | |
| Fibrinógeno (mg/dl) | 141±56 | 119±61* |
| Tiempo protrombina (%) | 54±16 | 45±16* |
| aPTT (segundos) | 59±44 | 64±28* |
| Plaquetas (k/μl) | 100±36 | 81±29* |
| PDF (pg/dl) | 183±169 | 143±159* |
aPTT: tiempo parcial de tromboplastina activada; CC: coagulopatía por consumo; PDF: productos de degradación del fibrinógeno.
Insuficiencia respiratoria aguda en el puerperio inmediato, vinculadoa con distrés pulmonar y requerimiento de asistencia respiratoria mecánica, se presentó en 12 enfermas. Otras 13 puérperas fueron ventiladas en el postoperatorio inmediato, durante pocas horas, por depresión ventilatoria postanestésica. 10 casos se complicaron con insuficiencia renal aguda oligoanúrica (diuresis <400ml/día), que revirtieron dentro de la primer semana de puerperio, excepto en un caso que se prolongó durante 14 días y necesitó tratamiento hemodialítico. 5 puérperas expresaron a través del hepatograma algún grado de disfunción asintomática, que se normalizó pocos días más tarde. En total se registraron 27 fallos de órganos (tabla 2). Además, 2 enfermas presentaron arritmias: bigeminia ventricular y taquiarritmia supraventricular, que revirtieron con el tratamiento específico. En otras 2 enfermas se observó hipocalcemia sintomática.
Todas las puérperas sobrevivieron sin secuelas.
DiscusiónEn el periodo final del embarazo existe un incremento de la volemia de 30–50% aproximadamente, llegando a 8,5–9% del peso corporal. Esta situación permite que las gestantes toleren pérdidas sanguíneas de hasta el 15% de su volumen circulante antes de manifestar taquicardia o hipotensión arterial3. Cuando estos síntomas se presentan, el sangrado supera 1.000ml y por lo tanto estamos en presencia de una hemorragia obstétrica grave, que con rapidez progresa al shock en un número considerable de casos.
En nuestras pacientes, el tratamiento instituido evitó la hipotermia central menor de 34°C, valores considerados inductores de coagulopatía4–6 y previno la acidosis metabólica cuando la estabilidad hemodinámica pudo preservarse.
Con pérdidas hemáticas que superen la mitad de la volemia, ya efectuada la reposición inicial con cristaloides, coloides y glóbulos rojos7, la concentración de los factores de la coagulación disminuye por debajo del 50% de su valor normal aproximadamente8. La reposición con PFC y plaquetas evita la coagulopatía dilucional9,10; no obstante, la presencia de shock agravó la condición clínica de las enfermas y en más de la mitad de los casos originó una CC. En una serie de enfermas críticas con diversas patologías ingresadas en el área de cuidados intensivos, el 8,5% tenían diagnóstico de CID y la mortalidad fue 21,9%11. En las enfermas obstétricas, incluyendo el grupo analizado, la ausencia de antecedentes patológicos, la edad de las gestantes y la rápida reversibilidad de la patología que condiciona la descompensación generaron condiciones favorables para su pronta recuperación con mejor pronóstico que el referido. Sin embargo, observamos que la prevalencia de CC vinculada con la hemorragia obstétrica resultó más elevada que en la población general. El estado trombofílico en el momento del nacimiento responde a una necesidad fisiológica y podría facilitar la inducción de CC ante la presencia de ciertos estímulos: hipotensión arterial, hipoxemia, acidosis, hipotermia y tromboplastinas circulantes.
La enfermedad se manifiesta en dos etapas12; durante la primera, trombos fibrinoplaquetarios se depositan en la microvasculatura, con el consiguiente daño isquémico multiorgánico13. Algunos órganos podrán exhibir mayor lesión que otros y, en coincidencia con lo referido en la literatura, observamos que la función renal y la respiratoria fueron las que con mayor frecuencia resultaron afectadas. Se discutió si la disfunción de órganos fue producto de la hipoperfusión y caída de la disponibilidad tisular de oxígeno o si esta última resulta dependiente de la microtrombosis en el curso de la CID13. Es razonable asignar esta responsabilidad a la suma de ambos procesos fisiopatológicos; en nuestras enfermas, la asociación de shock y coagulopatía provocó mayor morbilidad. La prevalencia de CC resultó menor en las pacientes sin shock (tabla 2) y llegó al 88% en los casos con hemorragias exanguinantes2.
La puntuación obtenida con la escala de CID se relacionó con la falla multiorgánica y el pronóstico11,14,15. Las dos escalas usuales para diagnóstico y cuantificación de gravedad de la CID16,17 no resultaron aplicables a nuestra población. Una de ellas no incluyó las hemorragias obstétricas graves en el listado de condiciones clínicas que habilitan su uso; la otra, descartó el sangrado grave con transfusiones masivas.
En un segundo periodo, el agotamiento por consumo de los factores de coagulación y de las plaquetas y la degradación plasmínica de la fibrina conducen a la CID con hemorragias múltiples, como observamos en el 11% de las enfermas con shock. Solo registramos un caso con CID en ausencia de descompensación hemodinámica (tabla 2). En el resto de las pacientes, la CC se asoció con sangrado microvascular limitado a las heridas quirúrgicas o al lecho placentario.
Hace más de 30 años, Hardaway demostró en animales los beneficios de mantener el flujo tisular normal en presencia de tromboplastinas circulantes, al evitar el desarrollo de CID18. Observamos una reacción fibrinolítica intensa y precoz asociada a una abrupta caída de la fibrinogenemia, que justificó el uso de CrPr con el inicio del tratamiento sustitutivo. En casi todas las enfermas se respetó la respuesta fibrinolítica secundaria evitando el uso de antagonistas específicos; no obstante, revaluamos esta conducta. Letsky19 sostiene que, en estas condiciones, los PDF circulantes podrían deteriorar la contracción del miometrio con atonía e inclusive deprimir la función miocárdica. En ocasiones, la hipotensión arterial no resulta dependiente de la hipovolemia, sino consecuencia directa de la liberación de bradiquinina en el curso de la CID20.
Si bien la etiología de la CC es múltiple, en la mayor parte de los casos es mediada por la generación de citoquinas liberadas desde las células endoteliales y monocitos circulantes21 que activan la vía extrínseca a través del factor tisular (TF tissue factor). A continuación, un mecanismo de interacción y amplificación induce cambios en todo el sistema de coagulación con formación de trombina22. Takahashi et al determinaron los niveles de TF en enfermos con CID, cuyo promedio resultó tres veces por encima del valor obtenido en sujetos normales23.
La concentración del inhibidor natural del TF (TFPI, tissue factor pathway inhibitor), liberado por las células endoteliales en respuesta a la injuria celular24, resultó demasiado baja para evitar que la coagulación se dispare25. Valores elevados de TFPI no se correlacionaron con los del TF23 y en todos los casos la relación TF/TFPI disminuyó en presencia de CID. Este efecto resultaría del agotamiento del inhibidor ante la exposición continua al TF21. Simultáneamente, disminuyen otros inhibidores circulantes: la antitrombina III (AT-III) y el complejo de proteínas C y S.
Por su parte, los tejidos uteroplacentarios poseen sustancias tromboplásticas que, aun en ausencia de shock, pueden inducir el comienzo de una CID cuando son liberadas en la circulación materna. La determinación de las concentraciones de TF en el miometrio y en el tejido placentario fueron muy superiores a los niveles sanguíneos25. El líquido amniótico posee una concentración de TF 44 veces más elevada que su concentración plasmática26.
El sistema fibrinolítico también se altera; altos niveles de los inhibidores del activador del plasminógeno (PAFI-1, plasminogen activator factor inhibitor) y PAFI-2 (este último de exclusivo origen placentario) inhiben la fibrinolisis y, por lo tanto, contribuyen al depósito de fibrina durante la fase inicial del proceso.
La CID nunca es primaria, siempre responde a un factor desencadenante, por lo tanto, el tratamiento básico deberá dirigirse a la causa que la origina, complementado por el aporte de los factores de coagulación y plaquetas consumidas12. En este caso, la perpetuación de la CID está condicionada por la persistencia de la hipotensión arterial y la hipovolemia, cuyo tratamiento adquiere carácter prioritario. Sin embargo, la adecuada reposición del volumen perdido no evitó la CC en todas las enfermas que evaluamos.
Últimamente, se asignó valor pronóstico a la concentración de fibrinógeno durante la hemorragia y se destacó la importancia de reponerlo mediante concentrados6. Por su parte, Charbit demostró que el riesgo de hemorragia severa posparto se incrementó 2,6 veces por cada 100mg/dl que disminuyó la concentración de fibrinógeno plasmático27. Un reciente estudio confirmó que la administración de PFC y CrPr no incrementó el riesgo de trombosis venosa puerperal28.
El intento por restaurar la coagulación fisiológica mediante la infusión de AT-III o proteína C activada no obtuvo los resultados esperados. Se consideró la inhibición del TF; no obstante, esta estrategia surge de los conocimientos teóricos asimilados, no avalada aún por estudios prospectivos29,30.
De acuerdo con los resultados obtenidos, concluimos afirmando que:
- 1.
La prevalencia de la CC en nuestras pacientes con hemorragias obstétricas graves resultó mayor que la observada en la población general de enfermos en estado crítico.
- 2.
En presencia de CC se observó una respuesta fibrinolítica precoz e intensa.
- 3.
La prevención del shock no excluyó la CC en un número considerable de pacientes. Esta situación alerta sobre el riesgo de coagulopatía en las hemorragias del periodo periparto como consecuencia de la activación endotelial no dependiente del grado de hipovolemia o debido a la liberación de sustancias tromboplásticas de origen uteroplacentario en la circulación materna.
- 4.
El fallo multiorgánico se vinculó con la presencia de shock hemorrágico y CC, resultando las complicaciones más frecuentes el distrés pulmonar y la insuficiencia renal aguda.
- 5.
El pronóstico favorable de nuestras enfermas lo vinculamos con el diagnóstico precoz, la reanimación oportuna y suficiente2, la implementación de diferentes técnicas quirúrgicas en casos con atonías y acretismos31, la amplia disponibilidad de hemoderivados2, el acceso a la radiología intervencionista32 y el uso de un protocolo institucional para el tratamiento de las hemorragias obstétricas33–35.