Relacionar las concentraciones de ferritina plasmática materna en el tercer trimestre del embarazo con el crecimiento fetal.
Materiales y métodosSe seleccionaron pacientes con embarazos simples en el tercer trimestre que presentaron partos a término y que fueron atendidas en el Hospital Central «Dr. Urquinaona», Maracaibo, Venezuela. Se evaluaron la edad materna, edad gestacional al momento de la toma de la muestra y del parto, valores de hematocrito, concentraciones plasmáticas de ferritina materna y peso del recién nacido.
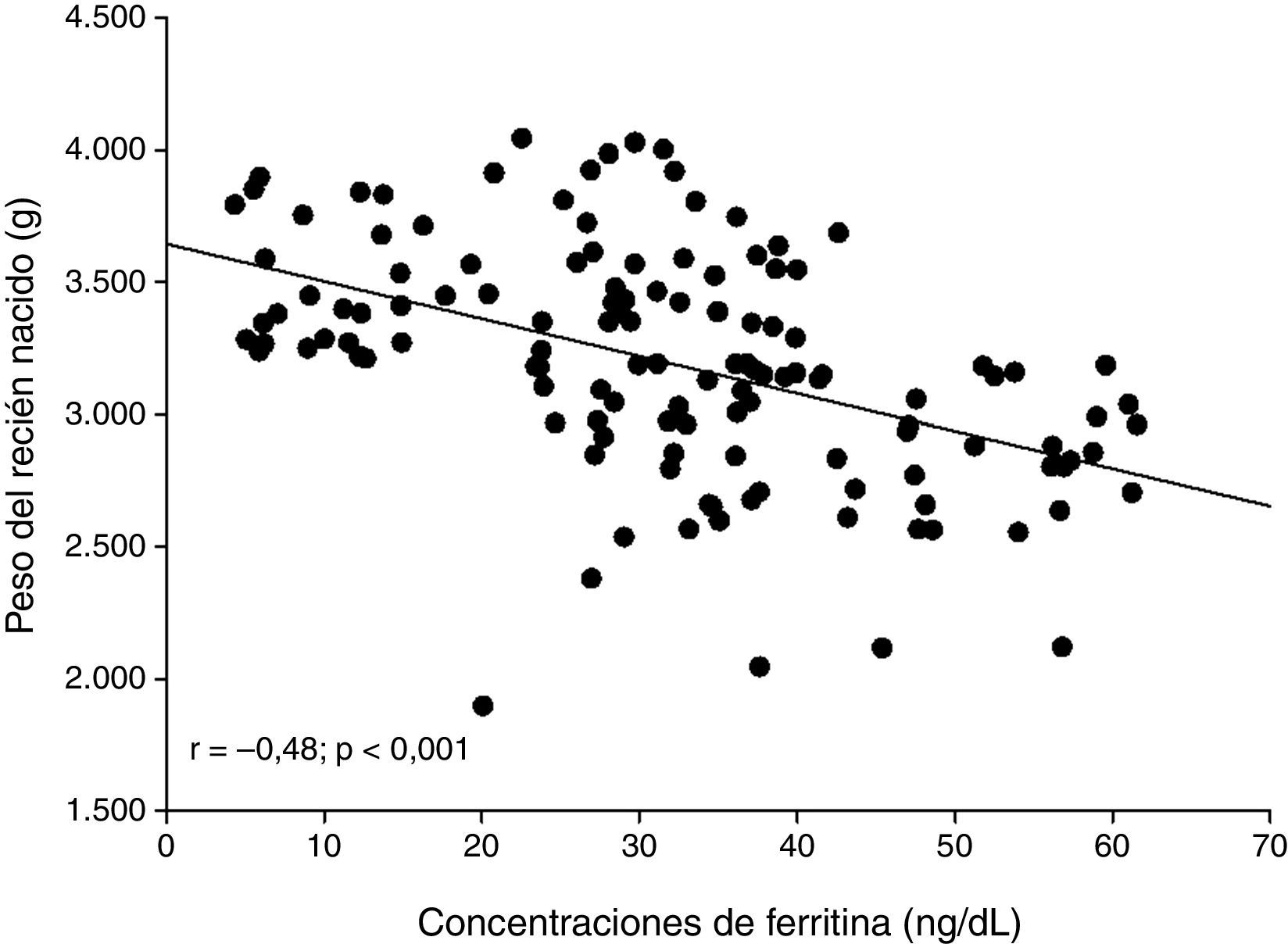
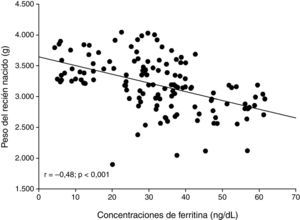
ResultadosSe seleccionaron 131 pacientes embarazadas en el tercer trimestre a las cuales se les pudo realizar las mediciones de ferritina. La edad promedio de las pacientes fue de 30,6±4,1años. Las concentraciones promedio de ferritina fueron de 31,7±14,7ng/dl y el peso promedio de los recién nacidos fue de 3.194±434g. Al dividir las concentraciones de ferritina materna en cuartiles (concentraciones bajas, medias, altas y muy altas), se observó que las pacientes con concentraciones muy altas y altas de ferritina materna tenían recién nacidos con pesos significativamente más bajos que las pacientes con concentraciones bajas de ferritina (p<0,001). Se observó una correlación moderada, negativa y significativa entre la concentración de ferritina materna y el peso de los recién nacidos (r=–0,481; p<0,001).
ConclusiónExiste una relación negativa y significativa de las concentraciones de ferritina plasmática materna en el tercer trimestre del embarazo con el crecimiento fetal.
To relate maternal plasma ferritin concentrations during the third trimester of pregnancy to foetal growth.
Materials and methodPatients with single pregnancies in the third trimester who had term deliveries and were cared for at the Hospital Central ‘Dr. Urquinaona’, Maracaibo, Venezuela were selected. Maternal age, gestational age at moment of sample and delivery, haematocrit values, maternal plasma ferritin concentrations and birth weight were evaluated.
ResultsWe selected 131 patients in the third trimester of pregnancy in whom ferritin measurements could be performed. The mean age of the patients was 30.6±4.1 years. The mean ferritin concentration was 31.7±14.7ng/dl and the mean birth weight of the newborns was 3,194±434g. When the ferritin concentrations of the mothers were divided in quartiles (low, medium, high and very high concentrations), it was apparent that patients with very high and high concentrations of ferritin had newborns with significant lower birth weight than patients with low concentrations of ferritin (P<.001). A moderate, negative and significant correlation between maternal plasma ferritin concentration and newborn birth weight was also observed (r=−.481; P<.001).
ConclusionThere is a negative and significant relationship between maternal plasma ferritin concentrations during the third trimester of pregnancy and foetal growth.
Las causas de las alteraciones del crecimiento fetal son heterogéneas, y el cuidado de los recién nacidos con restricción del crecimiento intrauterino del feto produce retos diagnósticos y terapéuticos1,2. La identificación prenatal de la alteración del crecimiento es crucial debido a que la evaluación y manejo adecuado están generalmente asociados con resultados favorables. Los fetos y recién nacidos con alteraciones del crecimiento se diagnostican sobre la base del índice ponderal al nacer y varias mediciones ecográficas prenatales. Los riesgos de morbimortalidad para los fetos con alteración del crecimiento parecen ser diferentes, por lo que podría ser importante para definir las etiologías y evaluar las estrategias de manejo para la reducción de los riesgos en los diferentes tipos1.
Las concentraciones de ferritina sérica son consideradas un indicador confiable de los depósitos corporales totales de hierro, siendo las concentraciones bajas indicadoras de deficiencia3,4. Las altas concentraciones se han asociado a varias condiciones, incluyendo infecciones e inflamación aguda o crónica y preeclampsia5-8. La ferritina es un reactante de fase aguda sintetizado por varios tejidos, incluyendo el hígado5,9. Los tejidos placentarios producen una forma de ferritina (isoferritina placentaria), y varios investigadores han asociado las alteraciones de las concentraciones de ferritina sérica, o isoferrina fetal, con varias complicaciones del embarazo, como la preeclampsia, parto pretérmino y bajo peso al nacer6,8,10-12. Sin embargo, no existe suficiente evidencia sobre la posible relación de las concentraciones plasmáticas de ferritina materna en el tercer trimestre del embarazo con el crecimiento fetal.
El objetivo de la investigación fue relacionar las concentraciones de ferritina plasmática materna en el tercer trimestre del embarazo con el crecimiento fetal.
Materiales y métodosSe realizó un estudio explicativo, longitudinal y prospectivo, entre enero de 2013 y noviembre de 2015, que incluyó pacientes con embarazos simples en el tercer trimestre que presentaron partos a término y que fueron atendidas en el Hospital Central «Dr. Urquinaona», Maracaibo, Venezuela. El Comité de Ética del hospital aprobó el estudio antes del inicio y se obtuvo consentimiento por escrito de todas las pacientes.
Fueron excluidas las pacientes con condiciones que producen alteraciones de las concentraciones plasmáticas de ferritina, como infecciones crónicas, alteraciones inflamatorias, neoplasias conocidas, antecedentes de uso de corticosteroides, enfermedad hepática, vaginitis, infección del tracto urinario, insuficiencia renal, hipertensión crónica, o el uso de cualquier sustancia que pueda interferir con las concentraciones o producción del marcador al momento de la investigación.
También se excluyeron pacientes con condiciones obstétricas como embarazos múltiples, restricción del crecimiento intrauterino del feto, anomalías placentarias, hemorragias de la segunda mitad del embarazo (placenta previa o desprendimiento prematuro de placenta), alteraciones de la frecuencia cardiaca fetal, sangrado genital durante el embarazo, anomalías cromosómicas o congénitas, presencia de infecciones intrauterinas (por ejemplo corioamnionitis), rotura prematura de membranas, polihidramnios, malformaciones uterinas conocidas, diabetes mellitus y preeclampsia/eclampsia. Las pacientes con antecedentes de hábito tabáquico o con embarazos con edad gestacional incierta no fueron seleccionadas para la investigación.
Una vez seleccionadas las pacientes para el estudio, se llenó una ficha de recolección de datos que incluyó: datos de la paciente, edad materna, edad gestacional al momento de la toma de la muestra y del parto (por fecha de última regla o ecografía del primer trimestre), valores de hematocrito y concentraciones plasmáticas de ferritina.
Las muestras de sangre venosa (10ml) se tomaron en un tubo de ensayo seco y estéril para la evaluación bioquímica, al momento del ingreso al hospital, sin importar el momento del día y antes de la administración de cualquier medicamento. El plasma y el suero fueron protegidos de la luz ultravioleta y separados en los 30min siguientes a la toma de la muestra. Posteriormente fue centrifugado a 4.000rpm por 10min, separado en alícuotas y almacenado a –70°C hasta el momento del análisis. La determinación del valor del hematocrito materno se realizó con un autoanalizador. Las determinaciones de las concentraciones de ferritina se realizaron con un kit comercial de inmunoanálisis enzimático de quimioluminiscencia (Immulite 2000, Diagnostic Products) con coeficientes de variación intra e inter ensayo de 8,7 y 7%. El límite inferior de detección de la prueba es de 0,1mg/dl.
Para evaluar la relación entre las concentraciones de ferritina plasmática materna y el peso del recién nacido, se dividió la muestra en cuartiles (concentraciones bajas, medias, altas y muy altas) sobre la base de las concentraciones de ferritina materna. El peso al nacer fue medido en la hora siguiente al parto con un peso electrónico. La edad gestacional al momento del parto se expresó como una variable continua en semanas completas, sobre la base del último periodo menstrual confirmado por ecografía antes de las 22 semanas. Si el último periodo menstrual y la edad gestacional por ecografía tenían más de 10 días de diferencia, se utilizó el estimado ecográfico de la edad gestacional al momento del parto.
Los valores se expresaran como promedio ± desviación estándar. Se utilizó la prueba de Kolmogorov-Smirnov para comprobar la distribución normal de los datos (p>0,05). El análisis estadístico entre los grupos se realizó con la prueba de ANOVA con posprueba de Dunnett para comparar las características demográficas, valores de hematocrito y concentraciones plasmáticas de ferritina materna entre los grupos, tomando como controles a las pacientes con concentraciones maternas de ferritina bajas. Los coeficientes de correlación entre la ferritina y el peso de los recién nacidos se evaluaron usando la prueba de Pearson. Se consideró un valor p<0,05 como estadísticamente significativo.
ResultadosSe seleccionaron 131 pacientes embarazadas en el tercer trimestre a las cuales se les pudieron realizar las mediciones de ferritina. La edad promedio de las pacientes fue de 30,6±4,1 años. La edad gestacional al momento de la toma de la muestra fue de 32,1±1,1 semanas y la edad gestacional al momento del parto fue de 39,0±1,1 semanas. Los valores promedio de hematocrito fueron de 34,7±2,1%. Las concentraciones promedio de ferritina plasmática fueron de 31,7±14,7ng/dl, y el peso promedio de los recién nacidos fue de 3.194±434g.
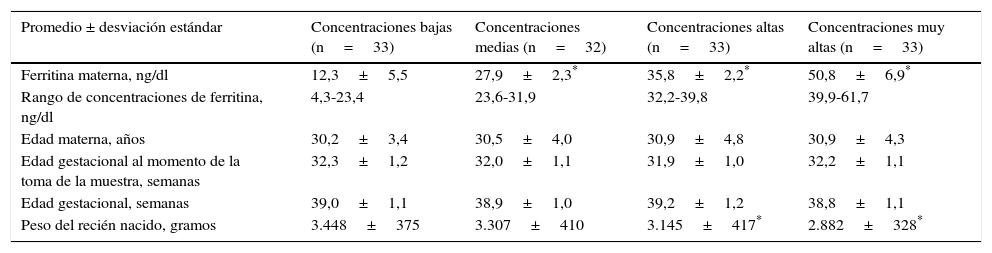
En la tabla 1 se muestran las concentraciones de ferritina materna divididas en cuartiles (concentraciones bajas, medias, altas y muy altas). Se observó que las pacientes en las concentraciones medias, altas y muy altas presentaron valores de ferritina significativamente más altos comparado con las pacientes bajas (p<0,001). No se encontraron diferencias estadísticamente significativas en los valores promedio entre los grupos en la edad materna, edad gestacional al momento de la toma de la muestra y edad gestacional al momento del parto (p=n.s.). Se observó que las pacientes con concentraciones muy altas y altas de ferritina materna tenían recién nacidos con pesos significativamente más bajos (2.882±328g y 3.145±417g) que las pacientes con concentraciones bajas (3.448±375g; p<0,001). El peso de los recién nacidos de pacientes con concentraciones de ferritina medias (3.307±410g) no mostró diferencias estadísticamente significativas con las pacientes con concentraciones bajas (p=n.s.).
Grupos por concentración materna de ferritina
| Promedio ± desviación estándar | Concentraciones bajas (n=33) | Concentraciones medias (n=32) | Concentraciones altas (n=33) | Concentraciones muy altas (n=33) |
|---|---|---|---|---|
| Ferritina materna, ng/dl | 12,3±5,5 | 27,9±2,3* | 35,8±2,2* | 50,8±6,9* |
| Rango de concentraciones de ferritina, ng/dl | 4,3-23,4 | 23,6-31,9 | 32,2-39,8 | 39,9-61,7 |
| Edad materna, años | 30,2±3,4 | 30,5±4,0 | 30,9±4,8 | 30,9±4,3 |
| Edad gestacional al momento de la toma de la muestra, semanas | 32,3±1,2 | 32,0±1,1 | 31,9±1,0 | 32,2±1,1 |
| Edad gestacional, semanas | 39,0±1,1 | 38,9±1,0 | 39,2±1,2 | 38,8±1,1 |
| Peso del recién nacido, gramos | 3.448±375 | 3.307±410 | 3.145±417* | 2.882±328* |
Al analizar la correlación entre la concentración de ferritina materna y el peso de los recién nacidos, se observó una correlación moderada, negativa y significativa (r=–0,481; p<0,001) (fig. 1).
DiscusiónLos resultados de la presente investigación confirman el hecho que las concentraciones elevadas de ferritina materna están relacionadas en forma significativa con la disminución del peso fetal en recién nacidos a término, y son consistentes con varios informes que indican un aumento en el riesgo de diferentes resultantes negativas sobre el recién nacido (bajo peso al nacer y restricción del crecimiento intrauterino del feto) en embarazadas con concentraciones elevadas de ferritina10-14. Debido a que la ferritina es un reactante de fase aguda, las concentraciones elevadas en estas circunstancias no reflejan el estado de los depósitos de hierro, sino que puede ser utilizado como un biomarcador de inflamación aguda o crónica9,15.
La ferritina sérica es un reactante de fase aguda que aumenta sus concentraciones en respuesta a varias condiciones inflamatorias. La inflamación crónica también suprime la eritropoyesis, subutilizando los depósitos de hierro e incrementando sus valores. Este incremento en los depósitos de hierro es paralelo al incremento de las concentraciones séricas de ferritina8. Por lo tanto, las concentraciones séricas elevadas de ferritina podrían indicar la exposición a una infección, o la presencia de una condición inflamatoria no infecciosa además de un nivel adecuado de concentraciones de hierro. Se ha sugerido que una posible explicación para la asociación entre las concentraciones séricas elevadas de ferritina y las alteraciones del crecimiento fetal es que esta elevación puede servir como un marcador de la respuesta inflamatoria vascular no infecciosa16.
Aunque los hallazgos de esta investigación y de otras investigaciones previas son controversiales12, ya se ha demostrado previamente en diferentes poblaciones que las concentraciones plasmáticas o séricas, utilizadas como marcadores de los depósitos totales de hierro, pueden utilizarse como indicador de alteración del crecimiento fetal11,17,18. De igual forma, se ha propuesto que las altas concentraciones de ferritina materna pueden ser un marcador de reacciones inflamatorias de fase aguda. Esto se hace evidente por la asociación entre las altas concentraciones de ferritina materna y el aumento de la frecuencia de parto pretérmino, en la cual la ferritina puede ser un indicador de inflamación/infección19.
Thame et al.20 demostraron una relación inversa entre ferritina sérica y volumen placentario determinado por ecografía durante el segundo trimestre del embarazo. Esta relación no fue afectada por la paridad, edad materna o consumo de tabaco. Estos hallazgos demostrarían que las concentraciones de ferritina sérica más altas se relacionarían con placentas más pequeñas. Estos resultados demuestran que las concentraciones séricas de ferritina dependen de la función de la unidad fetoplacentaria para extraer el hierro materno, de forma que las elevadas concentraciones de ferritina materna pueden deberse a alteraciones placentarias.
Rosen et al.21 describieron alteraciones en las concentraciones de isoferritina oncofetal o placentaria en gestantes con restricción del crecimiento intrauterino, lo cual podría interpretarse como una alteración del metabolismo del hierro desde la ferritina sérica materna hacia el feto, secundario a la alteración de la actividad placentaria. Estas tienen un efecto inhibitorio sobre la hematopoyesis y la función de los linfocitos T22. Las alteraciones de las concentraciones de ferritina placentaria en gestantes con restricción del crecimiento intrauterino del feto no se relacionan con alteraciones en las concentraciones de gonadotropina coriónica, estradiol o progesterona22,23.
Una posible explicación para las elevadas concentraciones de ferritina en las pacientes con recién nacidos de peso más bajo es que ellas pueden ser relativamente hipovolémicas. En este estudio no se midió el volumen plasmático, pero el hecho que las concentraciones de hematocrito fueran similares para los 4 grupos de concentración de ferritina, sugiere que la hipovolemia no es la causa de la diferencia en las concentraciones de ferritina durante el tercer trimestre del embarazo, debido a que los depósitos de hierro están disminuidos por las necesidades fetoplacentarias y la expansión de glóbulos rojos maternos4. También se han descrito relaciones entre las bajas concentraciones de ferritina materna, como medida de anemia por deficiencia de hierro, y alteraciones del crecimiento fetal21,24. Por lo tanto, el hecho que existan casos de bajas concentraciones de ferritina en el tercer trimestre podría indicar una mala nutrición materna16.
En estudios previos, la hipertensión materna, en especial la preeclampsia, se ha relacionado en forma significativa con la restricción del crecimiento intrauterino del feto25,26. Entman et al.8 demostraron que las mujeres con preeclampsia tienen concentraciones elevadas de ferritina. El hecho que las alteraciones del crecimiento fetal son comunes en pacientes con preeclampsia26 y en embarazadas sin hipertensión ni proteinuria con altas concentraciones de ferritina, como se observó en la presente investigación, sugiere que las alteraciones de crecimiento fetal podrían ser el final de una secuencia que involucra a las altas concentraciones de ferritina materna.
Aunque el mecanismo subyacente de la alteración del metabolismo de la ferritina en pacientes que presentan alteraciones en el crecimiento fetal aún no ha sido claramente comprendido, la asociación entre las elevadas concentraciones maternas de ferritina y la disminución del peso de los recién nacidos a término podría servir como un indicador de alteración del crecimiento fetal, o de restricción de crecimiento intrauterino del feto, al inicio del tercer trimestre del embarazo.
ConclusionesSe concluye que existe una relación negativa y significativa de las concentraciones de ferritina plasmática materna en el tercer trimestre del embarazo con el crecimiento fetal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.