Los espermatozoides viajan por el tracto reproductivo femenino en búsqueda del oocito con el fin de fecundarlo. En su recorrido interactúan con diferentes sustancias y microorganismos que alteran la biología espermática, interfiriendo con el éxito reproductivo. El objetivo de este trabajo fue evaluar la capacidad que tienen los espermatozoides humanos de interactuar y transportar las bacterias Escherichia coli (E. coli) y Enterococcus faecalis (E. faecalis).
Materiales y métodosSe incubaron espermatozoides humanos seleccionados de muestras de semen de voluntarios aparentemente sanos con concentraciones crecientes de E. coli y E. faecalis durante una hora. Posteriormente se realizaron cultivos cuantitativos en los agares MacConckey y chocolate de la mezcla bacterias-espermatozoides con y sin lavados o tratamiento postinfección con tripsina.
ResultadosLos espermatozoides interactúan y transportan las bacterias. En conjunto, los lavados y el tratamiento con tripsina causan una disminución estadísticamente significativa de unidades formadoras de colonia para E. faecalis ATCC 29212, E. faecalis ATCC 51299 y E. coli ATCC 25922.
ConclusiónLos espermatozoides humanos crean interacciones fuertes con las bacterias E. coli y E. faecalis favoreciendo su difusión en el tracto reproductivo femenino.
Sperm travel through female reproductive tract seeking an oocyte to fertilise. During this journey, the sperm may interact with various substances and microorganisms that change its biology, interfering with reproductive success. The aim of this study was to evaluate the ability of human sperm to interact with and carry the bacteria Escherichia coli (E. coli) and Enterococcus faecalis (E. faecalis).
Materials and methodsHuman sperm selected from semen samples of apparently healthy volunteers were incubated with increasing concentrations of E. coli and E. faecalis for one hour. Subsequently, quantitative cultures of the bacteria-sperm mixture were grown in MacConckey and chocolate agars with and without washing or post-infection treatment with trypsin.
ResultsSperm interact and carry bacteria. Washes and trypsin treatment together cause a statistically significant reduction in colony-forming units for E. faecalis ATCC 29212, E. faecalis ATCC 51299 and E. coli ATCC 25922.
ConclusionHuman sperm create strong interactions with E. coli and E. faecalis bacteria, promoting their dissemination in the female reproductive tract.
La interacción con el ambiente incluye el contacto permanente con microorganismos, relación de predominio microbiano, debido a que en una persona promedio existen al menos 10 veces más células microbianas que humanas1. En la mayoría de los casos esta interacción es benéfica, sin embargo existen ocasiones en las cuales su desequilibrio ocasiona infecciones como es el caso del tracto reproductivo donde se incluyen las infecciones endógenas, iatrogénicas y de transmisión sexual2.
Las infecciones de transmisión sexual son un grupo de infecciones transmitidas de individuo a individuo por medio de las relaciones sexuales y pueden ser ocasionadas por bacterias3, virus4,5 hongos e incluso parásitos6. Se encuentran entre las diez primeras causas de infecciones de los adultos jóvenes en los países desarrollados y en el mundo es la segunda causa de infección en mujeres adultas7, con amplias consecuencias sobre la salud como la enfermedad pélvica inflamatoria, muerte fetal, disfunción sexual e infertilidad, incrementando los costos en salud, con altas consecuencias sociales, económicas y personales3,4.
Además de las infecciones de transmisión sexual, las infecciones del tracto urogenital son la causa más común de infecciones bacterianas y son responsables de una alta morbilidad5, siendo E. coli el principal agente etiológico8 y este microorganismo también es descrito por diferentes autores como el más prevalente en las infecciones prostáticas5,9,10. Aunque en los hombres las infecciones del tracto urogenital generalmente son asintomáticas y se caracterizan por afectar sitios anatómicos del tracto reproductivo, como las vías urinarias, los testículos, el epidídimo y las glándulas sexuales accesorias6, un estudio llevado a cabo en nuestro grupo reportó que el semen puede albergar microorganismos como E. coli, E. faecalis, Morganella morganii, Staphylococcus coagulasa negativo, Klebsiella pneumoniae y microbiota mixta, lo que indica que el semen puede ser un reservorio de bacterias, especialmente las denominadas enterobacterias5.
Por otro lado, los espermatozoides, el mayor componente celular del eyaculado, son células altamente especializadas cuya principal función es transportar el material genético paterno hasta el oocito en el tracto reproductivo femenino (TRF)3 y durante su viaje, pueden interactuar con algunas sustancias, células epiteliales y microorganismos que aprovechan la movilidad de estas células para colonizar algunos lugares del TRF que en condiciones normales deberían estar libres de patógenos3. Adicionalmente, debido a los múltiples orígenes de bacterias en el tracto urogenital, se presume que los espermatozoides durante su desarrollo, maduración y transporte, interactúan con diferentes especies bacterianas, permitiendo su difusión a otros organismos mediante el contacto sexual11. Es así como las infecciones provenientes del tracto urinario podrían tener un papel importante en el proceso reproductivo. Por ejemplo, las enterobacterias E. coli y E. faecalis, patógenos encontrados en las infecciones del tracto urogenital, interactúan con los espermatozoides12, promoviendo procesos inflamatorios en los cuales se liberan especies reactivas del oxígeno desencadenando efectos deletéreos sobre el espermatozoide13–15 y sobre otros parámetros espermáticos16.
Estudios previos del Grupo Reproducción, han demostrado que el espermatozoide tiene la capacidad de interactuar con el virus de la inmunodeficiencia humana (VIH) in vitro4, sugiriendo que esta célula no solo es importante en la transmisión horizontal sino también vertical, del padre al hijo4,17,18. Por lo tanto, el siguiente paso fue postular que los espermatozoides sirven como medio de transmisión y difusión de infecciones bacterianas, resaltando el papel que cumple el hombre y la célula espermática en la transmisión de microorganismo por vía sexual. Por lo tanto, el objetivo del presente trabajo fue evaluar la capacidad de interacción y transporte de las bacterias E. coli y E. faecalis con los espermatozoides humanos in vitro.
Material y métodosBacteriasSe emplearon las cepas: i) E. coli sensible (ATCC 25922) y resistente (ATCC 35218) a ampicilina/sulbactam y piperacilina/tazobactam; ii) E. faecalis sensible (ATCC 29212) y resistente (ATCC 51299) a gentamicina y estreptomicina de alto nivel. Los cultivos se realizaron en agar chocolate y MacConkey (Merck-Chemicals, Alemania). Los inóculos bacterianos de 105, 103, 101 unidades formadoras de colonias –UFC– se prepararon a partir de la primera dilución de 0,5 McFarland (1,5×108 –UFC– por mL, DensiCHEK™ Estados Unidos).
Muestras de semenLas muestras de semen fueron donadas por voluntarios aparentemente sanos, mayores de 18 años, mediante masturbación después de una abstinencia sexual de 3 a 5 días, con parámetros seminales iguales o superiores a los límites inferiores de referencia establecidos por la Organización Mundial de la Salud en 201019. A cada muestra de semen se le determinaron los parámetros seminales convencionales: volumen, movilidad, viabilidad siguiendo los lineamientos de la Organización Mundial de la Salud19,20, la concentración fue determinada empleando la cámara de Makler (Sefi-Medical Instruments, Israel)21.
Posteriormente, se realizó la selección de los espermatozoides móviles empleando la técnica de gradiente (PureSperm® Nidacon, Gothenburg, Suecia). Brevemente, en un tubo cónico de 15mL se adicionaron 300μL de la fase más densa (PureSperm® 80), 300μL de la fase menos densa (PureSperm® 40) y 600μL de semen sobre ambas fases, se centrifugó durante 12 min a 2.000g. Finalmente, se retiró el sobrenadante y el botón de espermatozoides móviles fue resuspendido en 1mL de medio HAM-F12 (GIBCO®, Grand Island, NY, EE. UU.), centrifugando durante 6 min a 2.000g, para finalmente determinar la concentración espermática.
Interacción entre espermatozoides y bacterias in vitroUn millón de espermatozoides se incubó con cada concentración de bacterias (101, 103 y 105UFC) durante una hora. Posteriormente se centrifugaron a 2.000g/5 min, el botón fue resuspendido en 50μL de PBS y homogenizado mediante vortex (Labnet, Estados Unidos), repitiendo este procedimiento cinco veces. Finalmente 10μL fueron sembrados cuantitativamente en agar MacConkey o chocolate e incubados a 37°C/24 h. La muestra inicial de espermatozoides (10μL) se sembró como control de los microorganismos existentes en la muestra.
Adicionalmente, se realizaron ensayos incubando la solución de los espermatozoides y bacterias con tripsina (Gibco®, Grand Island, New York) por 15 min/37°C, en relación 1:1 v/v.
Análisis estadísticoPara el análisis de los datos obtenidos se realizó una prueba no paramétrica: un test de Friedman y un postest de Dunns, empleando el programa estadístico GraphPad Prism 6 GraphPad Prism 6 (Graphpad, CA, EE. UU.). Para todos los casos se utilizó un nivel de significación de p< 0,05.
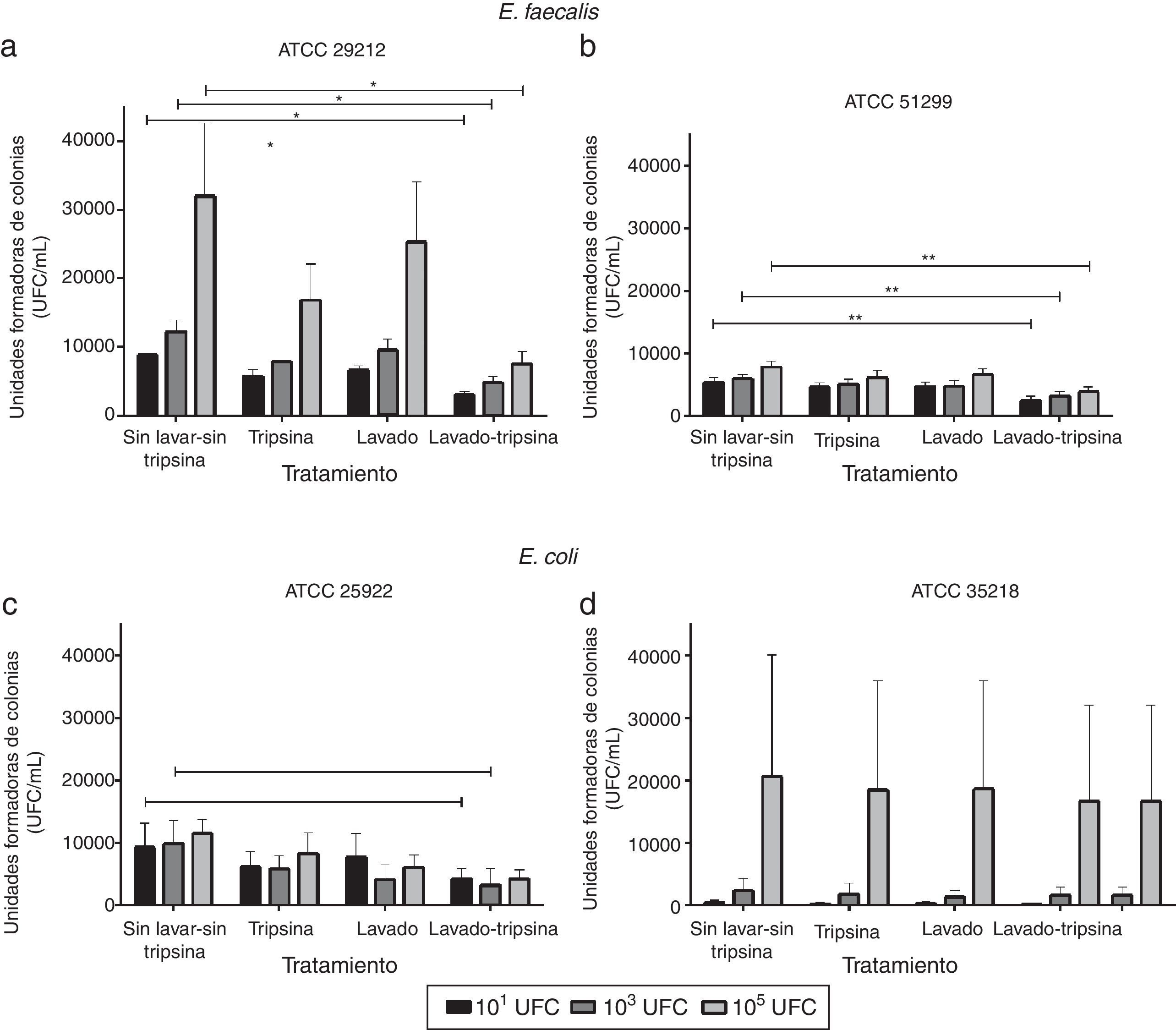
ResultadosLos espermatozoides humanos interactúan in vitro con las bacterias (E. coli y E. faecalis) y logran transportarlas al medio de cultivo (fig. 1). Adicionalmente, el tratamiento con tripsina y los lavados disminuyen el crecimiento bacteriano. Se observó que los lavados y el tratamiento con tripsina en conjunto causan una disminución estadísticamente significativa de UFC frente al control (muestras sin lavado y sin tripsina). Con la cepa de E. faecalis ATCC 29212, se observó una reducción del 65,9, 64,0 y del 82,5% en el recuento de las UFC para las concentraciones 101UFC, 103UFC y 105UFC, respectivamente frente al control; p<0,05. Con la cepa E. faecalis 51299 las reducciones observadas fueron del 59,4, 54,4 y del 56,0% para las concentraciones 101UFC, 103UFC y 105UFC, respectivamente; p<0,01. Finalmente, con la cepa E. coli 25922 las reducciones en el conteo de UFC después de los tratamientos con lavados y tripsina fueron de 58,2 y de 95,2% para las concentraciones 101UFC y 103UFC, respectivamente, p<0,05.
Evaluación de la interacción espermatozoide-bacteria y el efecto de los tratamientos aplicados.
a: E. faecalis ATCC 29212; b: E. faecalis ATCC 51299; c: E. coli ATCC 25922 d: E. coli ATCC 35218.
* p< 0,05; ** p<0,01. E. coli y E. faecalis disminuyen su crecimiento de forma estadísticamente significativa con respecto al control (muestras sin lavado y sin tripsina) tras la aplicación de los diferentes tratamientos.
Gracias a diversos estudios se ha observado que la célula espermática cuenta con una amplia capacidad de interacción con diferentes microorganismos y sustancias a través de su recorrido por el tracto reproductivo masculino y femenino4–6,22, facilitando su transmisión y generando diferentes procesos infecciosos e inflamatorios5,8,23. Adicionalmente, teniendo en cuenta los resultados previos4–6,9,13,18 y los obtenidos en el presente estudio, se puede afirmar que los espermatozoides interactúan con diferentes enterobacterias, por lo cual participarían como vectores de transmisión de infecciones hacia el TRF.
En este estudio se analizó la interacción de los espermatozoides seleccionados empleando la técnica de gradiente, con las bacterias E. coli y E. faecalis. La selección con gradiente facilita la obtención de espermatozoides móviles, pero se observó que no elimina los microorganismos unidos a estas células espermáticas, debido a que se encontró que muestras de espermatozoides seleccionados no incubados con las cepas bacterianas empleadas, presentaban crecimiento bacteriano en el cultivo (datos no mostrados), por lo que estas muestras eran excluidas del estudio. Datos similares se obtienen con otras técnicas de selección por migración como el Swim up24, con las cuales no se logra una eliminación completa de los microorganismos presentes en la muestra, aspecto importante especialmente en lo que refiere a las técnicas de reproducción asistida donde se debe tener mayor cuidado y vigilancia para evitar la transmisión de microorganismos que afectarían el éxito reproductivo.
En este estudio observamos que los tratamientos en conjunto de lavados y tripsina disminuían de forma estadísticamente significativa la interacción bacterias-espermatozoides. La tripsina es una enzima peptidasa que rompe los enlaces peptídicos de la membrana espermática principalmente en las cabezas de los espermatozoides, la debilita y por tanto modifica su interacción con las bacterias empleadas en el estudio, tal como lo refiere Gerald et al.25.
En estudios previos del grupo evaluando la interacción del espermatozoide con el VIH4, se evidenció un incremento en la difusión del virus a través de los espermatozoides después del tratamiento con tripsina. El hecho de encontrar una interacción mayor del virus del VIH con los espermatozoides tratados con tripsina en comparación con los no tratados, sugiere un efecto potenciador de esta enzima en la unión del virus y por lo tanto de su difusión. Sin embargo, con los resultados obtenidos en el presente ensayo, se pudo observar que la tripsina tiene un efecto contrario en la interacción espermatozoide-bacteria, su aplicación disminuyó el crecimiento bacteriano en los cultivos probablemente por el debilitamiento de la membrana espermática, lo que impide que las bacterias se adhieran adecuadamente al espermatozoide.
Similar a lo encontrado en estudios con Neisseria gonorrhoeae (N. gonorrhoeae) tratada con tripsina, se encontró que esta molécula disminuye las interacciones espermatozoide-bacteria, pero no las elimina completamente, causando debilitamiento de la membrana y eliminación de estructuras como el pili, el cual facilita la adhesión bacteriana26. Teniendo en cuenta que no todas las bacterias cuentan con dichas estructuras y considerando la existencia de otros medios de adhesión, se puede explicar la presencia de crecimiento bacteriano postratamiento, al igual que N. gonorrhoeae, cuya cepa con ausencia de pili al ser expuesta a la acción de la tripsina, no presentó una disminución significativa en el crecimiento bacteriano26.
Gracias a las estructuras de adherencia, las bacterias podrían continuar unidas a los espermatozoides a pesar de tratamientos para debilitar la membrana espermática con la aplicación de tripsina, lo que sugiere que la unión de los espermatozoides con diferentes microorganismos podría estar mediada también por receptores presentes en la membrana espermática como el caso del virus del VIH, el cual interactúa con el receptor de manosa27, sin embargo, no se puede descartar que E. faecalis se adhiera a los espermatozoides humanos a través de estructuras como el pili28. E. coli puede emplear para su interacción con los espermatozoides al receptor de manosa9, o estructuras como el pili28, por lo que queda aún por definir cuál de las estructuras es de mayor relevancia para esta interacción, si hay otras estructuras involucradas o si hay varias estructuras que en conjunto sean responsables de esta unión; por lo que la profundización sobre el conocimiento de estas interacciones ayudaría a implementar técnicas de eliminación de microorganismos especialmente en procedimientos de reproducción asistida, además de contribuir a limitar la difusión de infecciones a través de los espermatozoides, esencialmente de los microorganismos responsables de la infección de transmisión sexual.
En conclusión, los espermatozoides interactúan con las bacterias E. coli y E. faecalis seguramente mediante receptores de la membrana espermática y esta interacción no es eliminada mediante los tratamientos, por lo tanto los espermatozoides son un vector importante en la transmisión de procesos infecciosos e inflamatorios hacia el TRF18.
FinanciaciónEste trabajo fue financiado por Colciencias (111556933373) y por la Estrategia de Sostenibilidad, Grupo Reproducción, de la Universidad de Antioquia. LSG es joven investigadora de la Universidad de Antioquia (2014-2015).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la bacterióloga Mariluz Giraldo por su ayuda técnica.