INTRODUCCIÓN
El virus del papiloma humano (VPH) se asocia sin ninguna duda a carcinoma de cérvix y también a otros procesos malignos del aparato genital masculino y femenino. Es un virus pequeño con doble cadena de ácido desoxirribonucleico (ADN) que pertenece a la familia Papovaviridae. El genoma es muy complejo, y se distinguen dos regiones distintas de lectura abiertas (open reading frames), regiones de expresión temprana y regiones de expresión tardía. Entre estas últimas, las más importantes son las secuencias que codifican las proteínas E6 y E7, ya que se ha comprobado que son proteínas oncogénicas que controlan la proliferación y transformación y se expresan en la mayoría de los procesos malignos asociados al VPH.
Los VPH con capacidad para infectar las mucosas del aparato genital se han clasificado en dos grupos, según el riesgo de producir cáncer de cérvix. Según Muñoz et al1, los genotipos incluidos en los VPH de alto riesgo son los siguientes: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 y 82. Los genotipos con bajo riesgo son: 6, 11, 40, 42, 43, 44, 54, 61, 70, 72 y 81. Hay tres genotipos, 26, 53 y 66, que se han clasificado como de probable alto riesgo.
Hay numerosos estudios que relacionan el cáncer de cérvix con la infección persistente de VPH de alto riesgo e incluso algunos autores han demostrado que las pruebas de biología molecular para detectar genotipos de alto riesgo en muestras cervicales tienen mayor sensibilidad que la prueba de Papanicolaou2 para el diagnóstico de una CIN III (neoplasia cervical intraepitelial de grado 3) y cáncer de cérvix. También el valor predictivo negativo (VPN) de las pruebas de biología molecular (la proporción de mujeres que teniendo estas pruebas negativas no tienen riesgo de experimentar carcinoma de cérvix) es mayor que el de la citología clásica, puesto que el VPN está cercano al 100%. Por esto, la detección de VPH de alto riesgo con pruebas de biología molecular en muestras de cérvix es una técnica indispensable que debe incluirse de rutina junto a la citología cervicovaginal en la prevención, el diagnóstico y el tratamiento del cáncer de cérvix en mujeres mayores de 30 años3.
El diagnóstico de infección por VPH, desde el punto de vista virológico, se hace mediante técnicas de biología molecular. Las más utilizadas son la captura de híbridos (HC) y la reacción en cadena de la polimerasa (PCR). La primera es la única que, hasta ahora, la Food and Drug Administration de Estados Unidos ha aprobado. Ambas técnicas son laboriosas, caras, requieren medios técnicos adecuados y experiencia por parte del personal para su realización e interpretación.
El objetivo del presente estudio es valorar las técnicas de detección de VPH disponibles en este momento (HC y PCR) en mujeres que presentan resultados anormales en la citología cervicovaginal y estudiar la prevalencia de los genotipos de VPH presentes en las muestras cervicales.
MATERIAL Y MÉTODOS
Desde octubre de 2003 hasta junio de 2004 se han estudiado 342 muestras cervicales pertenecientes a 171 mujeres, atendidas en la consulta de Ginecología del Hospital Ramón y Cajal, que tenían resultados citológicos anormales según la clasificación de Bethesda4. En el servicio de microbiología se recibieron dos muestras de cada paciente tomadas el mismo día, una en torunda seca (Genomica, SA, Madrid, España) para detección de VPH por PCR, y otra en cepillo cervical (Digene Cervical Sampler®, Digene Corporation, Gaithersburg, Estados Unidos) para detección de VPH por HC. Ambas muestras se conservaron según las instrucciones de los fabricantes hasta el momento de realizar las pruebas en el servicio de microbiología.
La técnica de PCR (PVHfast®, Genomica, SA) se basa en la amplificación de un fragmento de ADN de 450 pares de bases de la región L1 del VPH que posteriormente se digiere con dos enzimas de restricción, RSA1 y RSA2 según protocolo. La visualización del producto amplificado se realizó por electroforesis en gel de azarosa, según las instrucciones del fabricante. Los resultados se interpretaron utilizando plantillas para ambas enzimas. La técnica determina el genotipo concreto que produce la infección, y a veces se encuentran infecciones mixtas. Sin embargo, en algunos casos los genotipos presentes en la muestra no están todavía identificados convenientemente y se han señalado como «no tipables».
La prueba de HC (Hybrid Capture®, Digene Corporation, Gaithersburg, Estados Unidos) es un ensayo de captura de anticuerpos con hibridación y amplificación de la señal, en la que el VPH se detecta por quimioluminiscencia en microplaca. Los resultados se expresan como presencia de VPH-bajo riesgo (incluye los genotipos 6, 11, 42, 43 y 44) o presencia de VPH-alto riesgo (genotipos 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 y 68). En nuestro estudio sólo se han considerado las muestras con resultado positivo a la sonda que contenía genotipos de alto riesgo. En la realización de la prueba se siguieron las instrucciones del fabricante. La concordancia entre las dos técnicas se midió con el índice kappa.5
RESULTADOS
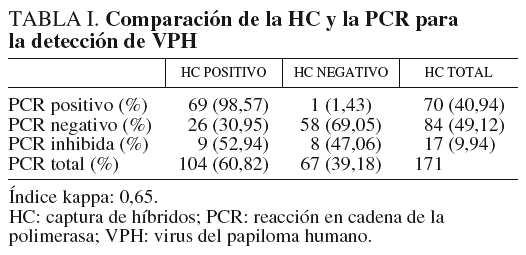
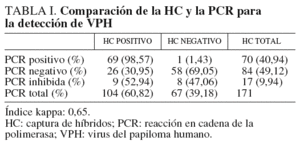
Los resultados de la detección de VPH de las 171 pacientes estudiadas se muestran en la tabla I. En total, 70 (40,94%) muestras resultaron positivas por la PCR. Diecisiete muestras se inhibieron y no se pudo obtener ningún resultado, probablemente debido a que la toma de la muestra no era adecuada (presencia de sangre u otras sustancias inhibidoras de la reacción de la PCR). De estas 17 muestras, 9 (52,94%) resultaron positivas en la HC y 8 (47,06%) resultaron negativas. Cincuenta y ocho (69,05%) muestras resultaron negativas con las dos técnicas y hubo discordancia en los resultados en 27 pacientes (26 muestras positivas por HC resultaron negativas por PCR y sólo una fue positiva por PCR, con resultado negativo en la HC).
Los genotipos más frecuentemente encontrados en 63 infecciones únicas se muestran en la tabla II. El genotipo prevalente fue el 16/82 y se encuentra en 20 (31,75%) de las 70 muestras positivas, seguido por el genotipo 53 presente en 6 (9,52%) muestras. En 17 muestras no se pudo genotipar el VPH debido al escaso ADN que se obtuvo o que el amplificado mostraba patrones distintos a los indicados en el esquema de identificación suministrado por el fabricante. También se encontraron 7 infecciones mixtas (tabla III), que representan el 10% de las pacientes con resultado positivo para la presencia del VPH, causadas por los genotipos 66 más 59, 53 más 16/82 en dos casos, 58 más 6 y 53, 58 más 83, 52 más 91 y 18 más 56. El índice kappa obtenido, en el que se excluyen las 17 muestras inhibidas en la reacción de PCR, fue de 0,65, el cual se considera un grado de acuerdo sustancial6.
DISCUSION
El carcinoma de cérvix ocupa el segundo lugar en frecuencia entre los procesos neoplásicos que afectan a mujeres y el primero en los países subdesarrollados7. Un dato muy importante a tener en cuenta es que el 50% de los carcinomas de cérvix se presentan en mujeres que no han participado en programas de cribado8. Por lo tanto, es importante que cada país tenga un plan de prevención de cáncer de cérvix con un calendario de cribados que incluya al mayor número de mujeres posible en edad de riesgo.
Numerosos estudios confirman que la infección persistente del cérvix con algún genotipo de VPH clasificado como de alto riesgo es necesaria para el desarrollo del cáncer cervical, aunque también intervienen otros factores considerados de riesgo como la conducta sexual de la mujer, uso de tabaco, contraceptivos, etc. Por otra parte, también hay que considerar que en mujeres sexualmente activas de todas las edades son muy frecuentes las infecciones por VPH, que la gran mayoría de las veces producen infecciones benignas. Según estudios de prevalencia realizados recientemente, muchas mujeres están infectadas por algún genotipo o varios de VPH-alto riesgo (aproximadamente entre un 5-15%)3 pero afortunadamente sólo en un número bajo de ellas, la infección por VPH será persistente y algunas de éstas desarrollarán lesiones precancerosas en cérvix. Es imprescindible identificar a este «grupo de riesgo» entre las mujeres infectadas para que reciban un tratamiento adecuado y evitar el desarrollo del cáncer cervical.
Hasta ahora la citología cervicovaginal tradicional o prueba de Papanicolaou se consideraba como la prueba de laboratorio principal para detectar lesiones que pueden derivar en carcinoma (ASCUS, LSIL y HSIL según la clasificación de Bethesda4). Recientemente se ha añadido la detección de VPH en muestras cervicales por su alto valor predictivo negativo, cerca del 100% y superior al de la citología clásica, aunque una desventaja importante es el bajo valor predictivo positivo. Incluso algunos autores consideran la detección de un VPH-alto riesgo como una prueba más sensible que la citología clásica para detectar lesiones precancerosas, y se propone que se utilice para el cribado primario y la citología se reserva para las mujeres en las que se ha detectado infección por un VPH-alto riesgo2.
Sin embargo, actualmente las pruebas para la detección del VPH en cérvix tienen varios problemas y no se pueden utilizar como cribado. Son laboriosas, caras, requieren medios técnicos especiales y necesitan personal con experiencia en su realización e interpretación. Las más utilizadas son la HC y la PCR. Las sensibilidades de ambas técnicas son diferentes. Aunque según algunos autores9 la sensibilidad de la PCR es superior a la de la HC, esta sensibilidad depende en parte de varios factores relacionados con la realización de la técnica, como los cebadores utilizados, la eficacia en recuperar todo el ADN de la muestra, la longitud del fragmento de ADN amplificado, la sensibilidad del método de detección, etc. También depende de la calidad de la muestra cervical. Ésta no debe contener sangre ni otras sustancias que puedan inhibir las polimerasas y debe haber suficientes células para que el ADN esté en cantidad suficiente y en buenas condiciones. En nuestro estudio, la HC se mostró más sensible que la PCR, 104 muestras resultaron positivas por la técnica de HC frente a 70 por la PCR. Hay que considerar que un alto número de estas (17, 9,94%), se inhibieron y no fue posible obtener ningún resultado, quizá por presencia de hemoglobina o mala conservación de la muestra por retraso en llegar al laboratorio. De estas, 9 resultaron positivas por HC. Solamente una muestra negativa por HC resultó positiva por PCR, pero no fue posible genotipar el VPH, ya que las bandas obtenidas con las enzimas de restricción no correspondían a ningún genotipo identificado hasta el momento.
En cuanto a la prevalencia, según nuestros datos, el genotipo más frecuentemente encontrado en las mujeres con citología cervicovaginal alterada fue el 16/82 (20 muestras). La técnica que hemos utilizado no permite distinguir cuál de los dos genotipos es el que está presente. Muñoz et al1 también reconocen al genotipo 16 como el primero en prevalencia en mujeres que presentan cáncer cervical de células escamosas. Sin embargo, la presencia del genotipo 53 puede plantear algunas dudas. En nuestro estudio es el segundo en prevalencia y está presente en 6 pacientes como genotipo único y en 2 infecciones mixtas, pero en el estudio realizado por Muñoz et al1 solamente aparece en un caso asociado a cáncer cervical y en ninguna mujer del grupo control. Por esto, los autores proponen que este genotipo se clasifique como «probablemente de alto riesgo». No está incluido en ninguna de las sondas de hibridación de la técnica HC, pero curiosamente todas las muestras que presentaban el genotipo 53 por la técnica de PCR resultaron positivas por HC para la sonda de alto riesgo. Está descrito que puede haber reacciones cruzadas con tipos de VPH no incluidos en las sondas7. Sería importante conocer con exactitud la relación del genotipo 53 con el cáncer de cérvix por la conveniencia de detectarlo y, por tanto, incluirlo en las sondas de alto riesgo en la HC y por la posibilidad de introducirlo en las futuras vacunas de VPH. Cabe destacar que 17 (9,94%) muestras resultaron positivas por PCR, pero fueron no tipables, es decir, no fue posible identificar el genotipo infectante, quizá debido a la escasa cantidad de ADN o a la presencia de algún VPH aún no clasificado.
En conclusión, las técnicas de biología molecular utilizadas en nuestro estudio para la detección de VPH en muestras cervicales, PCR y HC, tienen un alto grado de coherencia según el índice kappa obtenido (0,65). Sin embargo cada una de las técnicas tiene sus ventajas e inconvenientes. La HC detecta la presencia de genotipos de alto riesgo sin permitir conocer el genotipo infectante. Esta información es suficiente en la mayoría de los casos para el cribado de las mujeres en riesgo de presentar cáncer de cérvix. La PCR identifica el genotipo exacto y detecta las infecciones mixtas, lo que permite realizar estudios epidemiológicos y de prevalencia, aspecto importante en la inclusión de determinados genotipos en las futuras vacunas. En cuanto a prevalencia, el genotipo predominante en las mujeres con resultados citológicos alterados es el 16/82, y el segundo lugar lo ocupa el genotipo 53.
Es necesario realizar más estudios para establecer definitivamente el papel que tiene la detección del VPH en la prevención del cáncer de cérvix y considerar la existencia de otros factores que pudieran influir, como la presencia de infecciones mixtas o la carga viral. También es muy importante encontrar la prueba de laboratorio adecuada que identifique a las mujeres con riesgo de desarrollar lesiones precancerosas teniendo en cuenta el coste económico, la facilidad y la rapidez en su realización y, sobre todo, con el valor predictivo positivo y negativo adecuado para identificar solamente a las mujeres en riesgo entre todas las que están infectadas transitoriamente por el VPH.