INTRODUCCIÓN
El factor VII de la coagulación fue descrito por Koller en 1951 como acelerador de la formación de trombina. Ha recibido muchos nombres1: autoprotrombina I, cotromboplastina, cofactor V, protrombinógeno, factor estable, acelerador de la conversión en el suero de protrombina y convertina. Es una glucoproteína sintetizada en el hígado, en el hepatocito, de peso molecular de 50 KDa y un factor dependiente de la vitami na K. Su concentración en sangre es de 10 nmol/l (0,5 µg/ml), y es esencial en la vía extrínseca de la coagulación2. El gen del factor VII se encuentra en el brazo largo del cromosoma 13. Hay polimorfismos del gen, causales del 30% de la variación en los valores de factor VII circulantes. No hay correlación entre el déficit de factor VII y el riesgo de hemorragia, pero sí con el riesgo de trombosis.
El déficit de factor VII es un raro desorden de la coagulación heredado. Alexander et al lo describieron, en 1951, en un niño con diátesis hemorrágica congénita, con tiempo de protrombina (TP) prolongado. Lo llamaron hipoproconvertinemia. La etiología es síntesis de factor VII reducida o ausente. El 20% de los pacientes tienen concentraciones circulantes de factor VII, pero con disminución de la actividad funcional3. La incidencia de enfermedad congénita es muy rara; se estima que ocurre en 1/500.000 personas. La herencia es autosómica recesiva; el heterocigoto es asintomático y el homocigoto tiene los síntomas de sangrado. Hay aumento con matrimonios consanguíneos.
En la clínica, el sangrado, de gravedad variable, no tiene correlación con los valores del factor VII: puede haber concentración normal y sangrado, y sin síntomas con niveles muy bajos. Hay influencias ambientales2: edad, sexo, dieta grasa, triglicéridos y colesterol, obesidad, diabetes. Con < 10 U/dl, hay epistaxis y menorragias, sangrado postoperatorio y posparto y en la cavidad oral. Menos frecuente es la presencia de hemartros y sangrado muscular, así como hematomas, hematuria, hemorragias del tracto gastrointestinal y gingival, hematoma retroperitoneal y hemorragia cerebral fatal3. La muerte se produce por embolia pulmonar o trombosis de la vena cava inferior. Pero sólo en menos del 2% hay riesgo de sangrado alto. En el diagnóstico: TP prolongado, tiempo de tromboplastina parcial activada (TTPA) normal y ensayo específico de factor VII disminuido.
El diagnóstico diferencial se establece con causas que disminuyen el factor VII, como enfermedades hepáticas, intoxicación por warfarina, disminución de vitamina K secundaria a hipoabsorción; la homocistinuria; asociado al síndrome de Gilbert y al síndrome de Dubin-Johnson; inhibidores adquiridos del factor VII (pero son raros).
El tratamiento con un valor de 10-15 U/dl es hemostático, y más de cara a la cirugía. El factor VII tiene una vida media de 3-4 h. El tratamiento con 12-24 h es suficiente. No hay respuesta a la vitamina K. La vida media es corta, especialmente en niños y en embarazadas; en éstas hay que suministrar infusión continua.
En el manejo se han utilizado2: inhibidores de la fibrinólisis; plasma fresco congelado (puede producir riesgo de sobrehidratación y de transmisión de virus); concentrado de factor IX (complejo de protrombina), que aumenta la trombosis arterial y venosa. No debe darse en enfermedades hepáticas, traumas severos y neonatos. Concentrado de factor VII, que tiene una vida media corta y coste elevado (8-40 U/kg/4-5 h); rF VIIa recombinante (NOVO-SEVEN), que es de elección (20-25 µg/kg/2-3 h en el postoperatorio y luego, cada 3-8 h).
Los portadores de déficit de factor VII pueden estar sintomáticos, pero no siempre. Hay que solicitar4 tiempo de sangrado, TP, TTPA, factor VII y estudio hepático: transaminasas GOT y GPT, fosfatasas alcalinas (FA), bilirrubina y albúmina.
En este trabajo presentamos un caso de déficit de factor VII que cursó con hematoma abdominal y pélvico postlaparoscópico por quiste anexial, y que no necesitó tratamiento específico.
CASO CLÍNICO
Mujer de 38 años, G2P1C1 + ET. Menarquía, 12 años. Fórmula menstrual de 4/28. Antecedentes sin interés. En octubre de 1997, en una ecografía ginecológica se halló un folículo quístico en el ovario izquierdo (OI) de 32* 26 mm. Tomó anticoncepción hormonal oral (ACHO) 3 meses y en una nueva ecografía al año siguiente el quiste en OI era de 43* 30 mm. El 15 de junio de 1999, en la ecografía se apreció un quiste simple en OI de 34 mm. El 23 de junio de ese mismo año se realizó punción transvaginal del quiste, y se obtuvo 20 ml de líquido claro, que en el estudio citológico fue un líquido acelular. El 12 de enero de 2000, en la ecografía se apreciaba un quiste simple de 39 mm. Se solicitó el preoperatorio para laparoscopia.
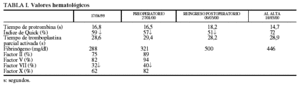
En la analítica de hematología anterior (17-6-99) destacaba un índice de Quick (IQ) disminuido (59%) (normal, 70-130) y un factor VII disminuido, del 32% (tabla I). En la analítica preoperatoria (27-1-2000) tenía IQ del 57%. Hematología no lo consideró un problema, ya que un déficit moderado de factor VII a nivel hemostático no precisa reparación con vitami na K.
El 24 de enero de 2000 se practicó laparoscopia quirúrgica y exéresis de un quiste de paraovario izquierdo de 4 cm. También se vieron puntos endometriósicos en útero sacros. Los ovarios eran normales. Se libera una adherencia de la trompa derecha a la pared pélvica. Se le da el alta al día siguiente.
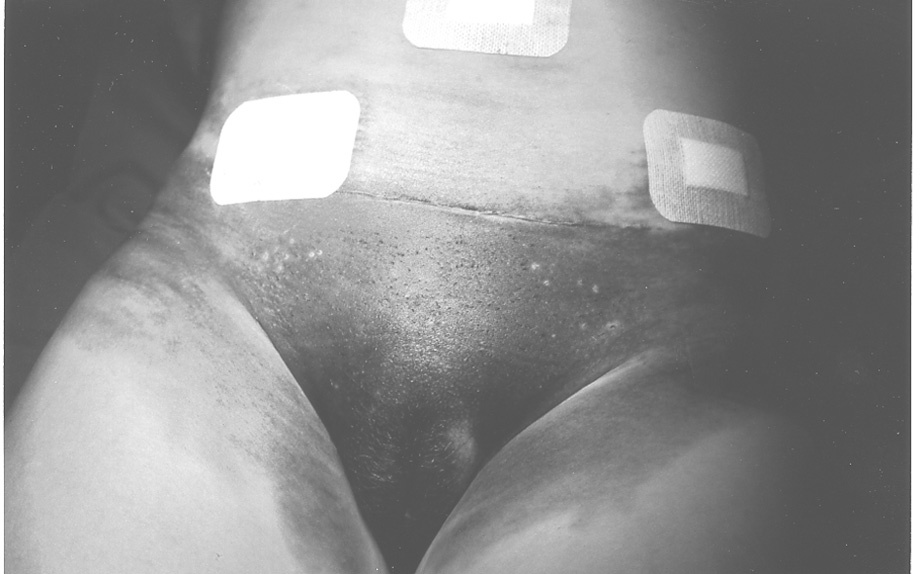
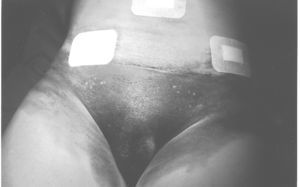
El 7 de marzo de 2000 reingresa de urgencia por algias intensas periumbilicales (fig. 1). La ecografía y la tomografía computarizada (TC) evidencian un hematoma intraperitoneal de 11,6 * 6,1 cm. Se traslada a quirófano, donde se practica una incisión periumbilical con drenaje del hematoma, de aproximadamente 150 ml, mantenido por el epiplón. No había punto sangrante.
Fig. 1. Hematoma abdominal poslaparoscópico.
En la analítica (9-3-2000) se apreció que tenía IQ de 51%, disminuido. El tiempo de hemorragia (Ivy) fue de 9 min (normal, 4-10). Se solicitó consulta a hematología por un hematoma subcutáneo a las 48 h de la cirugía y un hematoma organizado intraperitoneal, que se drenó 15 días después de la intervención. Se produjo una hemorragia por una grapa a las 24 h de la reintervención y por el punto que sustituyó a la grapa. Ambas hemorragias cedieron a la compresión.
El tiempo de sangría fue de 9 min. Se descartó un defecto de función plaquetaria. Podría ser un déficit de factor XIII, muy raro, que produce hemorragias tardías. No hay disminución de fibrinógeno y el TTPA es normal. No hay problema de fibrinólisis aumentada. El plan de actuación sería no intervenir si no vuelve a sangrar, y compresión local y transfusión de plasma (2 U), si sangra. Si el cuadro cede, hay que esperar, y si persiste, realizar valoración quirúrgica.
El 10 de marzo de 2000 se le dio el alta, ya recu-perada, con hematocrito del 30%, y con tratamiento de hierro y ácido fólico. Ya no tuvo más problemas de sangrado. Aunque se propuso, no se llegó a estudiar el factor XIII, pues debía remitirse a otro centro.
DISCUSIÓN
Hay casos descritos de déficit de factor VII congénito. El caso de Ziljmans et al5 se trata de un hombre de 27 años con hematoma muscular y subcutáneo espontáneos. En su dieta no tomaba vegetales ni frutas. Tenía asociado un déficit de vitamina C (escorbuto). Se trató con plasma fresco congelado y vitamina C.
Hirshberg et al6 presentan un caso de una mujer de 57 años, diabética y con adenocarcinoma de endometrio. Se practicó una histerectomía total con doble anexectomía, y no sangró. Las neoplasias pueden producir inhibidores circulantes del factor VII y seudodéficit. En este caso se investigaron y no tenía inhibidores circulantes. Se trataba de un déficit de factor VII.
En el caso de Cheng et al7 hubo sangrado postoperatorio en un chico de 15 años, tras la extracción quirúrgica de un canino superior izquierdo impactado. Se lo trató con medidas locales y transfusión. Se realizó con anestesia general. Tenía historia de epistaxis y el TP alargado, 24,3 (normal, 9,5-12,5 s). El factor VII estaba disminuido, al igual que en sus padres.
La hemorragia puede ser fatal; necesita un diagnóstico precoz, tratamiento efectivo y consejo genético. Hay que investigar la causa de anemia y lesión del tracto gastrointestinal. Las extracciones dentales se toleran bien sin tratamiento, así como también las cesáreas, la tonsilectomía y la circuncisión.
Gago et al8 exponen un caso en un varón de 20 años, en una apendicitis aguda, sin antecedentes. La madre y 2 hermanos eran heterocigotos. El heterocigoto tiene niveles del 26-60%. El homocigoto tiene hemorragias espontáneas de repetición, incluso mortales. Es grave con factor VII < 3%; moderada con 3-5%, y benigna con > 5%.
La pauta sería: si no hay hemorragia, no se indica tratamiento. Con antecedentes de hemorragia, sustitución. Con hemorragia moderada, realizar tratamiento si previamente tuviera extracción dentaria y sangrado.
La actitud práctica en caso de intervención quirúrgica, en el paciente afectado de déficit congénito de factor VII9, es en tratamiento con riesgo: se debe observar la tasa de factor VII; la gravedad del síndrome hemorrágico espontáneo; los antecedentes quirúrgicos, y el tipo de intervención.
Cirugía:
1. Menor, no hemorrágica, como apendicectomía.
2. Menor, hemorrágica, como amigdalectomía o extracción dentaria.
3. Mayor, hemorrágica, como la ósea.
Síndrome hemorrágico:
No: sustitución, con cirugía menor hemorrágica y cirugía mayor, o factor VII < 5%.
Moderado: sustitución necesaria.
Severo: sustitución obligatoria.
Lo mejor es el factor VII concentrado. Según el riesgo, y en tanto que éste persista, la pauta inyectable es: 20 U/kg/4 h en cirugía menor no hemorrágica, y 40 U/kg/8 h en cirugía menor hemorrágica y cirugía mayor. Hemostasia quirúrgica con tasa de factor VII > 10%. Hacer ligaduras, no electrocoagulación. Para la anestesia, tener cogidas 2 vías gruesas, calibre 16 G.
Sadraoui et al10 presentan un caso de un niño de 9 años con déficit de factor VII, al que practican circuncisión sin tratamiento sustitutivo. Con tasa de factor VII > 20% no hace falta tratamiento sustitutivo, aun con intervención de alto riesgo (sustitución, con factor VII < 10%, y hemorragia).
Ranchère et al11 presentan 2 casos de déficit de factor VII con intervención por carcinoma: uno, es un varón de 58 años, con un cáncer lingual y déficit de factor VII del 8% congénito. Se trató con perfusión y no hubo hemorragia. El otro, un varón de 30 años, con tumor retroperitoneal derecho, leiomiosarcoma epitelioide de alto grado, déficit de factor VII del 33%, en relación a la enfermedad tumoral. Se resecó el tumor y se practicó nefrectomía derecha y hepatectomía parcial. Se administraron inyecciones preoperatorias de factor VII, y no hubo complicaciones hemorrágicas. El riesgo hemorrágico es difícilmente previsible. La severidad de las complicaciones hemorrágicas no se correlaciona con el déficit. Para la prevención se utilizan inyecciones de concentrado o perfusión continua. En la perfusión hay riesgo de transmisión viral, por ello hoy se utiliza el factor VII activo recombinante, que evita este riesgo.
Hay una serie de 17 casos de déficit de factor VII, con < 0,1 U/ml y cirugía sin terapia de reemplazo12, 6 varones y 11 mujeres con edades entre 6 y 81 años, pertenecientes a 10 centros. Se consideraron 2 grupos: grupo A, con 4 casos, sin historia de sangrado, y el B, con 13 casos, con historia de sangrado (menorragias, epistaxis, hematomas espontáneos y traumáticos). Hubo sangrado excesivo en 6 casos, que presentaron epistaxis y hematomas. La conclusión es que en procedimientos quirúrgicos menores (dientes, ORL y cirugía vaginal) no es necesaria la sustitución. En caso de sangrado en cirugía, se puede administrar concentrado de factor VII o factor VII activado recombinante.
El factor VII activado recombinante (rF VIIa) se ha utilizado en 8 casos con inhibidores del factor VII (4 casos de hemofilia A y 4 casos sin hemofilia) para el tratamiento13 del sangrado abdominal y es efectivo. Tuvo éxito, con hemostasia adecuada, en 7/9 episodios (78%). Pero hubo 4 muertes, sin relación con la terapia, por hipotensión-shock, tromboembolia cerebral, embolia pulmonar, fallo respiratorio o hemorragia intracraneal.
El factor VII recombinante activado también se ha utilizado para el tratamiento del sangrado por tumores en oncología ginecológica con coagulopatías preexistentes14. Veamos 2 casos, un adenocarcinoma endometrial en una mujer de 67 años, y un sarcoma vaginal en una mujer de 42 años. En el primer caso se practicó radioterapia, histerectomía total, y factor VIIr por sangrado abundante, que se resolvió; en el segundo, exéresis del tumor y radioterapia; quimioterapia por un tumor recurrente, y factor VII por sangrado severo, que se resolvió. En situación excepcional, de peligro de muerte, el factor VIIr es efectivo y espectacular, y con efecto duradero. Tendrían un nivel alto suprafisiológico de factor VII, tras la administración exógena. Y acelera o facilita la hemostasia en los tejidos con transformación maligna.
Finalmente, en nuestro caso, una mujer de 38 años con niveles de factor VII disminuidos, 32-40%, presentó IQ disminuidos, 59-51%, y tras laparoscopia quirúrgica para quiste anexial (de paraovario), hizo un hematoma abdominal y un hematoma pélvico intraperitoneal. Se resolvieron quirúrgicamente y por compresión. No se necesitó tratamiento sustitutivo.