CASO CLÍNICO
Paciente de 77 años de edad, que ingresa para estudio por distensión abdominal y dificultad para miccionar. No presenta antecedentes medicoquirúrgicos de interés. Nuligesta. Menopausia a los 50 años.
A la palpación abdominal destaca una tumoración dura irregular en hemiabdomen inferior. Precisó de sondaje vesical (500 ml) por retención urinaria.
En el estudio ecográfico se identifica en la pelvis una masa compleja, solidoquística, mal delimitada de 8 * 9* 10 cm de diámetro sugestiva de carcinoma de ovario y ascitis. Asimismo, se identifica una lesión quística de 3 cm en el segmento hepático 4. En la tomografía computarizada (TC) se objetivan varios nódulos hepáticos de características quísticas, compatibles con quistes biliares, y la tumoración referida en la ecografía es compatible con carcinoma ovárico. Ascitis. Trombosis de la vena femoral izquierda.
Marcadores tumorales: Ca 19.9, 12.929 U/ml (normal, 0-37), y Ca 125, 705,6 U/ml (normal, 0-35).
Con la sospecha de carcinoma de ovario se realiza laparotomía de estadificación que consistió en histerectomía + doble anexectomía + omentectomía + linfadenectomía pélvica bilateral + biopsias peritoneales.
Entre los hallazgos quirúrgicos destacó una gran tumoración solidoquística de 18 cm de diámetro, dependiente del anejo derecho, con componente gelatinoso y adherida a las asas intestinales y pared pélvica. El útero y el anejo izquierdo eran normales. El epiplón era macroscópicamente normal y no se palparon adenopatías.
La tumoración se extirpó en su totalidad, sin rotura durante el acto quirúrgico, y no quedó tumor residual tras la cirugía.
Anatomía patológica macroscópica
Útero atrófico. Tumoración de 300 g y 20 * 15 cm dependiente del anejo derecho, abollonada y brillante, heterogénea con áreas sólidas y quísticas.
Anatomía patológica microscópica
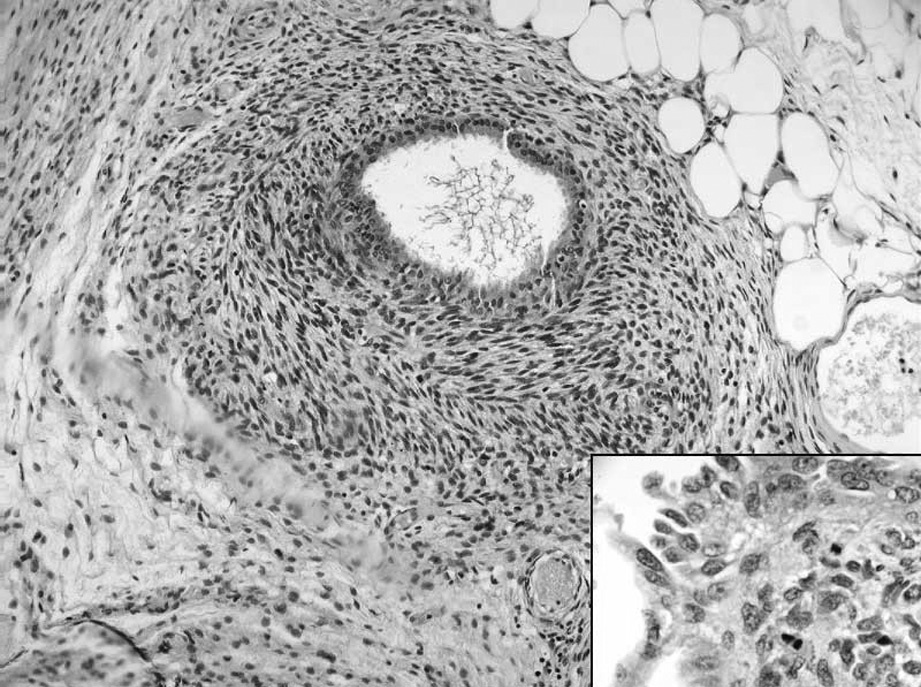
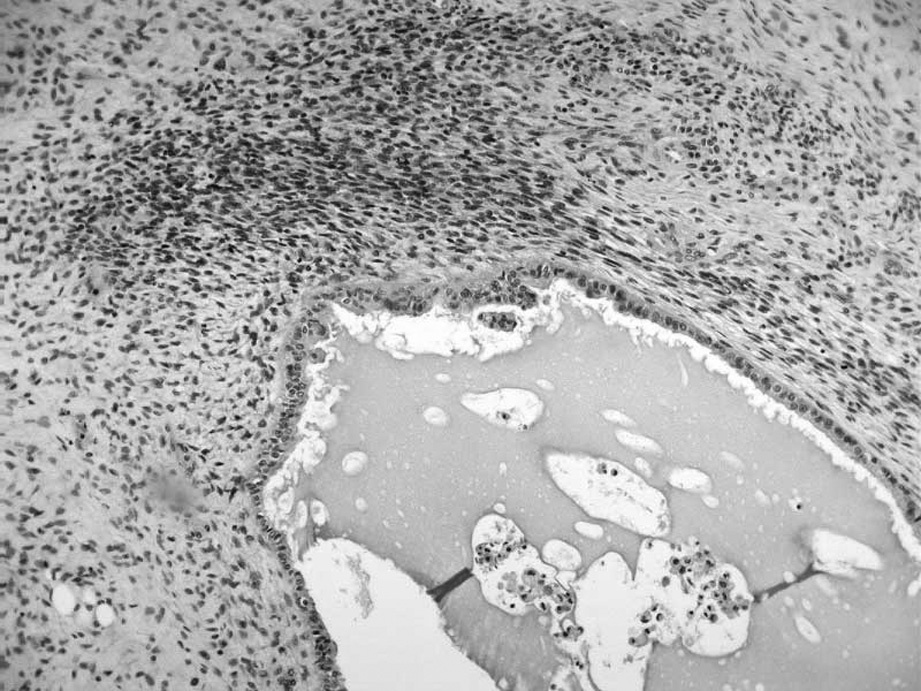
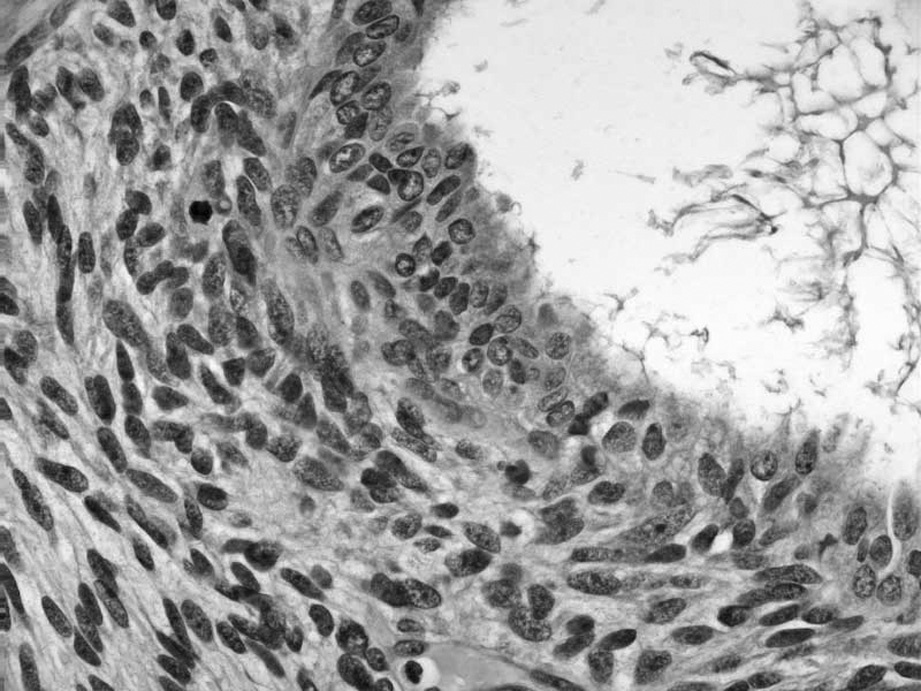
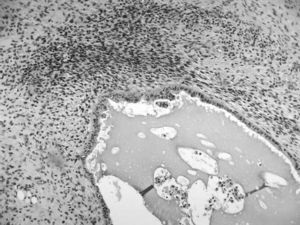
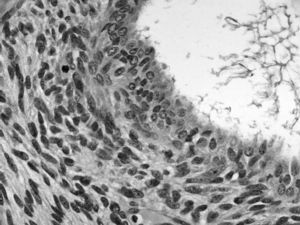
La tumoración está formada por múltiples cavidades quísticas, revestidas por un epitelio cúbico bajo de aspecto seroso, sin atipias evidentes y que, en ocasiones, adquieren una disposición papilar con eje conectivovascular. Junto a estas áreas se observan otras densamente celulares, de células fusiformes, con patrón estoriforme, similares a la estroma endometrial aunque con zonas centrales hemorragiconecróticas (fig. 1). Frecuentemente, las células estromales se distribuyen más densamente alrededor del epitelio glandular, y muestran anisocariosis evidentes y un índice mitótico de 1-10 mitosis por 10 campos de gran aumento (figs. 2 y 3). Tanto las áreas más densamente celulares como las más laxas presentan abundante tejido adiposo maduro entre ellas, así como zonas de aspecto condroide (componente heterólogo). Incluso en las zonas más celulares puede observarse la presencia de glándulas de tipo endometrial que, en ocasiones, muestran cambios de metaplasia escamosa. El epiplón y el peritoneo se encontraban libres de afección tumoral, y los ganglios pélvicos, libres de infiltración tumoral.
Fig. 1. Existe un doble componente: por un lado, glándulas epiteliales formadas por epitelio cúbico o cilíndrico de aspecto endometrioide sin atipias apreciables y sorprendente estroma periepitelial que muestra atipia variable y aisladamente figuras de mitosis (recuadro).
Fig. 2. La disposición de la estroma es concéntrica alrededor del epitelio glandular; las zonas más densamente celulares son las que muestran mayor atipia citológica. El epitelio glandular, en ocasiones, muestra proyecciones papilares irregulares.
Fig. 3. Las zonas más celulares muestran células fusiformes de anisocariosis evidente con figuras de mitosis aisladas.
Diagnóstico: adenosarcoma ovárico de bajo grado. Estadio Ia.
Inmunohistoquímica
Las glándulas endometriales son queratina (+) y el componente estromal es fuertemente positivo para vimentina, positividad moderada para alfa-1-antitripsina, CD 34 positivo difusamente y negativo para desmina, estrógenos, progesterona y p53. El índice de proliferación celular utilizando (Ki-67) oscila entre el 50 y el 75% según la zona observada.
Tras la cirugía se objetiva una reducción importante de marcadores tumorales (Ca 125, 33,7 U/ml, y Ca 19.9, 137,4 U/ml). No se realizó tratamiento adyuvante.
A los 2 meses y medio de la cirugía, la paciente ingresa al servicio de urgencias por un cuadro de suboclusión intestinal. La palpación abdominal pone de manifiesto una tumoración gigante que alcanza la zona umbilical. En estudio ecográfico se objetiva una masa, que ocupa la totalidad de la pelvis, heterogénea de predominio hipoecógeno con múltiples tabiques y áreas de polo sólido de 13 * 13 * 10 cm y otras áreas sólidas con degeneración quística de 12 * 6 cm, que contactan con las asas de intestino delgado. La TC muestra una tumoración, de 15* 15 * 17 cm, heterogénea que ocupa la totalidad de la pelvis y que asciende hasta la región umbilical con componentes quísticos y áreas sólidas. Asas de delgado con infiltración tumoral.
La paciente presenta un deterioro progresivo de su estado general, y fallece a los 2 meses y 20 días de la cirugía.
DISCUSIÓN
El adenosarcoma mülleriano es un tumor infrecuente que fue descrito por primera vez por Clement y Scully en 19741. Se caracteriza histológicamente por presentar un componente glandular benigno, aunque ocasionalmente atípico, asociado a un componente estromal sarcomatoso, generalmente de bajo grado, pero que puede ser de alto grado2. El componente epitelial generalmente consiste en glándulas con epitelio tipo endometrial, endocervical y ciliado.
Es un tumor mixto de localización generalmente uterina, que se manifiesta como un pólipo endometrial o una tumoración cervical. Las variantes extraendometriales, con origen en ovario, trompas de Falopio, miometrio o mesotelio peritoneal, son mucho menos frecuentes.
Su histogénesis es probablemente similar a la de otros tumores endometrioides, esto es, su origen se encuentra en la superficie epitelial ovárica y estroma adyacente o en focos de endometriosis ovárica3. Se ha sugerido un origen en tejido endometriósico, lo que es discutible en los de origen uterino, ya que generalmente asientan en el endometrio y no en focos de adenomiosis. Se han documentado casos originados en zonas en las que la endometriosis es frecuente, como en el ovario y el peritoneo pélvico4, así como casos que asientan en endometriosis colónica y apendicular5. A pesar de todo ello se cree que los adenosarcomas asientan más directamente en la superficie epitelial y en la estroma ovárica que en el tejido endometriósico6. En casos de origen multicéntrico (útero y ovario), pudiera ser que las lesiones ováricas se originen en el peritoneo de los anejos más que como lesiones metastásicas secundarias a la lesión uterina.
La edad de presentación oscila entre 30 y 84 años, con una mediana de 53 años. Generalmente se presentan en edad reproductiva, o al menos en pacientes premenopáusicas, en contra de los de origen uterino, que se suelen diagnosticar en pacientes posmenopáusicas6.
Los síntomas más frecuentes en el momento del diagnóstico son la presencia de tumoración abdominal palpable y molestias abdominales. Se han descrito otros síntomas, como hemorragia vaginal, pero con mucha menor frecuencia. La localización ovárica se asocia a masa pélvica en un 50% de los casos y hemorragia genital en un 15% (en los uterinos únicamente se detecta masa pélvica en el 5% y hemorragia en el 83%).
Generalmente, el tamaño de los adenosarcomas de origen ovárico es mayor que el de los uterinos, de hecho se ha documentado un tamaño medio de 14 cm (5,5-50 cm) en los ováricos y de 5 cm (1-17 cm) en los uterinos6. Las diferencias clínicas y patológicas entre adenosarcoma uterino y ovárico se muestran en la tabla I.
Para realizar su diagnóstico diferencial se debe distinguir entre variedades benignas (adenofibroma) y de otros tipos de tumor maligno (tumor mülleriano mixto maligno).
El criterio para diferenciarlo del adenofibroma en casos dificultosos no está bien establecido, puesto que se han descrito pocos casos en la bibliografía7.
Clement y Scully2 manifiestan que se debe diagnosticar adenosarcoma en vez de adenofibroma cuando al menos uno o más de las siguientes premisas está presente:
Dos o más mitosis en 10 campos de gran aumento.
Marcada celularidad estromal.
Atipia nuclear más que moderada en las células estromales.
La presencia de componente fibromatoso con atipia mínima hace difícil el diagnóstico diferencial entre el adenofibroma y el adenosarcoma de bajo grado.
El componente sarcomatoso con marcada atipia nuclear parece que deriva de la transformación focal del componente fibromatoso con atipia mínima. Aunque el componente sarcomatoso puede mostrar atipia nuclear similar a la derivada del componente glandular fibromatoso con atipia mínima, los componentes sarcomatoso y fibromatoso con atipia mínima son claramente diferentes en la expresión de proteína p53 y antígeno Ki-67.
Los tumores de bajo grado, como el caso que nos ocupa, muestran atipia en células estromales menor que moderada y un índice mitótico inferior a 10 mitosis por 10 campos de gran aumento; en cambio, los de alto grado muestran moderada o marcada atipia nuclear y un índice mitótico similar o mayor a 10 mitosis.
La sobreexpresión de p53 y Ki-67 se puede correlacionar con el potencial maligno del adenosarcoma y debería ayudar a distinguir claramente el sobrecrecimiento sarcomatoso con un peor pronóstico que el adenosarcoma de bajo grado8.
De hecho, las células sarcomatosas son positivas para p53 y Ki-67 y las células fibromatosas con atipia mínima suelen ser negativas.
En nuestra paciente, el índice de proliferación celular Ki-67 osciló entre un 50 y un 75% según la zona observada; en cambio, la expresión de p53 fue negativa.
Generalmente son microscópicamente similares a los uterinos. Histológicamente el componente sarcomatoso recuerda el sarcoma de la estroma endometrial. El componente estromal puede contener elementos heterólogos, tales como rabdomiosarcoma embrionario, cartílago, músculo esquelético, diferenciación lipomatosa, elementos de cordones sexuales o tumor de células de la granulosa. La presencia de elementos de los cordones sexuales en los de origen ovárico (en torno a un 7%) es más frecuente que en los de origen uterino.
Aunque los de origen uterino son generalmente indolentes, los de origen ovárico tienen un mayor grado de malignidad. Se especula que la localización extrauterina deja un acceso libre a la cavidad abdominal, en contra de los de origen uterino, en los que el miometrio ejerce de barrera3. Además de la carencia de barreras anatómicas, el gran tamaño de los adenosarcomas de localización ovárica (el 75% presentan un estadio Ic o superior al diagnóstico) y la alta frecuencia de roturas del tumor hacen que el pronóstico sea peor que el de los de origen uterino. De hecho, el tamaño del tumor y el índice mitótico son considerados marcadores de mal pronóstico3. A menudo son difíciles de extirpar completamente debido a la susceptibilidad a la rotura en la operación y su adherencia a estructuras vecinas6.
Se ha estimado que recidivan en un 63%. La diseminación extraovárica y el alto grado tumoral se asocian a una alta tasa de recidiva, incluso en estadio I. Se sugiere que una edad inferior a 53 años, la rotura del tumor y el alto grado son predictores de recidiva (sobre todo en estadio I)6. Parece que el estado premenopáusico, y por consiguiente el estado hormonal de la paciente, podría tener un papel en la progresión de estos tumores.
Se recomienda que cuando un cirujano en el acto quirúrgico se encuentre ante un seudocistoadenofibroma, o un seudoadenofibroma, no asuma de entrada su benignidad, sino que realice un estudio intraoperatorio e incluya las adherencias, si están presentes, en la resección de la pieza, si es posible. Si se da el diagnóstico de adenosarcoma, se debe realizar estadificación quirúrgica completo.
El empleo de terapia adicional depende de si el tumor escindido es de bajo o alto grado o de si el componente sarcomatoso recuerda un fibrosarcoma o un sarcoma de la estroma endometrial. Este último es potencialmente tratable con progesterona, radioterapia o ambos, mientras que el tratamiento quimioterápico puede estar indicado en fibrosarcomas de alto grado.
El tratamiento adecuado del adenosarcoma mülleriano consiste en la realización de una histerectomía abdominal total con salpingooforectomía bilateral y muestreo linfático pélvico. El estudio citológico de la ascitis es muy importante para determinar la estadificación clínica de los tumores ováricos malignos y proporcionar un tratamiento adecuado .
En las pacientes que han recibido tratamiento quimioterápico adyuvante, radioterápico o ambos (es tadio Ic o superior), el 90% tuvo al menos una recidiva6. Se ha descrito un caso tratado con radioterapia y quimioterapia con evolución libre de enfermedad a los 9 años9.
El adenosarcoma de ovario tiene un peor pronóstico que su homónimo uterino10, con recidiva tumoral en 2/3 de los casos, casi siempre en los primeros 5 años tras la cirugía. La mayoría de las pacientes con enfermedad en estadio I tienen al menos una recidiva. En las pacientes en estadio I, con menos de 53 años, rotura del tumor, alto grado y con sobrecrecimiento sarcomatoso, se asocia con una alta tasa de recidiva.
Se ha estimado que el tiempo desde el diagnóstico hasta la primera recidiva es de 0,4 a 6,6 años (media, 2,6 años; mediana, 2,2 años). Las lesiones metastásicas a distancia, si se producen, suelen ser precedidas por recidivas intraabdominales. La recidiva puede producirse tanto en forma de adenosarcoma de bajo o alto grado como en forma de sarcoma de grado variable.
Se ha documentado una supervivencia actuarial global del 64, el 46 y el 30% a los 5, 10 y 15 años del diagnóstico, con una mediana de supervivencia de 7,3 años3.
La sobreexpresión de p53 y Ki-67 puede correlacionarse con el potencial maligno del adenosarcoma y podría ayudar a distinguir claramente sobrecrecimiento sarcomatoso con pronóstico mucho más grave que el del adenosarcoma de bajo grado8. El título de Ca 125 sérico puede no ser predictor de recidiva de sobrecrecimiento sarcomatoso sin componente epitelial, aunque generalmente está bien correlacionado con el curso clínico de recurrencia de la enfermedad3,11.