Se define hydrops fetal no inmune (HFNI) como la acumulación anormal de líquido en piel (edema) y en cavidades corporales (derrame pericárdico, pleural o ascitis), sin la evidencia de anticuerpos circulantes dirigidos frente a antígenos eritrocitarios. El HFNI, es una condición causada por un grupo heterogéneo de patologías cardiovasculares, gastrointestinales, pulmonares, cromosómicas, hematológicas e infecciosas, y es una importante causa de pérdida perinatal, con una mortalidad que varía entre el 50 y el 98%, según la etiología.
Non-immune hydrops fetalis (NIHF) is characterized by abnormal accumulation of serous fluid in the skin (edema) and body cavities (pericardial, pleural or ascitic effusions), without evidence of circulating antibodies against red blood cell antigens. This entity is caused by a heterogeneous group of disorders, including cardiovascular, gastrointestinal, pulmonary, chromosomal, hematological and infectious diseases. NIHF is an important cause of perinatal loss, with mortality ranging from 50% to 98%, depending on the etiology.
La hidropesía fetal de origen no inmunológico (HFNI) se define como la acumulación extracelular de líquido en los tejidos y en las cavidades serosas, sin evidencia de anticuerpos circulantes dirigidos frente a antígenos eritrocitarios.
La exploración ecográfica debe demostrar acúmulo de líquido en al menos 2 zonas. Los hallazgos ecográficos habituales son: polihidramnios, edema cutáneo de un grosor mayor de 5 mm, aumento del tamaño de la placenta, derrame pericárdico o pleural y cardiomegalia. Se recomienda no efectuar el diagnóstico de HFNI cuando la acumulación de líquido se limita a una cavidad corporal. Sin embargo, y dado que una acumulación aislada de líquido puede representar el primer signo del futuro desarrollo de HFNI, es necesario efectuar un seguimiento mediante ecografía1,2.
Las condiciones patológicas más comúnmente asociadas al HFNI son las malformaciones gastrointestinales, las genopatías, las malformaciones cardiovasculares, las respiratorias y las infecciosas3.
El estudio de la HFNI es complejo e implica ecografía, pruebas analíticas y técnicas invasivas. El tratamiento del hydrops es individualizado.
El resultado de la hidropesía causada por cualquiera de estos mecanismos es malo, con una mortalidad global que fluctúa entre el 50 y el 98%4, debido a las múltiples etiologías involucradas en su génesis, muchas de ellas sin tratamiento conocido, por lo que implican un elevado riesgo de muerte perinatal.
CASO CLÍNICOSe describe el caso clínico de una paciente secundigesta de 28 años de edad, de 31 semanas de gestación (s.g.), sin antecedentes personales de interés. Antecedentes obstétricos: un parto con fórceps, del que nació un varón cromosómicamente normal. En la gestación actual los controles evolutivos y ecográficos hasta el ingreso son normales, con serología negativa y grupo AB positivos.
Ingresa en la unidad de patología obstétrica con carácter urgente por amenaza de parto prematuro. Al ingreso presenta constantes normales, cérvix no modificado, con altura uterina mayor que amenorrea. En el registro cardiotocográfico, el feto es reactivo y se objetiva dinámica regular.
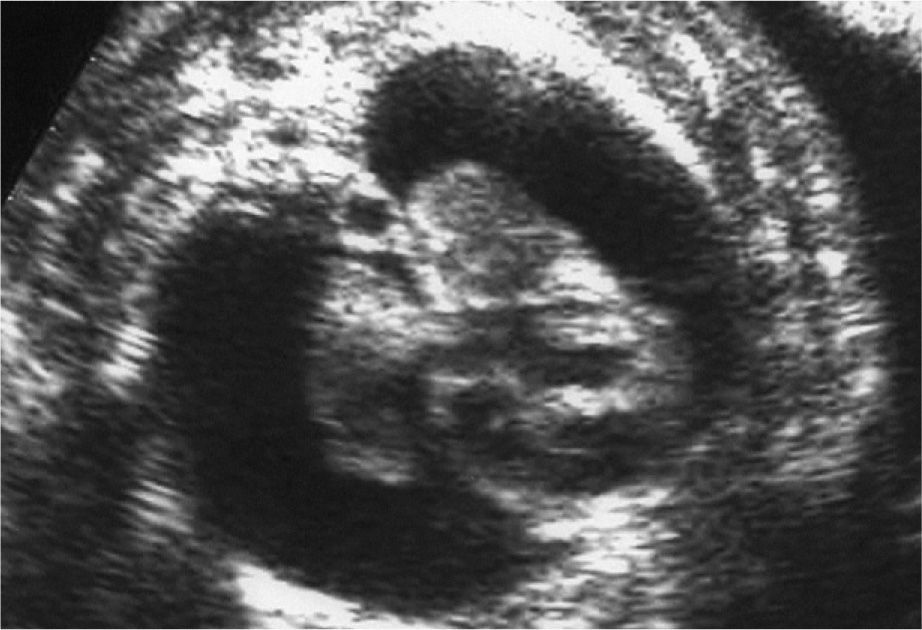
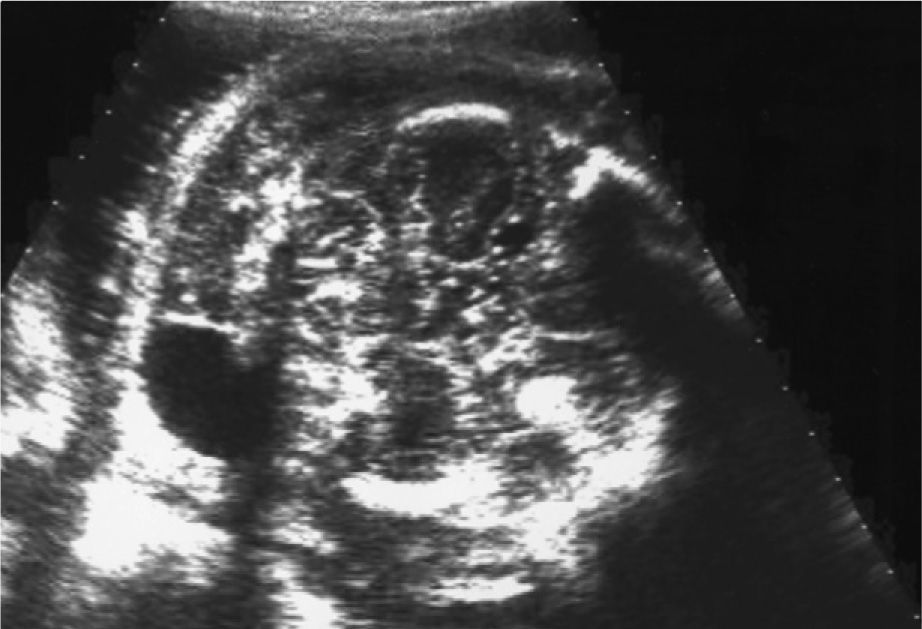
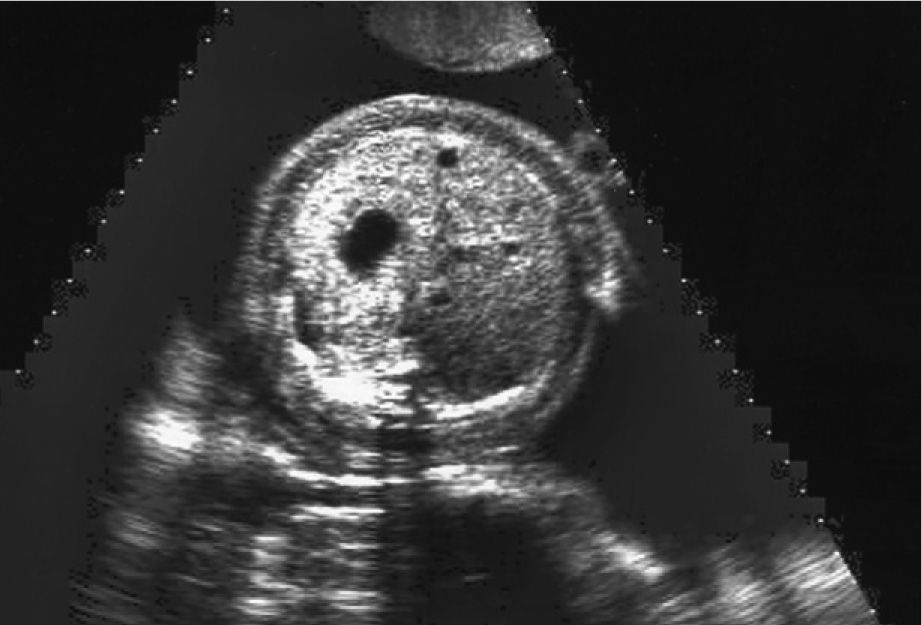
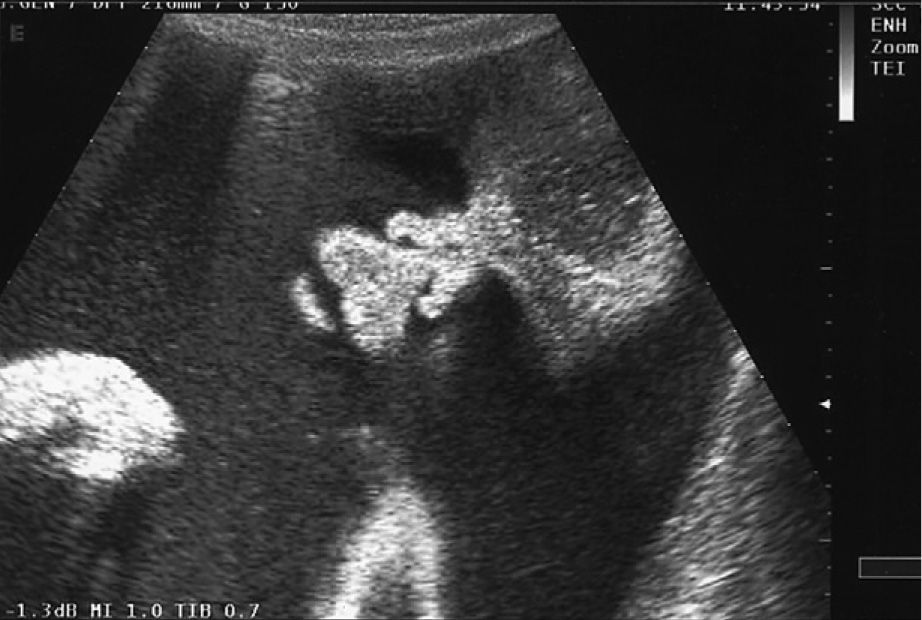
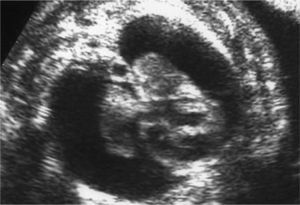
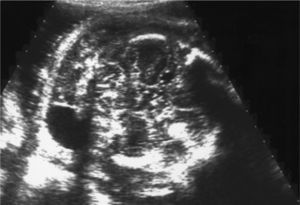
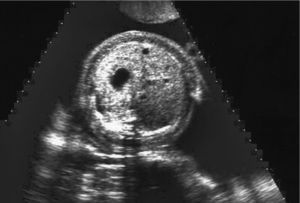
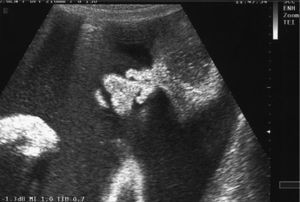
En la ecografía abdominal se observsa: feto único; LCF+; movimientos fetales disminuidos; situación longitudinal; presentación cefálica; placenta en cara anterior grado 1; cordón 3 vasos; hidramnios; DBP: 87 mm (33 + 3 s.g.); LF: 59 mm (31 s.g.); PA: 318 mm (37 s.g.); el feto presenta un edema cutáneo masivo, higroma quístico e hidrotórax que colapsa ambos pulmones. Corazón a 134 lpm, morfológicamente normal, trabajando contra elevada poscarga; con Doppler umbilical y de arteria cerebral media dentro de la normalidad.
Se realiza amniocentesis para estudio de los cromosomas 13,18, 21, X e Y, por FISH, en líquido amniótico, que es normal. En el estudio analítico, T4 libre: 1 ng/dl; escrutinio de anticuerpos irregulares negativo; serología negativa para sífilis, toxoplasmosis, rubéola, parvovirus B19, citomegalovirus, HBsAg, anti-VHC anti-VIH 1 y 2/Ag p24, con hematimetría , bioquímica y coagulación dentro de la normalidad, y urocultivo negativo, calificándose de hydrops idiopático.
La interrupción del embarazo se sometió a la consideración de los padres, dada la presencia de registros repetidos hiporreactivos y la disminución de movimientos fetales, observados en la ecografía, con previa maduración pulmonar fetal. Se realizó cesárea, y nació un varón vivo de 2.707 g de peso, apgar: 5/7/7, con intenso edema cefálico, de pabellones auriculares y de hemiabdomen superior, así como edema escrotal. Se realizó intubación, con reanimación tipo 4 y drenaje pleural bilateral. El recién nacido precisó ventilación mecánica y sedación, estando estable las primeras 12 h, produciéndose la muerte a las 28 h del parto por fallo respiratorio por hipoxia severa prolongada con hipotensión refractaria. La necropsia no evidenció malformación alguna.
DISCUSIÓNEn 1943, Potter describió una entidad clínica que afectaba a embarazos sin sensibilización Rh y que se caracterizaba por anasarca fetal, edema placentario y, a menudo, derrames serosos en el feto. Potter reconoció que esta entidad, denominada desde entonces hydrops fetalis no inmune, no representaba una enfermedad específica, sino más bien una manifestación tardía de muchas enfermedades severas 5. La incidencia del HFNI varía entre 1/1.500 y 1/ 3.500 nacidos vivos. Antes de la introducción, en 1960, de la profilaxis con gammaglobulina anti-D, el 80% de los casos de hidropesía fetal se debía a isoinmunizació Rh. En la actualidad esta enfermedad se previene con éxito, y la HFNI constituye el 87% de todos los casos de hidropesía en los países desarrollados4.
Hay una gran cantidad de patologías fetales y placentarias que pueden determinar el desarrollo de hydrops. En la actualidad, la lista supera las 100 causas. Esta situación hace que el tratamiento de la enfermedad sea difícil y muchas veces imposible, ya sea porque no se llega al diagnóstico etiológico o porque está fuera del alcance terapéutico. El hydrops fetal no inmune es el resultado de un grupo heterogéneo de circunstancias. Las 3 primeras causas, por orden de frecuencia, son: cardiovasculares, idiopáticas y cromosómicas6.
Dentro de las causas cardiovasculares, las malformaciones cardíacas, las arritmias y las neoplasias son responsables de aproximadamente el 20% de todos los casos de hydrops no inmune. El estudio hemodinámico mediante Doppler color y pulsado es un elemento clave en el diagnóstico del hydrops no inmune, tanto en la valoración cardíaca completa como a nivel periférico en el sistema venoso, y para poder determinar la presencia de anemia con flujometría Doppler de la arteria cerebral media7. El mecanismo común que lleva al hydrops es un estado de insuficiencia cardíaca congestiva. Después de una investigación etiológica general, el 15-30% de los casos de hydrops se clasifican como idiopáticos.
Las alteraciones cromosómicas se ven en el 10-16% de los casos de hydrops no inmune. Las anomalías más habituales son la trisomía 21 y el síndrome de Turner.
Otras causas menos frecuentes son:
- –
Los trastornos hematológicos representan aproximadamente el 7-10% de los casos de hydrops no inmune, y se han atribuido a alfatalasemia mayor, anemia fetal grave e insuficiencia cardíaca de alto gasto. Se debe realizar un volumen corpuscular medio de los hematíes, y si este valor está alterado, una electroforesis de hemoglobina.
- –
Las malformaciones pulmonares asociadas con más frecuencia con hydrops son la malformación adenomatoidea quística del pulmón, el hamartoma de la pared torácica, el secuestro extralobar intratorácico y la hernia diafragmática congénita.
- –
Las infecciones son el 1,6-5% de todos los casos de hydrops. Los microorganismos implicados son varios: parvovirus, Toxoplama, sífilis, citomegalovirus, herpes, ecovirus, etc.).
Por todo ello, la anamnesis debe ser extremadamente cuidadosa y debe valorar si hay riesgo de alguna enfermedad hereditaria, si hay infección en curso o si se utilizan fármacos que puedan determinar anemia fetal. Se realiza el test de Coombs indirecto para comprobar la presencia de isoinmunización materna y el test de Klaihauer-Betke para valorar la cantidad de eritrocitos fetales que ha pasado al torrente sanguíneo materno. Habrá que descartar la condición de portador sano de alfatalasemia, de G6PDH (glucosa-6-fosfato-deshidrogenasa) o de déficit de piruvato cinasa. De igual modo, habrá que indagar los agentes infecciosos que pueden determinar anemia fetal (sobre todo citomegalovirus y parvovirus B19 ). Se realizará cardiotocografía fetal y ecografía con Doppler. La amniocentesis estará indicada en el estudio del cariotipo fetal, de algunas enfermedades genéticas y de agentes infecciosos mediante cultivo celular o amplificación del ADN. Además, es indispensable para efectuar la amniorreducción y establecer la madurez pulmonar. La cordocentesisis está indicada para la determinación rápida del cariotipo fetal, para la investigación de agentes infecciosos, la valoración del hemocromo, del cuadro proteico y de las cadenas de la hemoglobina fetal.
El tratamiento del hydrops debe ser individualizado, de manera que las decisiones puedan tomarse de acuerdo con los padres. La interrupción de la gestación es una opción previa a la viabilidad fetal. En los fetos viables, el tratamiento varía ampliamente en función de la causa y del pronóstico. En los casos con malformaciones anatómicas graves o anomalías cromosómicas, el tratamiento debe ser expectante; por contraposición, en los fetos sin anomalías anatómicas y con problemas que sean tratables, como taquiarritmias, el tratamiento se hará con terapia medicamentosa transplacentaria8,9, la anemia por parvovirus se debe tratar de modo agresivo.
La amniocentesis se ha utilizado para extraer el exceso de líquido amniótico, para mejorar las incomodidades de la madre y para reducir el riesgo de parto prematuro. En ciertos casos seleccionados, se ha realizado paracentesis y toracocentesis del feto para disminuir las posibilidades de distocia y facilitar la reanimación neonatal. Otras modalidades terapéuticas que se han utilizado con resultados prometedores son la inyección intraperitoneal de hematíes o albúmina, la transfusión intrauterina para tratar la anemia fetal inducida por parvovirus y la derivación toracoamniótica en los casos de derrames pleurales.
El pronóstico del feto con hydrops fetal no inmune es malo. La tasa de muerte perinatal se sitúa en el 40-98%. El pronóstico depende del origen del hydrops. Las malformaciones anatómicas presentes en aproximadamente el 40% de los casos comportan el peor pronóstico, y constituyen situaciones letales en casi todos los casos. Solamente los casos de infección por citomegalovirus y las arritmias cardíacas sin malformaciones estructurales tienen una resolución espontánea del hydrops, con pronóstico razonablemente bueno.
Otros factores asociados con hydrops y que contribuyen al mal pronóstico son la preeclampsia, el parto pretérmino, la rotura prematura de membranas y la hemorragia posparto.