El higroma, o linfangioma quístico, se debe a una anomalía del sistema linfático producida por la obstrucción del drenaje de los sacos linfáticos cervicales al sistema venoso yugular. Habitualmente se localiza en la región cervical posterior o posterolateral y contiene múltiples tabiques. Entre el 20 y el 40% de los casos se asocia a normalidad cromosómica; el resto de los casos se asocia a diversas aneuplodías o malformaciones. El diagnóstico diferencial incluye edema nucal, meningocele, encefalocele, teratoma cervical, seudomembranas, hemangioma y quiste placentario subcorial.
Su incidencia es de uno cada 1.775 a 6.000 nacidos vivos. La tasa de aneuploidía asociada al linfangioma quístico diagnosticado prenatalmente es del 45 al 60% (principalmente síndrome de Turner y síndrome de Down). También se ha observado asociación a otros síndromes polimalformativos. El resultado fetal es incierto y varía según los estudios revisados.
A continuación se presenta el caso de un linfangioma quístico inusual por varios motivos: su gran tamaño, la ausencia de otras anomalías morfológicas y de aneuploidías, la joven edad de la madre y el desarrollo morfológico posnatal normal.
Hygroma or cystic lymphangioma is due to an obstruction of jugular lymph sac drainage to the jugular venous system. The most common localization is the posterolateral neck region. These lesions are usually multiseptated. Between 20% and 40% of affected individuals have a normal karyotype and the remainder show diverse aneuploidies and/or malformations. The differential diagnosis includes nuchal edema, meningocele, encephalocele, cervical teratoma, pseudomembranes, hemangioma and subchorial placental cyst.
The incidence of cystic lymphangioma has been reported to be 1/6,000–1,775 live-newborns. The rate of aneuploidy associated with prenatally diagnosed cases are between 45% and 60% (mainly Turner and Down syndromes). Some cases are associated with other polymalformation syndromes. Fetal outcome is uncertain and differs among studies.
We present the case of a fetal cystic lymphangioma that is unusual for several reasons: its huge size, the absence of any other morphological abnormalities and aneuploidies, the young age of the mother, and the normal morphological postnatal growth.
El linfangioma quístico tiene una incidencia de uno cada 1.775 a 6.000 nacidos vivos. Se asocia con frecuencia a anomalías cromosómicas y a síndromes polimalformativos. El caso que se expone es inusual debido a su gran tamaño y a la ausencia de otras anomalías asociadas.
Caso clínicoMujer primigesta de 27 años de edad, sin antecedentes de interés, enviada a la Unidad de Patología Obstétrica de este hospital a las 26 semanas de gestación (SDG) tras diagnóstico ecográfico de masa de aspecto líquido, de 35×27mm, tabicada, no vascularizada y multiloculada en la región cervical fetal (posterolateral izquierda). Esto sugirió el diagnóstico de linfangioma quístico y planteó teratoma cervical y bocio congénito como diagnósticos diferenciales. La biometría fue acorde con la edad gestacional y no se visualizaron otras anomalías morfológicas.
Dado el alto riesgo de asociación a cromosomopatías del linfangioma quístico, se realizó la prueba de amniocentesis genética que dio como resultado un cariotipo normal con fórmula cromosómica 46XX. La alfafetoproteína en líquido amniótico (LA) fue de 2.124U/ml (normal según los valores de referencia). Tras la amniocentesis se aplicó una dosis de gammaglobulina anti-D.
Hasta ese momento, el control gestacional había sido correcto y completo. La mujer tenía grupo sanguíneo A1 factor Rh negativo. Los controles serológicos y analíticos habituales (según las recomendaciones de la Sociedad Española de Ginecología y Obstetricia) fueron normales. Desde el inicio de la gestación, se le administró ácido fólico, vitamina B12 y un complejo multivitamínico como suplemento. El triple cribado resultó de bajo riesgo para anomalías cromosómicas y para defectos del tubo neural. En la ecografía del primer trimestre no se detectaron anomalías.
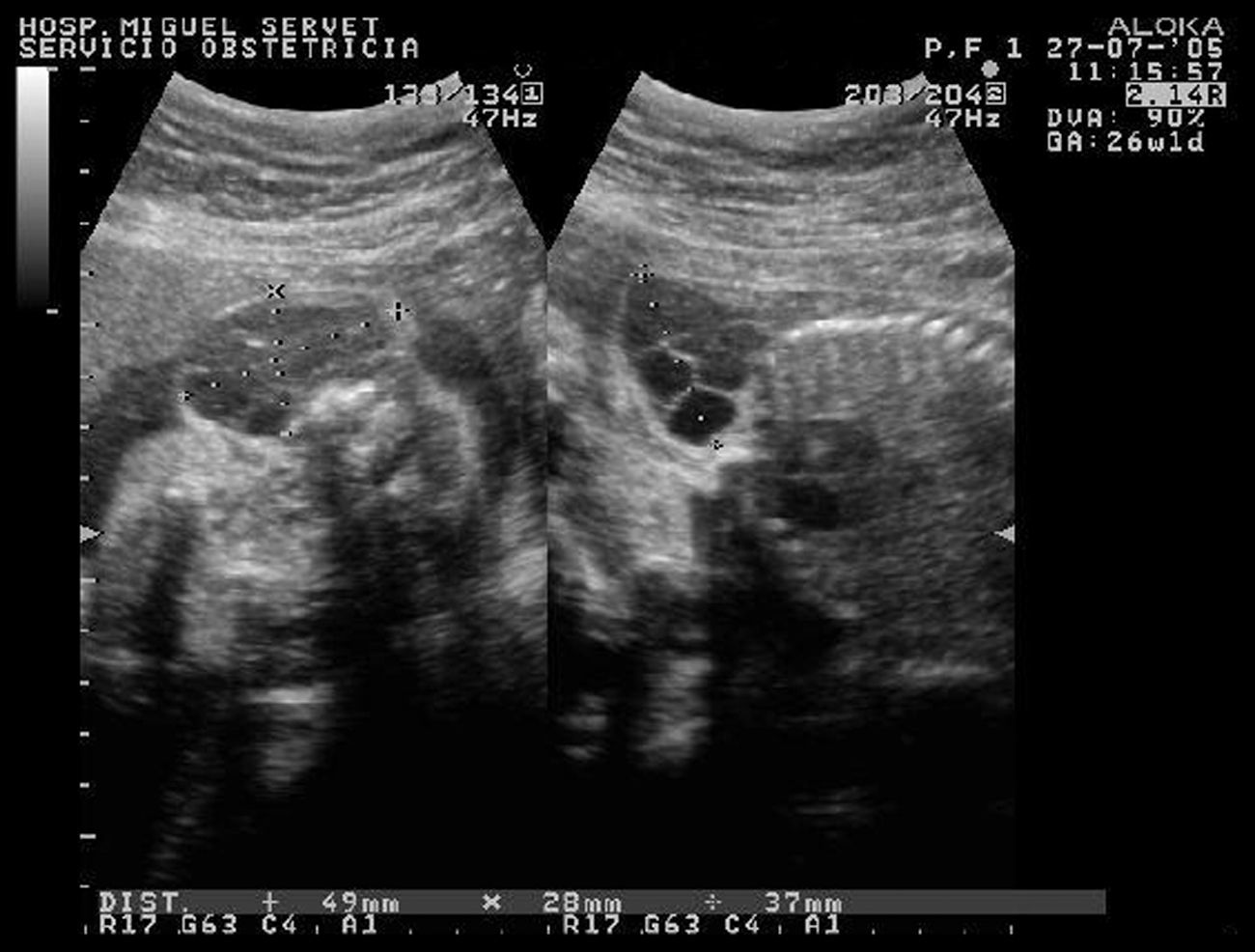
Tras este diagnóstico, se controló a la mujer en la Unidad de Patología Obstétrica de este hospital, donde se le realizaron numerosos controles ecográficos. En la primera ecografía se observaron biometría y morfología normales, salvo una imagen quística multitabicada de 49×28×37mm en la región paracervical, con contenido líquido y compatible con linfangioma cervical (fig. 1). Se practicó un ecocardiograma con resultado de morfología y funcionamiento cardíacos sin anomalías. Una nueva ecografía a las 291 SDG mostró una masa de 53×47×29mm, sospechosa de linfangioma quístico. El LA y la placenta eran normales, así como el estudio Doppler. A las 331 SDG, se realizó otra ecografía con el único hallazgo anormal de la masa ya conocida pero con tamaño de 59×56×40mm. Un nuevo ecocardiograma mostró morfología y funcionamiento cardíacos normales. A las 353 SDG se observó una tumoración anecógena de 74×65mm, con tabiques finos en su interior, paracervical izquierda fetal, sin vascularización en su interior, ya descrita con anterioridad y compatible con linfangioma quístico. No había ascitis ni derrame torácico, tampoco se observó ninguna otra anomalía.
Todos los controles analíticos gestacionales fueron normales. A las 36 y 37 SDG se realizaron controles cardiotocográficos y no hubo alteraciones en los registros.
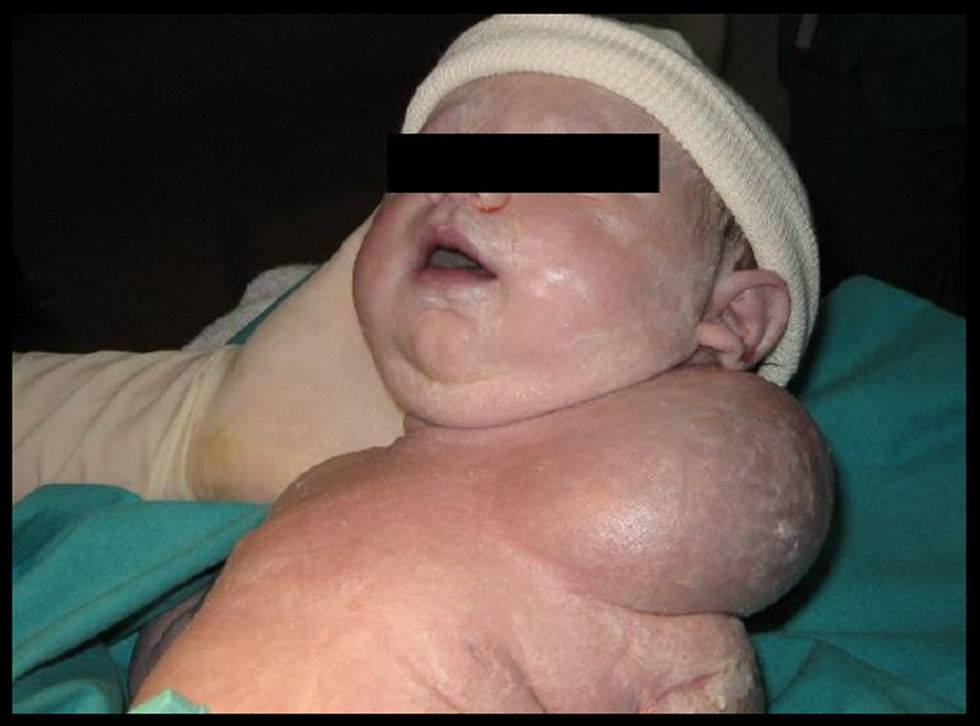
Dado el tamaño de la tumoración y la duda diagnóstica, se programó cesárea electiva a las 38 SDG, que se practicó sin complicaciones para la extracción fetal. Se obtuvo un recién nacido de sexo femenino, de 3.740g, test de Apgar de 8-8 y pH arterial de 7,30. La placenta y el cordón umbilical eran normales y el LA era claro. El recién nacido presentaba externamente tumoración paracervical izquierda (que afectaba a las regiones clavicular, deltoidea y supraescapular izquierdas), de morfología ovoidea y de 7 a 8cm de diámetro, bien delimitada, elástica y con transiluminación positiva (fig. 2). La auscultación pulmonar, del abdomen y el resto de la exploración física realizadas con aparatos fueron normales.
El recién nacido resultó de grupo sanguíneo A factor Rh positivo; el resultado del test de Coombs directo fue negativo. El estudio analítico neonatal fue normal, incluidos la proteína C-reactiva que fue negativa, la calcemia que fue normal y el frotis ocular que fue negativo. No obstante, se aplicó tratamiento profiláctico con antibióticos (amoxicilina y ácido clavulánico) hasta saber que los parámetros de infección eran negativos. Se realizó un estudio radiográfico cervical, torácico y abdominal en el que no se hallaron otras anomalías (salvo la tumoración cervical izquierda) ni se visualizaron imágenes cálcicas o alteraciones parenquimatosas evidentes. Se realizó un estudio ecográfico cervical a las 24h de vida en el que se observó una masa cervical izquierda no mensurable (desbordaba las posibilidades de la sonda), de límites precisos y regulares, fundamentalmente líquida, serosa, sin crecimientos endofíticos y multiseptada, que no incluía vasos y que improntaba los vasos cervicales sin alterarlos. La tiroides era normal. En conjunto, los hallazgos eran indicativos de linfangioma quístico.
Se programó tratamiento quirúrgico a los 9 días de vida tras obtener un estudio preoperatorio normal. En la intervención se incidió en huso (la línea superior siguió un pliegue del cuello) sobre la tumoración. Se realizó disección y exéresis completa del quiste, que estaba bien separado de las estructuras neurovasculares del cuello y por encima del estrecho torácico. Posteriormente se suturó el platisma. Se dejó drenaje de Redón y se suturó de piel con puntos totales de Ethicon®.
Tras la intervención, la niña permaneció estable, con curva ponderal ascendente y buena evolución de la herida quirúrgica. Se retiraron el drenaje al cuarto día postoperatorio y la sutura cutánea al séptimo día. Se le dio de alta a los 7 días de la intervención, con lactancia materna como alimentación. Se realizó tomografía craneal de control 5 días después y no se observó ninguna anomalía.
El informe anatomopatológico describió una pieza multilobulada de 9×8×3cm, acompañada por un huso cutáneo, formada por una cavidad quística multilocular con contenido líquido y mucoide de coloración verde. El diagnóstico fue linfangioma quístico.
A los 35 días de la cirugía se realizó una revisión y no hubo hallazgos anormales. A los 2 meses de vida, se detectó una tumoración nasal compatible con pólipo nasal. En una resonancia magnética se visualizó una lesión de 1cm con un pequeño componente quístico en fosa nasal izquierda. Dada la duda diagnóstica, se resecó la tumoración; el resultado anatomopatológico fue proliferación fibrohistiocitaria de forma polipoide sin signos de malignidad. La evolución posterior de la niña fue completamente normal.
DiscusiónEl higroma, o linfangioma quístico, se debe a una anomalía del sistema linfático producida por la obstrucción del drenaje de los sacos linfáticos cervicales al sistema venoso yugular. Una obstrucción incompleta de este drenaje generaría el higroma no septado. El aumento de presión en el sistema linfático podría superar una obstrucción incompleta, lo que explicaría los casos de resolución espontánea1,2,3. Habitualmente se localiza en la región cervical posterior o posterolateral y contiene múltiples tabiques (en este caso se localizó en la región paracervical izquierda y era multitabicado). Ocasionalmente se localiza en la zona cervical anterior, la axila, la pared torácica o la ingle. Entre el 20 y el 40% de los casos se asocia a normalidad cromosómica; en el resto de los casos se asocia a diversas aneuplodías o malformaciones. La historia natural del higroma no es bien conocida; hay series amplias de casos que ofrecen una aproximación a la naturaleza de esta enfermedad2,4.
El diagnóstico diferencial incluye edema nucal, meningocele, encefalocele, teratoma cervical, seudomembranas, hemangioma y quiste placentario subcorial. El diagnóstico diferencial con translucidez nucal es muy importante, pues ésta puede resolverse espontáneamente y, si el cariotipo es normal, tiene un buen pronóstico fetal. Para diferenciarlos, debe considerarse que el linfangioma quístico suele aparecer en localización cervical posterolateral y tiene morfología quística, mientras que la translucidez es una colección de líquido que aparece sólo tras el cuello2.
La incidencia de esta enfermedad oscila entre uno cada 200 a 750 abortos espontáneos, una cada 600 a 700 gestaciones de bajo riesgo y uno cada 1.775 a 6.000 nacidos vivos4,5. La tasa de aneuploidía asociada a linfangioma quístico diagnosticado prenatalmente es del 45 al 60% (síndrome de Turner, síndrome de Down, síndrome de Edwards, síndrome de Patau y otros). También se ha observado asociación a otros síndromes, como el de Noonan, el de pterigium múltiple, el de acondrogénesis tipo i, el de Fryn, el de Robert, el de Cowhock y el de alcoholismo fetal y teratógenos2,4–11.
El resultado fetal es incierto y varía según los estudios revisados. Algunas series muestran tasas altas de resultado fetal normal si el cariotipo es normal y no se identifican otras anomalías asociadas. Otros estudios muestran resultados más escasos2,5–11.
La prevalencia es de uno cada 1.775 a 6.000 nacidos vivos diagnosticados prenatalmente. De éstos, entre el 65 y el 89% de los casos opta por interrumpir voluntariamente la gestación, el 19% de los casos aborta espontáneamente y el 16% nace con vida. Al 96% se lo diagnostica antes de las 21 SDG y al resto entre las 22 y las 34 SDG. La edad gestacional media al diagnóstico es de 14 a 15 SDG. En este caso, el diagnóstico se realizó a las 25 semanas y 3 días; se trata por tanto de un diagnóstico tardío2,4,5. La edad media materna al diagnóstico es de 37 años (rango 19–48). En este caso, la mujer tenía 27 años2.
El tamaño medio es de 11,4mm de diámetro mayor (rango 2,8–2,9) al diagnóstico. En este caso medía 35×27mm inicialmente y creció hasta medir 74×65mm al final de la gestación; se trata pues de un caso excepcional por su gran tamaño2.
Entre el 82 y el 88% de los casos realiza cariotipo; de éstos, entre el 45 y el 61% de los casos son anormales (en estudios antiguos era del 9 al 51%). Las anomalías cariotípicas más frecuentes son síndrome de Turner (del 15 al 50%), síndrome de Down (del 9 al 15%), síndrome de Edwards (del 7 al 11%) y síndrome de Patau, en este orden5–11. Sin embargo, otros estudios afirman que las trisomías se asocian con más frecuencia que el síndrome de Turner a gestaciones con linfangioma quístico y aneuploides1,2,4,5,12. En este caso, el cariotipo, realizado mediante amniocentesis, fue 46XX.
El grado de gravedad (tamaño) del higroma se asocia al pronóstico fetal: los higromas graves se asocian a muy mal pronóstico. No obstante la gravedad es una valoración subjetiva y por eso puede inducir a error4,8,13. En este caso, el higroma tenía un gran tamaño y presentó buena evolución; también por esto es excepcional. La presencia de hidropesía también se asocia a un pronóstico desfavorable; el líquido rico en proteínas acumulado en el higroma puede generar hipoproteinemia fetal, que produciría edema generalizado e hidropesía no inmune1,2,4,8. Este caso presentaba alta concentración de proteínas en el linfangioma, pero no desarrolló hidropesía. En general, cualquier anomalía supone un factor de mal pronóstico2. Es más, el riesgo de aneuploidía aumenta con el número de malformaciones detectadas14.
Los casos sin aneuplodía se agrupan principalmente en los nacidos vivos, mientras que los casos con aneuplodías lo hacen en las interrupciones voluntarias de gestación. No obstante, el 12% de los casos no realiza cariotipo. Entre las interrupciones voluntarias con cariotipo normal, el 40% presenta otras anomalías asociadas, pero el resto no presenta ninguna otra alteración. En los abortos espontáneos, sólo entre el 33 y el 50% presenta aneuplodía, pero en la mayoría de los casos restante se observan múltiples malformaciones y síndromes malformativos complejos5. Las malformaciones, que aparecen en torno al 53% de los casos, son con más frecuencia cardíacas (28% de los casos) y menos frecuentemente son malformaciones renales, del sistema nervioso central, esqueléticas y craneofaciales2,5.
De entre los nacidos vivos (16% del total), sólo el 43% de los casos corresponde a lactantes normales (supone 7 casos de una serie de 99) que no presentan otras alteraciones tras la resolución del higroma. Así pues, sólo entre el 7 y el 9% de los casos sobrevive normalmente; su seguimiento hasta los 4 años muestra crecimiento y desarrollo normales. En los demás casos de nacidos vivos, se resuelva o no el higroma, aparecen diversos síndromes y malformaciones (Turner, Down, Noonan, polimalformación, etcétera) que conducen a la muerte ya en los primeros meses de vida2,4,5. Este caso supone pues uno de los pocos en los que ninguna otra anomalía afecta al lactante, que tiene un desarrollo completamente normal en los primeros meses de vida.
Según Ganapathy et al4, el higroma regresa espontáneamente en el 10% de las gestaciones aneuploides y en el 17,6% de las gestaciones euploides. El 90% de fetos aneuploides son mujeres, mientras que entre los fetos euploides el 70,5% son varones. Todos los niños normales que sobreviven tienen sexo masculino (3 de 42). Por tanto, el pronóstico de los casos diagnosticados podría ser mejor en fetos varones con cariotipo normal, a pesar de la alta mortalidad ya sea por aneuploidía o por las malformaciones asociadas. Este caso también difiere de lo habitual, pues se trata de una niña euploide con muy buen pronóstico.
Dada la alta asociación a aneuploidía, es aconsejable la realización de cariotipo en todos los casos de linfangioma quístico diagnosticado. No obstante es discutible la interrupción del embarazo según la aneuploidía y los hallazgos morfológicos. Así, en un caso de síndrome de Turner sin otras anomalías morfológicas salvo el higroma, es cuestionable la interrupción dada la evolución incierta del intelecto y la normalidad física de esos casos, más aun si una ecocardiografía mostrase normalidad cardíaca. Asimismo, es cuestionable la finalización de la gestación en casos con cariotipo normal en los que el único hallazgo sea el higroma; parece más razonable un estricto seguimiento ecográfico4,5. Por ejemplo, en este caso, la interrupción del embarazo habría supuesto la pérdida de una vida humana completamente normal.
Tan sólo entre el 33 y el 50% de los abortos espontáneos presenta aneuploidía. Esto podría inducir a pensar en la existencia de otros factores asociados. Las múltiples malformaciones asociadas aconsejan realizar un profundo estudio ecográfico de los casos de higroma, fundamentalmente ecocardiográfico, tal como se realizó en este caso. Asimismo, es aconsejable incidir en la necesidad de cariotipo y de estudio post mórtem de estos casos a fin de profundizar el conocimiento de esta enfermedad y de buscar factores asociados que justifiquen la presencia o ausencia de aneuploidías y de múltiples malformaciones4,5.
Algunos de los síndromes tienen una alta tasa de recurrencias (hasta el 25% si son síndromes autosómicos recesivos), por lo que el estudio y el consejo genético se hacen imprescindibles en parejas con un embarazo afectado5.
Diversos tratamientos para el linfangioma compiten hoy en día con la cirugía con muy buenos resultados, como por ejemplo la inyección intraquística de bleomicina o de OK 432. Así, la inyección de OK 432 ha demostrado una eficacia similar a la cirugía y una tasa mínima de complicaciones y de recidivas15–18. En este caso se optó por el abordaje quirúrgico, pues era sencillo y rápido, y se obtuvo un resultado óptimo.