Intentar dar una respuesta a los aspectos más controvertidos que se presentan en el estudio de esta patología mamaria tan prevalente.
MétodosRevisión bibliográfica existente al respecto.
ResultadosLa ecografía es el método diagnóstico de elección en la mastopatía fibroquística, pudiendo encontrar imágenes de similares características ecográficas que en las tumoraciones quísticas, diferenciándose en su número y en su diámetro máximo. En cuanto a su manejo, con nódulo dominante o separado, se hará ecografía para determinar si la lesión es quística o sólida. Si es quística, punción-aspiración con aguja fina; si es sólida, biopsia con aguja gruesa. Si existe mastalgia y nodularidad sin un nódulo dominante o con mamas difusamente nodulares que son indoloras, no necesitan ningún tratamiento activo.
Conclusiones1. La mastopatía fibroquística simple no tiene riesgo de malignización; sí lo tiene la mastopatía proliferativa con atipia (RR de 4-5). 2. La ecografía es la técnica diagnóstica de primera elección, que permite diferenciar los quistes simples de los quistes complicados, pudiéndose también emplear como método de seguimiento y servir como guía para realizar la aspiración del quiste. 3. Ante un cuadro clínico–eco y radiológico dudoso (BI-RADS 3) o sugerente de malignidad (BI-RADS 4 y 5), hay que hacer una punción-aspiración con aguja fina y/o biopsia con aguja gruesa como primera medida. 4. La mastopatía fibroquística asintomática no requiere seguimiento; la sintomática se seguirá con ecografía y/o mamografía.
To elucidate the most controversial features of fibrocystic breast disease, which is highly prevalent.
MethodsWe reviewed the literature on the topic.
ResultsIn fibrocystic breast disease, the diagnostic method of choice is ultrasound, which shows similar characteristics to those in cystic tumors but with differences in number and maximum diameter. With dominant, or separate, nodules, ultrasound can be used to determine whether the lesion is cystic or solid. In cystic lesions, fine-needle aspiration can be used; in solid lesions, core needle biopsy can be employed. No active treatment is required if there is mastalgia and nodularity without a dominant nodule, or if diffusely nodular breasts are painless.
Conclusions1. There is no risk of malignancy in simple fibrocystic breast disease but proliferative mastopathy with atypical cells has a relative risk of 4-5. 2. The diagnostic technique of choice for differentiating simple from complex cysts is ultrasound, which can also be used for monitoring and as a guide when aspirating the cyst. 3. When there are clinical and radiologic signs suspicious for malignancy (BI-RADS 3) or suggestive of malignancy (BI-RADS 4 and 5), the first step is fine-needle aspiration or core needle biopsy, or both. 4. Asymptomatic fibrocystic breast disease does not require follow-up, while symptomatic disease can be monitored with ultrasound and/or mammography.
La mastopatía fibroquística (MFQ), también conocida como enfermedad fibroquística de la mama, cambios fibroquísticos1, displasia mamaria y mama nodular dolorosa, es una entidad clinicopatológica crónica no maligna, que se evidencia como una zona dura, debido a la proliferación del tejido conectivo, del epitelial y a la presencia de quistes, de forma focal o difusa.
Entre un 45-85% de las pacientes que acuden a una consulta de mama lo hacen por este cuadro clínico. Constituye el proceso benigno más frecuente de la mama.
- -
Produce síntomas incapacitantes en el 5-10% de las pacientes.
- -
Se observa, clínicamente, en un 50% de las mujeres adultas y se detecta en un 90% de los estudios histológicos2,3.
- -
Representa la alteración más común evidenciada en la mama de la mujer durante la madurez sexual.
Clínicamente, se manifiesta con molestias en una o ambas mamas y con dolor a la palpación. El dolor suele ser uni o bilateral, generalmente de carácter cíclico, premenstrual. Otros síntomas son nodularidad y/o induración de forma variable y secreción por el pezón; la telorrea serosa suele aparecer en la MFQ y en los quistes simples y suele ser bilateral y pluriorificial, igual que la de aspecto lechoso. La sintomatología es frecuente que mejore con el embarazo y lactancia y también tras la menopausia.
A la exploración, se palpa un engrosamiento en forma de placa o múltiples irregularidades en una parte de la mama, sobre todo en cuadrantes superiores y externos, normalmente bilateral. Si hay un nódulo dominante, se presenta de forma regular, borde y superficie definidos y con poca movilidad.
Para su diagnóstico, además de la exploración y clínica, contamos con las pruebas de imagen4, cuyo objetivo fundamental es confirmar o descartar la existencia de una lesión maligna. Las lesiones de mama se clasifican mediante el sistema BI-RADS, que caracteriza los hallazgos de la imagen en varias categorías que van desde la normalidad hasta la confirmación histológica de malignidad. Se considera el idioma universal en el diagnóstico de la patología mamaria5. Este sistema fue diseñado en principio para clasificar las lesiones detectadas mediante mamografía; actualmente se han incorporado la ecografía y la RM a esta clasificación6,7. Las pruebas de imagen son:
Mamografía: zonas densas, difusas y con quistes. Los nódulos descritos (BI-RADS 2) son los quistes simples demostrados en el estudio ecográfico. La placa fibrosa se manifiesta en el estudio mamográfico como una densidad focal asimétrica de márgenes mal definidos (BI-RADS 3), precisando de la ecografía para completar el estudio.
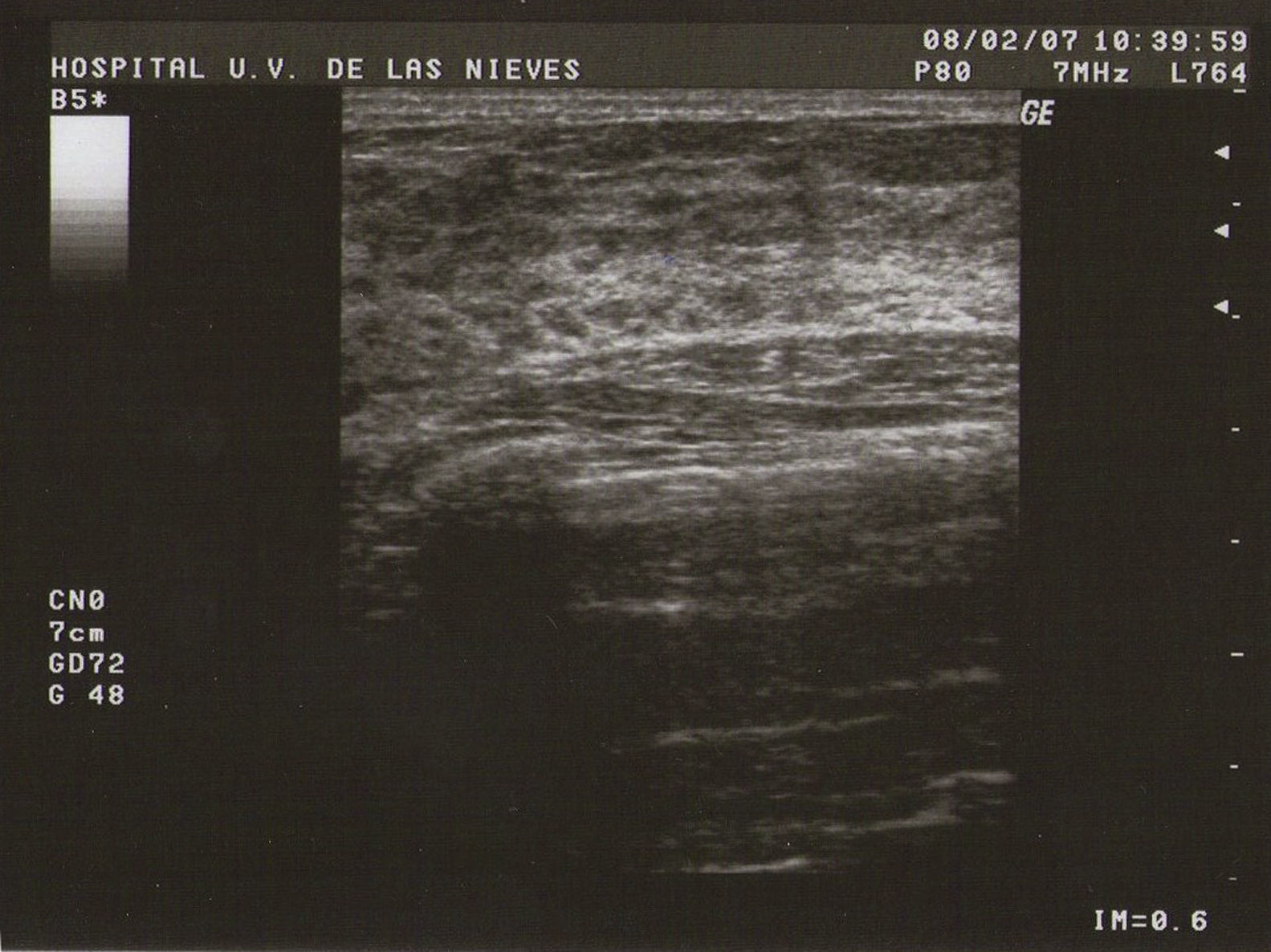
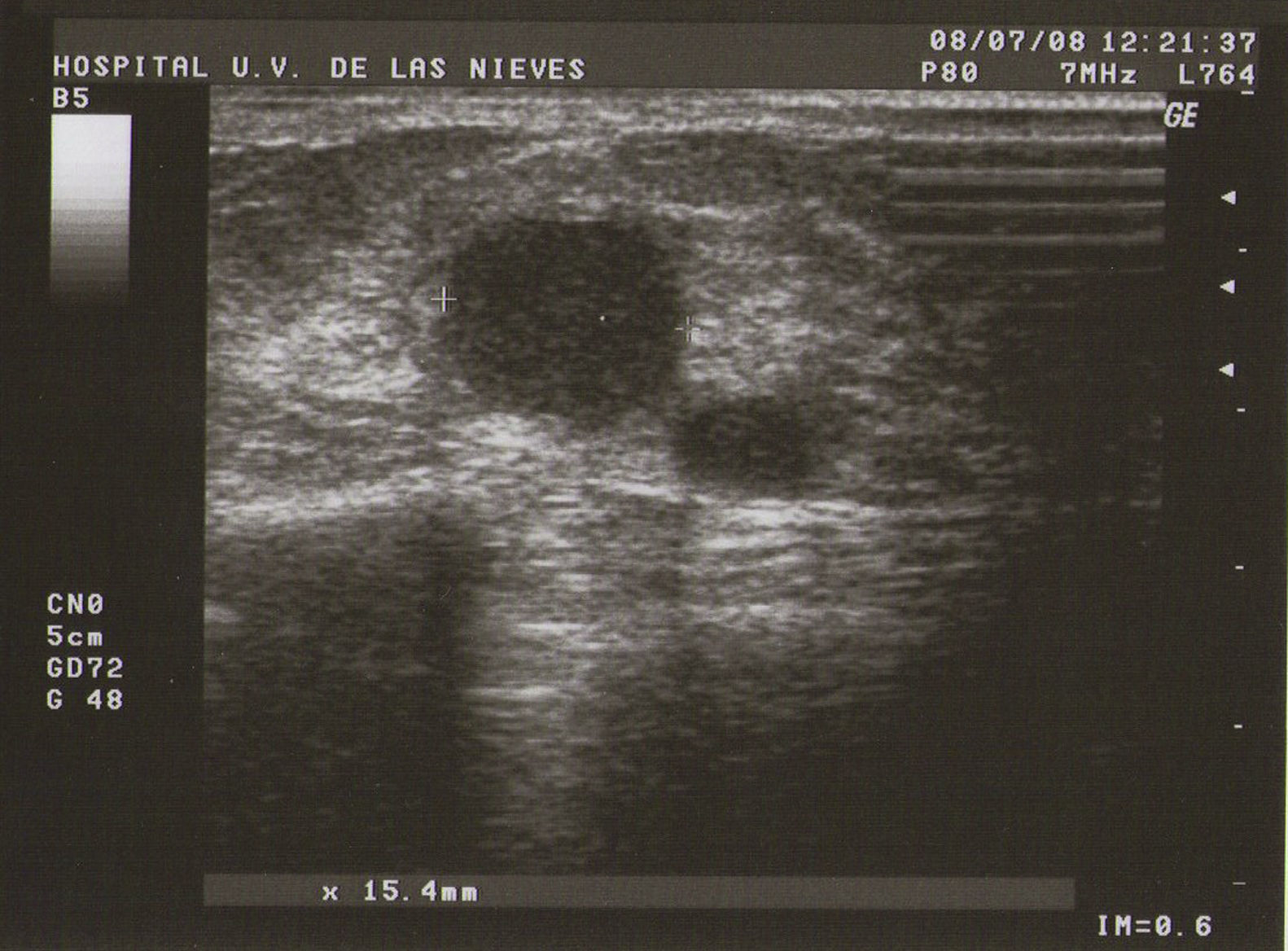
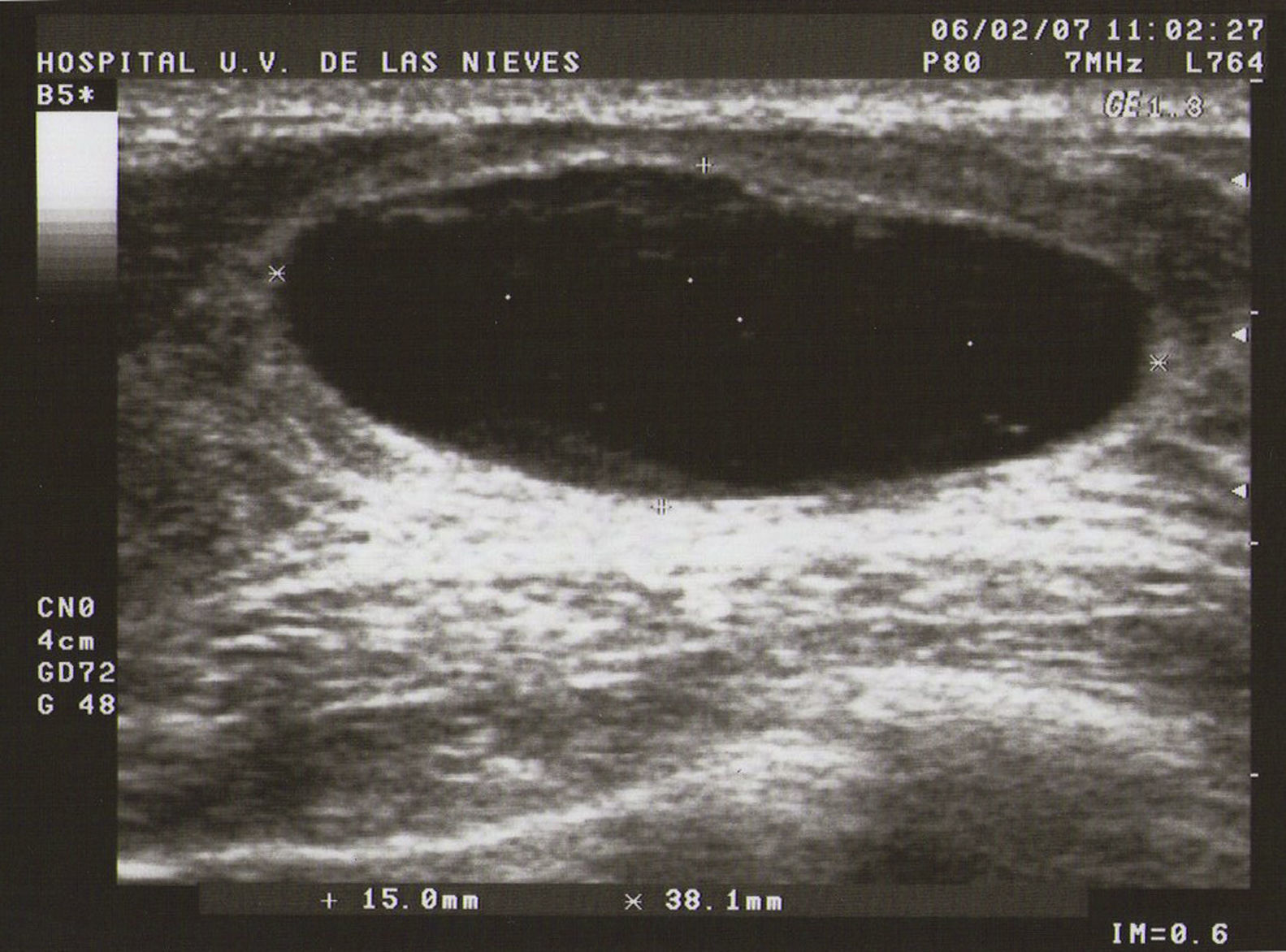
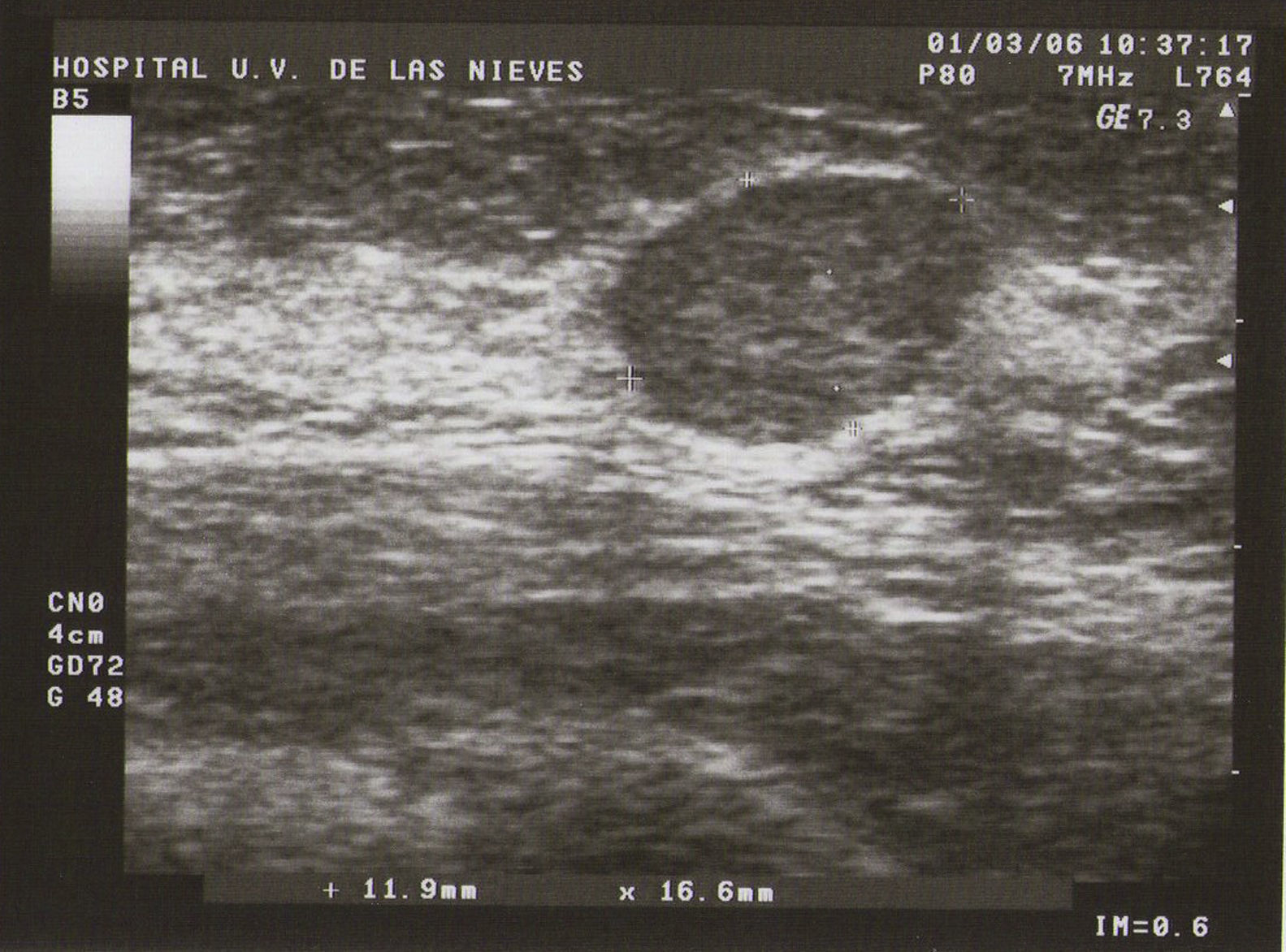
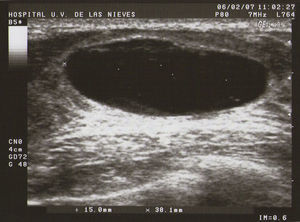
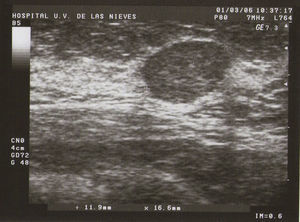
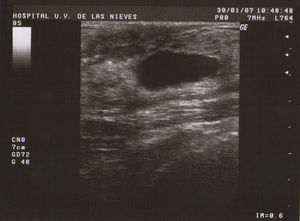
Ecografía: lo más habitual es que nos podemos encontrar en la MFQ imágenes de similares características ecográficas que en las tumoraciones quísticas, diferenciándose en su número y en su diámetro máximo. Atendiendo a su diámetro máximo, dividimos la MFQ en8:
- •
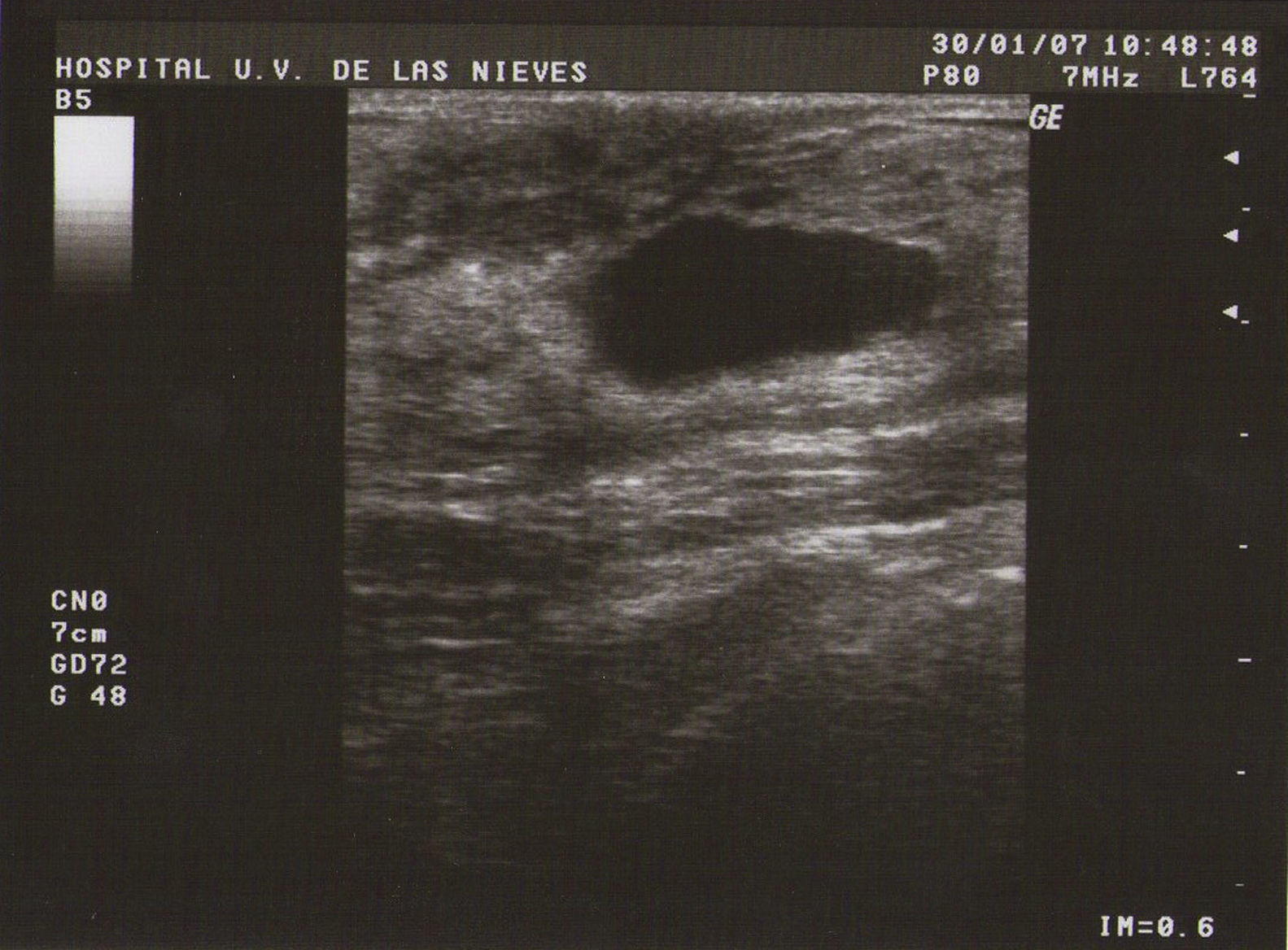
Tipo I (de pequeñas formaciones): tumoraciones quísticas de diámetro<0,5cm (fig. 1).
- •
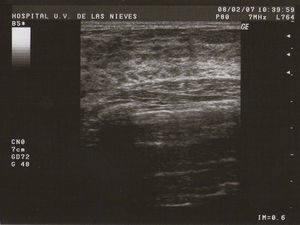
Tipo II (de medianas formaciones): entre 0,5–2cm (fig. 2).
- •
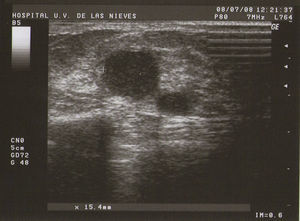
Tipo III (de grandes formaciones):>2cm (fig. 3).
Como todas las tumoraciones quísticas, ecográficamente se presentan redondeadas u ovaladas, con ecoestructura generalmente anecoica (BI-RADS 2), aunque pueden presentar otros aspectos como hipoecogénico con finos ecos internos, de contenido turbio o espeso, a veces con finos tabiques en su interior (BI-RADS 3). Sus bordes están bien definidos, su eje mayor suele ser horizontal y, con gran frecuencia, están presentes los signos indirectos (refuerzo acústico posterior y sombra acústica lateral), pudiendo ser, a veces, bilobuladas. No tienen ninguna señal Doppler interna.
En muchas ocasiones, tras el estudio ecográfico, se modifica la categoría BI-RADS previamente asignada por mamografía. Está indicada la realización de una ecografía mamaria ante la presencia de una alteración mamográfica para una caracterización más precisa, como es la presencia de una densidad asimétrica focal que, cuando no es palpable, la lesión es categoría BI-RADS 3. También, ante la evidencia de una distorsión arquitectural en el seno de áreas densas de tejido mamario, catalogada como BI-RADS 4.
Resonancia magnética: herramienta diagnóstica plenamente integrada en la detección y diagnóstico del cáncer de mama (CM), puede hacer aportaciones en el diagnóstico de la MFQ9,10 y de la patología mamaria en general, incluido el CM:
- -
Tamaño tumoral: la RM tiene una mejor correlación con el tamaño histológico de la lesión, mientras que la mamografía y la ecografía lo infravaloran.
- -
Multifocalidad y multicentricidad: la RM de mama puede detectar el 96% de la enfermedad multifocal y el 95% de las lesiones multicéntricas, mientras que la mamografía detecta el 37 y el 18%, y la ecografía el 41 y el 9%, respectivamente.
- -
RM para excluir presencia de enfermedad: cuando la mamografía y la ecografía no son concluyentes, una RM negativa puede ayudar a descartar patología tumoral.
En general, se puede afirmar que la RM tiene una alta sensibilidad y baja especificidad en la evaluación de las lesiones mamarias11.
También se dispone de las pruebas diagnósticas intervencionistas, como la punción-aspiración con aguja fina (PAAF)/biopsia con aguja gruesa (BAG): fibrosis, proliferación epitelial, adenosis, quistes y, en ocasiones, hiperplasia intraductal o lobulillar típica o atípica.
El diagnóstico diferencial se realiza en quiste único con: fibroadenoma, carcinoma, necrosis grasa y nódulo dominante de adenosis12.
En cuanto a su tratamiento, debe iniciarse con el uso de preparados hormonales existentes para el tratamiento sintomático13, tales como los progestágenos (de uso tópico o por vía oral o vaginal), antiprolactínicos (bromocriptina), antiestrógenos, fundamentalmente el tamoxifeno, medicamento no autorizado en nuestro país para el tratamiento de la mastalgia14 pero sí en otros países, y antigonadotropos (danazol). Si dichos preparados fracasan, se adoptarán otras diversas medidas paliativas15–17.
ObjetivosLos objetivos de este trabajo van a ser intentar dar una respuesta a los aspectos más controvertidos que se presentan en el estudio de esta patología mamaria tan prevalente, la MFQ, tales como: riesgo de malignización, técnica diagnóstica de imagen más efectiva, indicaciones actuales existentes para la realización de PAAF/biopsia, seguimiento más adecuado de estas pacientes y, finalmente, qué indica la Medicina Basada en la Evidencia acerca de esta patología mamaria.
Para lograr dichos objetivos, se ha seguido la siguiente metodología: revisión bibliográfica existente al respecto, desde 1990. Se han consultado libros específicos de patología mamaria, entre los que destaca el de K.I. Bland, E.M. Copelan, directores (2000), y atlas de ecografía mamaria, como el de Stavros (2004), Hagen-Ansert (2006), así como artículos publicados en revistas de prestigio, como Oncologist, N Engl J Med, J Ultrasound Med, etc. También se ha realizado una búsqueda a través de PubMed, con las palabras clave fibrocystic breast disease; fibrocystic change of the breast; cystic mastophaty. Finalmente, para constatar la evidencia existente, se ha consultado la Cochrane Library y Guías de Práctica Clínica, como la de la Sociedad de Obstetricia y Ginecología Canadiense; ICSI Health Care Guideline…
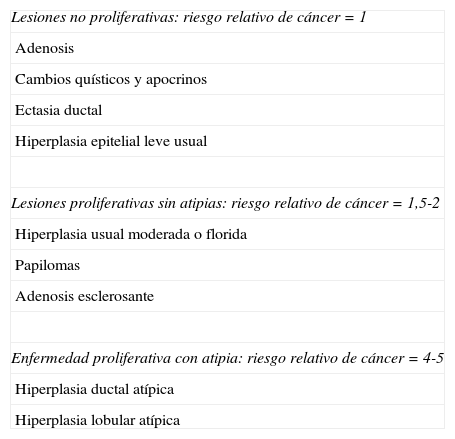
Primer objetivoLa mastopatía fibroquística es una patología mamaria benigna, pero ¿tiene riesgo de malignización?La naturaleza precancerosa de la MFQ es muy discutida, aceptándose que su transformación maligna es baja. La MFQ simple no proliferativa no implica tener un mayor riesgo de padecer CM. La mastopatía proliferativa sin atipia (que incluye hiperplasia, fibroadenoma con hechos complejos, adenosis esclerosante y papiloma intraductal) tiene un riesgo relativo para CM de 1,5-2 y la mastopatía proliferativa con atipia tiene un riesgo relativo para CM de 4-518,19 (tabla 1). Según Hartmann et al.20, el riesgo de CM en mujer joven con diagnóstico de proliferación epitelial atípica es 2 veces más que en las mujeres mayores de 55 años. En este mismo estudio, la historia familiar de CM es un factor independiente de incremento del riesgo, incluso en pacientes con lesiones no proliferativas. Habor et al.21 analizaron 677 intervenciones quirúrgicas mamarias y en 115 de las mismas (17%) hallaron la coexistencia de cáncer con enfermedad fibroquística mamaria. Estos hallazgos sugieren que el CM puede comenzar inicialmente como una hiperplasia epitelial, lo que corrobora que estos cambios hiperplásicos son un factor de riesgo de CM.
Cambios fibroquísticos, lesiones proliferativas y riesgo de cáncer de mama
| Lesiones no proliferativas: riesgo relativo de cáncer=1 |
| Adenosis |
| Cambios quísticos y apocrinos |
| Ectasia ductal |
| Hiperplasia epitelial leve usual |
| Lesiones proliferativas sin atipias: riesgo relativo de cáncer=1,5-2 |
| Hiperplasia usual moderada o florida |
| Papilomas |
| Adenosis esclerosante |
| Enfermedad proliferativa con atipia: riesgo relativo de cáncer=4-5 |
| Hiperplasia ductal atípica |
| Hiperplasia lobular atípica |
Modificada de Dupont WD, Page DL18.
Sin duda alguna, en este grupo de pacientes, la ecografía es la técnica diagnóstica más efectiva, constituyéndose en la prueba diagnóstica de imagen de primera elección, por diversos motivos:
- -
Un alto porcentaje de estas mujeres tienen mamas muy densas a estas edades, que no dan buena imagen en mamografía.
- -
Se debe evitar la radiación ionizante en mujeres jóvenes.
Ante el hallazgo en la palpación de una masa, la ecografía puede perfectamente determinar si es sólida (fig. 4) o quística (fig. 5)22–24 con un valor predictivo positivo del 94-96%, convirtiéndose por ello en el estudio auxiliar más relevante de la mamografía, especialmente en las lesiones no palpables de tamaño superior a 1cm.
El manejo de la masa sólida está bien definido; no ocurre lo mismo si es quística, por lo que la ecografía de alta resolución puede definir sus características y ayudar a adoptar una conducta adecuada25,26. En la MFQ difusa, la ecografía tiene gran validez diagnóstica; así, los estudios de Trofimova y Solntseva27 han demostrado que más de 14mm de espesor de la capa glandular y cambios glandulares inespecíficas de los tejidos no correspondientes a la edad de las pacientes identifican claramente, por ecografía, este tipo de MFQ. Por otra parte, la ecografía ductal28 puede diferenciar los quistes ductales de los lobulillares.
Si la masa ecográficamente es benigna, podrá usarse la ecografía como método de seguimiento. Del mismo modo, la ecografía resulta ser muy útil para diferenciar los quistes simples de los quistes complicados y masas complejas mamarias29 y también puede servir como guía para realizar la aspiración del quiste. Por otro lado, la ecografía puede evitar hacer biopsias innecesarias y reducir el número de exámenes de seguimiento a corto plazo25,30, fundamentalmente en aquellos casos en los que, ecográficamente, se detecte un patrón quístico simple (BI RADS 2).
La mamografía tiene el hándicap de que un alto porcentaje de estas mujeres tienen mamas muy densas a estas edades, que no dan buena imagen en la exploración mamográfica, precisando, en muchas ocasiones, de la ecografía para completar el estudio. Esta limitación de la mamografía tiene gran trascendencia clínica, pues en el estudio de Boyd et al.31 se demostraba que la densidad mamográfica elevada se asocia con un incremento de riesgo de padecer CM. Por su parte, la RM, aunque una de sus principales aplicaciones en la práctica clínica es ante la presencia de mamas densas con ecografía y mamografías dudosas, tiene 2 importantes limitaciones32:
- •
Baja especificidad para distinguir entre lesiones benignas y malignas (alta tasa significativa de falsos positivos); y
- •
Baja disponibilidad y alto coste.
En cuanto a la primera limitación, se ha demostrado que la especificidad, con cifras bajas que oscilan entre el 37 y el 97%, puede aumentar cuando se utiliza combinada con otros métodos diagnósticos y por profesionales con experiencia (70-80%). Dado que la especificidad no es muy elevada, deben biopsiarse las lesiones detectadas exclusivamente por RM con sistemas específicos de biopsia mamaria para decidir el manejo de la paciente.
En cuanto a la segunda limitación, hay que reseñar que en los últimos años se ha extendido considerablemente su uso, en especial para el diagnóstico y estadificación del CM, aunque bien es cierto que también encarece considerablemente el proceso diagnóstico.
Es muy importante reseñar que la RM no se recomienda como técnica diagnóstica para el cribado poblacional en mujeres de bajo riesgo ni tampoco en lesiones sospechosas de CM con el objetivo de evitar la realización de una biopsia por su ya referida baja especificidad que puede dar lugar a biopsias innecesarias y porque, a pesar de su elevada sensibilidad, existen falsos negativos que pueden proporcionar una falsa seguridad que puede empeorar el pronóstico33,34.
Aunque los trabajos existentes en la literatura sobre la utilidad de la RM en la MFQ son muy escasos, destaca el trabajo de Chen et al.10, en el que concluyen que, cuando la MFQ se presenta como una masa focal, la RM tiende a sobrediagnosticarla de malignidad.
Tercer objetivo¿En qué casos se realizará punción-aspiración con aguja fina/biopsia?Ante un cuadro clínico–eco y radiológico dudoso (BI-RADS 3) y ante todos los cuadros de mastopatía compleja, probablemente sospechosa de malignidad (BI-RADS 4) o altamente sugerente de malignidad (BI-RADS 5), hay que hacer una PAAF y/o BAG35. Si después del tratamiento médico persisten lesiones dominantes de enfermedad fibroquística o un área residual significativa, se debe recurrir a la biopsia o a la exéresis quirúrgica de la zona para su estudio histológico36. La biopsia escisional es recomendada en las siguientes situaciones23,25,37:
- •
Cuando queda masa tras su evacuación.
- •
En caso de recidiva antes de 2 meses.
- •
Cuando en la neumoquistografía se observan proliferaciones intraquísticas.
- •
Cuando la citología es atípica o dudosa.
- •
Si el líquido es hemorrágico y se reproduce a los pocos días, aunque todas las demás pruebas sean negativas.
En definitiva, la biopsia escisional estará indicada ante la presencia de quistes complejos, queson estos:
- •
Los quistes múltiples, con alta intensidad de proliferación epitelial asociada y distorsión arquitectónica (BI-RADS 3). Estos quistes catalogados como probablemente benignos presentan un índice de malignidad baja, entre el 0,336 y el 0,4%38 y, por ello, otra opción sería hacer un seguimiento periódico de los mismos, sin necesidad de biopsia escisional.
- •
Cuando hay asociación de enfermedad fibroquística con papilomatosis, vegetaciones o componentes sólidos intraquísticos y/o hiperplasia adyacente, todo lo cual implica una mastopatía compleja (BI-RADS 4), sospechosa de malignidad, en todos estos casos, sí es imperativa su escisión. Tea et al.39, con comprobación histopatológica, indican que criterios ecográficos de quistes complejos tales como pared gruesa quística, lobulaciones e hiperecogenicidad fueron predictores de malignidad y que 2 o más de dichos criterios, combinados entre si, estuvieron asociados con un riesgo de malignidad de 13,6 veces más elevado.
Es interesante reseñar el hecho de que, debido a que la mayoría de las lesiones mamarias benignas (entre las que se incluye la MFQ) no están asociadas a un incremento de riesgo para CM, los procedimientos quirúrgicos innecesarios deben ser evitados32,36. En este sentido, Daly et al.40, realizando punción-aspiración de quistes complejos, excluyendo los nódulos sólidos, los quistes con componentes sólidos intraquísticos y, por supuesto, los quistes simples, solo en una de las 243 lesiones puncionadas se evidenció signos de malignidad. Todos los casos de atipia fueron benignos tras su escisión quirúrgica. Debido a estos resultados obtenidos, dichos autores concluyen que, incluso los quistes complicados diagnosticados ecográficamente, deberían ser catalogados como probablemente benignos, ya que el CM que se presenta como un quiste complicado es muy poco frecuente (0,4%).
Cuarto objetivo¿Cuál es el seguimiento más adecuado de estas pacientes?17- 1.
MFQ asintomática: no requiere seguimiento. Se le aconsejará a la paciente autoexploración y si detectara algún cambio o iniciara síntomas, solicitará revisión.
- 2.
MFQ sintomática (mastalgia y nodularidad sin un nódulo dominante, con mamas difusamente nodulares):
- •
BI-RADS 2 (benigna): ey/o mamografía en 2 años, dependiendo de la edad de la paciente. Estas pacientes no necesitan tratamiento activo alguno, habiéndose demostrado que alrededor del 85% de las pacientes que presentan mastalgia pueden ser tratadas con éxito tan solo tranquilizándolas34. En un pequeño porcentaje de pacientes, en el 15% restante, sobre todo en mujeres jóvenes con dolor espontáneo, la mastalgia interfiere considerablemente con la actividad cotidiana. En estos casos, se intenta un tratamiento con analgésicos habituales o medidas físicas y, si no cede, se planteará una terapéutica hormonal13.
- •
BI-RADS 3 (probablemente benigna): seguimiento a los 6, 12 y 24 meses con pruebas de imagen. Dos años de seguimiento sin ningún cambio en la lesión se consideran suficientes para establecer diagnóstico de benignidad.
- •
- •
La nodularidad es un área de mayor sensibilidad y endurecimiento pobremente diferenciado del tejido adyacente, en forma simétrica, características clínicas frecuentemente encontradas en la mama fibroquística. Nivel de evidencia III.
- •
La ecografía es un estudio recomendado en mujeres menores de 35 años como estudio de apoyo en la evaluación clínica de la mujer con patología mamaria benigna (MFQ, por ejemplo). Grado de recomendación C.
- •
Los quistes mamarios presentes en la MFQ pueden ser palpables o no palpables, simples o complejos. Los quistes simples se encuentran frecuentemente como hallazgos ecográficos. Nivel de evidencia III.
- •
La ecografía puede ser útil no solo para diferenciar entre quiste y nódulo sólido, sino también entre masas benignas y malignas. Nivel de evidencia III.
- •
Existen trabajos que refieren que la ecografía tiene una precisión diagnóstica de casi el 100% para diferenciar quiste simple. Nivel de evidencia IV.
- •
Si una masa es palpable, debe diferenciarse si es sólida o quística. Grado de recomendación C.
- •
La aspiración de un quiste puro solo es necesario si es sintomático. El contenido líquido debe ser enviado a estudio citológico solamente en caso de tener características sanguinolentas o exista una masa residual. Nivel de evidencia IV.
- •
Si el contenido líquido de un quiste es turbio u opalescente debe ser enviado a estudio histopatológico. Grado de recomendación C.
- •
En una triple prueba que incluya examen físico, PAAF y estudio por imagen, si reporta características benignas, solo el 0,5% de los casos presentará cáncer. Nivel de evidencia III.
- •
En caso de quistes complejos, que no son palpables, requieren aspiración con aguja fina o biopsia para descartar malignidad. Grado de recomendación C.
- •
Un nódulo palpable en una mujer con factores de riesgo y/o hallazgos ecográficos o mamográficos anormales debe ser sometido a biopsia (PAAF o BAG). En caso de reporte de atipias, indicar una biopsia escisional. Buena práctica.
- •
La paciente que presenta una mamografía o ecografía con BI-RADS 3 debe ser enviada a valoración a un médico especialista. Buena práctica.
En cuanto al tratamiento de la mastalgia, presente en muchos casos de MFQ, la Medicina Basada en la Evidencia dice lo siguiente:
- •
La mastalgia, en general, raramente es un síntoma de CM, reportándose que solo el 5 al 18% se presentó como síntoma en CM. Nivel de evidencia IV.
- •
No ha mostrado evidencia el uso de vitamina E para el tratamiento de la mastalgia. Nivel de evidencia I.Grado de recomendación E.
- •
El tamoxifeno 10mg/día o el danazol 200mg/día durante 3 a 6 ciclos pueden ser considerados cuando los tratamientos de primera línea no sean efectivos. Nivel de evidencia I. Grado de recomendación A.
- •
Es efectivo el uso de bromocriptina 5mg/día para el tratamiento de la mastalgia cíclica, después de 3 meses de tratamiento. Sin embargo, sus efectos secundarios son mayores que con otros tratamientos. Nivel de evidencia IV.
- •
La aplicación tópica de progesterona para el tratamiento de la mastalgia cíclica no ha demostrado ser superior al placebo. Nivel de evidencia IV.
- •
El uso de 25g de linaza en la dieta diaria de la mujer es considerado como primera línea de tratamiento en la mujer con mastalgia cíclica severa. Nivel de evidencia I.Grado de recomendación A.
- •
Es una parte integral del tratamiento informar y tranquilizar a la mujer en el manejo de la mastalgia, como primera línea de tratamiento. Nivel de evidencia II. Grado de recomendación 1a.
- •
El uso de un sostén con un buen soporte puede aliviar la mastalgia cíclica y no cíclica. Nivel de evidencia II. Grado de recomendación 3b.
- •
No hay suficiente soporte para recomendar la reducción de cafeína en mujeres con dolor mamario. Nivel de evidencia i.Grado de recomendación e.
- 1.
La MFQ simple no tiene riesgo de malignización; sí lo tiene la mastopatía proliferativa con atipia (RR de 4-5).
- 2.
La ecografía es la técnica diagnóstica de primera elección, que permite diferenciar los quistes simples de los quistes complicados, pudiéndose también emplear como método de seguimiento y servir como guía para realizar la aspiración del quiste.
- 3.
Ante un cuadro clínico–eco y radiológico dudoso (BI-RADS 3) o sugerente de malignidad (BI-RADS 4 y 5), hay que hacer una PAAF y/o BAG como primera medida.
- 4.
La MFQ asintomática no requiere seguimiento; la sintomática se seguirá con ecografía y/o mamografía.
Los autores declaran no tener ningún conflicto de intereses.