La principal causa de mortalidad del carcinoma mamario es el desarrollo de metástasis producto de la invasión de células tumorales que viajan por la circulación sanguínea o linfática. Con el objetivo de detectar células tumorales circulantes en pacientes con cáncer de mama se han utilizado diversos marcadores. Los métodos utilizados principalmente son los inmunológicos y los basados en la detección de la expression de los marcadores por métodos de biología molecular, como la reacción en cadena de la polimerasa (PCR) y la transcripción reversa (RT)-PCR. La proteína denominada mamaglobina A (MGA) es parte de la familia de las secretoglobinas. La expression de MGA es altamente específica del epitelio mamario normal y neoplásico, y se utiliza para detectar células tumorales circulantes en pacientes con cáncer de mama mediante RT-PCR. No se ha detectado MGA en muestras de sangre de individuos sanos. Distintos estudios no encontraron una asociación significativa entre la detección de MGA y la presencia de metastasis ganglionar axilar, el tamaño tumoral, el grado histológico tumoral y la presencia de receptores hormonales en el tumor. Se ha sugerido que la detección de la MGA sería un marcador pronóstico independiente de la enfermedad. La determinación de MGA en sangre periférica de pacientes con carcinoma mamario, principalmente en las pacientes sin evidencia de metástasis, podría brindar un pronóstico de la evolución de la enfermedad y, tal vez, contribuir en la elección del tratamiento que hay que seguir para prevenir su recidiva.
The main cause of mortality in breast carcinoma is the development of metastases resulting from the invasion of tumor cells that travel by blood or lymphatic circulation. To detect circulating tumor cells in patients with breast cancer, diverse markers have been used. The methods applied are mainly immunological or based on the detection of marker expression by molecular biology techniques, such as polymerase chain reaction (PCR) and reverse transcription (RT)-PCR.
The protein known as mammaglobin A (MGA) is part of the secretoglobin family. MGA expression is highly specific to normal and neoplastic breast epithelia and is used to detect circulating tumor cells in patients with breast cancer by means of RT-PCR. MGA has not been detected in peripheral blood samples from healthy individuals. Several studies found no significant associations between MGA detection and the presence of axillary lymph node metastases, tumor size, histological grade and the presence of hormone receptors in the tumor.
MGA detection has been suggested to be an independent prognostic marker of the disease. Determination of MGA in the blood of patients with breast carcinoma, mainly in those without evidence of metastasis, could indicate a prognosis of disease progression and could contribute to the choice of treatment to prevent tumoral recurrence.
El cáncer esporádico surge principalmente a partir de mutaciones en células somáticas y es el resultado de un desarreglo genético acumulado a través del tiempo. La carcinogénesis en los seres humanos es un proceso de múltiples pasos y es dependiente de la edad. La proliferación celular descontrolada es una de las principales características del cáncer, donde las células tumorales han adquirido alteraciones en genes que están directamente involucrados en regular el ciclo celular1.
El cáncer puede desarrollar el proceso de metástasis tumoral, que ocurre por una secuencia de eventos ligados, que involucran múltiples interacciones huésped-tumor2. La metástasis se define como la diseminación de células neoplásicas a sitios secundarios separados, cercanos o distantes, donde proliferan para formar una masa extravascular de células tumorales3.
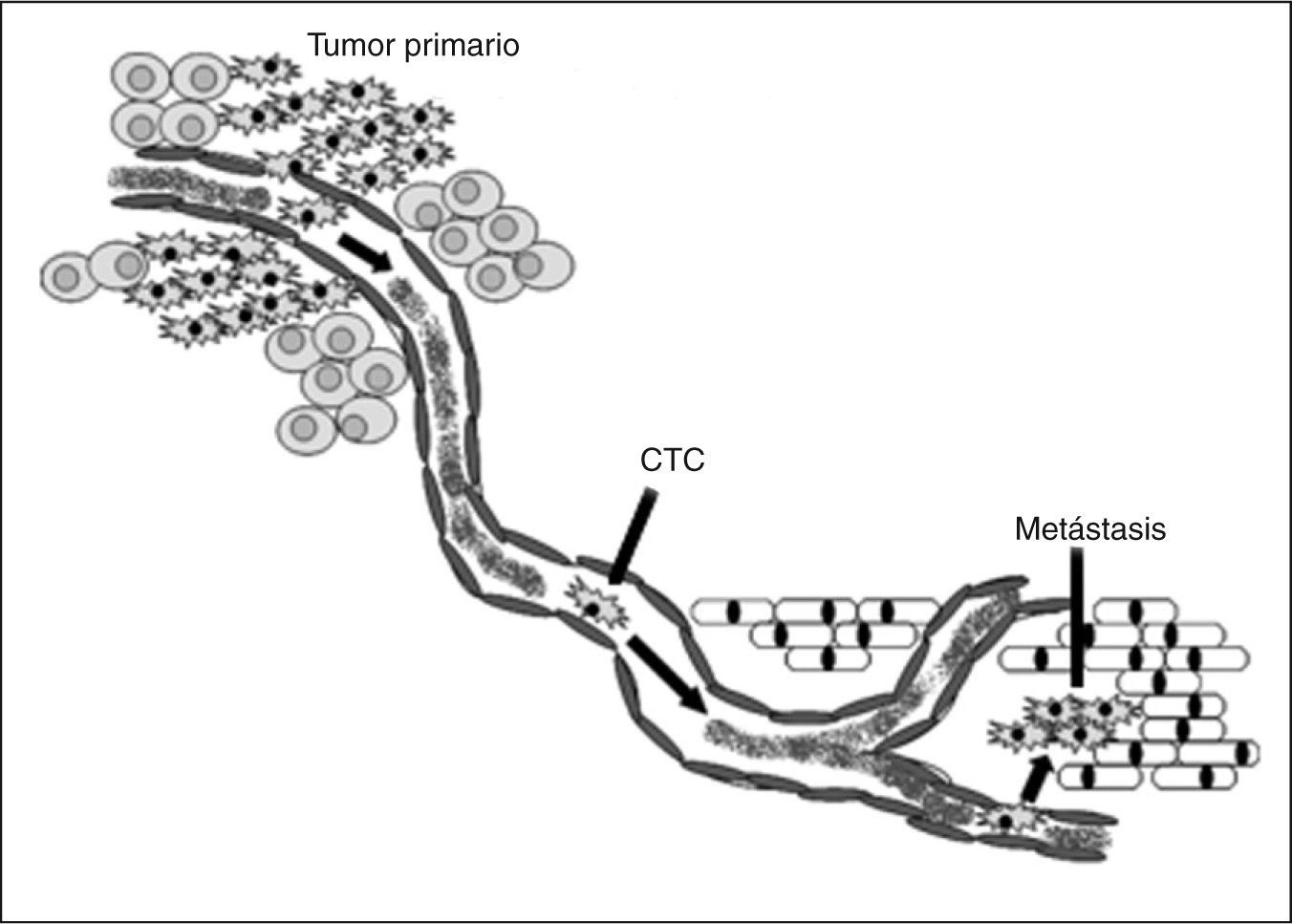
En el tumor se produce una selección clonal, que genera poblaciones de células con propiedades invasivas y potencial metastásico diferentes. De esta manera, el proceso metastásico consiste en una serie de pasos (fig. 1), que se deben completar satisfactoriamente para dar lugar a un tumor secundario: a) a medida que el tumor primario crece, requiere un suministro de sangre que le permita afrontar sus necesidades metabólicas (angiogénesis); b) la formación de nuevos vasos sanguíneos también puede proveer una ruta de escape, en la que las células pueden abandonar el tumor y entrar en el sistema circulatorio (intravasación); las células también pueden ingresar al sistema circulatorio indirectamente vía sistema linfático; c) las células tumorales necesitan sobrevivir en la circulación hasta que puedan detenerse en un nuevo órgano, donde abandonan el vaso e ingresan al tejido circundante (extravasación); d) una vez en el nuevo sitio, las células deben iniciar y mantener el crecimiento para formar micrometástasis; este crecimiento debe ser sostenido mediante el desarrollo de nuevos vasos sanguíneos, que permiten la formación de un tumor macroscópico (tumor secundario)4,5. En cada uno de estos estadios, la célula debe evadir la respuesta inmunológica y las condiciones metabólicas potencialmente adversas. Por lo tanto, se estima que solamente 1 de cada 105-106 células neoplásicas diseminadas va a ingresar en tejidos distantes del tumor primario y que sólo un pequeño porcentaje de estas células va a desarrollar una enfermedad metastásica6,7. Aun tumores de pequeño tamaño, muestran di seminación de células. Las células tumorales circulantes (CTC) incluyen células quiescentes o dormidas y microrresiduos celulares desprendidos del tumor primario8.
CÁNCER DE MAMAEl carcinoma mamario sigue siendo el tipo de cáncer más frecuentemente diagnosticado en las mujeres en todo el mundo y la mortalidad debida a esta enfermedad maligna está creciendo año a año9. Además, el cáncer de mama se encuentra entre las principales causas de muerte por cáncer en la mujer (15% de todas las muertes por cáncer en las mujeres)10,11.
A pesar de las mejoras en la detección y en el tratamiento del cáncer de mama, aproximadamente un 30-40% de las pacientes finalmente fallece por la enfermedad. El desarrollo de una enfermedad metastásica recurrente es la principal causa de estas muertes12.
Durante décadas se consideró que las células del cáncer de mama diseminadas alcanzaban en primer lugar los nódulos o ganglios linfáticos, antes de dirigirse a la sangre periférica y a localizaciones distantes, como la médula ósea. Sin embargo, actualmente se conoce que la dispersión metastásica ocurre en aproximadamente un 50% de los casos de pacientes con carcinoma mamario localizado y que alrededor del 30% de las pacientes sin enfermedad detectable en los nódulos linfáticos desarrolla metástasis distantes dentro de los 5 años siguientes al diagnóstico12,13.
Incluso las pacientes diagnosticadas precozmente, y en quienes se ha extraído quirúrgicamente el tumor, pueden recaer en la enfermedad como consecuencia de metástasis no detectadas que ocurrieron antes del diagnóstico inicial6. Las CTC ya aparecen en los estadios tempranos del carcinoma mamario, antes del desarrollo de metástasis, y pueden ser detectadas, en la mayoría de las pacientes, en el momento del diagnóstico de carcinoma mamario14.
DETECCIÓN DE CÉLULAS TUMORALES CIRCULANTESConsiderando que un número significativo de pacientes con nódulos linfáticos negativos han desarrollado enfermedad metastásica, la confiabilidad de los métodos histológicos para detectar células tumorales en nódulos linfáticos ha sido cuestionada12.
Dentro de los órganos distantes, la médula ósea sería un lugar común de asentamiento para las CTC provenientes de cáncer de mama y de otros carcinomas primarios, incluso en ausencia de metástasis en ganglios linfáticos o signos clínicos de otras metástasis distantes15. Sin embargo, la aspiración de la médula ósea durante la cirugía consume tiempo, es costosa y es dolorosa para el paciente. Por otra parte, no se pueden tomar múltiples muestras, particularmente cuando se quiere realizar una monitorización del paciente a través del tiempo2.
Por el contrario, la detección de CTC en sangre periférica parece ser el método ideal; la toma de muestra es relativamente simple y se puede realizar en reiteradas oportunidades. Además, muchos pacientes que no presentan CTC en médula ósea sí lo hacen en sangre periférica12. Varios estudios han demostrado la presencia de CTC en sangre periférica de pacientes con un estadio temprano de cáncer sin metástasis10,16,17.
Técnicas para la detección de células tumoralesEl examen histológico de nódulos linfáticos teñidos con hematoxilina-eosina es el método más frecuente y tradicional. Sin embargo, esta técnica no permite detectar pequeñas cantidades de células tumorales18.
Para nódulos linfáticos también se utiliza la inmunohistoquímica, mediante anticuerpos que se unen a marcadores más o menos específicos de células de cáncer de mama. Esta técnica es laboriosa y consume mucho tiempo, ya que se debe analizar numerosas secciones del tejido para un ensayo fiable19. Además, este método requiere un citólogo que confirme la identidad de las células teñidas y no es apto para detectar la pequeña cantidad de células tumorales presente en médula ósea y sangre periférica2.
Por otro lado, se puede utilizar métodos basados en la detección de secuencias específicas de ácidos nucleicos, de los cuales los más usados son la reacción en cadena de la polimerasa (PCR), ya sea cuantitativa o cualitativa, y la transcripción reversa (RT)-PCR, y variaciones de ésta, en la que se requiere un paso previo de transcripción reversa a partir de ARNm específicos, por lo tanto, esta última estaría indicando la expresión de genes específicos2. La PCR se utiliza para identificar y caracterizar CTC, mediante la búsqueda de mutaciones puntuales asociadas al tumor en oncogenes o genes supresores de tumores, pero su principal desventaja es el grado sustancial de variabilidad genética entre tumores12. Por otra parte, el uso de PCR tiene poca especificidad; no está claro si el ADN libre que es amplificado en sangre periférica es de CTC o si proviene de tumores primarios, tumores metastásicos o de tejido normal7. La RT-PCR se utiliza para identificar CTC a través de la expresión en dichas células de transcriptos de ARNm específicos o asociados a cáncer de mama, y es una técnica cuya sensibilidad (la cual es generalmente superior a la de las técnicas basadas en anticuerpos) permite detectar pequeñas cantidades de moléculas de ARNm específicas entre la totalidad de los ARNm de un tejido o células20. Esta detección de ARNm específicos de tejido en un lugar del cuerpo donde normalmente estos transcriptos no son expresados indica una diseminación del tumor, ya que las células malignas generalmente continúan expresando los marcadores que son característicos o específicos del tejido normal a partir del cual el tumor se originó21. Asimismo, el ARN es más frágil que el ADN y es muy susceptible a la degradación por ribonucleasas sanguíneas, haciendo que la detección de ARNm específicos de células tumorales indique la presencia de CTC viables que están generando ácidos nucleicos activamente2. La RT-PCR anidada, en la que se realizan 2 rondas de amplificación consecutivas, se usa para aumentar la sensibilidad de la detección. También se puede utilizar RTPCR cuantitativa18.
Para la mayoría de los marcadores determinados por técnicas basadas en ácidos nucleicos se logra alcanzar, en la mayoría de los casos, una sensibilidad de 1 CTC detectada entre 107 células nucleadas de sangre periférica22,23.
Enriquecimiento preanalítico de células tumorales circulantesIncluso en las pacientes con metástasis, el número de células tumorales diseminadas en sangre periférica o en médula ósea es bajo comparadas con las células normales que las rodean. En sangre periférica, las CTC se encuentran generalmente en una frecuencia de 1 célula cada 105-107 células mononucleares24 o en un número < 10 CTC/ml. Esto llevó a la necesidad de desarrollar métodos específicos para enriquecer (hasta 10.000 veces) la población de CTC antes de proceder a su detección en sangre periférica o médula ósea12. Los métodos comúnmente utilizados son los gradientes de densidad, como los de Percoll o Ficoll, que permiten la separación de las células mononucleares que contendrían la mayor fracción de CTC25.
Marcadores de células tumorales circulantesLas células de cáncer de mama expresan comúnmente varios marcadores, como las citoqueratinas, el antígeno carcinoembriogénico, el CA 15.3, el receptor del factor de crecimiento epidérmico (EGF-R) y el cerbB-2, entre otros12,26. Sin embargo, estos marcadores presentan una sensibilidad y/o especificidad insuficiente para detectar CTC provenientes del carcinoma mamario27. La baja especificidad es consecuencia, entre otras cosas, de la presencia de seudogenes, de la transcripción ilegítima (transcripción en bajas cantidades de un gen específico de tejido en células no específicas) en otras células y tejidos o de la inducción de los genes investigados por citocinas y factores de crecimiento en trastornos hemáticos12,28.
Mamaglobina AEn 1996 Watson y Fleming aislaron un ADNc desconocido a partir de una muestra de adenocarcinoma mamario, y denominaron a este nuevo gen mamaglobina humana (hMAM)29,30. La mamaglobina exhibe homología con varias proteínas secretorias epiteliales, formando parte de la superfamilia de las secretoglobinas (SCGB)31,32. Las SCGB son un grupo de proteínas pequeñas de secreción, raramente glucosiladas, que forman homodímeros, heterodímeros y heterotetrámeros, y que se expresan principalmente en tejidos mucosos33. Todavía no hay una función fisiológica aceptada para ninguna de las SCGB, aunque algunas de ellas se han implicado en el desarrollo del cáncer34, en la señalización, en la regulación del sistema inmunitario, en la quimiotaxis y, posiblemente, en el transporte de moléculas aromáticas como hormonas esteroides y bifenilos12,35.
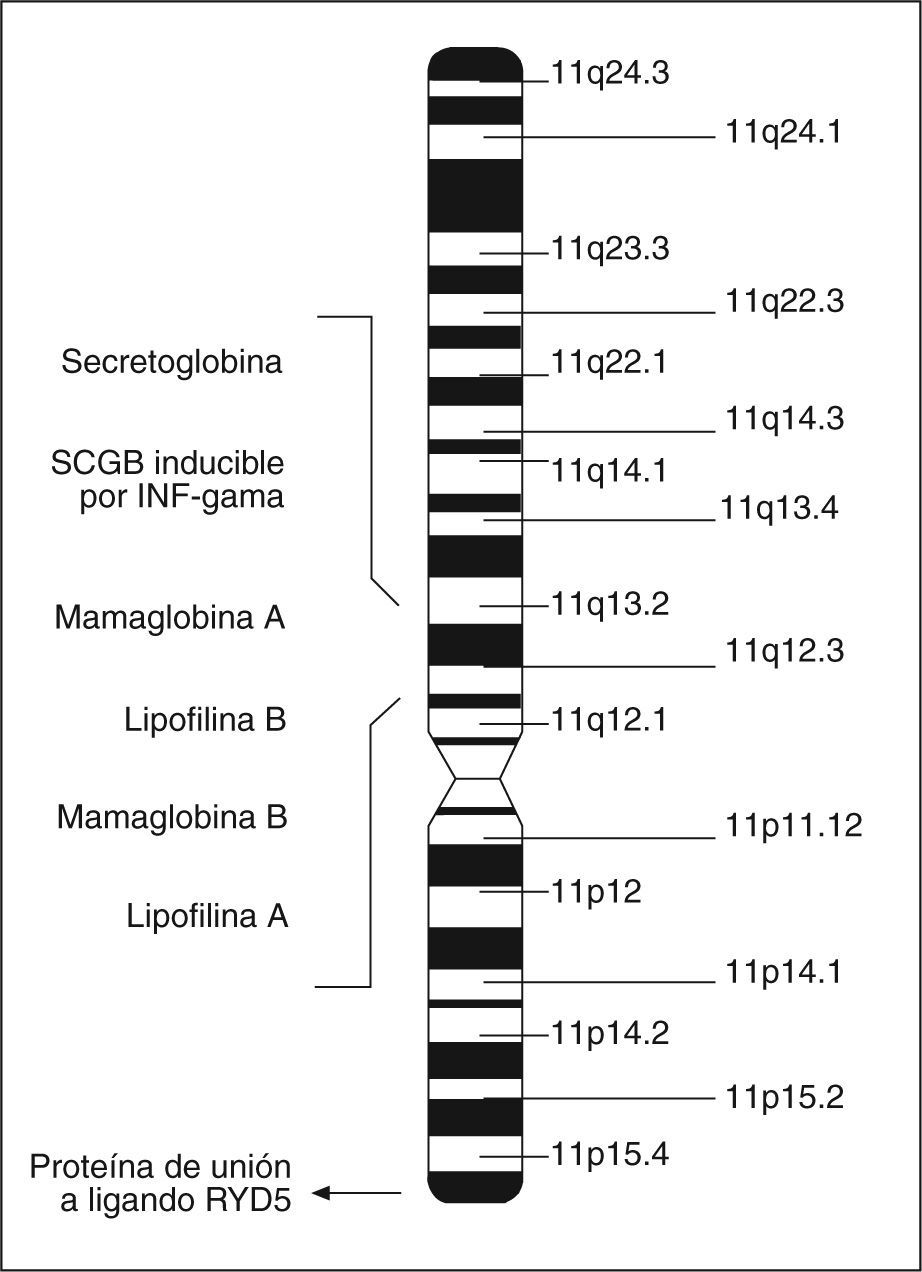
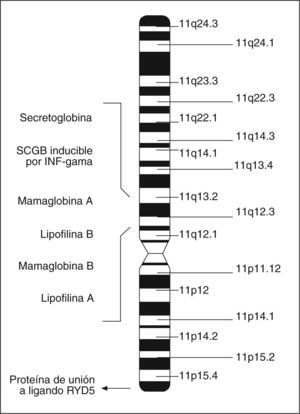
Las proteínas de la superfamilia de las SCGB están presentes en los mamíferos36 y las aves37, y la cantidad de miembros crece continuamente. En la actualidad se conocen 9 SCGB humanas33, entre las que se encuentra la mamaglobina A (MGA). La MGA y la mayoría de los otros miembros humanos se localizan en el cromosoma 11q12.3-13.1, donde se encuentran de manera agrupada31,36 (fig. 2). Esta región está frecuentemente amplificada en neoplasias de mama31.
El ADNc de la MGA codifica un polipéptido de 93 aminoácidos con una masa molecular de 10,5kDa, en el que los primeros 19 residuos corresponden a una secuencia péptido señal hidrófuga, que es clivada durante la secreción de la proteína madura de 8,5 kDa37. En el tejido mamario, la MGA se encuentra glucosilada y unida covalentemente a la lipofilina B de manera antiparalela (heterodímero), formando a su vez un heterotetrámero de 45kDa mediante unión no covalente de 2 heterodímeros35,38. Estudios previos sugieren que la expresión de la MGA no estaría asociada con la lactancia sino con la proliferación de la glándula mamaria y la diferenciación terminal31. Sin embargo, hasta el día de hoy la función de la MGA sigue siendo desconocida39.
Mamaglobina A como marcador de células tumorales circulantes de cáncer de mamaLa determinación de MGA se ha convertido en uno de los principales métodos para la detección de CTC mediante RT-PCR, y es el marcador de cáncer de mama más estudiado después de la citoqueratina 19 (CQ-19)12.
Expresión de mamaglobina A en tejidos sanos y en tumores primariosEn un trabajo pionero, Watson y Fleming analizaron la expresión de MGA en 35 carcinomas mamarios usando RT-PCR y Northern blot. Se comunicó la sobreexpresión de MGA (al menos 10 veces respecto del tejido normal) en el 23% de los tumores estudiados30. Al examinar la expresión del ARNm de MGA en tejidos adultos y fetales de humanos, entre ellos mama, pulmón, glándula salival, útero, próstata, ovario, testículo y placenta, y en leucocitos de sangre periférica, ganglios linfáticos y médula ósea, determinaron que la expresión de MGA estaba restringida a la glándula mamaria adulta30,40.
Corradini et al41 estudiaron una serie de marcadores tumorales y concluyeron que la MGA y la maspina eran los únicos específicos para cáncer de mama, expresándose en un 97 y un 80% de las muestras de tejido con carcinoma mamario, respectivamente. A diferencia de las citoqueratinas 19 y 20, del receptor del EGF-R, del CA 15.3 y del antígeno carcinoembriogénico, la MGA y la maspina no se expresaron en ninguna muestra de sangre periférica ni en células progenitoras de sangre periférica o de médula ósea de donantes sanos, ni en muestras de tumores hemáticos, muestras de sangre o células progenitoras de sangre periférica de pacientes con tumores hemáticos o tumores sólidos diferentes del carcinoma mamario.
O'Brien et al42 compararon la expresión de 3 miembros de la familia de SCGB humanas (MGA, mamaglobina B y lipofilina B) en tejidos de mama no malignos, fibroadenomas y carcinomas mamarios. La MGA mostró ser el marcador más específico de los 3 para el cáncer de mama.
Recientemente se realizó un estudio43 de los perfiles de expresión en tejidos tumorales de varios marcadores moleculares, con el fin de determinar los más adecuados para identificar el origen de los sitios primarios de carcinomas metastásicos de diferentes órganos. La MGA y el factor de transcripción Ets derivado de la próstata fueron los únicos que mostraron alta especificidad para detectar metástasis provenientes del cáncer de mama.
En estudios recientes27,33,44-46 la MGA se ha detectado también en tejidos normales y malignos del tracto genital femenino (cérvix, útero y ovario) y en efusiones malignas ginecológicas. Sin embargo, Grünewald et al44 encontraron una expresión de MGA significativamente mayor en tejidos de mama respecto de tejidos de ovario y de endometrio. Se comunicó también la expresión de MGA en tejidos normales y tumores de las glándulas sudoríparas47 y salivales46, y raramente y en bajo grado de expresión en otros tejidos33.
Expresión de mamaglobina A en sangreEn un estudio previo, donde detectaron CTC mediante la determinación de la expresión de MGA en sangre periférica de pacientes con cáncer de mama, ninguna de las muestras de sangre de 27 donantes sanos fue positiva, mientras que un 25% de las muestras de sangre de pacientes con cáncer de mama fue positivo para el ARNm de MGA28. Estos resultados coinciden con los de Cerveira et al48, quienes detectaron MGA en sangre en el 41% de las pacientes con cáncer de mama pero en ningún donante sano. Otros trabajos28,49,50 demostraron también la especificidad del marcador, al detectarlo en las pacientes con carcinoma mamario pero no en los individuos sanos.
Grünewald et al26 mostraron que la MGA es un marcador de mayor especificidad en comparación con el receptor del EGF-R y la CQ-19 para la detección de CTC en sangre de pacientes con cáncer de mama. En dicho estudio, ninguna de las muestras de sangre de individuos sanos o de pacientes con enfermedades hemáticas fueron positivas para MGA. Sin embargo, el 39% de los individuos sanos fueron CQ-19 positivos y el 25 y el 10% de los pacientes con enfermedades hemáticas expresaron EGF-R y CQ-19, respectivamente26.
Ballestrero et al51 estudiaron el efecto de diferentes citocinas sobre la expresión de la MGA y la maspina en muestras de sangre y de médula ósea mediante RTPCR anidada. A diferencia de la maspina, la MGA no fue inducida por ninguna citoquina. Además, la maspina se detectó en un 40% de muestras de sangre y de médula ósea de pacientes con trastornos hemáticos/ inflamatorios, no así la MGA. Estos resultados indicaron una mayor especificidad por parte de la MGA al no haber interferencia por citocinas en los sitios de detección estudiados, que de lo contrario podrían llevar a falsos positivos51.
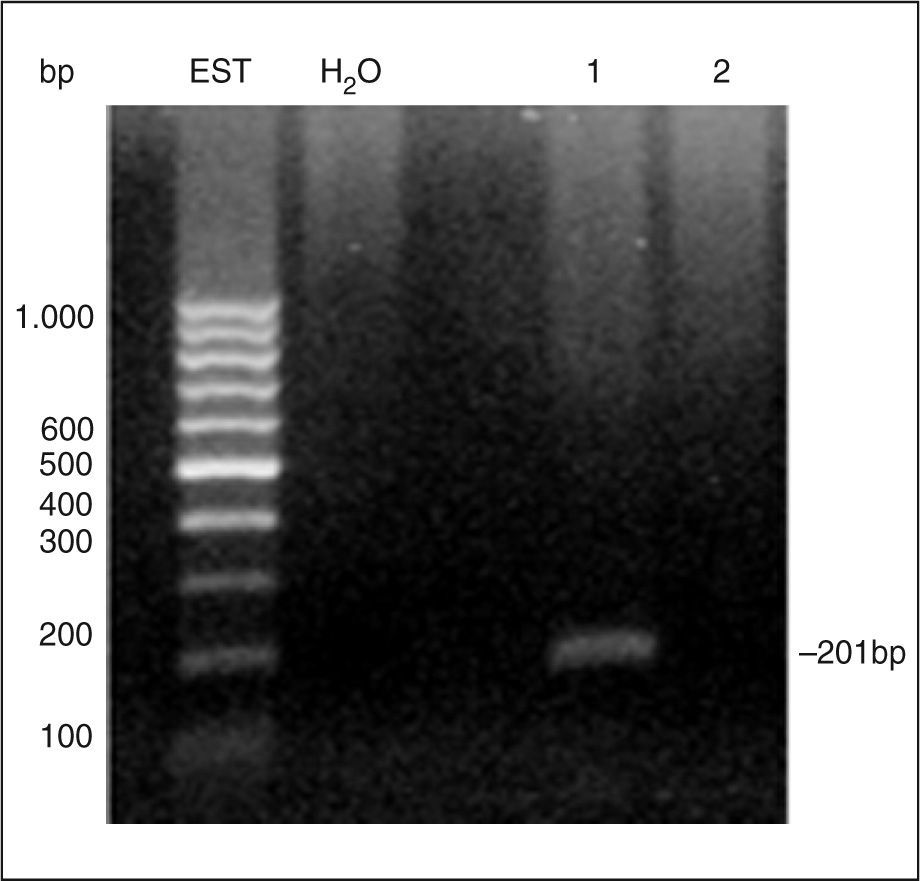
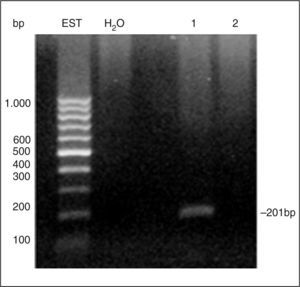
En un estudio preliminar realizado en nuestro laboratorio se ha detectado la expresión de MGA mediante RT-PCR en alrededor del 40% de las muestras de sangre de 50 pacientes con cáncer de mama (fig. 3). En tanto que el marcador no se encontró en ninguna de las muestras de sangre provenientes de donantes sanos, avalando su especificidad.
Mamaglobina A y detección de células tumorales circulantes: perspectivasEstudios previos no han encontrado asociaciones significativas entre la presencia de MGA en sangre periférica de las pacientes con cáncer de mama y otros factores pronósticos del tumor, como la presencia de metástasis ganglionares, tamaño del tumor, grado histológico, etc.27,49,50,52. Estos resultados sugieren que la determinación de MGA sería un marcador independiente. Se ha reportado una tendencia hacia una mayor expresión de MGA en pacientes cuyos tumores de mama no expresan receptores de estrógeno50.
Cabe recordar que alrededor de un 30% de pacientes sin enfermedad detectable en los nódulos linfáticos en el momento del diagnóstico igualmente pueden desarrollar metástasis distantes y recaer en la enfermedad. La detección de CTC mediante MGA podría utilizarse entonces para evaluar la progresión de la enfermedad, así como para identificar, pacientes que, a pesar del tratamiento, tienen un mayor riesgo de recurrencia o mayor probabilidad de desarrollar un tumor secundario y que, por lo tanto, deberían continuar con una terapia adyuvante más agresiva.
Los resultados de numerosos estudios sugieren que MGA es un marcador de alta especificidad y es independiente de los factores pronósticos tradicionalmente utilizados en el cáncer de mama27,49,50,52. Sin embargo, en los últimos consensos sobre marcadores en cáncer de mama se estableció que aún falta mayor evidencia clínica para poder incorporar la detección de CTC en los estudios de rutina del carcinoma mamario53.
En conclusión, aunque los datos preliminares sugieren que la detección MGA en sangre es un marcador independiente y muy específico, será necesario realizar nuevos estudios clínicos para corroborar si la expresión del marcador en sangre periférica de pacientes con carcinoma mamario, principalmente en las pacientes sin evidencia de metástasis, puede brindar un pronóstico de la evolución de la enfermedad y, tal vez, contribuir en la elección del tratamiento que hay que seguir para prevenir su recidiva.