INTRODUCCION
Vía anticoagulante de proteína C
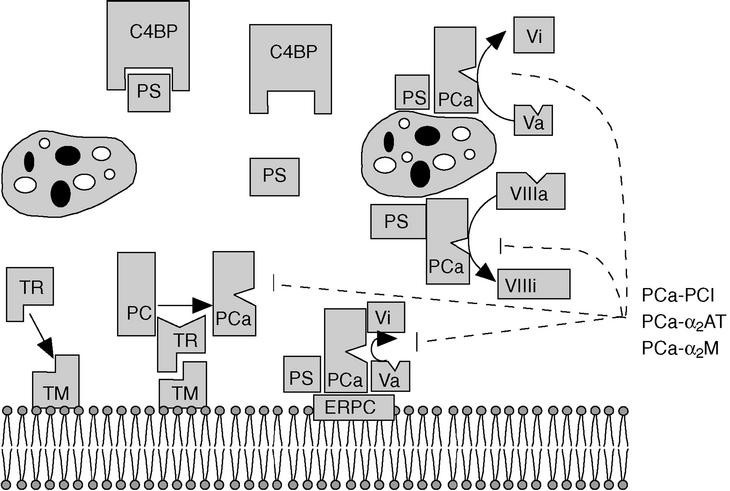
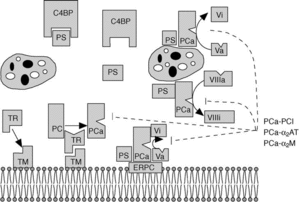
La proteína C es una glucoproteína dependiente de la vitamina K sintetizada en el hígado que circula en el plasma a una concentración de 50-80 nmol. Es el precursor de una serinproteasa y contiene residuos (check)-carboxilados que le confieren la capacidad de unirse a los fosfolípidos mediante el calcio. Una vez activada, la proteína se une a los fosfolípidos de membrana o al receptor endotelial de la proteína C y actúa como un potente anticoagulante degradando los factores Va (factor V activado) y VIIIa (factor VIII activado). En esta actividad proteolítica actúan como cofactores la proteína S y el propio factor V1-4.
La trombomodulina es una proteína integral de membrana. Consta de una zona aminoterminal parecida a la lecitina (lecitin-like domain), seguida de dos dominios parecidos al ipso de crecimiento epitelial (EGF), un dominio rico en los aminoácidos serina y treonina, un dominio transmembrana y una cola citoplasmática. El quinto y el sexto EGF son esenciales para la unión a la trombina, mientras que la unión calcio-dependiente a la proteína C requiere la región que une el tercer y cuarto EGF. En el residuo Ser 474, la trombomodulina contiene una cadena de sulfato de condroitin. Se ha identificado trombomodulina humana en diferentes tejidos, como vasos linfáticos, placenta, plaquetas, megacariocitos, macrófagos, neutrófilos y células musculares. En el sistema vascular se localiza principalmente en los capilares y, en menor cantidad, en las arterias y venas. La actividad anticoagulante de la trombomodulina consiste en que, tras su unión a la trombina, neutraliza la actividad procoagulante de ésta, y el complejo formado activa la proteína C. La trombina se une con gran afinidad a la trombomodulina. Una vez unida, la trombina pierde su actividad procoagulante: no transforma el fibrinógeno en fibrina, no activa los factores V, VIII o XIII, y tampoco las plaquetas o las células endoteliales Además, la trombomodulina ejerce una actividad parecida a la heparina acelerando la neutralización de la trombina por diferentes inhibidores de las proteasas como la antitrombina, cofactor II de la heparina etc. La trombomodulina induce un cambio conformacional en la trombina resultando en un eficiente reconocimiento y activación de la proteína C. La expresión de trombomodulina en la superficie endotelial es susceptible a diversas condiciones patológicas: disminuye por diversos agentes antiinflamatorios como el factor de necrosis tumoral, la interleucina 1, las endotoxinas bacterianas, la hipoxia, etc.4-14.
La proteína S es una glucoproteína dependiente de la vitamina K. Se sintetiza en el hígado, pero también en las células endoteliales y megacariocitos. Se encuentra en el plasma en una concentración de 250-350 nmol. Está formada por un dominio C terminal homólogo a la proteína que une a los andrógenos (androgen binding protein), 4 EGF, un dominio sensible a la trombina y un dominio Gla aminoterminal que le facilita su unión al calcio y a la membrana celular. La unión al calcio protege a la proteína S de la degradación por la trombina y, además, induce un cambio de conformación que es necesario para que actúe como cofactor de la proteína C activada (PCa). La interacción con la PCa se cree que se realiza mediante el dominio sensible a la trombina y el EGF. La zona parecida al transportador de andrógenos está relacionada con la unión al C4b binding protein (C4bBP). El C4bBP es una glucoproteína de alto peso molecular reguladora del complemento, reactante de fase aguda, formada por 7 subunidades * idénticas y una subunidad ß. Las subunidades * se unen al C4b y la subunidad ß a la proteína S. En el plasma un 5% de proteína S circula libre y posee actividad cofactor Pca. El 60% restante está unido a C4bBP, y en esta forma no participa en la actividad anticoagulante de PCa4,12,14-18.
El mecanismo anticoagulante de la proteína C se inicia cuando se genera una pequeña cantidad de trombina4 (fig. 1). Ésta se une a la trombomodulina y el complejo trombina-trombomodulina activa a la proteína C unida a los fosfolípidos de la membrana o al receptor endotelial de la proteína C. La PCa, junto con la proteína S y el factor V, que actúan como cofactores, tiene como principal sustrato el factor Va, al que degrada rompiendo dos enlaces: el primero en la Arg 506, que produce una rápida, pero incompleta, pérdida de actividad, y después en la Arg 306, con lo que la inactivación del factor Va es completa. Una alteración en la molécula del factor V relativamente frecuente y asociada a trombofilia es el factor V de Leiden. Consiste en un factor V en el que el aminoácido Arg 506 ha sido sustituido por una Gln y por ello la molécula es más resistente a la degradación por la PCa. El factor VIIIa es también un sustrato para la PCa, pero debido a la inestabilidad del factor VIIIa no parece ser muy relevante desde el punto de vista fisiológico. La proteína S y el factor V actúan de forma sinérgica como cofactores en la degradación del factor Va4.
Fig. 1. Vía de la proteína C. La trombina (TR), tras unirse a la trombomodulina (TM) en la superficie de las células endoteliales, activa la proteína C (PC). La PC activada (PCa), en la superficie del endotelio (mediante la unión al receptor de la PCa, ERPC) y de las plaquetas, se une con la proteína S (PS) libre (no unida al C4bBP), y degrada los factores Va y VIIIa produciendo factores inactivos Vi y VIIIi. En líneas discontinuas aparecen las reacciones de inhibición de la PCa, y los principales inhibidores: el inhibidor de la PCa (PCI), la*2AT y la*2-macroglobulina (*2M). (Tomada de Mateo et al4.)
Después de su activación la PCa es lentamente neutralizada por al menos tres inhibidores de proteinasas4: el inhibidor de la PCa (PCi), la *2-macroglobulina (*2-M) y la *1-antitripsina (*1-AT).
Coagulación y embarazo. Mutación del gen del factor V
La enfermedad tromboembólica venosa es, en los países occidentales, una de las principales causas de mortalidad femenina en la gestación. La aparición de un accidente tromboembólico es, no obstante, un fenómeno relativamente raro, del orden de 0,5-3/1.000 embarazos19, con una incidencia similar de trombosis a lo largo de la gestación y del posparto20.
Al lado de la estasis venosa, que es el factor predisponente más constante, existe un estado de hipercoagulabilidad relativa a lo largo del embarazo, secundario a un incremento de fibrinógeno y de los factores de la coagulación (II, VII, VIII, X y moderado del factor V), una disminución de los inhibidores de la coagulación (descenso de antitrombina III y proteína C no modificada, pero disminución de la actividad anticoagulante del sistema de la PCa) y caída de la proteína S a partir del fin del primer trimestre, asociado a una disminución de la actividad del sistema fibrinolítico.
Hobisch-Hagen et al21 comentan que, a medida que transcurre el período gestacional, así como en el posparto, se produce una serie de alteraciones hemostáticas que, por los resultados analíticos, se asemejan a una coagulopatía intravascular compensada. Estos cambios, como decimos, afectan tanto a las vías intrínseca y extrínseca como al sistema fibrinolítico. En tanto que el aumento de fibrinógeno, factor VII y factor X se mantiene de manera prolongada, el incremento del factor VIII, del antígeno del factor VIII y del factor Von Willebrand alcanza concentraciones máximas en el tercer trimestre22. Los fragmentos 1 y 2 de la protrombina aumentan de forma progresiva durante la gestación y serían los principales responsables del estado de hipercoagulabilidad que se produce23. Los factores II y V no se modifican, o lo hacen en forma muy moderada. En cambio, se observa una disminución de los factores XI y XIII.
Todas estas modificaciones, en su conjunto, son responsables de un estado de hipercoagulabilidad in vivo que se traduce en una elevación progresiva de los marcadores biológicos de activación de la coagulación medidos en el plasma: D-dímeros (se observa en el 60% de los embarazos sobre las 23 semanas de gestación) o productos de degradación de la fibrina y complejo trombina-antitrombina que resulta de la inactivación de la trombina formada en exceso por la antitrombina III. Además, el riesgo trombótico es particularmente elevado cuando a estas modificaciones fisiológicas se asocian otros factores de predisposición de origen genético (esencialmente los déficit en antitrombina III, proteínas C o S22,24) o adquiridos (presencia de anticuerpos antifosfolípidos). Algunos autores han probado una disminución de la proteína S del 60% respecto a un grupo control a partir de la semana 10 gestacional23. El sistema fibrinolítico no presenta alteraciones funcionales especialmente destacables, pero se caracteriza por un aumento del activador tisular del plasminógeno (t-PA) y de sus inhibidores (PAI-1 y PAI-2), y los valores de plasminógeno y *2-antiplasmina se mantienen22.
Este estado de hecho quedó trastocado o modificado hace unos años por el descubrimiento de una mutación del gen del factor V, de transmisión autosómica dominante, llamado factor Leiden, responsable de una resistencia a la acción anticoagulante de la proteína C activada (RPCa). Se hizo la interesante observación clínica de que algunos pacientes con trombo embolias venosas recidivantes, o de presentación familiar, no presentaban prolongación del tiempo de tromboplastina parcial (TTP) cuando se añadía PCa a su plasma. Es decir, el síndrome RPCa, inicialmente, se definió como un alargamiento insuficiente del tiempo de cefalina más activador en presencia de PCa.
La biología molecular permitió precisar el mecanismo fisiopatológico de la RPCa. Éste es el resultado de una mutación puntual del gen del factor V (llamado factor V Leiden y portado por el cromosoma 1) que se sitúa en un punto de clivaje del factor V para la PCa, impidiendo así su acción inactivadora. Este factor V Leiden resiste, pues, a la acción de la proteína C y a una acción procoagulante más duradera que el factor V normal induciendo un estado de hipercoagulabilidad susceptible de trombosis. Esta mutación, una sustitución de la arginina en posición 506 de la cadena pesada del factor V por una glutamina (Arg 506 Gln), ha sido encontrada en más del 95% de los casos de sujetos resistentes a la PCa13,18,25-27. Esta mutación, insistimos, está localizada en el sitio exacto de la acción de la PCa, por lo que no puede, por tanto. ejercer su actividad proteolítica anticoagulante sobre el factor V activado (FVa). Con esto desaparece un sitio donde la PC se separa del factor V, lo que prolonga el efecto trombógeno de la activación del factor V.
El análisis de la bibliografía muestra que el aumento del riesgo trombótico asociado a la RPCa es significativo en comparación con un grupo control: del 19 al 41% de los pacientes portadores de la anomalía han presentado un accidente tromboembólico, frente al 3% de los sujetos indemnes a la mutación27-29. Este riesgo, en caso de contracepción oral, se multiplica por 30 para las mujeres portadoras de la mutación en estado heterocigoto y por 50-80 para las mujeres homocigotas30. En el curso del embarazo ese riesgo aumenta y alcanza del 28-60% según la bibliografía27,31,32.
Verspyck et al18 señalan que la prevalencia de la RPCa es elevada en Europa y en Estados Unidos, puesto que alcanza cotas del 3 al 7%, y Handin13 subraya que aproximadamente un 3% de la población de todo el mundo es heterocigota para esta mutación, lo cual puede explicar el 25% de los pacientes que experimentan episodios repetidos de trombosis venosa profunda y de embolia pulmonar.
La herencia conjunta del factor V Leiden y otro defecto de baja penetrancia, como el déficit de proteínas C o S, también tienen efectos aditivos. Se están revaluando muchos estudios anteriores sobre los factores de riesgo que predisponen a los pacientes a tromboembolias venosas para que se tenga en cuenta esta frecuente mutación13.
Todos estos datos justifican, pues, la búsqueda del factor V Leiden en toda paciente gestante que presente una historia personal y/o familiar de flebitis y de embolias pulmonares, conociendo, como hoy se conoce, la gran variedad de expresión de la RPCa.
Métodos de estudio de la coagulación y fibrinólisis: proteína C y resistencia a la proteína C activada
Los métodos para la determinación funcional de la proteína C (PC) se basan en la activación del cimógeno inactivo a serinproteasa activa para después medir la PCa sobre un sustrato. Para activar la PC se puede utilizar el complejo trombina-trombomodulina, que sería el más fisiológico, o venenos de serpiente que tienen la capacidad para romper el péptido de activación y producir PCa. En cuanto a la detección de la PCa, se puede utilizar un sustrato cromogénico, o bien su sustrato natural, que es el factor Va y el VIIIa del plasma. En el primer caso se trata de un método colorimétrico que valora la capacidad de la PCa de romper un sustrato artificial de pequeño peso molecular, y en el segundo de una técnica coagulativa en la que se valora el alargamiento del tiempo de coagulación por la PCa. En el caso de encontrar una disminución de PC por un método funcional, es conveniente dosificarla con un método antigénico para ver si se trata de un defecto de síntesis o tipo I, o de una proteína disfuncional o tipo II4,33.
Con la técnica resistencia a la proteína C activada (RPCa) se valora la capacidad de la PCa para alargar el tiempo de coagulación de plasma. El método para estudiar esta resistencia consiste en realizar un tiempo de tromboplastina parcial activada en presencia y en ausencia de la PCa exógena. El resultado se expresa en razón del tiempo empleado con PCa respecto al obtenido en ausencia de PCa. Una variante de este método utiliza el plasma del paciente diluido con plasma deficiente en factor V y tiene una gran sensibilidad y especificidad para la detección del factor V Leiden. El test inicial está influido por muchos factores: embarazo, ingestión de anticonceptivos orales, anticoagulantes tipo lupus, valores elevados de factor VIII, etc., lo que hace que proporcione una información adicional de la respuesta del plasma a la PCa a la que aporta el método modificado que sólo indica la presencia o no del factor V Leiden4,33.
La técnica para determinar la mutación factor V Leiden consiste en la detección del cambio del nucleótido 1691 G*A en el gen del factor V, que corresponde en la proteína a un cambio de la Arg 506 por Gln. Como consecuencia, el factor V es más resistente a la degradación por la PCa. El diagnóstico se basa en el análisis de la molécula de ADN, mediante la amplificación por PCR de un fragmento genómico que contiene el nucleótido 1691 G/A y digestión con una enzima de restricción4,33.
OBJETIVO
Aportar nuestra experiencia a propósito de la eficacia y de la tolerancia del tratamiento profiláctico con heparinas de bajo peso molecular (HBPM) en el curso de embarazos asociados a esta mutación.
MATERIAL Y MÉTODOS
Siete mujeres que presentan la mutación factor V Leiden han sido incluidas en nuestro protocolo, después de obtener su consentimiento, y han recibido una tromboprofilaxis con HBMP durante su embarazo y posparto (tabla I).
La edad media de las mujeres era de 29,42 ± 2,99 años (27 a 33). Cuatro de ellas eran primigestas, dos secundigestas y una tercigesta. La existencia de la RPCa era conocida antes de la gestación en 4 casos. En los otros tres el diagnóstico se efectuó en el primer trimestre de la gestación.
La búsqueda de la anomalía de la hemostasia se realizó ante los antecedentes personales y familiares. De las 7 mujeres, 5 (71,42%) pertenecían a una familia trombofílica, pero dos de ellas no habían tenido nunca procesos trombóticos (casos 3 y 6). Por el contrario, de las otras 5 mujeres que habían presentado accidentes tromboembólicos venosos (recidivantes en dos casos), tres tomaban contraceptivos orales en el momento del accidente y en dos de ellas dicho accidente sobrevino en un postoperatorio anterior (caso 1: laparotomía por quiste seroso de ovario; caso 3: cesárea).
Las 7 mujeres no tenían más anomalía constitucional de la hemostasia que la mutación del gen del factor V (antitrombina III, PC y proteína S normales) y no presentaban anticoagulantes circulantes ni anticuerpos anticardiolipinas. Cuatro de ellas (57,14%) eran homocigotas para la mutación y tres (42,85%), heterocigotas (tabla I).
La tromboprofilaxis con HBPM se inició, en las cuatro mujeres cuyo proceso era conocido con anterioridad, en el momento del diagnóstico del embarazo. En las otras tres, el tratamiento se inició entre las semanas 9 y 11 de amenorrea. La terapia consistía en una inyección subcutánea diaria de enoxaparina (40 mg; Clexane®, Rhône-Poulenc-Rorer, Madrid), para mantener una actividad anti-Xa entre 0,3 a 0,4 UI/ml, 3 h después de la inyección.
A cada paciente se le realizó un eco-Doppler venoso de los miembros inferiores antes de iniciar el tratamiento para que dicha exploración sirviera de referencia en caso de trombosis durante el embarazo.
La vigilancia de la eficacia y la tolerancia del tratamiento se basó en un control bisemanal del recuento plaquetario, asociado a la determinación de la actividad anti-Xa, semanal durante el primer mes de tratamiento, y bisemanal después. Además, de forma mensual se determinaron marcadores de la activación de la coagulación y de la fibrinólisis (D-dímeros y complejos trombina-antitrombina), asociado al estudio de cefalina activada, del tiempo de Quick y de la dosificación de fibrinógeno.
El parto se programó 24 h después del cese del tratamiento con HBMP (enoxaparina), con el fin de efectuar un parto natural y de beneficiarse, si fuera preciso, de una analgesia peridural. Se reanudó el tratamiento en el posparto, durante al menos 8 semanas, es decir, en tanto persiste el estado de hipercoagulabilidad gravídica20,27, y más tiempo en función de los antecedentes y del genotipo.
Se controló, en el momento del nacimiento, el recuento plaquetario de los neonatos.
RESULTADOS (TABLA II)
No se produjo ningún incidente en el curso de los 7 embarazos y, en particular, no se constató ningún accidente hemorrágico o trombótico.
En cuanto a los análisis, no se constató ninguna trombopenia inducida por heparina. A lo largo de cada uno de los tratamientos, los tests de hemostasia estándar (tiempo de cefalina más activador, tasa de protrombina y fibrinógeno) fueron normales en las 4 mujeres en las que se inició tempranamente el tratamiento con HBPM por conocerse con anterioridad el proceso; se practicó en el puerperio una osteodensitometría, que resultó normal.
En los 7 casos, la inyección diaria de 40 mg de enoxaparina permitió obtener, a lo largo de toda la gestación, una actividad anti-Xa circulante normal, con criterios de eficacia aceptados4,27,33.
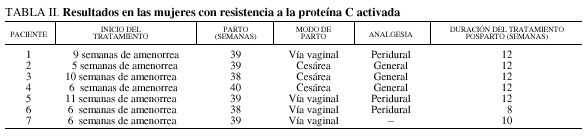
En un caso (caso 3) se programó cesárea en la semana 38 por cesárea anterior. En otro caso (caso 2) se programó cesárea a la semana 39 por sospecha de desproporción cefalopélvica. En los otros 5 casos se procedió a maduración cervical con prostaglandinas E2 vaginales, entre las semanas 38 y 40 de amenorrea, en función de las condiciones cervicales, 24 h después de la última inyección de enoxaparina. Hubo que realizar una cesárea (caso 4) por sufrimiento fetal agudo. El día de la maduración cervical se efectuó una determinación anti-Xa residual, encontrando en cada mujer valores inferiores a 0,05 UI/ml.
No aconteció ninguna hemorragia durante el trabajo de parto o el alumbramiento en los 7 casos, evaluándose las pérdidas hemáticas como normales. En las mujeres en las que se practicó analgesia peridural (casos 1, 5 y 6), ésta se desarrolló sin incidentes. Las tres mujeres sometidas a cesáreas pidieron anestesia general.
El peso medio de los recién nacidos fue de 3.057,14 ± 489,41 g (2.250 a 3.900 g). La puntuación media del test de Apgar fue de 8 al minuto y 10 a los 5 min. No se detectó ninguna manifestación hemorrágica en los neonatos, que presentaron todos un recuento plaquetario normal.
La reanudación de la tromboprofilaxis con HBPM se efectuó 6 h después del parto, con semidosis (20 mg de enoxaparina), para 24 h más tarde volver a la misma dosis instituida en el curso de la gestación. En el posparto hubo, en todas las mujeres, ausencia de accidentes hemorrágicos o trombóticos. En el posparto, las HBPM fueron utilizadas durante una duración total de 8 a 12 semanas, en función de los antecedentes. Durante el posparto el tratamiento permitió obtener, en todas las mujeres, una actividad anti-Xa comprendida entre 0,3 y 0,5 UI/ml.
DISCUSION
El principal objetivo de la terapia con heparina es prevenir la propagación proximal del trombo y la embolización resultante. Esta acción antitrombótica de la heparina tiene varias explicaciones: sirve como cofactor para la antitrombina III, que inhibe la coagulación; puede actuar para modificar la electronegatividad de la superficie endotelial, e inhibir así la adhesión plaquetaria, y los factores de la coagulación; por último, puede producir la libertad del activador endógeno del plasminógeno desde el endotelio34-36. El riesgo de una embolia recurrente después del tratamiento anticoagulante con heparina aumenta hasta 15 veces cuando el nivel de anticoagulación fue insuficiente dentro de las primeras 24 h de tratamiento34,35,37.
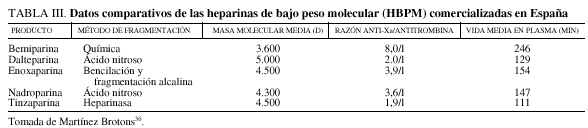
La heparina no fraccionada (HNF) es un glucosaminoglucano cuyas cadenas contienen una secuencia repetitiva de unidades disacáridas formadas por un ácido urónico y una glucosamina. Los residuos de glucosamina y ácidos urónicos pueden estar sulfatados y acetilados en mayor o menor medida. La heparina comúnmente utilizada en clínica posee tres radicales sulfato por unidad disacárida, lo que le confiere una fuerte carga negativa. La HNF presenta cadenas de longitud muy diversa, variando su peso molecular entre 3 y 50 kd, lo que corresponde a 10 de 167 unidades de sacárido, si bien predominan las formas de peso medio, alrededor de 1 kd (unos 50 sacáridos)36.
Las HBPM se obtienen a partir de las HNF, mediante despolimerización de sus cadenas por métodos químicos o enzimáticos, lo que da lugar a fragmentos de heparina, que presentan un peso molecular entre 2 y 9 kd, que corresponde a un número de sacáridos por cadena de entre 7 y 30, con un valor medio de 5 kd (17 sacáridos)36,38.
Desde hace numerosos años, la heparina cálcica (HNF comúnmente utilizada) se considera el anticoagulante más fiable y más seguro durante la gestación, especialmente en los tres primeros meses y el noveno mes porque, a diferencia de los anticoagulantes orales, no pasa la barrera placentaria27,35,36,39.
En las mujeres embarazadas con riesgos tromboembólicos, Toglia y Weg40 recomendaban una profilaxis con una heparina cálcica iniciada lo más pronto posible, en el curso de la gestación, a razón de 7.500 a 10.000 UI de heparina cálcica dos veces al día. No obstante, el riesgo trombótico presente a lo largo del embarazo y durante el posparto impone duraciones de profilaxis largas y rigurosas27,35,40. Por otra parte, aunque, como decimos, la heparina no atraviesa la barrera placentaria, su uso se puede asociar a secuelas fetales no desdeñables39. En una revisión de 135 casos publicados, se registraron un 12% de mortinatos, un 20% de nacidos pretérmino y los dos tercios restantes sin complicaciones39, aunque parece que hay autores que opinan que la mayoría de las complicaciones fetales se desarrollaron en mujeres con otros trastornos médicos35. Después de excluir los casos en los que la enfermedad materna u otros fármacos contribuyeron a los efectos indeseables fetales, Nageotte et al41 identificaron un pronóstico del 13%, en comparación con el 32%, ya referido, de Hall et al38. Esto es favorable en relación con un resultado fetal adverso superior al 30% de los embarazos tratados con anticoagulantes orales35. Asimismo, un estudio de LeClerc e Hirsh42 sugirió que, si no existen trastornos maternos importantes, la heparina es segura desde el punto de vista fetal. Un estudio comparativo final de la profilaxis prenatal con heparina frente a ausencia de tratamiento indicó sólo un ligero aumento en la morbilidad fetal43. Por tanto, hasta el momento hay divergencias de los efectos adversos sobre el pronóstico fetal35.
A la vista de lo expuesto, la revisión de la bibliografía parece indicar que la utilización de HBPM, en estas situaciones de riesgo tromboembólico, presentaría numerosas ventajas frente al uso de heparina estándar.
Efectivamente, las HBPM permiten obtener una actividad antitrombótica eficaz con una sola inyección subcutánea diaria, en la gran mayoría de los casos en razón de una biodisponibilidad y de una vida media de eliminación prolongada de 3 a 4 veces superior en comparación con la heparina estándar44. Por otra parte, como comentan otros autores36,38, para la potenciación del efecto antitrombina se requieren cadenas con al menos 18 sacáridos que pueden unirse, a la vez, a las moléculas de antitrombina y de trombina formando un complejo temario. Debido a este hecho, las HBPM, que tienen un gran contenido en cadenas de menos de 18 sacáridos, poseen una capacidad para potenciar la función anti-Xa de la trombina superior a la de la potenciación de la inhibición de la trombina36,38 (tabla III). El pico máximo de la actividad anti-Xa se sitúa 3 a 4 h después de la inyección y es proporcional a la dosis inyectada27,36,38,45.
Las HBPM contienen cadenas cortas pentasacáridas que, fijándose sobre la antitrombina III, permiten una inactivación del factor X activado (acción anti-Xa) suficiente para impedir la formación de trombina (acción antitrombótica). Estas cadenas cortas no son, sin embargo, suficientes para inactivar la trombina por intermedio de la antitrombina III: no habrá, pues alargamiento del tiempo de cefalina activada (TCA), de donde se deduce un riesgo hemorrágico teóricamente menor que con una heparina estándar y una disminución de la vigilancia biológica. Además, las HBPM tienen menor afinidad que la HNF por el cofactor II de la heparina, el factor plaquetario 4, el factor VIIIR y el endotelio vascular, hechos que se asocian con menos frecuencia con complicaciones hemorrágicas36,46,47.
Estas circunstancias y facilidades de uso permiten una mejor aceptabilidad y observancia para un tratamiento prolongado, máxime si lo es a título preventivo27,35,36.
Las HBPM carecen de efectos teratógenos en el animal47,48 y no atraviesan la barrera placentaria35,36,46,49,50. Existe una experiencia mínima con estas heparinas en el embarazo35,36,46,50, pero parecen efectivas y seguras durante el mismo. Priollet et al51 las utilizaron con buenos resultados para el tratamiento de la trombosis venosa en el embarazo, mediante un régimen de dosis subcutánea única después de la anticoagulación intravenosa continua estándar de la fase aguda inicial.
En comparación con la heparina estándar, los riesgos de trombopenia inducida están disminuidos con la utilización de HBPM y son de menor gravedad cuando aparecen27,52. Con las HBPM las formas moderadas de trombopenia (recuento por debajo de 150 *109) son 5 veces menos frecuentes que con las HNF y las graves son de aparición excepcional36,52. Parece oportuno recordar, aquí y ahora, que cuando se produce una trombopenia inmune secundaria al uso de HNF o HBPM el tratamiento de elección hoy día es la hirudina recombinante (lepirudin)36,53, que no presenta reacción cruzada alguna con las heparinas y permite una anticoagulación eficaz. Lo que aún no está claro es si la HBPM puede sustituir a la no fraccionada cuando, por el uso de ésta, se ha desarrollado trombopenia, ya que según algunos autores existe una reactividad cruzada importante entre las dos formas46,52,54.
Se conoce que el riesgo de osteoporosis inducido por la heparina después de su utilización durante largo tiempo, sobre todo en la gestación, no es desdeñable27,35,55-58. En un estudio prospectivo controlado, Dahlman et al55 evaluaron a 70 mujeres tratadas con heparina durante el embarazo. Un 17,14% de ellas desarrollaron osteopenia diagnosticada mediante radiografías convencionales de la columna vertebral y la cadera. Un 2,85% sufrió fracturas vertebrales por compresión. Hay dos pacientes (2,85%) que sufrieron fracturas y habían sido tratadas con dosis profilácticas elevadas con heparina subcutánea (25.000-30.000 UI/día) durante 9 y 27 semanas, respectivamente. No obstante, la magnitud de la osteopenia no se correlacionó con la dosis ni la duración del tratamiento con heparina55, contrariamente a un estudio retrospectivo anterior, de De Swiet et al59, quienes habían llegado a la conclusión de que la osteopenia se correlaciona con la dosis de heparina y no representa una reacción por idiosincrasia. Otros autores60-62 observaron osteopenia con dosis más bajas, de tan sólo 10.000-18.000 UI/día, durante un uso de 12 semanas. El 70% de las pacientes del estudio de Dahlman et al55 evolucionaron hacia una remineralización ósea normal en 612 meses, y las mujeres con enfermedad más grave se habían recuperado a los 24 meses.
Parece que las HBPM disminuyen el riesgo de osteoporosis27,35,36, pero sus efectos sobre la densidad ósea, después de su utilización de larga duración en la mujer gestante, no han sido aún comprobados con exactitud. Monreal et al63, que compararon el uso de heparina no fraccionada subcutánea con la HBPM en pacientes con tromboembolismo venoso, probaron que después de los tres y los 6 meses de tratamiento la densidad mineral ósea disminuyó en ambos grupos del estudio, pero el grupo de HBPM tuvo una tasa menor de fracturas óseas. Melissari et al49 comprobaron una ausencia de modificación de la densidad ósea, en tanto que Nelson-Piercy et al64 observaron una disminución de la masa ósea en más del 30% de las pacientes, sin que por otra parte se presentaran signos clínicos de osteoporosis. En cualquier forma, y como ya se ha apuntado, éste es un fenómeno reversible27,55,65. La osteoporosis inducida por heparina puede prevenirse con la administración concomitante de gluconato de calcio a la dosis de 1,5 g/día58,66.
Barjot et al27, que prefieren la utilización de las HBPM a las convencionales en las situaciones de alto riesgo como es esta que nos ocupa de resistencia a la proteína C, argumentan que las HBPM tienen un menor riesgo de hemorragia en el curso de actos quirúrgicos como las cesáreas, o en el curso del tratabajo de parto, o en el alumbramiento y en el puerperio, y sin necesidad de interrumpir el tratamiento antes del comienzo del trabajo de parto27,64,65,67. Estos27,64,65,67 y otros autores68-72 han demostrado la inocuidad de las HBPM, a dosis preventivas, en los actos quirúrgicos con anestesia locorregional. Pattee y Penning73 recomiendan que cuando se administran dosis profilácticas de heparina es mejor posponer el bloqueo neuroaxial hasta 4 h después de la última dosis. Reiteramos que estamos hablando de dosis profilácticas, puesto que las dosis terapéuticas de heparina contraindican la anestesia locorregional, a menos que se suspenda la heparina y se obtenga una cifra normal de TPT.
Una posible complicación de las HBPM son las lesiones cutáneas, de tipo urticariforme, muchas veces en la vecindad del punto de inyección, atribuibles a contaminantes del fármaco, o de tipo necrótico, más raras27,36. Se ha descrito la inhibición en la síntesis de aldosterona en el tratamiento con heparina, que suele carecer de importancia clínica, siendo los casos de hipoaldosteronismo excepcionales, y más en el uso profiláctico de este fármaco36.
Actualmente existen pocos estudios clínicos que traten sobre la inocuidad de las HBPM en el marco de la prevención trombótica en la mujer embarazada. No obstante, Barjot et al27 opinan que aunque el número de pacientes incluidos todavía no es muy grande, las publicaciones al respecto muestran que la relación beneficio-riesgo es satisfactoria a las dosis recomendadas para obtener una actividad anti-Xa eficaz, que como demuestran los estudios es alta27,49,64,67,74.
La posología óptima diaria eficaz está aún sujeta a discusión, y no existen hasta el momento estudios aleatorizados que comparen diferentes dosis de HBPM en el marco de la trombofilaxis durante el embarazo.
Los estudios de Barjot et al27 y Nelson-Piercy et al64 demuestran una ausencia de correlación entre los niveles de actividad anti-Xa y la edad gestacional, argumento esgrimido para no modificar la dosis en el curso del embarazo, una vez alcanzado el equilibrio en dicha actividad. Algunos autores64,65,67, no obstante, han tenido que adaptar secundariamente su esquema terapéutico, pasando de una dosis diaria de 20 mg a 40 mg de enoxaparina por día, dosis, recomendada en la prevención tromboembólica en los sujetos considerados de «alto riesgo trombótico»36,75, y modificar las dosis en función de la actividad anti-Xa. Por lo que hasta ahora conocemos por la bibliografía, la asociación de una gestación y de la mutación del factor V Leiden debe considerarse de alto riesgo trombótico14,25-27,29-32,76-79, por lo que parece razonable adoptar la actitud de iniciar la profilaxis con 40 mg de enoxaparina.
También se discuten las fechas del inicio y de la finalización de la profilaxis. A la vista de los datos de la bibliografía sobre el riesgo temprano de trombosis venosa en el curso de la gestación20, que es notable en las mujeres que presentan la mutación78-80, parece oportuno recomendar la prevención lo más pronto posible, es decir, en el primer trimestre del embarazo27,29. Además, en el curso del posparto, se ha comprobado que las modificaciones fisiológicas de la hemostasia persisten al menos durante 6 semanas, lo que hace recomendable imponer un período mínimo de tratamiento en aquellas mujeres que, por añadidura, presentan una anomalía trombógena de la hemostasia27. Es preciso destacar, sin embargo, que aún no existe consenso sobre la actitud ante una RPCa y las dosis profilácticas a utilizar en el posparto, teniendo en cuenta, por otra parte, que siempre es posible usar antivitamínicos K, en particular la warfarina, sobre todo en casos de duración prolongada (más de 8-10 semanas) de tratamiento profiláctico.
Barjot et al27 opinan que el esquema terapéutico debe ser adoptado de forma individual, en función de la gravedad de los antecedentes trombóticos personales y familiares ligados a cada paciente, lo que permite establecer dos situaciones clínicas del posparto: a) ausencia de antecedentes tromboembólicos personales y presencia de la mutación en estado heterocigoto: HBPM, una inyección diaria a la dosis preventiva de 40 mg de enoxaparina durante un mínimo de 6 semanas; si la mutación está presente en estado homocigoto, la profilaxis se prolongará hasta las 8 semanas, y b) antecedentes trombóticos venosos: HBPM a dosis curativas (2 inyecciones diarias de 40 mg de enoxaparina) durante las 4 primeras semanas del posparto, después a la dosis preventiva de una inyección por día durante un mínimo de 4 semanas, que deben ser 8 semanas en caso de accidentes recidivantes y/o graves (embolia pulmonar, trombosis extensas) o de mutación en estado homocigoto.
El esquema, en opinión de Barjot et al27, permite evitar las trombosis en esta población de alto riesgo.
CONCLUSION
Parece que la resistencia a la PCa ligada a la mutación del factor V Leiden actualmente se considera como la causa más frecuente de trombofilia familiar13,14,18,26-32,76-79,81.
Es preciso pensar en este proceso, y buscarlo sistemáticamente, ante antecedentes tromboembólicos familiares y/o personales, antes del inicio de una posible gestación para, de esta forma, iniciar una tromboprofilaxis eficaz. Schneider et al79, muy recientemente, opinan que tal vez no esté justificado realizar el cribado a toda la población, pero sí estiman recomendable pensar en el proceso ante dichos antecedentes y realizar pruebas genéticas a los familiares y a la progenie en el caso en que se diagnostique específicamente a alguien.
Lo que sí parece adecuado, sabida la existencia de RPCa, es iniciar tempranamente la profilaxis y proseguir con la misma en el posparto.
La utilización de HBPM, con una inyección única diaria, permite obtener una eficacia comparable a la de la heparina estándar, una excelente tolerancia materna y fetal, así como una enorme simplicidad de vigilancia y utilización.
Queda, no obstante, por establecer un consenso sobre la posología eficaz, sobre el momento óptimo del inicio de la terapia tromboprofiláctica y validar la utilización de los marcadores biológicos de la coagulación en la vigilancia del riesgo trombótico en la gestación, a fin de adoptar una postura más individualizada y menos estricta27.