INTRODUCCIÓN
La diabetes gestacional (DG) es una alteración en el metabolismo de los hidratos de carbono que se diagnostica por primera vez durante el embarazo1. Afecta a un 3-12% de la población obstétrica y, normalmente, no comporta tanta importancia por su clínica como por sus consecuencias, algunas de las cuales son de especial relevancia, lo que justifica un diagnóstico y tratamiento de esta patología lo más temprano posible2.
En casos de hiperglucemia, como en las distintas formas de diabetes mellitus (DM), es conocida la existencia de alteraciones que comportan mayor riesgo trombótico y aterósico3. La activación del proceso arteriosclerótico y del daño tisular presenta una importante variabilidad interindividual4. Así, se conocen algunas variantes genéticas que pueden determinar mayor riesgo cardiovascular. Entre ellas destacan las variaciones descritas para el gen del receptor de la glucoproteína de la membrana plaquetaria IIb/IIIa (GP IIb/IIIa) y para el gen del inhibidor del activador del plasminógeno (PAI-1) que se han asociado, en algunos trabajos, a una mayor susceptibilidad para presentar formas trombóticas en el contexto de enfermedades cardiovasculares5,6.
En este trabajo se evalúa el papel de la susceptibilidad genética del gen del receptor de la GP IIb/IIIa y del PAI-1 en el contexto de la DG.
MATERIAL Y MÉTODOS
Se tomaron muestras de sangre en la vena antecubital de las pacientes mediante vacutainer en tubos con EDTA entre las semanas 16 y 36 de embarazo. Se extrajo el ADN de las muestras y se congelaron a 20 °C. Posteriormente, atendiendo a la evolución de la gestación y a los resultados perinatales, se dividieron los grupos en gestantes sin patología asociada (n = 77) y mujeres con DG (n = 74); este último grupo se subdividió, asimismo, en gestantes con DG con complicaciones (n = 35) y DG sin complicaciones asociadas (n = 39). Se consideraron DG complicadas aquellas que presentaron preeclampsia, oligoamnios o polihidramnios fetal, feto grande para la edad gestacional (GEG), necesidad de insulinización materna y feto pequeño para la edad gestacional (PEG)7.
Extracción del ADN
Inicialmente las células se lisaron por incubación de la muestra en agitación y se procedió a la precipitación del ADN. Se recuperó el ADN y se cuantificó mediante lectura de la absorbancia de la muestra.
Detección por reacción en cadena de la polimerasa (PCR) del gen del receptor de la GP IIb/IIIa
El polimorfismo consiste en una mutación puntual de la citosina por timidina en la posición 198 en el exón 2 del gen en el cromosoma 17q21. Se somete el ADN a los procesos de amplificación, desnaturalización, hibridación y extensión sucesivamente. La reacción se lleva a cabo en un volumen final de 50 µl con 100 ng de muestra, 1,6 mM MgCl2, 0,1 nM de cada dNTP (Boehringer Mannheim, Mannheim, Alemania), 0,1 mM de cada oligonucleótido y 1 U de Taq polimerasa (Gibco BRL). Se procedió a la electroforesis con un gel de agarosa y la aplicación de un campo eléctrico de 120 V, 10 V/cm gel durante 30-60 min. Una vez asegurada la amplificación se procedió a la digestión de parte del producto con la enzima de restricción MspI. Se preparó un nuevo gel y se obtuvo un polimorfismo dialélico con tres bandas de distinto tamaño: una de 106 pb correspondiente al alelo A1 (sin presencia de sitio de restricción) y un conjunto de 67 pb y 39 pb del alelo A2 (presencia de sitio de restricción).
Detección por PCR del gen del PAI-1 (inserción/deleción C región promotora 7q)
El gen del PAI-1 se encuentra localizado en el brazo largo del cromosoma 7 (7q). Se trata de un polimorfismo de inserción/deleción de una sola base, la citosina situada en la región promotora, 675 pb por encima del sitio de inicio de la transcripción. La inserción se denomina 5G y la deleción 4G. La técnica que se utiliza se denomina ASO-PCR (oligonucleótidos específicos de alelo-reacción en cadena de la polimerasa) y consiste en una doble amplificación con unos alelos comunes que sirven como control y un oligonucleótido específico para el alelo que queramos amplificar. Cada reacción se lleva a cabo en un volumen final de 25 µl que contiene 1,5 mM MgCl2, 0,2nM de cada dNTP (Boehringer Mannheim, Mannheim, Alemania), 0,2 µM de cada oligonucleótido y 1 U de Taq polimerasa (Gibco BRL). El ADN se somete sucesivamente a desnaturalización, amplificación, hibridación y extensión. Los productos de la PCR se someten a una electroforesis con gel. El alelo que estemos amplificando da lugar a una banda de 139 pb y la banda control tendrá 267 pb.
Análisis estadístico
La recogida de datos se llevó a cabo mediante la utilización de la hoja de cálculo del paquete informático Excel 97 para Windows 98. El análisis estadístico se realizó utilizando el paquete estadístico SPSS/PC (9.0 para Windows). Se comprobó la normalidad de las variables mediante la prueba de Shapiro-Wilks. Para las variables con distribución normal se utilizaron las pruebas de la t de Student-Fisher y ANOVA. Para las variables que no se distribuyeron con una curva de normalidad se utilizaron los tests, de la U de Mann-Whitney y de Kruskal-Wallis. Intervalo de confianza de la media del 95%. El nivel de significación aceptado fue de p < 0,5.
RESULTADOS
Datos epidemiológicos y clínicos
Los datos epidemiológicos y clínicos de cada grupo se recogen en la tabla I. Del grupo de DG un 10,4% del total inició el parto con una inducción o una cesárea electiva. La mayoría de los partos del grupo de gestantes sin patología se inició de forma espontánea (94,6%). El porcentaje de fetos GEG fue del 4,1% en el grupo de DG y del 2,6% en el grupo de gestantes control. Los fetos PEG quedaron claramente incluidos en el grupo de mujeres con DG, constituyendo un 17,6% del total de los fetos de este grupo.
Estudio de los polimorfismos genéticos para el receptor de la GP IIb/IIIa
Las frecuencias genotípicas observadas en el grupo de gestantes sanas no presentaron diferencias significativas al compararlas con el grupo de DG (tabla II). Tampoco observamos diferencias cuando se comparó la distribución genotípica entre las pacientes con DG según presentaran o no complicaciones (tabla III).
Al clasificar a las pacientes según la presencia en su genotipo del alelo A2, que se había descrito en la población normal como marcador de riesgo trombótico, no se observaron diferencias entre las pacientes con DG con y sin complicaciones (tabla IV).
Estudio de los polimorfismos para el PAI-1
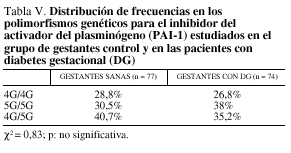
Si comparamos las frecuencias genotípicas en el PAI-1 en los grupos de gestantes normales y gestantes con DG, no obtenemos diferencias significativas (tabla V). Si comparamos los mismos genotipos del PAI-1 entre DG con y sin complicaciones, tampoco obtenemos diferencias significativas entre los grupos (tabla VI).
Igualmente, al separar el grupo de mujeres con el genotipo 5G/5G, considerado de menor riesgo trombótico frente a otras combinaciones genéticas, en las DG con y sin complicaciones no obtenemos diferencias significativas, a pesar de evidenciarse una cierta tendencia en el grupo de mujeres con complicaciones hacia los genotipos considerados de mayor riesgo trombótico (tabla VII).
La presencia del alelo 4G se asoció de forma estadísticamente significativa con mayor riesgo de presentar complicaciones entre las DG (37,2 frente a 53,1% para la ausencia y presencia de complicaciones, respectivamente) (tabla VIII).
Polimorfismos para el haplotipo GP IIb/IIIa más PAI-1
La distribución de frecuencias para el haplotipo considerado de no riesgo frente al resto de combinaciones presentó diferencias significativas entre el grupo de DG sin complicaciones y el de DG con complicaciones. Los resultados se recogen en la tabla IX.
DISCUSIÓN
La DM tipo 2 es una enfermedad con una importante carga genética familiar. La DG presenta, a su vez, una serie de características muy similares a las que acontecen en el contexto de la DM tipo 2. Así, la participación genética en la susceptibilidad de presentar DG puede desempeñar un papel importante en la patogenia de dicha enfermedad. Los estudios realizados hasta la actualidad para intentar descubrir alguna causa genética responsable del desarrollo de la DG son escasos y se han orientado, sobre todo, hacia marcadores genéticos del sistema HLA8-10. Ninguno de ellos ha conseguido demostrar con resultados concluyentes la presencia de algún gen que determine el aumento del riesgo de presentar esta enfermedad. Los trabajos más recientes se han orientado al estudio de mutaciones de diversos factores de transcripción de la célula beta, los cuales aparecen con una frecuencia muy baja en los pacientes con DG11.
El objetivo principal de nuestro trabajo se basa en el estudio de los polimorfismos para los genes descritos en los grupos de DG con y sin complicaciones asociadas. Parece ser que algunos de los polimorfismos descritos para el gen de la GP IIb/IIIa de la membrana plaquetaria y del PAI-1 se asocian a mayor incidencia de complicaciones cardiovasculares en algunos grupos poblacionales estudiados5,6.
La presentación asintomática en la mayoría de los casos de la DG durante el embarazo, sumada a sus consecuencias de cierta relevancia, ha motivado el cribado poblacional para esta enfermedad en todas las gestantes de riesgo. Pero, una vez diagnosticada la presencia o no de enfermedad, el desconocimiento completo de los factores que condicionan la evolución de esta patología durante el embarazo dificulta la puesta en marcha de actitudes preventivas de las posibles complicaciones en la gestación. El conocimiento acerca de qué gestantes son susceptibles o no de presentar complicaciones en el transcurso de la DG podría facilitar el inicio de maniobras preventivas.
El análisis poblacional de los polimorfismos obtenidos para el gen de la GP IIb/IIa y para el gen del PAI-1 no demostró diferencias entre la población de gestantes sanas respecto a la población con DG (tablas II y V). Así pues, dichos polimorfismos genéticos no se revelaron útiles como marcadores de suceptibilidad para presentar DG.
Basándonos en resultados previos de distintos grupos de trabajo para analizar las distintas variables estudiadas en el contexto de la DG, se procedió a la agrupación genotípica tanto del gen de la GP IIb/IIIa como del PAI-1 en relación con lo que ha sido determinado como genotipo de riesgo cardiovascular o de enfermedad tromboembólica respecto a aquellos genotipos con menos riesgo5,6,12. Concretamente, para el gen de la GP IIb/IIIa se agrupó a la población entre las portadoras homocigotas del alelo A1 frente al resto de genotipos, y para el gen del PAI-1 se agrupó a la población entre las portadoras homocigotas del alelo 5G frente al resto de genotipos. La distribución genotípica de ambos polimorfismos no se mostró diferente entre el grupo de DG sin complicaciones respecto al grupo con ellas. Sin embargo, la distribución alélica del gen del PAI-1 mostró que las mujeres que desarrollaron complicaciones en la DG durante el embarazo presentaban mayor incidencia de la presencia del alelo 4G en su genotipo (53,1% para el alelo 4G frente al 46,9% para el alelo 5G en el grupo de DG con complicaciones; p < 0,05). La comparación de genotipos múltiples para el gen de la GP IIb/IIIa y del PAI-1 mediante la distribución de frecuencias para la combinación considerada de no riesgo 5G/5G y presencia de A1/A1 frente al resto de combinaciones mostró una diferencia significativa entre el grupo de DG con una mayor frecuencia de la combinación genotípica considerada de riesgo, presencia de A2 y 4G, entre las DG que habían presentado alguna complicación durante el embarazo (tabla IX) (p < 0,005).
Así pues, a modo de síntesis, las observaciones que hemos descrito indican que los polimorfismos de los genes analizados no representan un determinante genético de susceptibilidad para presentar DG. Sin embargo, la presencia del alelo 4G del gen del PAI-1 y la combinación de genotipos considerados de riesgo, junto con el gen de la GP IIb/IIIa, parecen determinar un subgrupo de DG con mayor tendencia a desarrollar alguna complicación durante el embarazo.