Determinar si existe una relación entre los niveles plasmáticos de proteína A asociada a la gestación (PAPP-A) expresada en múltiplos de la mediana (MoM) con el retraso de crecimiento intrauterino (RCIU), independientemente de otros parámetros clínicos o ecográficos. Valorar si los valores de PAPP-A son capaces de predecir el riesgo de RCIU.
Material y métodoEstudio epidemiológico, observacional, analítico, tipo casos y controles, desarrollado entre enero de 2012 y septiembre de 2013 con pacientes del Complexo Hospitalario Universitario de Ourense.
El tamaño muestral fue de 138 gestantes y sus respectivos recién nacidos.
Para la determinación de las diferencias en las PAPP-A entre casos y controles se utilizó la prueba U de Mann-Whitney.
Se realizó la representación gráfica mediante modelos GAM con respuesta gaussiana y binaria para conocer el comportamiento de los valores de la PAPP-A con respecto a los pesos de los recién nacidos y el riesgo de presentar un feto con RCIU respectivamente.
Los valores de la PAPP-A fueron obtenidos de las muestras extraídas para el cribado combinado del primer trimestre entre la semana 11+3 y 13+5 de amenorrea.
El estudio estadístico se realizó con el paquete SPSS 15.0 y Epidat 3.0.
Se consideró significación estadística para una p<0,05.
ResultadosLos valores de PAPP-A expresados en MoM se comportan como un predictor independiente de retraso de crecimiento fetal, sin estar influidos por factores maternos o parámetros ecográficos fetales precoces.
Un valor de PAPP-A (MoM) por debajo de 0,33 MoM puede predecir pesos fetales inferiores al percentil 3, para un intervalo de confianza al 95% (0,24-0,56).
Un valor de PAPP-A (MoM) inferior a 0,4 MoM tiene un riesgo relativo de RCIU del 2,50; superior, incluso, al que presenta el consumo de tabaco en la gestación (RR: 1,7).
ConclusionesEl cribado combinado de cromosomopatías fetales es actualmente una práctica habitual en la mayoría de los hospitales. A partir de los datos que este nos ofrece, es posible seleccionar a un grupo de pacientes con mayor riesgo de alteraciones de la placentación, sin que ello suponga un incremento del gasto sanitario, facilitando la optimización de los recursos materiales y humanos.
To determine if there is a relationship between pregnancy-associated plasma protein-A (PAPP-A) levels, expressed in multiples of the median (MoM), and intrauterine growth retardation (IUGR) independently of other clinical or ultrasound parameters. To assess whether PAPP-A values are able to predict the risk of IUGR.
Material and methodAn epidemiological, observational, analytical, case-control study was conducted between January 2012 and September 2013 in patients attending the University Hospital Complex of Ourense. The sample consisted of 138 pregnant women and their respective newborns. Differences in PAPP-A between cases and controls were determined by the Mann-Whitney U test. Graphs were plotted using GAM models with Gaussian and binary response to determine the behavior of PAPP-A values with respect to birthweight and the risk of intrauterine growth restriction, respectively. PAPP-A values were obtained from samples taken for combined first trimester screening at weeks 11 + 3 and 13 + 5 of amenorrhea. The statistical analysis was conducted with the statistical package SPSS 15.0 and Epidat 3.0. Statistical significance was set at P<.05.
ResultsPAPP-A values, expressed as MoM, behaved as an independent predictor of IUGR, without being influenced by maternal factors or early fetal ultrasound parameters.
A PAPP-A value (MoM) below 0.33 MoM predicted fetal weights below the 3rd percentile for a 95% confidence interval (0.24–0.56). A PAPP-A value (MoM) of less than 0.4 MoM had a relative risk of IUGR of 2.50, which was even higher than that posed by smoking during pregnancy (RR: 1,7).
ConclusionCombined screening of fetal chromosomal abnormalities is currently routine practice in most hospitals. The data provided by this screening can be used to select a group of patients at increased risk of alterations of placentation, without increasing health costs, thus facilitating the optimization of material and human resources.
Se considera un feto «pequeño para la edad gestacional» (PEG) el que tiene un peso fetal estimado por debajo del percentil 10 (P10) según las tablas poblacionales de peso/amenorrea1. Sin embargo, esta definición no distingue los fetos que son constitucionalmente pequeños de los que presentan un verdadero retraso de crecimiento con una base fisiopatológica subyacente. Esta distinción resulta de suma relevancia en tanto en cuanto el 70% de los fetos con peso inferior al P10 son pequeños debido a factores constitucionales como el sexo femenino, la etnia o la paridad, y no presentan alto riesgo de morbimortalidad perinatal.
Los fetos con retraso de crecimiento intrauterino (RCIU) se definen como aquellos que no alcanzan su peso potencial debido a la influencia de factores genéticos o ambientales. Estos fetos sí presentan un elevado riesgo de resultados perinatales adversos, sobre todo, aquellos con un peso inferior al P32,3.
Hoy en día, la diferenciación entre RCIU y PEG no debe basarse solo en el estudio doppler de la arteria umbilical, ya que este índice solo detecta las formas graves de aparición temprana. El diagnóstico de RCIU debe realizarse en presencia de cualquiera de los factores asociados a un peor pronóstico perinatal, incluyendo el índice cerebroplacentario, el doppler de la arteria uterina y un crecimiento fetal por debajo del P34,5.
Las causas del RCIU pueden ser de origen fetal, placentario o materno y, aunque no siempre es posible identificarlas, es un hecho importante a la hora de estimar el potencial riesgo de recurrencias. La base fisiopatológica común a todos los procesos que pueden causar RCIU es la disfunción placentaria, que originará trastornos de tipo isquémico que impedirán el correcto aporte de nutrientes y oxígeno al feto, mermando así su desarrollo.
Además de complicaciones perinatales tales como la asfixia perinatal, aspiración de meconio, prematuridad, alteraciones de la termorregulación, hipoglucemia, alteraciones hematológicas, incremento del número de cesáreas y disfunción del sistema inmune, los fetos con RCIU no están exentos de complicaciones a largo plazo, sobre todo con anomalías del crecimiento y del neurodesarrollo. Hay estudios que también apuntan a que los adultos que sufrieron RCIU presentan predisposición a padecer alteraciones cardiovasculares, hipertensión arterial y enfermedad renal crónica6.
Por todas estas implicaciones, uno de los objetivos primordiales de la atención prenatal debe estar enfocado a la detección de fetos con alto riesgo de desarrollar restricción del crecimiento intrauterino. Se ha demostrado que la identificación temprana de estos fetos mejora los resultados perinatales en relación con los casos no detectados7. Por otro lado, la precisión de la ecografía del tercer trimestre no ha demostrado tener una sensibilidad aceptable para el diagnóstico de las alteraciones del crecimiento fetal intrauterino en la gestación de bajo riesgo8, con una tasa de detección inferior al 25%. Esto la convierte en una herramienta de dudosa utilidad7, e incluso algunas guías9 proponen no usarla como método sistemático de cribado en la gestación de bajo riesgo.
El diagnóstico de esta afección se realiza cuando ya está instaurada, de ahí la importancia de la investigación de un método de cribado precoz (no invasivo y de bajo coste) que permita identificar los fetos en riesgo, con el fin de realizar un seguimiento más estrecho que mejore la morbimortalidad, optimizando tanto los recursos humanos como materiales y centrando el control en la población de riesgo con el objetivo de mejorar su pronóstico perinatal.
Muchos autores han propuesto el empleo de marcadores bioquímicos, sobre todo los utilizados para el cribado de cromosomopatías, añadiéndoles un beneficio secundario para la predicción de malos resultados obstétricos. Podemos encontrar en la literatura múltiples estudios que relacionan los niveles bajos de proteína plasmática A asociada a la gestación (PAPP-A) con un mayor riesgo de desarrollar RCIU.
El objetivo principal de nuestro trabajo fue valorar la relación entre los niveles plasmáticos de PAPP-A obtenidos en el cribado de aneuploidías del primer trimestre y la predicción de RCIU, independientemente de otras variables clínicas maternas o ecográficas. Se intenta calcular el riesgo que puede presentar una gestante de tener un recién nacido (RN) con RCIU en función de los valores de PAPP-A.
Secundariamente, se analizó si existe relación entre otras características maternas (edad, peso, hábito tabáquico) que puedan influir en las alteraciones del crecimiento fetal intrauterino.
Material y métodosEstudio epidemiológico, observacional, analítico, tipo casos y controles que se desarrolla entre enero de 2012 y el 30 de septiembre de 2013 con pacientes controladas en el Complexo Hospitalario Universitario de Ourense (España). La muestra estuvo formada por 138 pacientes, distribuidas en los siguientes grupos:
Grupo casosPacientes con RN diagnosticados de RCIU al nacimiento, establecido según las tablas de peso/amenorrea. Se emplearon las tablas de pesos fetales para la población española10, por carecer de tablas propias de nuestro centro. Fueron seleccionados los RN con pesos por debajo del P3 para la amenorrea al nacimiento por ser este grupo el definido por todos los autores como RCIU independientemente de la fluxometría. Las pacientes fueron controladas en nuestro servicio y habían realizado el cribado combinado del primer trimestre (CCPT) (n=64).
Exclusiones: gestaciones gemelares, fetos con cromosomopatía, diagnóstico prenatal o posnatal de malformaciones fetales graves.
Grupo controlesGestaciones simples seleccionadas aleatoriamente que habían parido en nuestro servicio independientemente del peso del RN y que habían realizado CCPT (n=74).
Análisis estadísticoSe realizó el análisis descriptivo de los datos. Las variables continuas se muestran como media, mediana, mínimo, máximo y desviación típica, con las pruebas de normalidad de Kolmogorov-Smirnov.
Para la determinación de las diferencias en las PAPP-A entre casos y controles se utilizó la prueba U de Mann-Whitney y para las variables continuas gaussianas, la prueba t de Student.
Se realizó la representación gráfica mediante modelos modelos aditivos generalizados (GAM) con respuesta gaussiana y binaria para conocer el comportamiento de los valores de la PAPP-A con respecto a los pesos de los RN y el riesgo de presentar un feto con RCIU respectivamente.
Se estimó la potencia del estudio mediante la utilización del programa Epidat 3.1.
En el análisis estadístico de la muestra se aplicó el programa SPSS 15.0.
Se consideró significación estadística para una p<0,05.
Los valores de la PAPP-A fueron obtenidos de las muestras extraídas para el CCPT entre la semana 11+3 y 13+5 de amenorrea. Las determinaciones de los marcadores bioquímicos se llevaron a cabo en el autoanalizador Inmulite 2000.
El principio de análisis para la determinación de la PAPP-A es un ensayo enzimático inmunométrico quimioluminiscente en fase sólida, con una sensibilidad de 0,025 mIU/mL, empleando anticuerpos monoclonales murino anti-PAPP-A. Para el cálculo de los múltiplos de la mediana (MoM) de la PAPP-A empleamos el programa PRISCA.
ResultadosEn nuestro centro, la prevalencia de RCIU severo en el periodo estudiado fue de un 2,19%; se encontraron 64 casos que cumplen los criterios de inclusión sobre un total de 2.922 nacimientos obtenidos en el mismo periodo de tiempo.
Para calcular la potencia del estudio, se consideró la desviación estándar del grupo control (0,777) y del grupo con RCIU (0,439), con una razón entre muestras de 1,156 y una diferencia de medias esperada de 0,554 para un tamaño de muestra de 138 mujeres y un nivel de confianza del 95%; la potencia estimada para nuestro estudio fue del 99,9%.
La distribución según el sexo de los RN con RCIU mostró una ligera predilección (53,1%; n=34) por el sexo femenino, pero sin significación estadística.
En el grupo de «fetos con RCIU» solo se encontró el criterio «gestación complicada con hipertensión» en el 7,81% (n=5) de los casos; el 60% (n=3) de las pacientes presentaron cuadros hipertensivos de la gestación de inicio tardío y el 40% (n=2) se correspondieron con cuadros hipertensivos precoces. También se identificaron 2 casos de diabetes gestacional sin relevancia clínica ni estadística. En el resto de las pacientes estudiadas del grupo RCIU no se encontró enfermedad materna conocida.
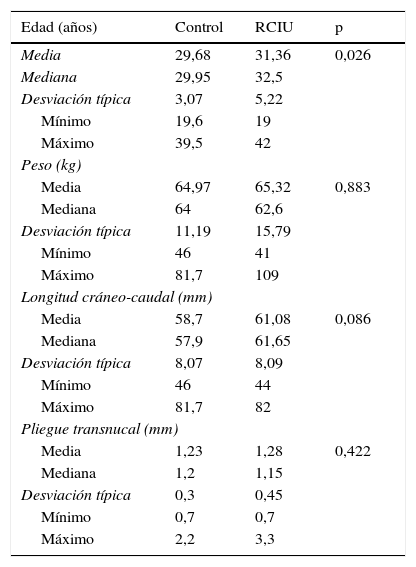
En la tabla 1 podemos observar los estadísticos descriptivos continuos de ambos grupos.
Estadísticos descriptivos de ambos grupos
| Edad (años) | Control | RCIU | p |
|---|---|---|---|
| Media | 29,68 | 31,36 | 0,026 |
| Mediana | 29,95 | 32,5 | |
| Desviación típica | 3,07 | 5,22 | |
| Mínimo | 19,6 | 19 | |
| Máximo | 39,5 | 42 | |
| Peso (kg) | |||
| Media | 64,97 | 65,32 | 0,883 |
| Mediana | 64 | 62,6 | |
| Desviación típica | 11,19 | 15,79 | |
| Mínimo | 46 | 41 | |
| Máximo | 81,7 | 109 | |
| Longitud cráneo-caudal (mm) | |||
| Media | 58,7 | 61,08 | 0,086 |
| Mediana | 57,9 | 61,65 | |
| Desviación típica | 8,07 | 8,09 | |
| Mínimo | 46 | 44 | |
| Máximo | 81,7 | 82 | |
| Pliegue transnucal (mm) | |||
| Media | 1,23 | 1,28 | 0,422 |
| Mediana | 1,2 | 1,15 | |
| Desviación típica | 0,3 | 0,45 | |
| Mínimo | 0,7 | 0,7 | |
| Máximo | 2,2 | 3,3 | |
La edad media del grupo control fue inferior respecto al grupo casos (29,68±3,07; 31,36±5,22), con significación estadística (p=0,026).
Al valorar el peso materno al inicio de la gestación, se observó que ambos grupos fueron similares (p=0,883). Al comparar el índice de masa corporal (IMC), parámetro mucho más objetivo para valorar el estado nutricional dado que tiene en cuenta el peso y la talla de la paciente, tampoco se encontraron diferencias estadísticas entre ambos grupos.
En el grupo de madres de fetos RCIU se calculó una prevalencia de tabaquismo del 42,2% (n=27), mientras que en el grupo control fue del 20,3% (n=15). Este parámetro alcanzó significación estadística (p=0,005). Se procedió a calcular el riesgo relativo (RR) que supone aisladamente el consumo de tabaco durante la gestación para la aparición de RCIU, y este alcanzó el 1,67 (IC 95%: 1,1-1,99).
No fue posible hallar diferencias entre ambos grupos al comparar si la gestación fue lograda mediante técnicas de reproducción asistida o espontáneamente; ya que en el grupo control no encontramos ninguna paciente con el antecedente de técnicas de reproducción asistida y en el grupo casos solo 2 pacientes presentaban el factor fecundación in vitro lo cual representa el 3,12% del total. No fue posible valorar este factor por falta de muestra.
Se estudió la longitud cráneo-caudal (CRL) de los fetos de ambos grupos en el momento de la determinación de la PAPP-A, dado que en la bibliografía se refiere que los valores de PAPP-A aumentan paralelamente a la CRL, y queremos demostrar que ambos grupos son similares en sus características. En el grupo RCIU la media fue de 61,08±8,09mm y en el grupo control de 58,7±8,07mm. Los valores encontrados de CRL fueron prácticamente idénticos (p=0,086).
Existen artículos médicos que correlacionan el pliegue transnucal (TN) con alteraciones del crecimiento fetal. En nuestro trabajo pretendíamos eliminar cualquier factor de confusión en la predicción de RCIU, por lo que se procedió a comparar esta variable. En el grupo a estudio la media fue de 1,28±0,45mm con un máximo de 3,3 y un mínimo de 0,7mm, mientras que en el grupo control la media fue de 1,23±0,3mm con un máximo de 2,2 y un mínimo de 0,7mm (p=0,422).
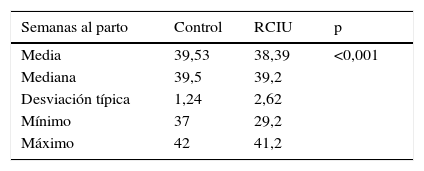
El grupo control presenta una edad gestacional al parto mayor que el grupo casos con significación estadística (p<0,001), sin embargo al estudiar el resultado, este parece tener poca relevancia clínica dado que la diferencia entre ambos grupos es de solo una semana y la mediana (estadístico que valora el grado de dispersión de la muestra) es prácticamente idéntica en ambos grupos (mediana: control 39,5; casos 39,2) (tabla 2).
El peso de los RN del grupo casos presentó una media de 2.234,05±302,68g, con un máximo y un mínimo de 2.500 y 722g, respectivamente. En el grupo control la media fue de 3.327,78±467,22g, con un máximo y un mínimo de 4.790 y 2.600g. Puede llamar la atención que el máximo del grupo RCIU y el mínimo del grupo control sean muy similares, ello es debido a que se tratan de pesos estandarizados por amenorrea al nacimiento, de tal modo que, un feto de 40 semanas y un peso de 2.500 g se corresponde con un P3, mientras que un feto de 36 semanas y el mismo peso estaría en un P50.
En nuestro grupo a estudio se estimó que el 26,56% (n=17) finalizaron la gestación mediante cesárea. En el grupo control la finalización mediante cesárea ocurrió en el 12,2% (n=9). Al comparar ambos grupos se observa que la finalización mediante cesárea fue más frecuente en el grupo de fetos con RCIU (p<0,001).
La principal indicación de cesárea en el grupo RCIU fue la pérdida de bienestar fetal que se diagnosticó en el 52,9% de los casos, seguida por la presentación podálica (25%). La indicación de cesárea por pérdida de bienestar fetal presentó significación estadística en el grupo a estudio sobre el grupo control (p<0,001). En el grupo casos no disponemos de datos del pH de cordón en el 29,7% (19/64). En el resto de la serie el 24,44% (11/45) de los RN presentaron acidosis neonatal con un pH de cordón al nacimiento menor a 7,20. El 4,44% tuvieron un pH<7,10. En el grupo control se determinó un pH<7,20 en el 18,46% (p<0,001) y el pH inferior a 7,10 se obtuvo en el 1,54% (p<0,005).
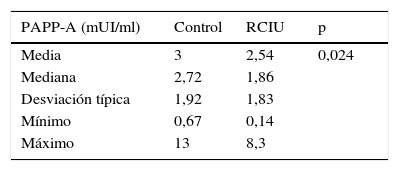
Los valores de la PAPP-A se pueden expresar en mUI/ml o como múltiplos de la mediana (MoM), se realizó el estudio estadístico con ambas formas de expresión.
La PAPP-A expresada en mUI/ml: en nuestro trabajo se calculó que estos valores fueron superiores en el grupo control que en grupo de fetos con RCIU, con significación estadística (p=0, 024) (tabla 3).
PAPP-A expresada en MoM: ¿qué son los MoM? En el cribado de cromosomopatías, el primer paso para obtener la razón de probabilidad dependiente de los marcadores (tanto ecográficos como bioquímicos) es la estandarización del valor de dichos marcadores. Para esta estandarización se usa como unidad de medida el MoM, el cual se obtiene dividiendo el valor del marcador por la mediana propia del centro para ese marcador y para la edad gestacional.
Esta simple operación nos permite la comparación de los valores (expresados en MoM) entre distintos centros que usen técnicas de medición diferente.
Existen algunos factores maternos (peso, raza, hábito tabáquico, gestación espontánea/fecundación in vitro o diabetes) que pueden afectar a la precisión de los marcadores bioquímicos, por lo que es necesario realizar ajustes.
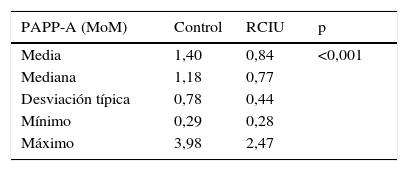
Al estudiar los valores de la PAPP-A (MoM) se observó que el grupo de RCIU presenta valores muy inferiores al grupo control, con una media en los primeros de 0,84 frente a 1,40 en el grupo control, para una p<0,001 (tabla 4).
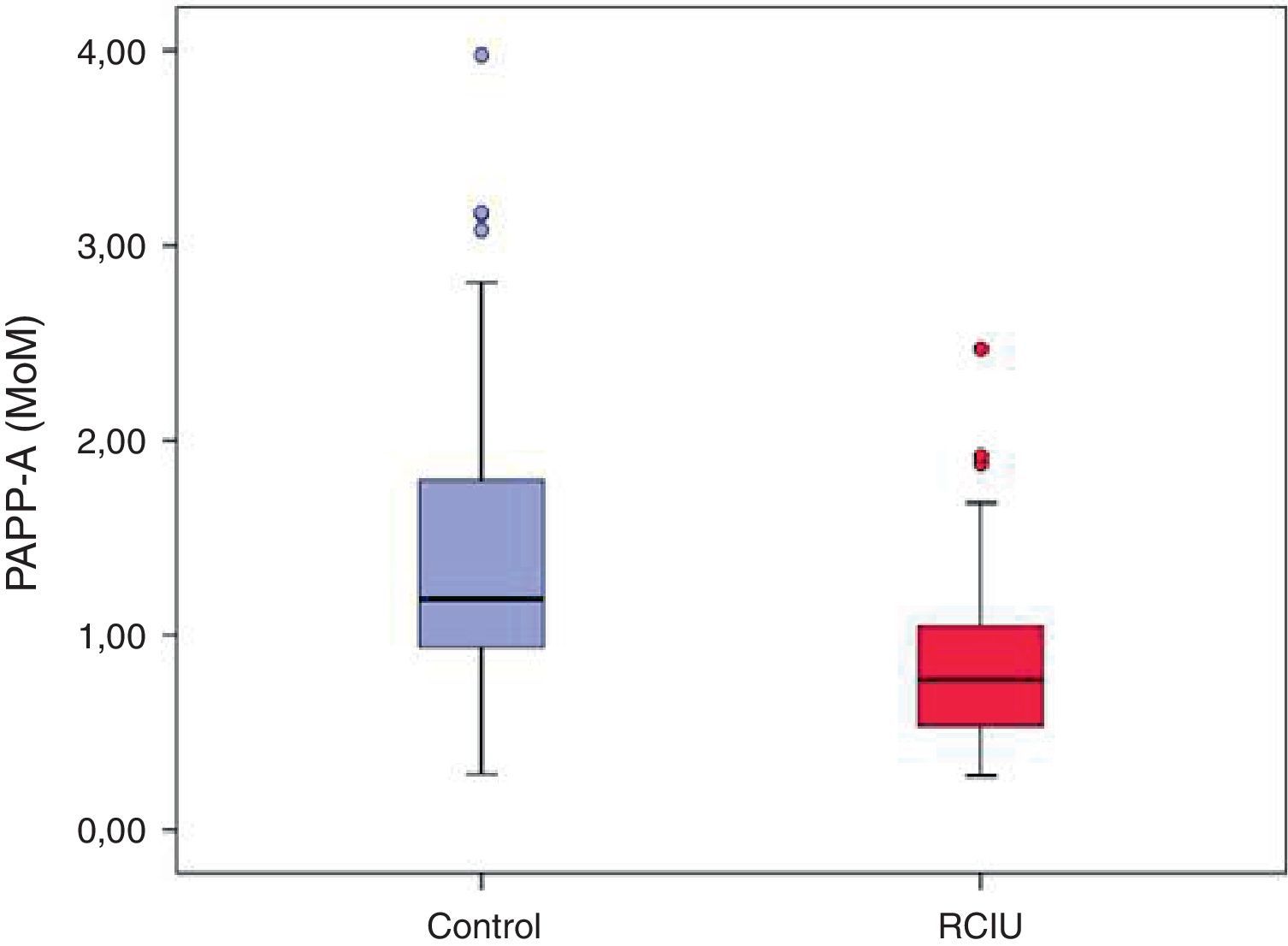
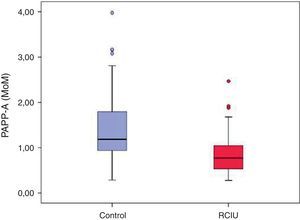
Procedemos a representar nuestros datos en un diagrama de cajas.
En la figura 1 se observa como prácticamente el 100% de los valores de PAPP-A del grupo control (caja azul) se sitúan por encima de 1 MoM. Por el contrario en el grupo de casos, representados en rojo, prácticamente el 100% de la muestra tiene valores inferiores a 1 MoM.
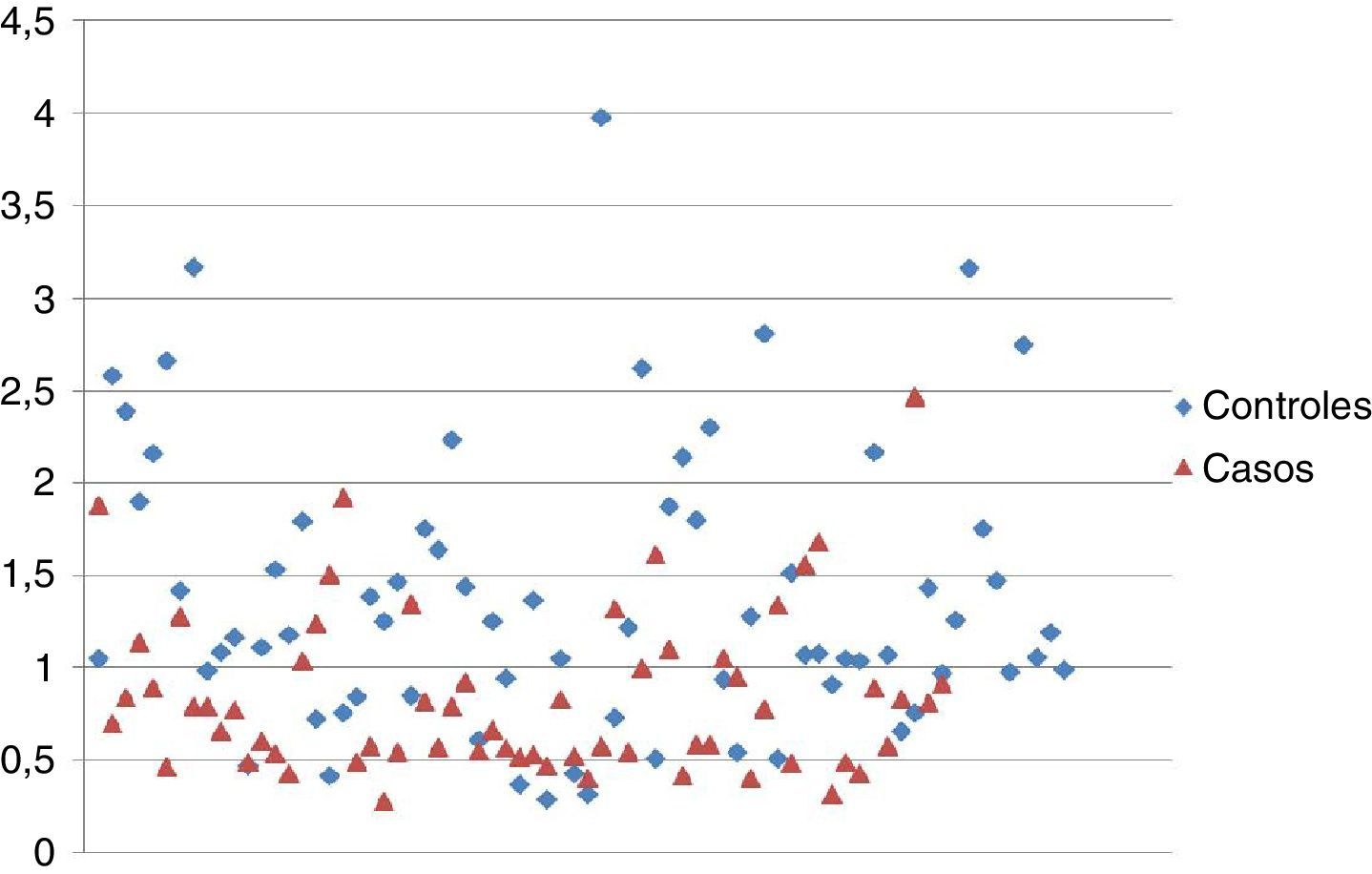
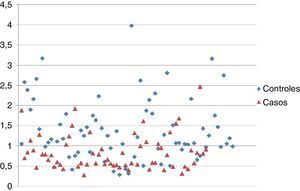
Esta misma relación la podemos evidenciar gráficamente mediante un diagrama de dispersión (fig. 2).
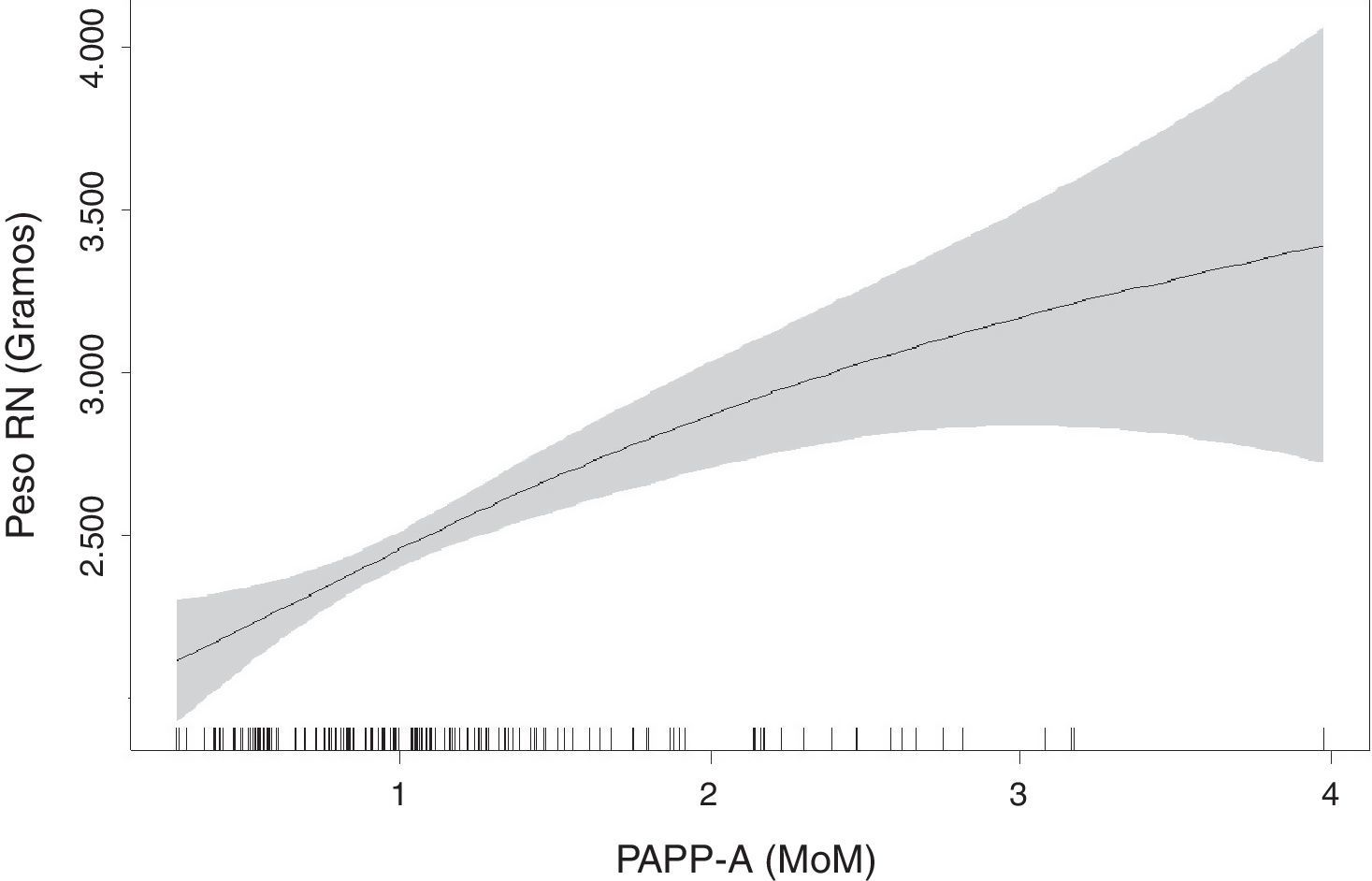
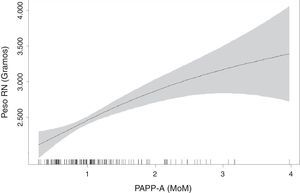
Con el modelo de regresión GAM suavizado mediante p-spline con respuesta logística y gaussiana se obtuvo que los valores de la PAPP-A poseían un comportamiento lineal y además significativo (p=0,05 para los pesos fetales y p<0,001 para el riesgo de ser RCIU).
La elección de un modelo GAM con suavización se debe a que este tipo de modelos resultan ser óptimos para confirmar el comportamiento lineal o no lineal de las variables. De esta forma conocemos que el «riesgo de ser RCIU» aumenta de forma lineal a medida que decrecen los valores de PAPP-A (MoM) y que los bajos pesos se correlacionan linealmente con valores decrecientes de la PAPP-A (MoM) (fig. 3).
Realizando una regresión lineal, determinamos que los valores de la PAPP-A expresados en MoM menores o igual a 0,336 predicen pesos fetales inferiores al P3, para un intervalo de confianza del 95% (0,24-0,56).
Procedemos a calcular el RR de RCIU. Cuando una paciente presenta una PAPP-A<0,4 (por aproximación al punto de corte anterior), obtenemos que el RR es de 2,507 (IC 95%: 1,8-3,1).
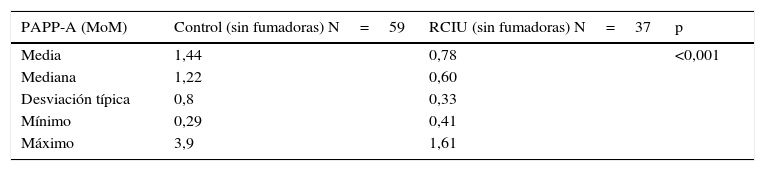
Dada la alta prevalencia de gestantes fumadoras en el grupo RCIU (42,2%) y a que el hábito tabáquico se ha asociado a menor peso fetal en múltiples artículos, se ha planteado la hipótesis de que «el tabaco pudiera ser el responsable del menor peso en el grupo casos» o bien que pudiera actuar como un factor de confusión. Con el fin de eliminar este factor, se procedió a realizar un estudio secundario que consistió en excluir a todas las gestantes fumadoras de ambos grupos y proceder al estudio estadístico de la muestra resultante (estadísticos descriptivos en la tabla 5).
Al comparar los valores de la PAPP-A (MoM) se observa que el grupo de RCIU sin fumadoras presenta valores muy inferiores al grupo control sin fumadoras (media en RCIU de 0,78±0,33 frente a 1,43±0,8 en el grupo control, para una p<0,001). Por tanto, se puede afirmar que el consumo de tabaco no es un factor de confusión en nuestro estudio.
ComentarioEl RCIU es una afección obstétrica con importantes repercusiones en la morbimortalidad perinatal. Se considera que es el responsable de hasta un 25% de las muertes intrauterinas sin otra causa evidente3. Su fisiopatología es muy variable, pero en la mayoría de los casos vamos a encontrar una disfunción placentaria, secundaria a una invasión trofoblástica inadecuada de las arterias espirales maternas, lo cual implica un estado de vasoconstricción crónica de los villi terciarios que finalmente conduce a una reducción en el aporte de nutrientes y oxígeno al feto que altera el correcto desarrollo. La mayoría de los autores1,4,5 definen RCIU como aquel feto con un peso inferior al P3 o bien con un peso comprendido entre P3 y P10 pero con alteraciones en el estudio doppler. Esta definición se ha aceptado partiendo de que son estos los fetos que van a presentar un incremento en la mortalidad y morbilidad perinatal4,5.
En relación con estos datos, se observó en la serie que el porcentaje de cesáreas por riesgo de pérdida de bienestar fetal en el grupo con peso restringido fue superior al del grupo control (p<0,001). En el grupo RCIU calculamos que el 24,44% presentaron un pH de cordón menor de 7,20 (de ellos el 4,4% con pH<7,10). En la base de datos perinatales de la SEGO de 200411, con una cohorte de 76.048 RN elegidos aleatoriamente, encuentran una frecuencia de pH<7,20 del 16,08%.
Con el estudio del pH de cordón se intentó encontrar una relación entre el bajo peso al nacer y peores resultados posparto. El pH nos indica el estado ácido-base del RN, pero no necesariamente predice su evolución posnatal. Encontramos que existe una relación estadísticamente significativa entre RCIU y pH menor de 7,20 (p<0,001), que refleja acidosis neonatal.
Nuestro estudio tiene como objetivo principal estudiar si los niveles bajos de PAPP-A son capaces de predecir el desarrollo de fetos con RCIU y para ello ha sido necesario analizar secundariamente diferentes características maternas que pueden influir en su desarrollo. Dado que nuestra hipótesis inicial es demostrar la relación entre PAPP-A y RCIU, nos interesa estudiar 2 grupos que sean comparables entre sí independientemente de las características maternas.
Se admite que, a partir de la 34 semana de embarazo, los fetos masculinos tienen, habitualmente, mayor peso que los femeninos, y, a término, la diferencia entre ambos sexos es de unos 150g de media. En nuestro estudio, la distribución según el sexo de los RN con RCIU mostró una ligera predilección (53,1%) por el sexo femenino, pero sin significación estadística.
Algunos autores describen un incremento de riesgo asociado a la edad materna. Gaudineau12 refiere que la edad superior a 35 años incrementa el riesgo de RCIU en 3 veces. Al valorar nuestros datos, observamos que las pacientes con RCIU presentaban una media de edad superior al grupo control (31,36 frente 29,68 años), pero esta diferencia fue menor a 2 años y, aunque presentó significación estadística, creemos que presenta poca trascendencia clínica.
Otro factor de riesgo ampliamente reseñado en la literatura médica es el IMC. Algunos trabajos12,13 demuestran una relación inversamente proporcional entre el IMC materno y el riesgo de RCIU; es decir, a mayor IMC menor riesgo de tener un RN con bajo peso. Spencer14 encuentra una odds ratio de 0,984 (IC 95%: 0,978-0,989) para esta característica. Nosotros no encontramos significación estadística al estudiar esta variable: los pesos maternos de ambos grupos fueron muy similares, con medias de 64,97 y 65,32kg; medias de peso que incluso fueron superiores en el grupo a estudio.
Las gestaciones obtenidas mediante técnicas de reproducción asistida también se citan como factor de riesgo para el desarrollo de RCIU12,13. En nuestra serie no fue posible evaluar este parámetro dado que la muestra de gestantes con el antecedente de fecundación in vitro fue muy pequeña (n=2).
El efecto del tabaquismo sobre el peso fetal al nacimiento ha sido ampliamente referido y se ha identificado como el principal factor de riesgo modificable para prevenir el RCIU en los países desarrollados15. En general, la odds ratio ajustada del hábito tabáquico para la aparición de RCIU es del 2,791 (IC 95%: 2,394-3,255)13 y se considera que el tabaco es el agente etiológico responsable del 13,9% de los casos de RCIU15. Estos mismos autores16 observan también que a mayor consumo de tabaco mayor riesgo de alteración de crecimiento fetal y que el efecto del tabaco a la hora de desarrollar RCIU se ve potenciado en las gestantes de mayor edad y que presentan el antecedente de parto prematuro. El mecanismo exacto por el cual el humo del tabaco tiene capacidad de alterar el crecimiento fetal es desconocido, si bien se postula que pueda deberse a los efectos citotóxicos directos de la nicotina o por el efecto vasoconstrictor sobre la circulación feto-placentaria.
Esposito et al.17 indicaron, tras investigación en animales, que el humo del tabaco puede alterar el crecimiento fetal en fases previas a la implantación y que esto ocurre de igual modo en las fumadoras pasivas.
En nuestra serie encontramos que el tabaquismo fue más frecuente en el grupo de gestantes con RCIU con significación estadística, con un RR de 1,67 (IC 95%: 1,1-1,99), inferior al encontrado por otros grupos. Además, debemos resaltar que es llamativo el alto porcentaje de gestantes fumadoras en el grupo que presentó alteraciones del crecimiento, representando el 42,2% del total de gestantes.
Recientemente se ha publicado que el consumo de tabaco durante el embarazo induce una disminución de la PAPP-A y de los factores de crecimiento similares a la insulina (IGF-I e IGF-II)18, lo que apoya la hipótesis de que la PAPP-A actúa como una proteasa regulando el sistema IGF, y este regulando el crecimiento intrauterino.
Con el fin de evitar este factor de confusión (la nicotina disminuye los niveles plasmáticos de PAPPA-A) y dada la alta prevalencia de fumadoras en nuestra serie, hemos realizado un estudio secundario, eliminando a todas las gestantes fumadoras de ambos grupos, en el que hemos llegado a las mismas conclusiones: los valores bajos de PAPP-A son un predictor de RCIU independientemente del consumo de tabaco materno.
Souka et al.19 encuentran una asociación entre la TN y el peso fetal al nacimiento. Describen que los valores TN son significativamente menores en la ecografía del primer trimestre de los fetos que posteriormente van a desarrollar retraso de crecimiento (p<0,001). El mecanismo fisiopatológico de dicha asociación es a día de hoy desconocido. Estos mismos datos vienen avalados por los estudios del grupo de Nicolaides13. En nuestra serie al estudiar los valores de la TN no se encontró significación estadística, siendo los mismos prácticamente idénticos en los 2 grupos.
Existen pocos trabajos que hayan examinado la contribución de la CRL en la predicción de las desviaciones del peso fetal, no obstante, algunos estudios concluyen que los valores de la CRL en el primer trimestre se relacionan de forma contundente tanto con los niveles de PAPP-A como con el peso al nacimiento. Otros autores20 postulan que la CRL medida en las semanas 11-13 es capaz de predecir RCIU, y que actúa como un indicador de la trayectoria del crecimiento fetal. En nuestro trabajo, las medias de las CRL de ambos grupos fueron prácticamente idénticas, sin significación estadística. Este resultado nos permitió eliminar este parámetro como factor de confusión a la hora de analizar la relación de la PAPP-A como factor independiente de predicción de RCIU.
El resultado más interesante de nuestro estudio es la asociación de niveles bajos de PAPP-A al retraso de crecimiento intraútero. Al estudiar los valores de la PAPP-A (MoM) se observó que el grupo de RCIU presenta cifras muy inferiores al grupo control, con una media en los primeros de 0,84 frente a 1,40 en el grupo control, para una p<0,001. Los modelos GAM de regresión nos ayudaron a demostrar que los valores de la PAPP-A poseían un comportamiento lineal, y además significativo, para predecir riesgo de desarrollar RCIU. Es decir, cuanto menor es el valor de la PAPP-A (MoM) mayor probabilidad tenemos de obtener un feto con RCIU. De este modo, se estimó que valores de la PAPP-A menores o igual a 0,336 predicen pesos fetales inferiores al P3, para un intervalo de confianza del 95% (0,24-0,56).
Pero, ¿qué es la PAPP-A y cuál es el mecanismo fisiopatológico que justifica nuestros hallazgos?
La PAPP-A se identificó por primera vez en 1974 por Lin et al.21. Es una enzima de alto peso molecular, fijadora de cinc, perteneciente a la familia de las mieloproteinasas22. Su expresión se regula mediante un gen localizado en el cromosoma 9q33.123.
Se sintetiza por el trofoblasto placentario desde el día 21 del embarazo. Sus niveles en el suero materno aumentan rápidamente, doblando sus valores en 6 días durante el primer trimestre. En las gestaciones normales su concentración se eleva con la edad gestacional hasta el parto, momento a partir del cual sus niveles descienden rápidamente, con una vida media de 3-4 días. También se secreta en una amplia variedad de tejidos y órganos tales como testículos, endometrio, riñón y colon24, pero sus concentraciones son mucho menores. A nivel celular se ha aislado la secreción de PAPP-A por células tan dispares como musculares, osteoblastos y células de la capa granulosa del ovario23.
En 1983 Westergaard et al.25 asocian por primera vez los niveles bajos de PAPP-A con el mal pronóstico gestacional y, solo un año después, estos mismos autores relacionan los valores plasmáticos bajos de esta enzima con el RCIU26 y los cuadros hipertensivos de la gestación27.
Las primeras publicaciones que apuntan que los niveles plasmáticos bajos de PAPP-A son capaces de predecir el riesgo fetal de síndrome de Down se realizaron en 199228 y, en la actualidad, la selección poblacional mediante el CCPT es una práctica habitual en la mayoría de los hospitales. De forma similar encontramos que algunos centros utilizan los valores bajos de PAPP-A (inferiores a 0,4 MoM) en la predicción de la preeclampsia29.
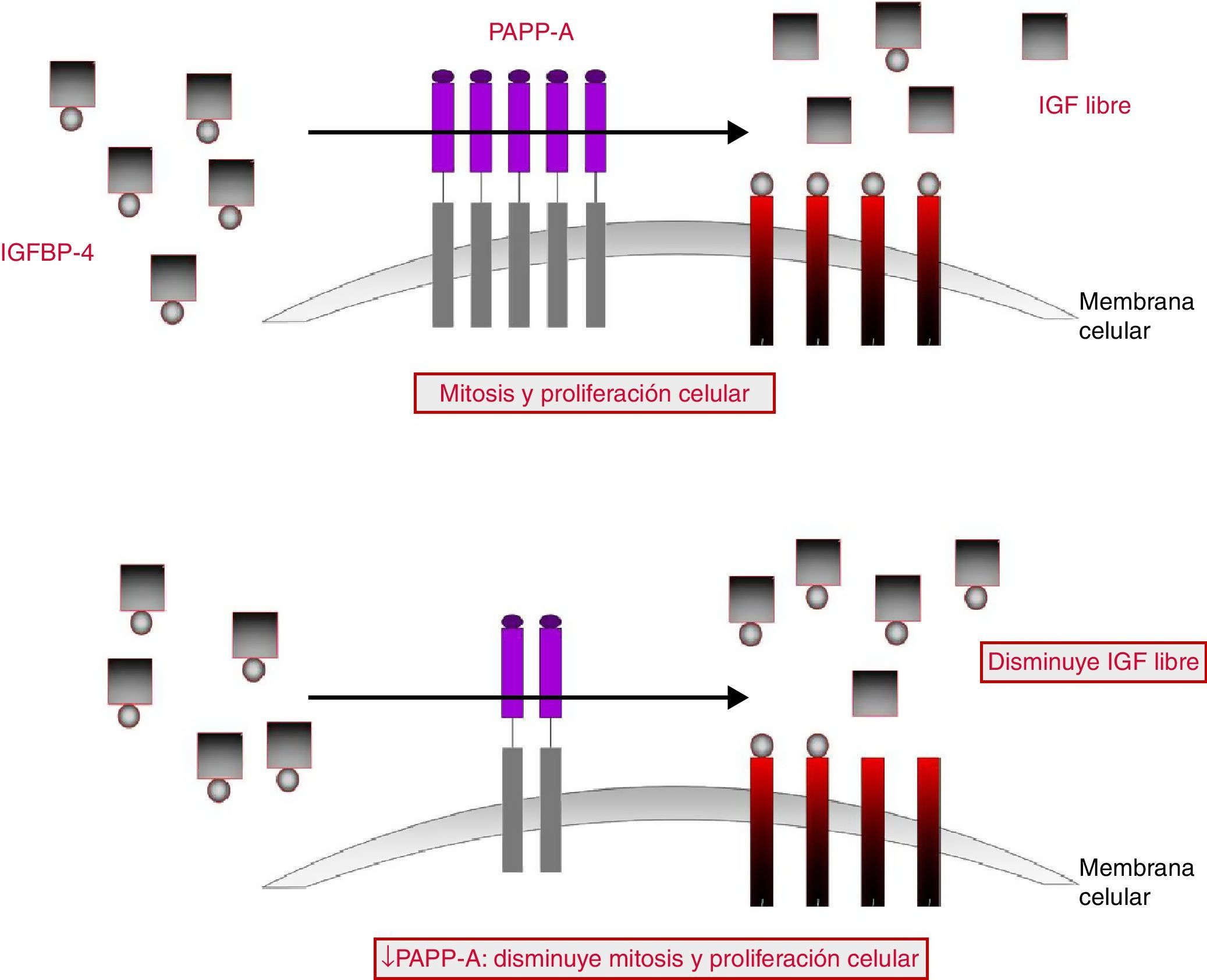
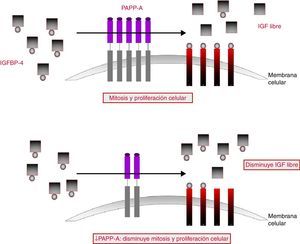
Lawrence et al.30, en 1999, identificaron la función de la PAPP-A y demostraron su actividad proteasa del factor de crecimiento insulin-like unido a la proteína-4 (IGFBP-4). En la gestación, el sistema relacionado con el factor de crecimiento insulínico (insulin-like growth factor [IGF]) está relacionado con el crecimiento y el desarrollo fetal. El IGF-I y el IGF-II31 son péptidos pequeños, similares a la insulina, que tienen acción mitogénica, metabólica y diferenciadora en un amplio rango de tejidos, incluida la placenta. Ambos se unen a uno de los 6 tipos de proteínas ligadoras de IGF (insulin-like growth factor binding proteína [IGFBP]) presentes a nivel plasmático y son capaces de modular la acción de estos péptidos. Esta modulación la realizan mediante el cambio en su vida media, transporte e incluso la localización del IGF en diferentes tejidos. La unión de la IGFBP y el IGF bloquea y disminuye la biodisponibilidad IGF libre.
La función de la PAPP-A consiste en fragmentar dicho complejo, de modo que los IGF se liberan, permitiendo su unión con los receptores celulares. Los IGF son capaces de promover localmente la mitosis y la diferenciación celular y son fundamentales tanto en la embriogénesis como en la regulación del crecimiento fetal y placentario. Los valores de PAPP-A en el suero materno reflejan los niveles locales de PAPP-A y la disponibilidad de los IGF. Por tanto, parece lógico que los niveles bajos de PAPP-A indiquen bajos niveles de IGF y se asocien a un pobre crecimiento fetal y placentario (fig. 4).
Estudios recientes32 encuentran que los niveles elevados de IGFBP-4 en la sangre materna durante el primer trimestre se asocian al desarrollo posterior de RCIU, con una odds ratio de 22 (IC 95%: 2,7-181). Estos autores consideran que la IGFBP-4 es un regulador clave del sistema IGF-II, implicado en la biodisponibilidad de IGF, por lo que jugaría un papel importante en la modulación de la placenta y el crecimiento fetal. Una explicación probable para esta elevación sería la deficiente proteólisis de esta proteína por la PAPP-A32, lo cual apoyaría la base de nuestro estudio.
Tras conocer la base fisiopatológica por la cual los niveles bajos PAPP-A pueden predecir el RCIU, siendo esta la hipótesis fundamental de nuestro estudio, procedemos a revisar la evidencia científica sobre dicha asociación.
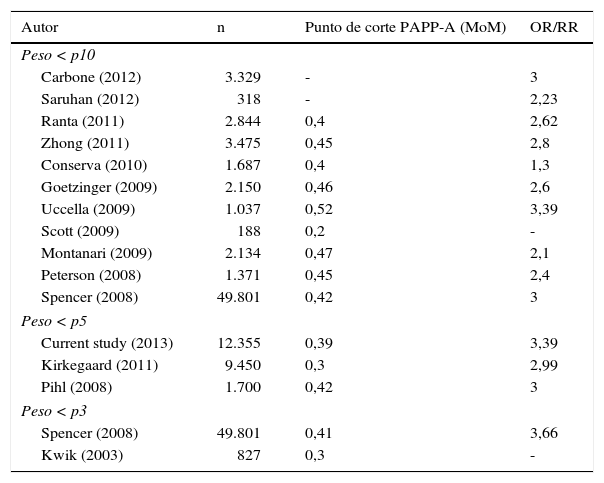
Desde que Westergaard et al.26 asocian por primera vez los niveles bajos de PAPP-A con el RCIU, son varios los estudios que llegan a la misma conclusión. Tal vez la principal limitación en todos estos trabajos es la definición de RCIU. Así, muchos autores seleccionan una cohorte de estudio de RN con pesos por debajo del P10 sin valorar la fluxometría, otros definen el RCIU en P5 y solo unos poco emplean el P3 para sus muestras. En la tabla 633 se muestra un resumen de dichos trabajos.
Resumen de la literatura
| Autor | n | Punto de corte PAPP-A (MoM) | OR/RR |
|---|---|---|---|
| Peso < p10 | |||
| Carbone (2012) | 3.329 | - | 3 |
| Saruhan (2012) | 318 | - | 2,23 |
| Ranta (2011) | 2.844 | 0,4 | 2,62 |
| Zhong (2011) | 3.475 | 0,45 | 2,8 |
| Conserva (2010) | 1.687 | 0,4 | 1,3 |
| Goetzinger (2009) | 2.150 | 0,46 | 2,6 |
| Uccella (2009) | 1.037 | 0,52 | 3,39 |
| Scott (2009) | 188 | 0,2 | - |
| Montanari (2009) | 2.134 | 0,47 | 2,1 |
| Peterson (2008) | 1.371 | 0,45 | 2,4 |
| Spencer (2008) | 49.801 | 0,42 | 3 |
| Peso < p5 | |||
| Current study (2013) | 12.355 | 0,39 | 3,39 |
| Kirkegaard (2011) | 9.450 | 0,3 | 2,99 |
| Pihl (2008) | 1.700 | 0,42 | 3 |
| Peso < p3 | |||
| Spencer (2008) | 49.801 | 0,41 | 3,66 |
| Kwik (2003) | 827 | 0,3 | - |
La mayoría de los autores encuentran el punto de corte para la PAPP-A (MoM) (PAPP-A cutoff) con capacidad para predecir RCIU por debajo de 0,4MoM. Con este valor hallan riesgos relativos de RCIU que varían entre el 1,3 y el 3,6. Nosotros encontramos una PAPP-A cutoff de 0,336 con un riesgo relativo de 2,507.
La diferencia de nuestro estudio con los de la mayoría de los autores es que nosotros hemos aplicado estrictamente la definición de RCIU y solo hemos incluido en el grupo casos a los fetos con un peso inferior al P3 para la amenorrea al parto. También es cierto que no hemos incluido a los fetos con peso superior a P3 y alteraciones en el estudio doppler, que por definición se corresponden con RCIU.
Tras nuestro trabajo podemos afirmar, al igual que el resto de autores, que los niveles de PAPP-A en sangre materna reflejan la función placentaria y nos van a servir para seleccionar una cohorte de fetos que van a presentar un mayor riesgo de complicaciones derivadas de las alteraciones de la placentación.
La Sociedad Canadiense de Obstetras y Ginecólogos34 afirma que los niveles bajos de la PAPP-A por debajo 0,4 o 0,5 MoM se relacionan con resultados obstétricos adversos asociados con la placentación y afirma que, cuanto menor sea el valor de la PAPP-A mayor es el riesgo relativo de un mal resultado perinatal, con un nivel de evidencia II-2A (niveles de evidencia del Grupo Canadiense de Salud Preventiva)34, pero también afirman que en la actualidad no existe un protocolo específico de tratamiento ni seguimiento de estos fetos.
La línea de las últimas investigaciones apunta hacia el desarrollo de modelos de predicción basados en algoritmos que combinan distintos marcadores bioquímicos, factores de riesgo materno y marcadores biofísicos, como el doppler de arterias uterinas, de los que ya disponemos en el primer trimestre, con la ventaja de que no suponen un coste adicional13,20,35,36. Si bien se ha logrado aumentar perceptiblemente las cifras de sensibilidad, hoy por hoy todavía no se ha conseguido establecer ningún método capaz de detectar precozmente anomalías en el crecimiento con la suficiente sensibilidad, especificidad y valores predictivos como para utilizarla como herramienta de cribado en la práctica clínica, ya que ninguno de los métodos propuestos consigue distinguir entre RCIU y PEG.
Nosotros, aunque hemos demostrado que los niveles bajos de PAPP-A en el primer trimestre se relacionan con un riesgo elevado de RCIU, tampoco hemos podido establecer su utilidad clínica como método de cribado poblacional sistemático, debido al reducido tamaño muestral, que no ha permitido calcular curvas ROC. Pero creemos que existe suficiente evidencia como para que un resultado de PAPP-A anormalmente bajo, junto con otros factores de riesgo, permita al clínico establecer un riesgo individual a priori para cada paciente, con quien adoptar estrategias de vigilancia específicas.
Como bien señala Nicolaides37, la identificación temprana de grupos de riesgo supone un estímulo para ampliar la investigación sobre la materia y ayudará en la creación de mejores protocolos para el seguimiento y desarrollo de estrategias preventivas. De hecho, ya hay trabajos que proponen que el uso de ácido acetil salicílico a bajas dosis en etapas precoces puede reducir potencialmente a la mitad no solo el riesgo de preeclampsia sino también de RCIU en ausencia de preeclampsia38.
El hecho de aprovechar los datos que nos proporciona el CCPT para detectar gestaciones de alto riesgo para determinadas enfermedades relacionadas con la placentación puede suponer un cambio en el concepto de atención prenatal que llevamos a la práctica hoy en día, pasando de una serie de visitas de rutina a un enfoque más individualizado tanto en términos de frecuencia como de contenido de dichas visitas.
Al margen de todas estas consideraciones, es necesario el desarrollo de grandes estudios prospectivos, de carácter multicéntrico, que empleen definiciones consistentes, con intervenciones asignadas al azar y con un seguimiento a largo plazo para obtener resultados con mayor solidez científica. Si bien es cierto que los estudios más recientes muestran una visión optimista de que el cribado de esta enfermedad obstétrica es posible.
ConclusionesLos valores de PAPP-A expresados en MoM se comportan como un predictor independiente de retraso de crecimiento fetal, sin estar influidos por factores maternos o parámetros ecográficos fetales precoces.
Un valor de PAPP-A (MoM) por debajo de 0,33 MoM puede predecir pesos fetales inferiores al P3, para un intervalo de confianza al 95% (0,24-0,56).
Un valor de PAPP-A (MoM) inferior a 0,4 MoM tiene un riesgo relativo de RCIU del 2,50, superior, incluso, al que presenta el consumo de tabaco en la gestación (RR: 1,7).
El cribado combinado de cromosomopatías fetales es actualmente una práctica habitual en la mayoría de los hospitales. A partir de los datos que este nos ofrece, es posible seleccionar a un grupo de pacientes con mayor riesgo de alteraciones de la placentación, sin que ello suponga un incremento del gasto sanitario, que facilita la optimización de los recursos materiales y humanos.
Los autores declaran no tener ningún conflicto de intereses.