La resonancia magnética de mama es una técnica de imagen que se ha consolidado con el tiempo y que ha demostrado tener la mayor sensibilidad en el diagnóstico del cáncer de mama, pero, con todo y con eso, es una técnica compleja en la que hay que estudiar concienzudamente los escenarios clínicos para una adecuada aplicación.
En este artículo hacer una revisión de las principales indicaciones clínicas y de la compleja técnica que conlleva.
Por supuesto, aún se encuentra en expansión tecnológica y surgen progresivamente herramientas y software que sin duda contribuirán al diagnóstico certero tanto de la enfermedad benigna como de la maligna.
Breast magnetic resonance imaging is an imaging technique that has been consolidated over time and has shown greater sensitivity in the diagnosis of breast cancer. It is, however, a complex technique because various clinical scenarios must be thoroughly studied for a better application.
This article reviews the main clinical indications and the technical points of magnetic resonance imaging.
It should be noted that magnetic resonance imaging is still improving technologically, with tools and software gradually emerging that will undoubtedly contribute to the accurate diagnosis of both benign and malignant breast disease.
Mi intención es revisar la bibliografía en lo que respecta a una técnica de suma relevancia en el diagnóstico de la enfermedad mamaria, con repercusiones muy importantes sobre la vida de la mujer con cáncer de mama.
Es una técnica muy específica y en constante desarrollo tecnológico, que ha demostrado una capacidad diagnóstica muy superior a los métodos convencionales de imagen y que se ha vuelto imprescindible a día de hoy en los arsenales diagnósticos de las afecciones mamarias, siempre atendiendo a unos requerimientos técnicos y escenarios clínicos muy concretos.
RevisiónSegún estimaciones de la Agencia Internacional para la Investigación del Cáncer (IARC), se diagnostican al año 1,44 millones de casos en el mundo. Actualmente, las diferencias geográficas han disminuido respecto a décadas anteriores, aunque aún se aprecia un claro patrón, con mayor incidencia en Europa, EE. UU. y Australia1. No obstante, actualmente atendemos también a un aumento de las cifras en países en vías de desarrollo debido a la progresiva mayor esperanza de vida, al aumento de la urbanización y a la adopción de modos de vida occidentales.
Una de cada 8 mujeres (12,5%) en el mundo desarrollará cáncer de mama a lo largo de su vida, por tanto, atendiendo a las cifras, el cáncer de mama hoy día constituye un problema de salud pública. Esta afirmación la podemos realizar basados no solo en la frecuencia global de esta enfermedad, sino en la repercusión que tiene en la vida de la mujer y en la presión que recae sobre nuestros sistemas sanitarios.
Los programas de detección precoz del cáncer de mama junto con los avances diagnósticos y terapéuticos recientes se han traducido en un incremento de la supervivencia, así como en la curación de este cáncer.
La mamografía es el procedimiento más conocido por todos e imprescindible en el diagnóstico de la enfermedad mamaria. De acuerdo con las sociedades nacionales e internacionales, actualmente se indica realizar una mamografía a toda mujer con edad comprendida entre los 40 y los 70 años. Es, además, la única técnica de imagen que ha demostrado un descenso en las tasas de mortalidad por cáncer de mama.
La mamografía es nuestra mejor arma para diagnosticar el cáncer de mama, pero se estima que entre un 10 y un 15% de los casos, debido a múltiples factores, entre ellos la densidad mamaria, la prueba es insuficiente para el correcto diagnóstico. Precisamente, en estos casos donde existe dificultad en la lectura mamaria, el médico radiólogo completa el estudio de imagen con una ecografía. Por tanto, la ecografía es un complemento radiológico de alto valor, pero no es un instrumento de screening por sí mismo; de hecho, la mamografía y la ecografía han de leerse e interpretarse de manera integrada.
La resonancia magnética (RM) es una técnica de imagen que se ha ido incorporando paulatinamente en el estudio por imagen del cáncer de mama, ahora hace ya 25 años. Se obtienen las imágenes a partir de la magnetización de los átomos de hidrógeno, que se convierten en señales que son interpretadas por un potente software y que dan como resultado las imágenes de resonancia que conocemos.
Esta técnica aplicada a las afecciones mamarias ha constituido uno de los avances más importantes en el diagnóstico por imagen, tanto por su poder de discriminación tisular como por su potencial caracterización de lesiones malignas, sobre todo, cuando son empleados los medios de contraste, ya que las lesiones malignas presentan habitualmente una alta vascularización.
Esta técnica se sustenta en la capacidad de analizar y estudiar el perfil morfológico y cinético de la captación de contraste paramagnético de la lesión tumoral, dada la alta avidez de entrada de contraste en los múltiples vasos sanguíneos generados en la lesión tumoral. La actividad angiogénica del cáncer da lugar a una vascularización que promueve la actividad tumoral y, a la vez, ayuda a mantener su homeostasis metabólica. Esta neoangiogénesis depende a su vez de múltiples factores interrelacionados biológicos, bioquímicos e histopatológicos que influyen y repercuten en el crecimiento de las lesiones malignas2, y es la que constituye la base del diagnóstico del cáncer de mama en la RM3. La administración de un agente de contraste intravenoso permite visualizar las lesiones: el más utilizado es el gadolinio-ácido dietilentriaminopentaacético (Gd-DTPA).
Las nuevas estructuras vasculares que se generan en el seno del tumor son considerablemente diferentes a las del tejido fibroglandular normal, con una alta desorganización y estructura heterogénea: se trata de vasos débiles y altamente permeables a macromoléculas, con shunts arteriovenosos, marcada tortuosidad y dilataciones vasculares, entre otras características4.
De hecho, es perfectamente plausible que tanto el aumento de la perfusión como las velocidades de difusión capilar puedan ser factores predictivos del realce de las lesiones en la RM. Por tanto, la correlación entre un crecimiento agresivo del cáncer de mama y la actividad angiogénica podría explicar la alta sensibilidad de la RM para el diagnóstico del cáncer de mama invasivo3. No obstante, a esto tenemos que añadir que la actividad angiogénica no es patognomónica de las lesiones malignas, sino que también en determinadas situaciones podemos ver un incremento de la vascularización del tejido mamario, como, por ejemplo, ante procesos inflamatorio-infecciosos agudos, o incluso en determinados cambios hormonales que presenta la mujer durante su ciclo menstrual y a lo largo de su vida.
En las pacientes premenopáusicas el parénquima mamario es sensible a los estrógenos, lo cual va a influir directamente en los procesos de permeabilidad vascular. Está establecido que en estas mujeres las mayores captaciones debido a este fenómeno son más frecuentes en la semana 1 y la 4 del ciclo menstrual, por lo que es más adecuado realizar la prueba entre las semanas 2 y 3, fundamentalmente entre los días 6 y 16 de su ciclo, con el fin de disminuir los falsos positivos de la técnica.
De forma sucesiva, y dado que a la RM de mama se le exigen unos mínimos requerimientos técnicos para obtener un estudio de alta calidad, se han ido estandarizando y consensuando los parámetros técnicos, así como se han ido estableciendo diferentes protocolos aplicados a la afección mamaria. Igualmente, también se han revisado sus indicaciones clínicas, que son, no obstante, objeto de discusiones en muchos casos.
Su uso en condiciones técnicas adecuadas mejora el proceso diagnóstico del cáncer de mama, siempre y cuando se utilice como un método de imagen adicional en el curso diagnóstico y, por supuesto, de forma coherente y coordinada con el resto de los recursos clínico-diagnósticos de los que hoy día disponemos. Además, los criterios diagnósticos se fundamentan en el sistema breast imaging report and database system de lectura mamográfica del Colegio Americano de Radiología (ACR).
La sensibilidad de la técnica en la detección de un cáncer infiltrante es del 91%, con un valor predictivo negativo del 94%5,6. Bazzocchi et al. se centraron en las microcalcificaciones y reportaron una sensibilidad de detección de la RM de los carcinomas in situ del 79%7. Sin embargo, la especificidad es inferior a la sensibilidad, con un rango mucho más variable, que oscila entre el 37 y el 100%8, con falsos positivos que plantean problemas en su interpretación. El valor predictivo positivo no difiere en gran medida de los métodos convencionales de diagnóstico, con unos porcentajes nada despreciables de falsos positivos. Estas cifras han provocado que las indicaciones de la técnica hayan tenido que seleccionarse mucho más cuidadosamente.
Son varios los estudios que han demostrado que la RM puede detectar más neoplasias multifocales y multicéntricas (10-30% de las pacientes diagnosticadas de cáncer de mama) y más tumores bilaterales (3-9%), respecto a las técnicas de imagen convencionales9-11. Estos tumores pasarían inadvertidos en la mamografía en el 75% de los casos12, lo que significa que con cierta frecuencia la RM cambia el protocolo terapéutico en muchas de las pacientes con diagnóstico de cáncer de mama11,13-15.
Se considera que una de las indicaciones con mayor peso de la RM de mama es la de evaluar la extensión del tumor y, de manera añadida, caracterizar las lesiones detectadas y estadificar la enfermedad aprovechando su alta sensibilidad.
TécnicaLa RM de mama es una técnica muy exigente que consta de numerosos parámetros muy complejos. Son necesarias estrategias y protocolos de imagen avanzados (imagen en paralelo, gradientes potentes y alto campo) y se recomienda que el espesor de corte no sea superior a 3mm. Cada variable, a su vez, tiene consecuencias directas sobre la capacidad de detección, mayor cuanto más pequeña es la lesión.
Uno de los 2requisitos más importantes es la utilización de una bobina específica de mama y la segunda, como ya hemos mencionado, es la utilización de un agente de contraste16.
La bobina de mama presenta un diseño geométrico que proporciona una alta señal-ruido, que cubre toda la región anatómica de ambas mamas, desde la región supraclavicular hasta el pliegue inframamario. Por otro lado, cada vez es mayor la demanda de esta técnica y, por tanto, es cada vez más importante una perfecta colocación de la paciente en la bobina con el fin de realizar una correcta exploración. El tiempo de la prueba, sin embargo, es relativamente largo, por lo que tenemos que contribuir a que la paciente se encuentre lo más cómodamente posicionada para permanecer lo más inmóvil que pueda, en decúbito prono con cada mama colocada en el interior de las aberturas con las que cuenta la bobina.
Para el estudio dinámico nos servimos de tiempos de barrido relativamente cortos para demostrar el realce de las lesiones tras la administración del agente de contraste. Otro requisito utilizado ya de forma prácticamente protocolizada es la adquisición de secuencias en las que se ha suprimido la grasa, lo que mejora la detección, especialmente de lesiones de pequeño tamaño, aunque, por otro lado, incrementa discretamente el tiempo de la secuencia. Esta técnica se realiza aprovechando la separación espectral entre las resonancias del agua y de la grasa.
Resolución temporal y espacialLa prueba se fundamenta de forma especial en el estudio tras la administración de contraste iv y la adquisición de secuencias potenciadas en T1 (3D eco de gradiente T1), antes y después de la inyección del bolo de contraste. Se adquiere una secuencia previa y al menos 4tras su administración, con una resolución temporal de 60-120 s (ideal 60 s por adquisición dinámica). La captación máxima que va a presentar, por lo general, una lesión maligna se encuentra entre los 90-180 s tras la inyección del agente iv, por lo que una resolución temporal inferior a 120 s es necesaria para realizar un adecuado estudio cinético de la lesión. Se continúan adquiriendo secuencias en los 6 min posteriores, aproximadamente, lo que, de forma general, conforma una curva de captación de contraste satisfactoria.
El medio de contraste más utilizado es un quelato de gadolinio de distribución extracelular (Magnevist, Omnniscan, Prohance, Optimark, Doarem, Gadovist, Gadograf), a dosis de 0,1-0,2mmol/kg de peso. Se administra en un bolo por una vía periférica, lo que condiciona un aumento de la intensidad de señal de las lesiones, los vasos sanguíneos y tejidos extracelulares vecinos, seguido de un bolo de suero salino de 20ml.
Posprocesado de la imagenUna RM de mama es un estudio de imagen largo que va a dar lugar a muchísimas imágenes, por lo que el radiólogo de mama va a tener que llevar a cabo un minucioso análisis de todas las secuencias y todos los parámetros. De hecho, el posprocesamiento de imagen se utiliza para reducir el número de imágenes que analizar.
La sustracción es una herramienta que resalta las características realzadas en las imágenes y también se aplica como método pasivo de supresión de la grasa. Otra herramienta de gran utilidad es la proyección de máxima intensidad, que es una técnica que proyecta el valor del píxel más brillante sobre una superficie bidimensional. En especial, lo utilizamos para crear imágenes de proyección de las estructuras vasculares16: precisamente los vasos y el tejido realzado son las imágenes más brillantes.
Caracterización de las lesiones en la resonancia magnéticaUna lesión o captación patológica en la RM de mama va a ser aquella que muestra una intensidad de señal por encima de la del tejido fibroglandular normal, tras la administración del agente de contraste. Vamos a atender a 2cuestiones: la primera, su morfología y la segunda, su comportamiento cinético.
Respecto a la morfología, lo primero que vamos a valorar es si dicha captación adquiere una forma de masa o, si al contrario, es un área no definida que llamaremos captación no masa. Si se trata de una masa, atenderemos a su forma (redondeada, ovalada, irregular), a sus márgenes (circunscritos, irregulares o espiculados) y a las características del realce interno de la lesión (homogéneo, heterogéneo, en anillo, con septos internos hipo- o hiperintensos). En cuanto a las captaciones no masa, es indispensable analizar su distribución (área focal, lineal, ductal, segmentaria o regional), la homogeneidad y el tipo de realce y su simetría.
En cuanto al comportamiento cinético, es decir, la conducta que exhibe la lesión con relación a la captación de contraste, la densidad microvascular en las lesiones malignas juega un papel de suma importancia en la determinación de la captación inicial de absorción de contraste y en la heterogeneidad del realce de la lesión. Los patrones dinámicos de captación de contraste se dividen en 3tipos, aunque en principio la curva de captación de contraste distingue una fase «inicial» y una fase «tardía»17,18, con base en la medición de la zona que realza con más intensidad. En esta área, que denominaremos región de interés, la intensidad de señal se mide a lo largo del tiempo, y se genera un gráfico de intensidad de señal/tiempo.
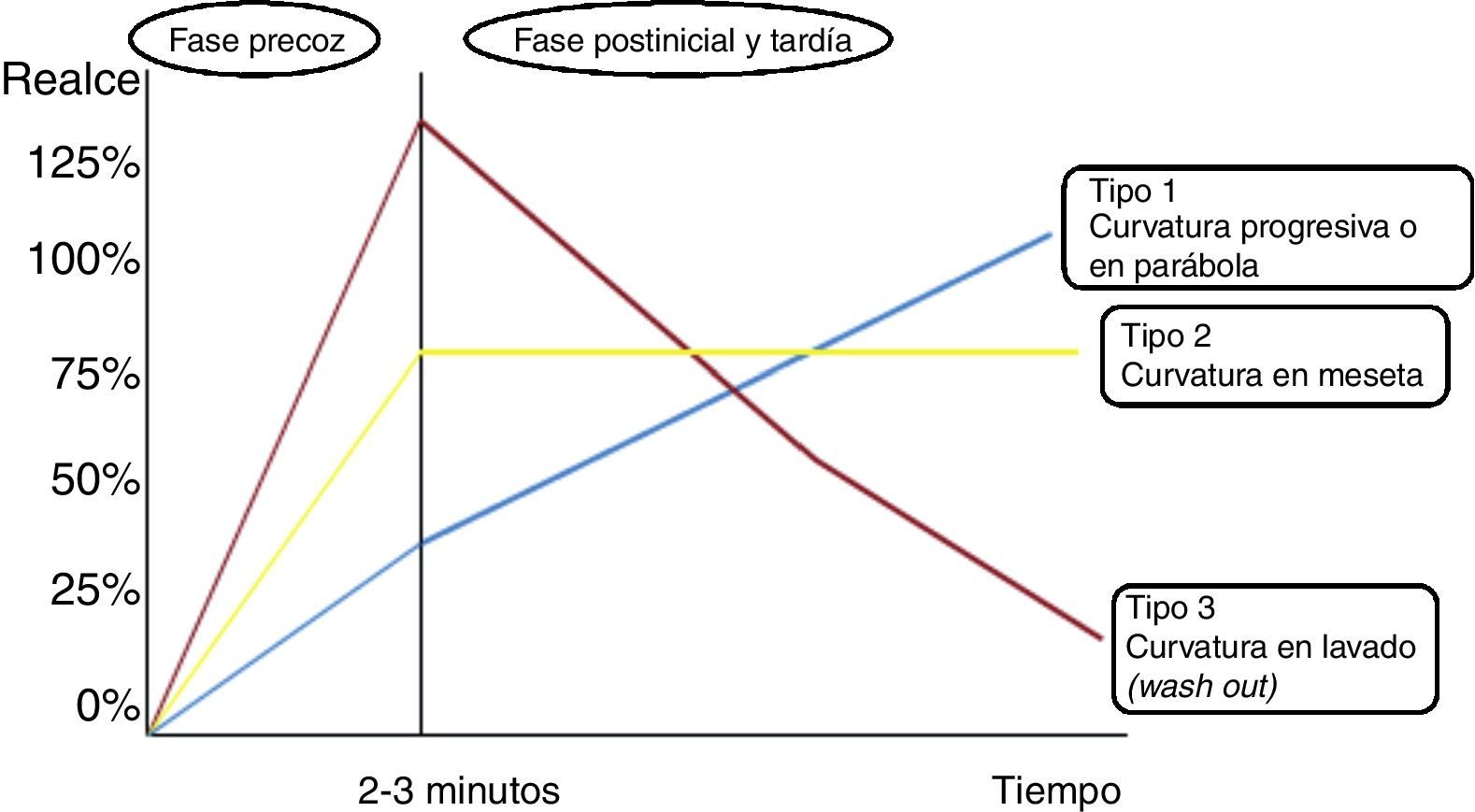
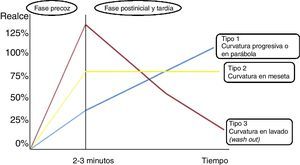
Se describen 3tipos de curvas en función de la morfología que adquiere el gráfico, si bien se describen además por una fase inicial (adquirida en los 2 primeros min tras la inyección del bolo de contraste), y una fase tardía una vez pasados dichos 2 min, en la que normalmente la curva suele empezar a cambiar y a definir su morfología global. Un realce continuo que aumenta progresivamente definirá una curva de tipo I. Una curva que muestra un realce máximo en los 2-3 primeros min y a continuación se estabiliza o entra en fase de meseta o plateau definirá una curva de tipo II y, finalmente, la de tipo III mostrará una caída o lavado (washout) tras una fase inicial de captación rápida. Por lo general, las lesiones de naturaleza benigna tenderán a presentar curvas de tipo I y las malignas preferentemente las de tipo III, si bien las de tipo II no son patognomónicas y se pueden ver en enfermedad maligna/benigna indistintamente (fig. 1).
Esquema ilustrativo de los tipos de curvas cinéticas. La curva de tipo I (línea azul) indica un realce persistente y progresivo. La de tipo II (línea amarilla) muestra un pico de realce hacia los 2-3 min iniciales tras la administración del contraste intravenoso, seguido de una fase meseta. La de tipo III (línea roja) muestra un pico de captación inicial que se continúa con una fase de rápido lavado (4).
En octubre del 2008 la Sociedad Europea de Especialistas en Cáncer de Mama (EUSOMA) organizó un grupo de trabajo para evaluar la evidencia clínica de la RM de mama y sus aplicaciones. Un total de 23 expertos en diferentes disciplinas en torno al cáncer de mama discutieron acerca del uso de esta tecnología y alcanzaron a definir en consenso las principales indicaciones y requerimientos de la técnica19. A continuación resumo las de mayor evidencia.
1. Estadificación del cáncer de mama: como señalábamos con anterioridad, realizar un estudio de extensión de la enfermedad resulta primordial. Nuestro objetivo es detectar lesiones mamarias sincrónicas al tumor diagnosticado en la misma mama y en la contralateral, lo cual modificaría radicalmente el planteamiento terapéutico. Además, se ha de indicar la necesidad de realizar reevaluación ecográfica o histológica de las lesiones detectadas.
Se estima que la RM detecta en torno a un 15% de lesiones secundarias en comparación con las técnicas estándar6,9,20,21.
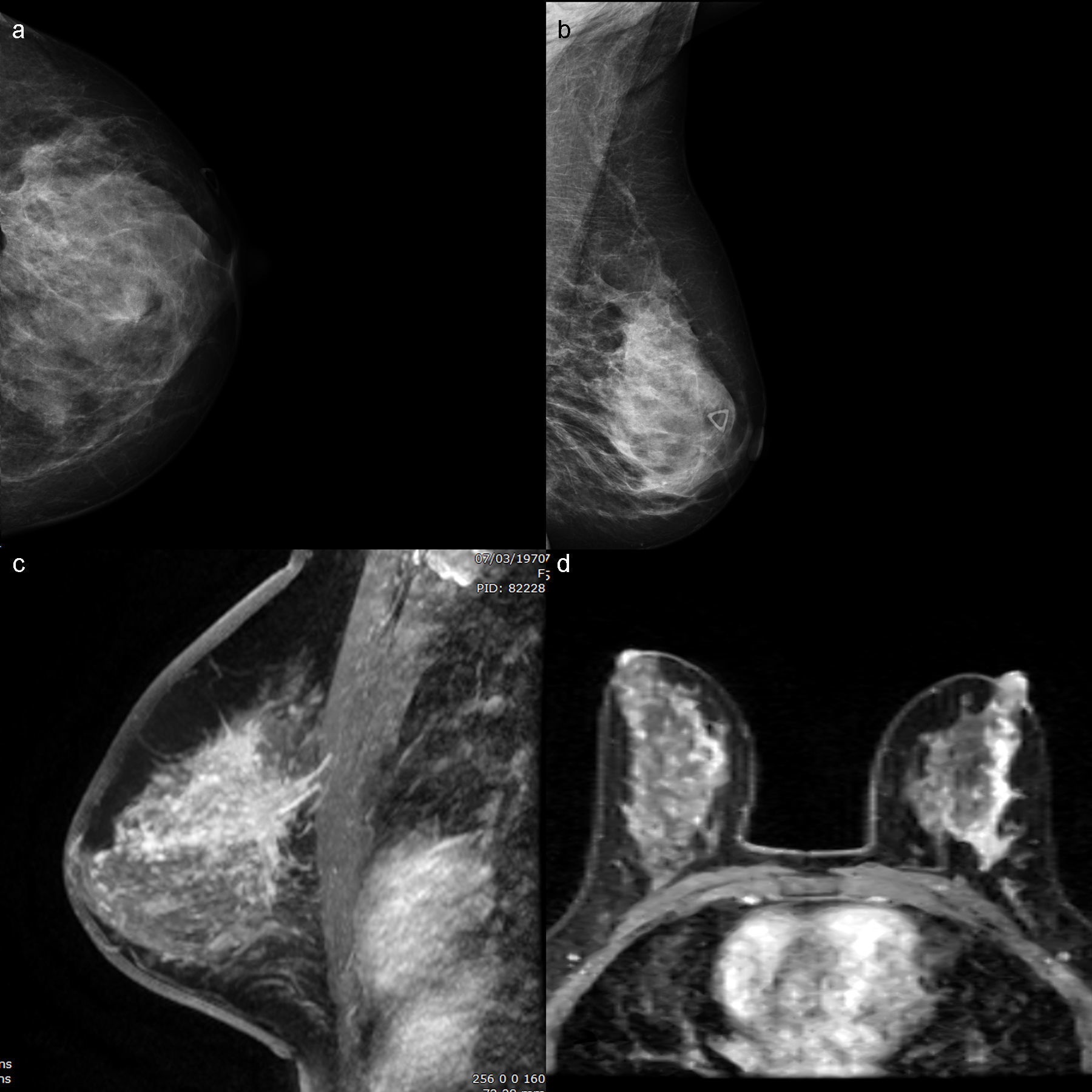
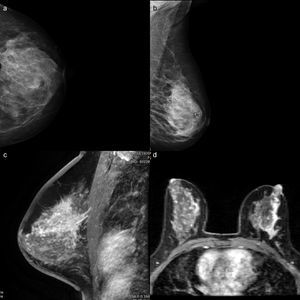
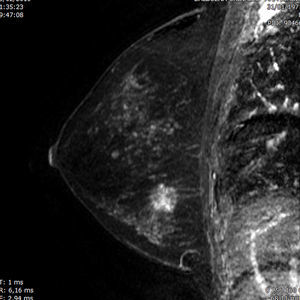
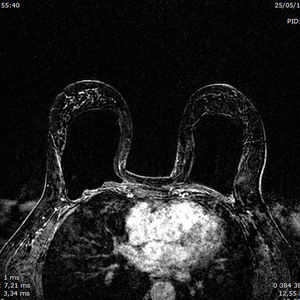
Es indiscutible que la RM presenta una mayor sensibilidad que las técnicas convencionales para evaluar la extensión real de la enfermedad y, además, para detectar carga tumoral adicional4,20 (figs. 2 y 3).
Mujer de 40 años sin factores de riesgo que acude por bultoma palpable desde hace un mes. Se realiza primera mamografía. a y b) Mamografía izquierda en proyecciones CC y OML, con sutil distorsión en intercuadrantes superiores. c y d) Secuencias T1 axial y sagital con supresión grasa tras administración de contraste, que muestran un marcado realce no masa asimétrico regional que afecta principalmente a cuadrantes superiores y externos, con realce interno a su vez heterogéneo, que asocia fenómenos de lavado de contraste, hallazgos que fueron catalogados como BIRADS5. La histopatología demostró un extenso carcinoma lobulillar.
También podemos diagnosticar enfermedad benigna. a y b) Mamografía izquierda en proyecciones CC y OML que muestran una asimetría palpable en cuadrantes internos, en paciente de 41 años sin factores de riesgo. c y d) Secuencia sagital T1 con supresión grasa tras administración de contraste, que exhibe un realce no masa regional y curva cinética de tipo III. La histopatología arrojó una pronunciada y extensa papilomatosis.
Ahora bien, la RM es más sensible que la mamografía en términos de diagnóstico y valoración de la extensión local, pero con un problema añadido —que son los falsos negativos, con respecto fundamentalmente al CDIS— así como la sobrestimación de la extensión lesional en el CDIS puro y en lesiones mixtas invasivas e in situ7,22,23. De hecho, el impacto del hallazgo de enfermedad adicional medido en términos de cambios de actitud terapéutica (CAT) muestra una tasa de CAT que oscila entre el 0,5 y el 11%. En el metaanálisis de Houssami se encontró un porcentaje de CAT del 16,6%4,13.
2. Evaluación de la respuesta al tratamiento quimioterápico. El estudio se practica para monitorizar la respuesta temprana al tratamiento y para identificar enfermedad residual.
En caso de que la paciente sea abordada con un tratamiento neoadyuvante, la RM es la mejor técnica para monitorizar si el tratamiento ha conseguido una reducción completa o no de la lesión de cara a la cirugía. De hecho, es un gran instrumento para evaluar in vivo la quimiosensibilidad del tumor. Además, no solo analiza la morfología de la lesión residual, sino que además no se ve afectada por cambios secundarios a fibrosis o necrosis postratamiento, que sí limitan las técnicas habituales.
Sin embargo, las tasas de infra- y sobrestimación de enfermedad residual no son despreciables —entre un 6 y un 25%— lo que limita discretamente los resultados4,24,25. No obstante, la RM tras la quimioterapia neoadyuvante no excluye tumor residual19,26.
Sin embargo, para disminuir costes es conveniente predecir en cuanto se pueda la no respuesta al tratamiento, en especial, tras el primer ciclo. Las nuevas técnicas como la difusión o la espectroscopia pueden ayudar a identificar a las pacientes respondedoras o no respondedoras incluso en las primeras 24h tras el inicio del tratamiento27.
Al finalizar el tratamiento, la RM es utilizada para valorar la existencia de enfermedad residual. Muchos estudios han demostrado la superioridad de la RM en este aspecto. No obstante, aunque es superior, la correlación no es del 100%. El grado de infraestimación depende del patrón de respuesta tumoral y también del tipo de quimioterapia aplicada27-30.
La infraestimación de la enfermedad residual se debe principalmente al efecto antivascular de los agentes quimioterápicos, los cuales pueden superar los efectos citotóxicos. El daño generado no solo afecta a la capacidad de crecimiento del tumor sino también al realce en RM y, por tanto, a su detectabilidad27-30.
3. Evaluación de enfermedad residual. En pacientes intervenidas mediante una cirugía conservadora con márgenes quirúrgicos positivos y sin RM realizada anteriormente, esta prueba es útil para evaluar enfermedad residual. En este caso, la RM determinará si se practica una nueva resección o bien una mastectomía, ya que evaluaremos el resto de la mama en busca de enfermedad residual, lo que impediría que la paciente recibiera tratamiento conservador; no así el lecho quirúrgico, puesto que el cirujano realizará una nueva resección a partir de los márgenes afectos31,32.
4. Detección de recidiva tras tratamiento conservador. La incidencia de recaída después de un tratamiento conservador es relativamente baja. A largo plazo, se ha demostrado una tasa acumulativa de recidiva ipsolateral del 8,8% a los 20 años19,33.
La mayor parte de las sospechas de recidiva del tumor se confirmarán mediante las técnicas convencionales de imagen, pero hay un número pequeño de casos en los que será difícil excluir la recidiva con estas técnicas. La RM tiene una alta sensibilidad para detectar la recurrencia y la enfermedad residual, incluso en fases tempranas tras la cirugía o la radioterapia19,34, además de la capacidad de diferenciar la recidiva de la fibrosis o cicatriz local. Se ha demostrado una sensibilidad del 90-100% y una especificidad de la técnica del 89-92%19,35,36.
5. Búsqueda de un carcinoma de mama oculto. El cáncer de mama oculto es una entidad poco frecuente que supone un 1% de todos los cánceres de mama. En aquellas mujeres con ganglios metastásicos axilares que apuntan a un origen primario de mama con estudios convencionales de imagen normales, la RM permitirá descubrir un cáncer en torno a un 70% de los casos6,19,37,38. Actualmente, en la literatura, los tratamientos para estas pacientes son diferentes, desde la mastectomía, cuadrantectomía, radioterapia, incluso, hasta la observación. Actualmente, se recomienda disección axilar y radioterapia19,39.
6. Cribado en pacientes de alto riesgo. Varios genes con mutaciones de alta penetrancia predisponen a las mujeres a desarrollar cáncer de mama en un alto porcentaje. En torno a un 3% de estos cánceres se ven en mujeres portadoras de los genes BRCA1 y BRCA2. Estas mujeres, así como sus familiares en primer grado, deben ser incluidos en los grupos de alto riesgo de cáncer de mama. La mamografía tiene una tasa de falsos negativos de hasta un 15% que se llega a elevar hasta un 50% en el caso de mamas densas premenopáusicas, por lo que es necesario considerar otras técnicas como la RM para un adecuado manejo de estas mujeres.
Desde finales de los años 90 el seguimiento radiológico de estas mujeres ha incluido la RM, y en la última década ya han ido apareciendo estudios prospectivos no aleatorizados que estudian el cribado con RM4,40 y demuestran una sensibilidad 2veces mayor que la mamografía. De hecho, en el análisis combinado de 5 estudios prospectivos de Sardanelli (3.571 mujeres) y en la revisión de Warner de 11 estudios los resultados son similares: la sensibilidad de la RM fue el doble que la de la mamografía41,42.
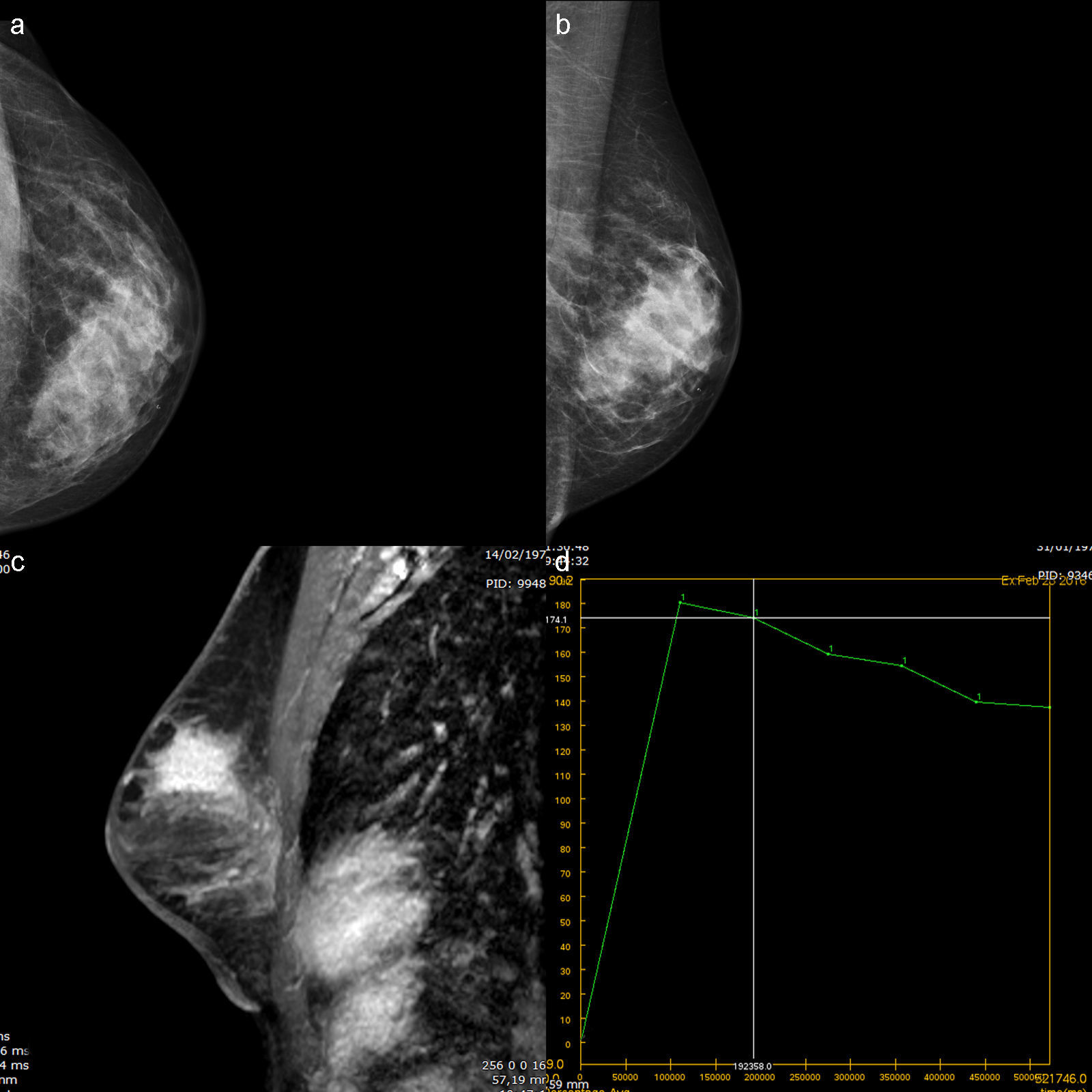
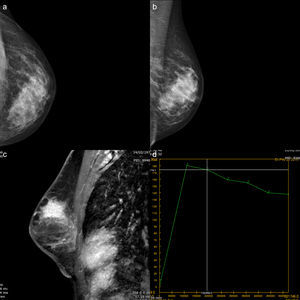
Cabe añadir que los cánceres de mama en estas pacientes con mutación de los genes BRCA1/BRCA2 cuentan con unas características de imagen especiales: estos cánceres se presentan con un comportamiento aparentemente benigno en edades más jóvenes y, además, con mayor agresividad que en las pacientes no portadoras; además, el subtipo más común entre esta población es el triple negativo, de peor pronóstico. En estas mujeres las mamografías son infradiagnósticas, ya que suelen tratarse de mamas densas y más radiosensibles (fig. 4).
Secuencia sagital T1 con supresión grasa tras administración de contraste con reconstrucción proyección de máxima intensidad en mujer de 38 años de edad, BRCA2+ y mamografías con un patrón de alta densidad. La RM demuestra una masa espiculada con realce interno heterogéneo, un hallazgo representativo de carcinoma ductal invasivo.
La Sociedad Americana del Cáncer recomienda un screening anual con RM a estas pacientes portadoras, a sus familiares en primer grado y a aquellas mujeres con un riesgo aumentado del 20-25% o superior a partir de los modelos establecidos de cálculo de riesgo19,40. Por otro lado, no hay recomendaciones a favor ni en contra de hacer RM en aquellas mujeres con un riesgo aumentado del 15-20%, en aquellas con neoplasia lobular intraepitelial, hiperplasia ductal atípica, mama densa o con historia personal de cáncer, incluyendo CDIS19,40. Finalmente, hay una clara recomendación de no hacer RM en mujeres con un riesgo inferior al 15% de desarrollar cáncer a lo largo de su vida, como es para la población general en EE. UU. Mientras que algunas mujeres optan por la mastectomía bilateral profiláctica, otras prefieren llevar a cabo un screening precoz con RM desde fases tempranas para prevenir la mortalidad. La justificación se basa en la extrapolación de la reducción de la mortalidad obtenida cuando se hace un diagnóstico temprano con el cribado con RM en la población general femenina de más de 50 años19,43.
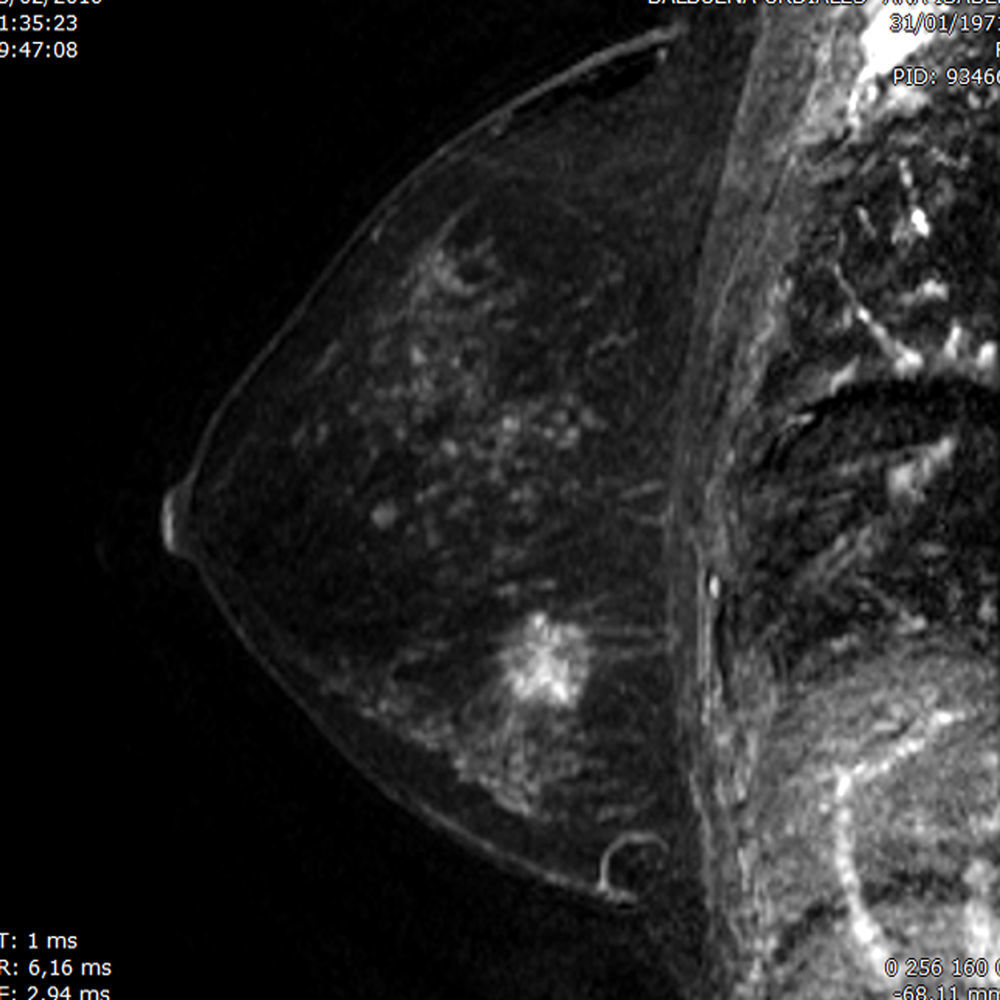
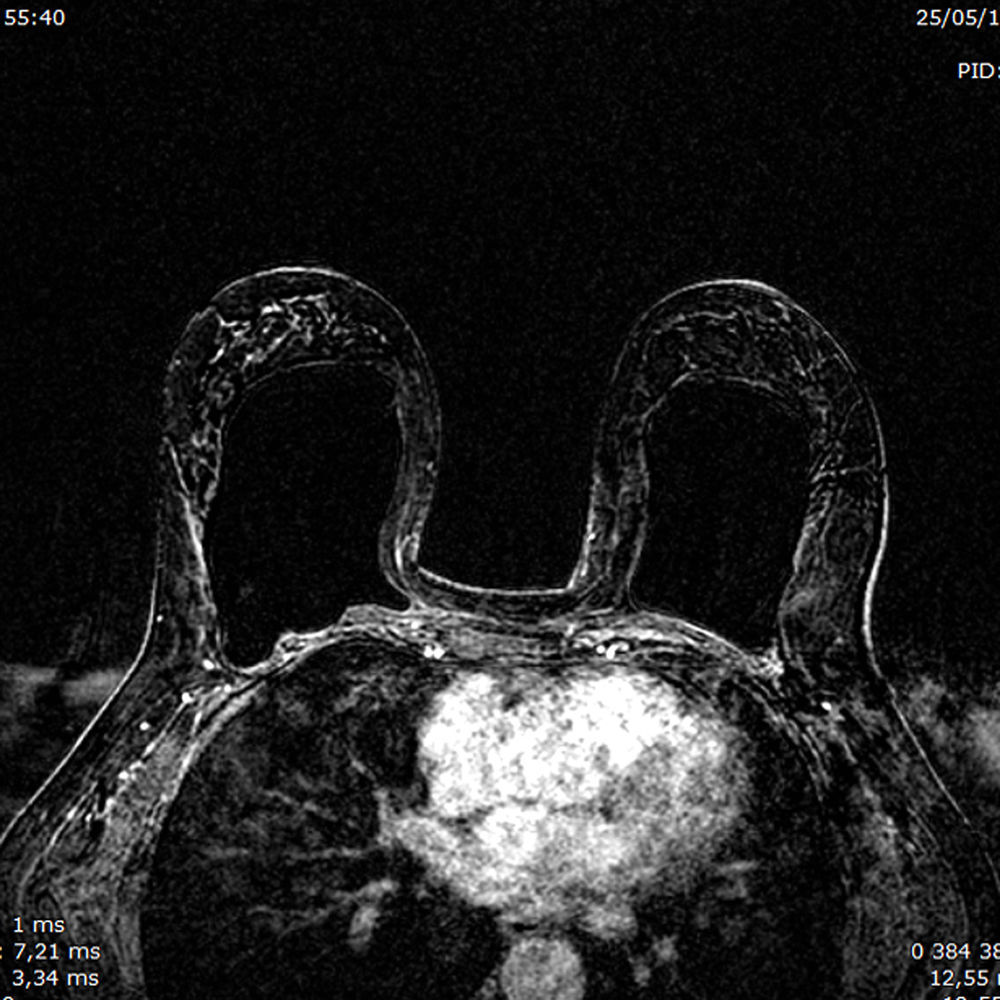
7. Evaluación de prótesis mamarias. Fuera del contexto oncológico, la RM ofrece la posibilidad de detectar complicaciones derivadas de los implantes mamarios (fig. 5), principalmente roturas. Para valorar la integridad de la prótesis el contraste intravenoso no es necesario, aunque su administración ayuda a detectar cambios inflamatorios crónicos secundarios a capsulitis o fibrosis, que en muchos casos dan sintomatología a la paciente. Adicionalmente, la RM detecta cánceres no diagnosticados por otras técnicas que, además, se encuentran en situación profunda respecto a las prótesis, por lo tanto, la RM es la técnica de elección en el diagnóstico de cáncer de mama en este subgrupo de pacientes27.
En cuanto a la valoración de roturas de los implantes, en un metaanálisis de 18 estudios publicados, se concluyó una sensibilidad global del 78% y una especificidad del 91%44. De hecho, la evaluación de la integridad de los implantes mamarios con RM la ha destacado la Administración de Alimentos y Medicamentos en el 2006, cuando esta institución aprobó el uso general de los implantes mamarios de silicona y recomendó el seguimiento con RM cada 2años a partir del tercer año tras su colocación, con el fin de detectar fugas subclínicas19,45. Esta recomendación se sustenta en un estudio realizado en el que se observó una tasa de roturas de implantes que oscila entre el 0,3 y el 77%, con salida extracapsular de gel en torno a un 12-26%46.
ConclusiónLa RM es una herramienta de imagen con un uso cada vez más extendido en la afección mamaria y en constante desarrollo. Ha demostrado ser la técnica con mayor sensibilidad en el diagnóstico del cáncer de mama, si bien su especificidad y valor predictivo positivo hacen necesario utilizarla con moderación y racionalidad, siempre dentro de equipos multidisciplinares de trabajo. Pero también ha demostrado que no solo puede diagnosticar el cáncer, sino además aportar datos de índole biológica, que son representativos de determinados criterios histológicos.
Sin embargo, son necesarias más líneas de investigación con el fin de ir definiendo progresivamente las indicaciones y eficacia/efectividad de la técnica de una manera más selectiva.
Considero, por tanto, que la RM de mama, junto con la mamografía y la ecografía, se ha erigido como otra arma indispensable y necesaria en el día a día del radiólogo en la lucha contra el cáncer de mama, con un largo camino aún de expansión tecnológica que abrirá nuevos caminos en el diagnóstico por imagen en la mama.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses.