El cáncer de mama es la primera causa de muerte por cáncer en mujeres europeas. Se plantea la duda de si el uso de DIU de levonorgestrel (DIU-LNG) podría estar asociado a un aumento del riesgo del mismo.
Material y métodosRealizamos una revisión sistemática para identificar el riesgo de cáncer de mama entre las usuarias de DIU-LNG.
ResultadosHemos encontrado ocho artículos, todos ellos realizados con el DIU Mirena® y observacionales. La mitad de los estudios no encuentra aumento del riesgo de cáncer de mama en las portadoras de DIU-LNG y la otra mitad sí. La heterogeneidad de estos estudios, así como la existencia de sesgo en ellos, y la ausencia de control de otros factores nos impiden la realización de metaanálisis.
ConclusionesCon la evidencia científica actual no podemos afirmar que exista mayor riesgo de cáncer de mama en las portadoras de DIU-LNG. Se requieren estudios bien diseñados para establecer conclusiones claras.
Breast cancer is the leading cause of cancer death in European women. The question arises whether the use of levonorgestrel IUD (LNG-IUD) could be associated with an increased risk of breast cancer.
Material and methodsWe conducted a systematic review to identify the risk of breast cancer among LNG-IUD users.
ResultsWe found 8 articles, all of them observational and concerning the Mirena® IUD. Half of the studies do not find an increased risk of breast cancer in LNG-IUD carriers and the other half do. The heterogeneity of these studies, as well as the existence of bias in them, and the absence of control for other factors prevent us from performing a meta-analysis.
ConclusionsWith the current scientific evidence we cannot confirm that there is a reater risk of breast cancer in LNG-IUD carriers. Well-designed studies are required to draw clear conclusions.
El cáncer de mama es la primera causa de muerte por cáncer en mujeres europeas, y supone el 29,2% de los tumores en mujeres1,2, con 404.920 nuevos casos1–3 y la muerte de 138.000 mujeres en 20184.
Se desconoce su etiología, pero se ha descrito una serie de factores de riesgo5, entre ellos, los hormonales. Parece que el estradiol participa en el desarrollo y la progresión de tumores, favoreciendo la proliferación del tejido mamario, siendo controvertido el papel de los gestágenos, puesto que pueden bloquear, estimular o no ejercer ningún efecto sobre esta proliferación6–8. Estudios bien diseñados sobre tejido mamario muestran cómo a nivel molecular algunos gestágenos pueden interferir con la apoptosis inducida por los estrógenos9, así como obstaculizar señales intracelulares, aumentando el potencial migratorio de las células cancerígenas en estadios iniciales10. Los estudios con anticoncepción hormonal combinada parece que indican una relación entre la toma de las hormonas y el cáncer de mama, pero su papel no está aclarado del todo11.
El dispositivo intrauterino (DIU) de levonorgestrel (DIU-LNG) más utilizado es el DIU Mirena®, que libera entre 10 a 20 μg/día de levonorgestrel (LNG)12. Los niveles máximos sistémicos se alcanzan poco después de la inserción, permanecen estables durante las primeras semanas y van disminuyendo con el paso del tiempo, y son inferiores a otras formas de administración de gestágenos13,14. La concentración de LNG en tejido mamario es también inferior comparado con otros anticonceptivos que contienen LNG15.
Con lo expuesto anteriormente, se plantea la duda de si el uso del DIU-LNG podría estar asociado a un aumento del riesgo de cáncer de mama16, pero las revisiones realizadas al respecto muestran resultados contradictorios17–21, por lo que nos planteamos una revisión sistemática que nos permita responder si hay asociación del cáncer de mama con el DIU-LNG.
Material y métodosRealizamos una revisión sistemática para identificar el riesgo de cáncer de mama entre las usuarias de DIU-LNG.
Para ello, hemos efectuado una búsqueda en PubMed (punto de corte de búsqueda de datos el 15 de enero del 2021), con las siguientes palabras clave: «([levonorgestrel intrauterine device] OR [IUD] OR [intrauterine system]) AND (breast cancer)». La búsqueda de los estudios se extiende a todos los existentes desde el comienzo del uso del DIU-LNG.
Se seleccionan los estudios que cumplen con los siguientes criterios: artículos originales, observacionales o ensayos clínicos, que hayan valorado numéricamente la relación entre cáncer de mama y uso de DIU-LNG, publicados en revistas médicas, idioma del artículo: inglés o español, realizados en mujeres adultas, que los resultados estén informados de una manera adecuada, ateniéndose a una metodología estadística consistente y reproducible.
La extracción de datos de los estudios la vamos a realizar de una manera detallada y sistemática. Lo que nos va a interesar principalmente son las medidas de relación del uso del DIU-LNG con la aparición de cáncer de mama (como son el riesgo relativo [RR] y la odds ratio [OR]). También hemos tenido en cuenta la fuente de financiación de los mismos.
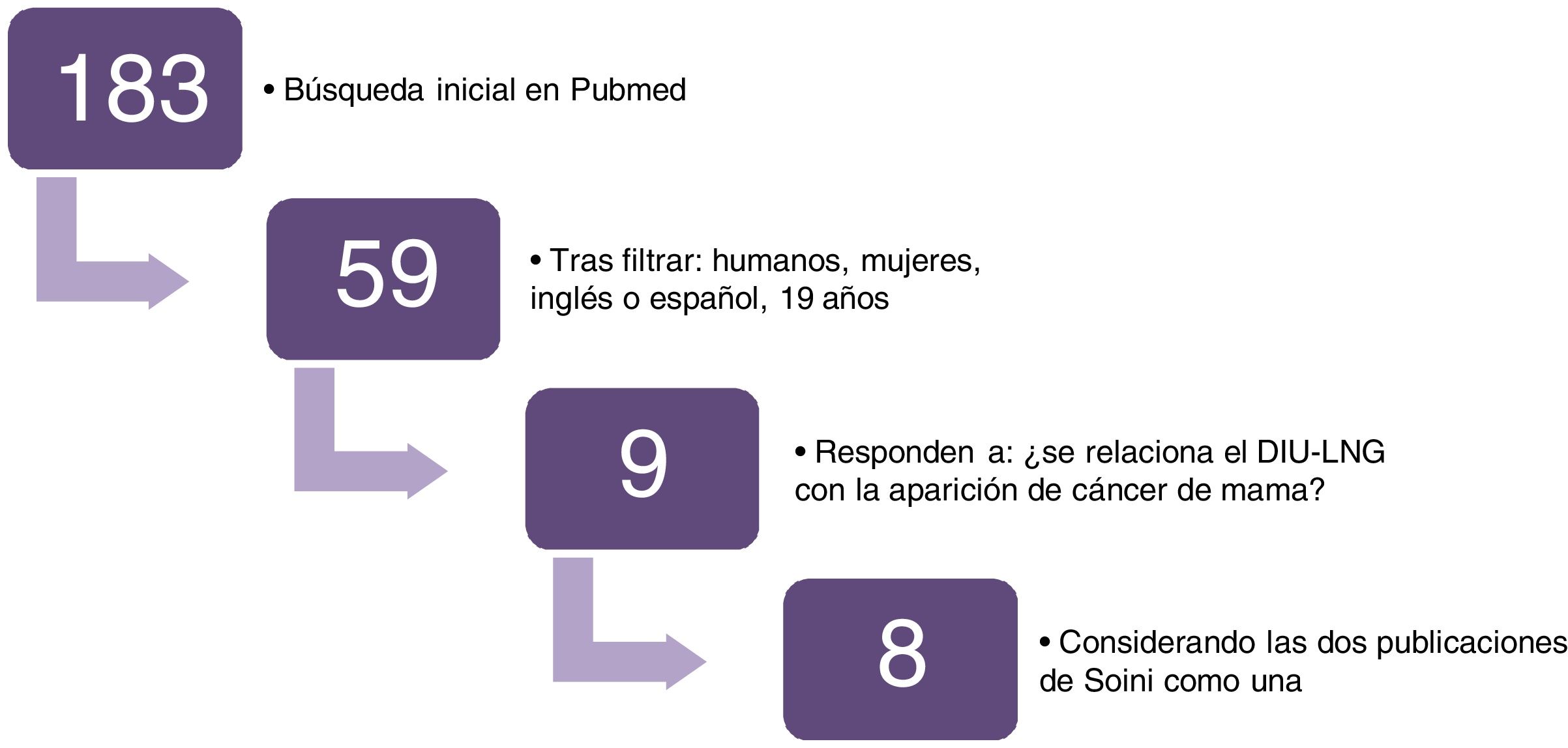
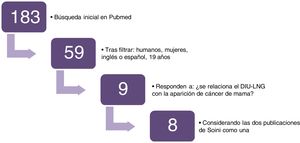
Como consecuencia de la búsqueda realizada y, después de eliminar las repeticiones, hemos encontrado 183 artículos. Al filtrar los resultados por: humanos, mujeres, idioma inglés o español y adultos (>19 años); obtenemos 59 estudios. De estos, escogemos los trabajos primarios que analizan la aparición de cáncer de mama en mujeres portadoras de DIU-LNG, cumpliendo así nuestros criterios de inclusión. Los estudios seleccionados son nueve pero ambos trabajos publicados por Soini (2016 y 2014)22,23 están realizados sobre las mismas pacientes y los mismos años por lo que los consideraremos como uno (en 2014, el seguimiento es hasta diciembre del 2009 y en 2016 hasta diciembre del 2012) (fig. 1).
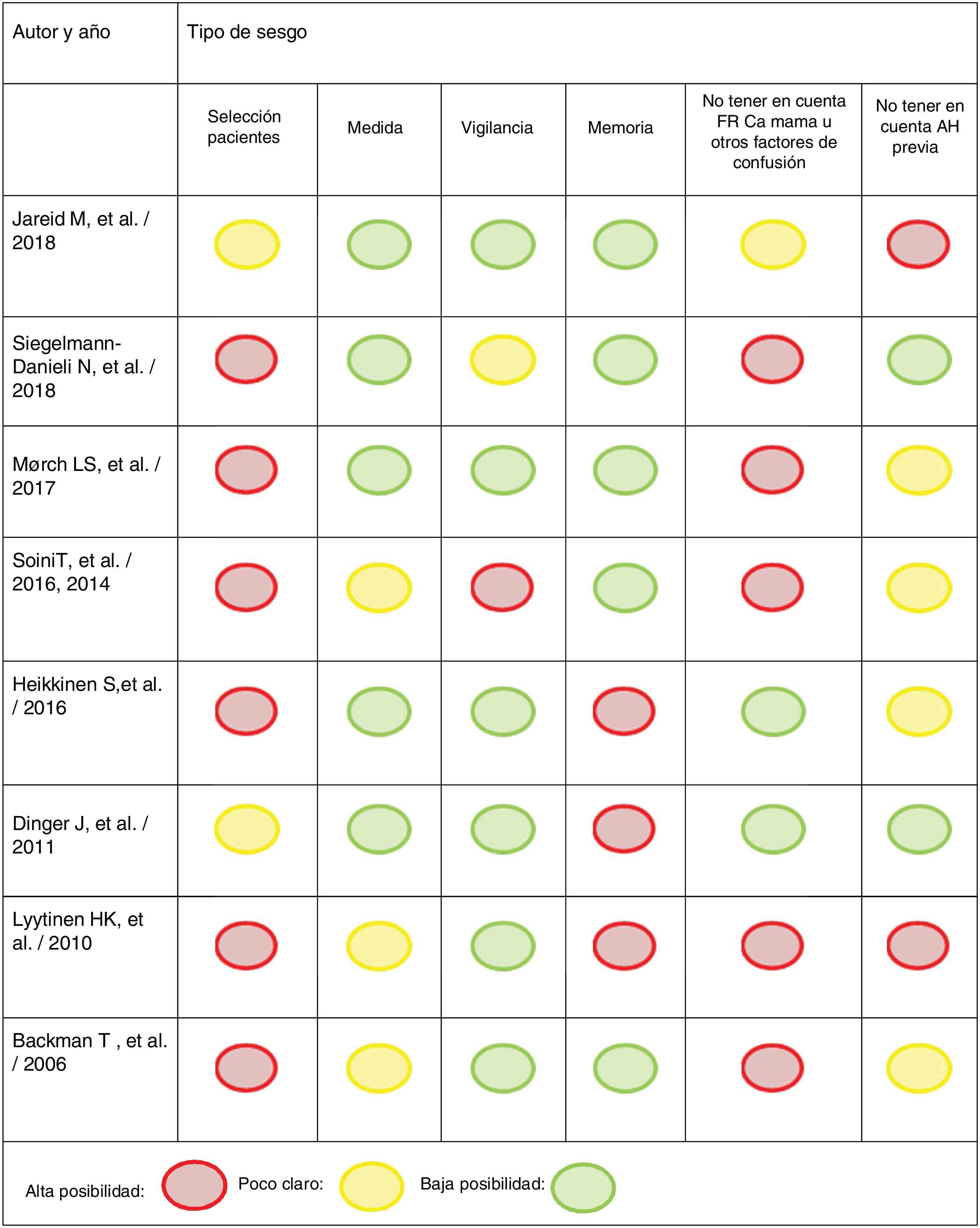
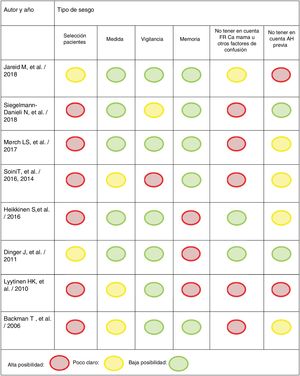
Hemos evaluado la calidad de los estudios ayudándonos del programa: «Critical Appraisal Skills Programme España» (CASPe) y de sus formularios (fig. 2).
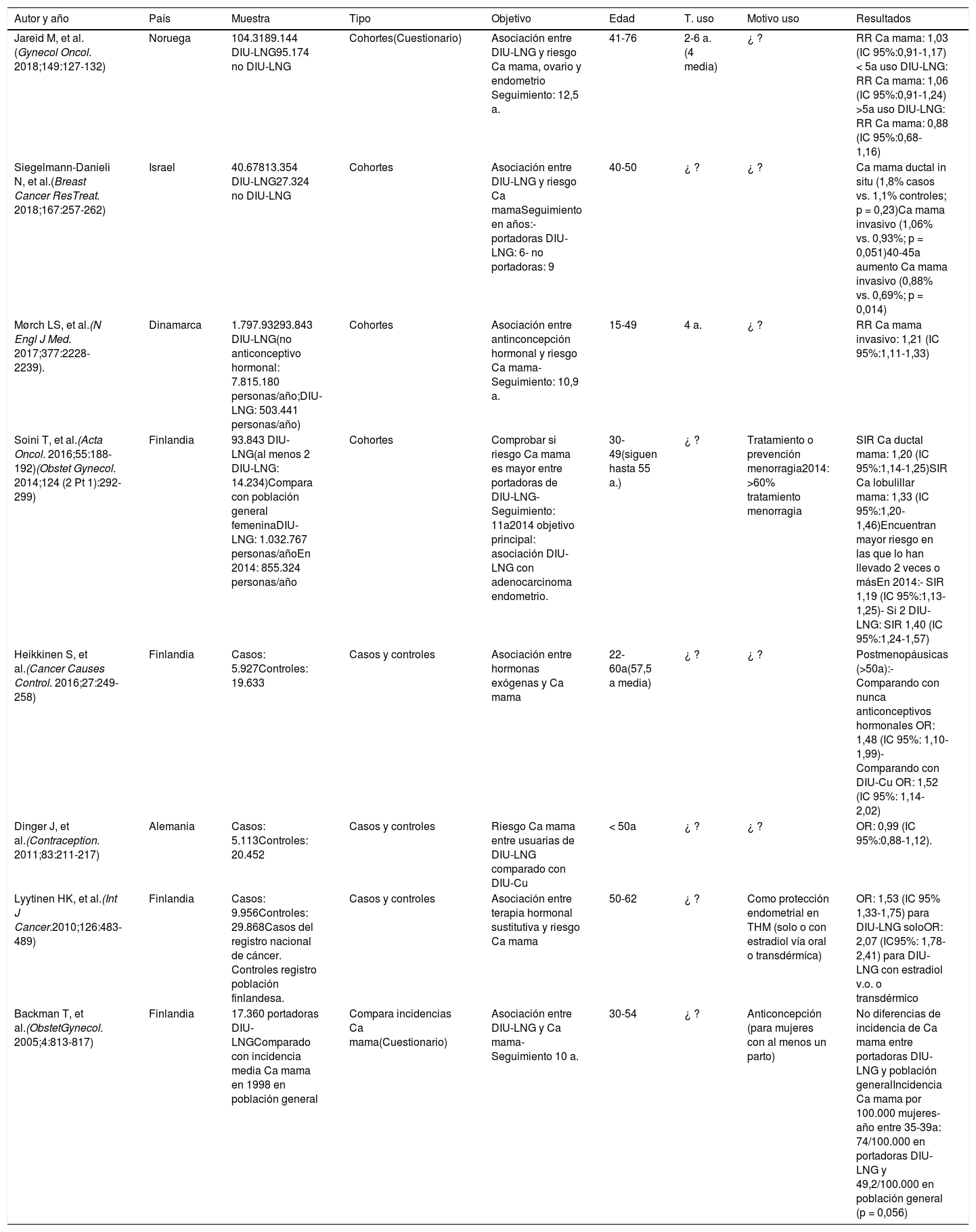
ResultadosEstudios seleccionadosHemos encontrado ocho artículos, todos ellos realizados con el DIU Mirena® y observacionales; cinco de ellos se llevaron a cabo en países escandinavos22–27, uno en Israel28 y el resto en otros países de Europa29,30. La descripción de estos artículos está en la tabla 1.
Estudios que valoran el riesgo de cáncer de mama en portadoras de DIU-LNG
| Autor y año | País | Muestra | Tipo | Objetivo | Edad | T. uso | Motivo uso | Resultados |
|---|---|---|---|---|---|---|---|---|
| Jareid M, et al.(Gynecol Oncol. 2018;149:127-132) | Noruega | 104.3189.144 DIU-LNG95.174 no DIU-LNG | Cohortes(Cuestionario) | Asociación entre DIU-LNG y riesgo Ca mama, ovario y endometrio Seguimiento: 12,5 a. | 41-76 | 2-6 a.(4 media) | ¿ ? | RR Ca mama: 1,03 (IC 95%:0,91-1,17)< 5a uso DIU-LNG: RR Ca mama: 1,06 (IC 95%:0,91-1,24) >5a uso DIU-LNG: RR Ca mama: 0,88 (IC 95%:0,68-1,16) |
| Siegelmann-Danieli N, et al.(Breast Cancer ResTreat. 2018;167:257-262) | Israel | 40.67813.354 DIU-LNG27.324 no DIU-LNG | Cohortes | Asociación entre DIU-LNG y riesgo Ca mamaSeguimiento en años:-portadoras DIU-LNG: 6- no portadoras: 9 | 40-50 | ¿ ? | ¿ ? | Ca mama ductal in situ (1,8% casos vs. 1,1% controles; p = 0,23)Ca mama invasivo (1,06% vs. 0,93%; p = 0,051)40-45a aumento Ca mama invasivo (0,88% vs. 0,69%; p = 0,014) |
| Mørch LS, et al.(N Engl J Med. 2017;377:2228-2239). | Dinamarca | 1.797.93293.843 DIU-LNG(no anticonceptivo hormonal: 7.815.180 personas/año;DIU-LNG: 503.441 personas/año) | Cohortes | Asociación entre antinconcepción hormonal y riesgo Ca mama- Seguimiento: 10,9 a. | 15-49 | 4 a. | ¿ ? | RR Ca mama invasivo: 1,21 (IC 95%:1,11-1,33) |
| Soini T, et al.(Acta Oncol. 2016;55:188-192)(Obstet Gynecol. 2014;124 (2 Pt 1):292-299) | Finlandia | 93.843 DIU-LNG(al menos 2 DIU-LNG: 14.234)Compara con población general femeninaDIU-LNG: 1.032.767 personas/añoEn 2014: 855.324 personas/año | Cohortes | Comprobar si riesgo Ca mama es mayor entre portadoras de DIU-LNG- Seguimiento: 11a2014 objetivo principal: asociación DIU-LNG con adenocarcinoma endometrio. | 30-49(siguen hasta 55 a.) | ¿ ? | Tratamiento o prevención menorragia2014: >60% tratamiento menorragia | SIR Ca ductal mama: 1,20 (IC 95%:1,14-1,25)SIR Ca lobulillar mama: 1,33 (IC 95%:1,20-1,46)Encuentran mayor riesgo en las que lo han llevado 2 veces o másEn 2014:- SIR 1,19 (IC 95%:1,13-1,25)- Si 2 DIU-LNG: SIR 1,40 (IC 95%:1,24-1,57) |
| Heikkinen S, et al.(Cancer Causes Control. 2016;27:249-258) | Finlandia | Casos: 5.927Controles: 19.633 | Casos y controles | Asociación entre hormonas exógenas y Ca mama | 22-60a(57,5 a media) | ¿ ? | ¿ ? | Postmenopáusicas (>50a):- Comparando con nunca anticonceptivos hormonales OR: 1,48 (IC 95%: 1,10-1,99)- Comparando con DIU-Cu OR: 1,52 (IC 95%: 1,14-2,02) |
| Dinger J, et al.(Contraception. 2011;83:211-217) | Alemania | Casos: 5.113Controles: 20.452 | Casos y controles | Riesgo Ca mama entre usuarias de DIU-LNG comparado con DIU-Cu | < 50a | ¿ ? | ¿ ? | OR: 0,99 (IC 95%:0,88-1,12). |
| Lyytinen HK, et al.(Int J Cancer.2010;126:483-489) | Finlandia | Casos: 9.956Controles: 29.868Casos del registro nacional de cáncer. Controles registro población finlandesa. | Casos y controles | Asociación entre terapia hormonal sustitutiva y riesgo Ca mama | 50-62 | ¿ ? | Como protección endometrial en THM (solo o con estradiol vía oral o transdérmíca) | OR: 1,53 (IC 95% 1,33-1,75) para DIU-LNG soloOR: 2,07 (IC95%: 1,78-2,41) para DIU-LNG con estradiol v.o. o transdérmico |
| Backman T, et al.(ObstetGynecol. 2005;4:813-817) | Finlandia | 17.360 portadoras DIU-LNGComparado con incidencia media Ca mama en 1998 en población general | Compara incidencias Ca mama(Cuestionario) | Asociación entre DIU-LNG y Ca mama- Seguimiento 10 a. | 30-54 | ¿ ? | Anticoncepción (para mujeres con al menos un parto) | No diferencias de incidencia de Ca mama entre portadoras DIU-LNG y población generalIncidencia Ca mama por 100.000 mujeres-año entre 35-39a: 74/100.000 en portadoras DIU-LNG y 49,2/100.000 en población general (p = 0,056) |
ACOs: anticonceptivos hormonales combinados; a.: años; Ca: cáncer; DIU-Cu: DIU de cobre; DIU-LNG: DIU de levonorgestrel; N: muestra; SIR: standardized incidence ratio; THM: terapia hormonal de la menopausia; T. uso: tiempo de uso.
En el estudio de Jareid et al.24 analizan también el riesgo de cáncer de ovario y de endometrio, y encuentran disminución de los mismos en usuarias de DIU-LNG.
Todos los estudios analizados se centran en un tema claramente definido. Aunque algunos25,29 abarcan más anticonceptivos hormonales, aparte del DIU-LNG; y el estudio de Lyytinen et al.26 trata sobre la terapia hormonal sustitutiva y el riesgo de cáncer de mama, pero lo hemos tenido en cuenta puesto que estudia el riesgo de este último en portadoras de DIU-LNG.
En algunos estudios, la selección se realiza teniendo en cuenta a las mujeres que contestan a un cuestionario24,27. El estudio de Siegelmann et al.28 presenta más proporción de mujeres más jóvenes en el grupo de DIU-LNG, cuando inicialmente refieren que van a emparejar por edad. Y, por último, lo que más observamos en la mayoría de estudios es que posiblemente se elige con más frecuencia el DIU-LNG en mujeres con más factores de riesgo para cáncer de mama22,23,26–29.
Los métodos de medida utilizados son correctos, pero los resultados se expresan de formas diferentes. En los estudios de cohortes: dos de ellos muestran el RR24,29; Siegelmann28, sin embargo, expresa los resultados como comparación de porcentajes y Soini et al.22,23 muestran el resultado mediante el standardized incidence ratio (SIR). En los estudios de casos y controles se expresan los resultados mediante OR25,26,30. Backman et al.27 comparan tasas de incidencia de cáncer de mama entre usuarias de DIU-LNG vs. población general y así lo expresan.
La mayoría de estudios no tienen en cuenta los factores de riesgo para cáncer de mama ni el uso previo de anticoncepción hormonal, que pueden actuar como factores de confusión.
Bayer® financia la redacción y la estadística del estudio de Siegelman et al.28 Novo Nordisk Foundation apoya el estudio de Mørch et al.29, Bayer Shering Pharma subvenciona el estudio de Dinger et al.30 y Shering financia el estudio de Backman et al.27
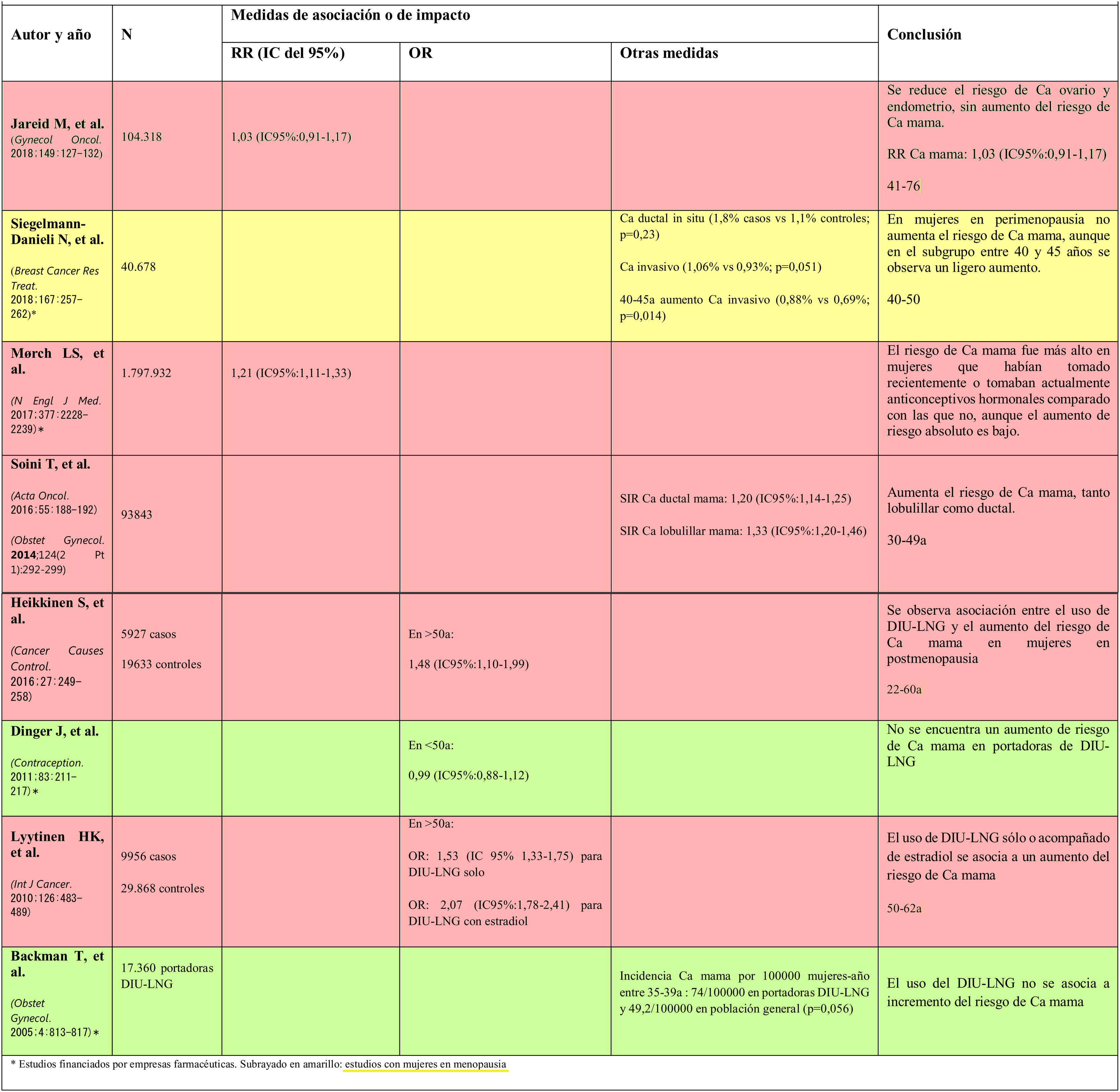
Relación del DIU-LNG con el cáncer de mamaLos resultados de la relación del DIU-LNG con el cáncer de mama están resumidos en la tabla 2. Hemos unido en esta tabla los resultados de los estudios con la calidad de los mismos. Como vemos, en cuatro no aumenta el riesgo (Jareid et al.24, Siegelman et al.28, Dinger et al.30 y Backman et al.27) y en otros cuatro sí que aumenta (Mørch et al.29, Soini et al.22,23, Heikkinen et al.25 y Lyytinen et al.26). Aunque en el de Siegelman et al. sí que encuentran una tendencia al aumento de riesgo de cáncer de mama28. La calidad de los estudios en los que no se observa aumento de riesgo de cáncer de mama en portadoras de DIU-LNG es mayor.
DiscusiónNo es posible llegar a una clara respuesta a nuestra pregunta inicial, si las portadoras de DIU-LNG presentan mayor riesgo de cáncer de mama.
Globalmente, podemos decir que la mitad de los estudios no encuentra aumento del riesgo de cáncer de mama en las portadoras de DIU-LNG y la otra mitad sí; estos últimos no llegan a tener incrementos de riesgo para estudios observacionales relevantes. Según Grimes et al., en estudios observacionales no hay una relación causal creíble si en los estudios de cohortes no supera el riesgo relativo el 2-3 y en los estudios de casos y controles la OR no supera 3-431. En nuestra revisión, no encontramos ningún RR ni OR que supere las cifras anteriores.
Por otra parte, a pesar de lo anterior y de la heterogeneidad de los estudios, parece intuirse cierto efecto sistémico del LNG, aunque las portadoras de DIU-LNG presentan menos concentración del mismo en sangre y en tejido mamario que las usuarias de LNG vía oral y las usuarias de combinado de LNG con etinilestradiol15.
Hemos encontrado grandes dificultades para llegar a conclusiones debido a la diversidad entre estudios: se mezclan mujeres en pre y en postmenopausia; unos estudios son de casos y controles y otros de cohortes; las medidas de los resultados difieren también (RR, OR, SIR, comparación de porcentajes, comparación de incidencias); el motivo de uso del DIU-LNG en unos casos es anticoncepción, en otros tratamiento del sangrado menstrual abundante y en otros como protección endometrial en el contexto de terapia hormonal de la menopausia (THM); y, en la mayoría, no está indicado; el tiempo de uso del DIU-LNG tampoco es homogéneo ni viene descrito en la mayoría de los estudios; si han utilizado previamente anticonceptivos hormonales tampoco viene descrito, probablemente no se ha estudiado o tenido en cuenta (en el estudio de Mørch et al.29 excluyen mujeres con tratamientos previos para infertilidad, en el estudio de Siegelman et al.28 excluyen a las mujeres que en los cinco años previos al comienzo del estudio han tomado anticonceptivos hormonales orales [AHOs], THM, tratamientos para infertilidad o tamoxifeno).
Además, existen múltiples factores de confusión difíciles de controlar, creemos que detrás de la indicación de DIU-LNG, muy posiblemente estemos seleccionando mujeres con más factores de riesgo para cáncer de mama inicialmente. Por tanto, esto influirá en encontrar más casos de esta patología en los grupos de portadoras de DIU-LNG; esto mismo concluyen en la revisión de Martínez et al.32
También hemos observado que la mayoría de los estudios revisados no tienen en cuenta factores de riesgo para cáncer de mama como son: menarquia, paridad, lactancia materna, antecedentes familiares, índice de masa corporal (IMC), actividad física, consumo del alcohol, uso de otras hormonas exógenas, edad de menopausia, estatus socioeconómico, etc. Los únicos que tienen más en cuenta los factores de riesgo son Jareid et al.24 (aunque no consideran el consumo de alcohol), Heikkinen et al.25 y Dinger et al.30, curiosamente, en el primero y el último no encuentran aumento de riesgo de cáncer de mama en portadoras de DIU-LNG.
Los estudios revisados difieren en la muestra, siendo el más amplio el de Mørch et al.29, con casi 1.800.000 mujeres, utilizando las bases de datos nacionales danesas. Estamos de acuerdo con la editorial publicada por Westhoff et al.33 en 2018 en la que la relación entre el DIU-LNG y el cáncer de mama encontrada puede ser biológica o debida en parte o completamente a sesgos o factores de confusión no medidos (selección de pacientes, estadio de la enfermedad con posibilidad de encontrar cáncer de mama en estadios más tempranos en usuarias de anticoncepción hormonal y uso previo de anticoncepción hormonal vía oral); también dicen, y estamos de acuerdo, que tanto en el estudio de Mørch et al.29, como en los de Soini et al.22,23 y Siegelmann et al.28 no tienen en cuenta ningún factor de riesgo asociado al cáncer de mama salvo la edad (encontrando en estos tres estudios cierto aumento de riesgo para cáncer de mama en portadoras de DIU-LNG). Kaunitz et al.34 en 2018 escriben también una editorial en la misma línea que la anterior, describiendo las limitaciones metodológicas del estudio de Mørch et al.29 y, añadiendo a las descritas por Westhoff et al.33, el hecho de que el registro danés tiene información de mujeres entre los 15 y los 79 años, sin embargo, el análisis se limita a aquéllas por debajo de 50, lo cual es desafortunado porque la mayoría de cánceres de mama invasivos son diagnosticados a partir de los 50 años35, y hubiese sido interesante ver si la diferencia de los riesgos persiste o desaparece durante la postmenopausia.
Coincidimos con el protocolo en anticoncepción hormonal y cáncer de mama de la Sociedad Española de Contracepción (SEC)36 de 2019 en que los resultados se han de interpretar con cautela.
Estamos de acuerdo con Marsden11, que revisa toda la anticoncepción hormonal en relación con el cáncer de mama y el DIU-LNG hasta el último estudio publicado por Soini23 en 2016, en el que el riesgo de cáncer de mama vinculado al DIU-LNG, si es que existiera, sería pequeño y comparable con otros factores de riesgos modificables.
La fortaleza de nuestro estudio es que se trata de una revisión sistemática que contiene todos los estudios realizados sobre la relación entre el uso de DIU-LNG y el cáncer de mama, desde el comienzo de uso del DIU-LNG.
La principal limitación de nuestra investigación es que no se ha podido realizar un metaanálisis por la heterogeneidad de los estudios, a diferencia del trabajo publicado por Conz et al.21 Estamos de acuerdo con la carta al editor publicada por Silva et al.37 en respuesta a Conz en agosto del 2020.
Consideramos que para establecer una relación causal entre el uso del DIU-LNG y el cáncer de mama sería deseable un estudio bien diseñado: que separase a las mujeres que lo llevan como anticoncepción, como tratamiento del sangrado menstrual abundante o como parte de la terapia hormonal sustitutiva; que tenga en cuenta el tiempo de uso; en el caso de las mujeres que lo empleen como anticoncepción, que se compare con un método de anticoncepción no hormonal (barrera, DIU de cobre); que se consideren todos los factores de riesgo y protectores para el cáncer de mama, y, por tanto, tengamos en cuenta todo tratamiento previo o actual hormonal.
ConclusionesAlgunos de los estudios localizados nos informan de un mayor riesgo de cáncer de mama entre las usuarias de DIU-LNG. Sin embargo, la heterogeneidad de estos, así como la existencia de sesgo en ellos, y la ausencia de control de otros factores, nos impiden llegar a una conclusión clara sobre este. Por lo que es deseable la realización de más estudios bien diseñados que nos aclaren esta relación.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.