CASO CLÍNICO
Paciente de 66 años, sin antecedentes personales ni familiares de interés, que acude a urgencias por cuadro clínico de sensación de mareo sin giro de objetos, visión doble, náuseas, vómitos e inestabilidad de la marcha de 48 h de evolución, que se inicia de forma aguda. En la exploración inicial se objetiva una presión arterial de 130/80 mmHg y en la exploración neurológica se demuestra dismetría y ataxia cerebelosa con marcha imposible; Romberg positivo y nistagmo horizontal en posiciones extremas de la mirada.
Ante el juicio diagnóstico inicial de posible accidente cerebrovascular agudo (ACVA) se realiza una resonancia nuclear magnética, en la que no se encuentran anomalías significativas. Durante la evolución se aprecian datos de afectación del tronco con trastornos de la deglución y de la emisión de lenguaje, por lo que se plantean como diagnósticos diferenciales: encefalitis, meningitis carcinomatosa o síndrome paraneoplásico.
En la punción lumbar tanto el cultivo como la citología fueron negativos, y sólo se encontró pleocitosis leve. Se instaura tratamiento con plasmaféresis y corticoides por la posibilidad de degeneración cerebelosa paraneoplásica, aunque sin mejoría. Se solicitan marcadores tumorales, que fueron normales, excepto el CA 125 (164,8), y anticuerpos: anti-Hu, Ri negativos y anti-Yo positivos en suero.
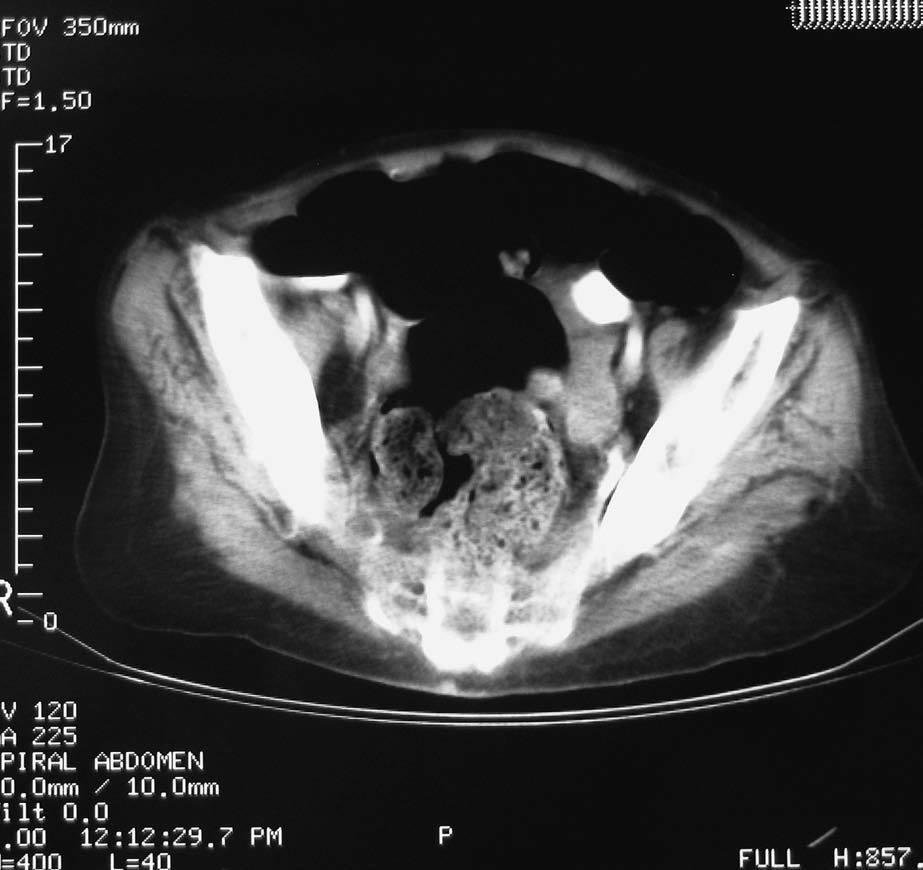
Para buscar el origen del tumor se realiza ecografía abdominal y tomografía computarizada (TC) abdominopélvica que fueron normales, excepto una imagen de 35 3 20 mm en zona anexial izquierda, aunque no precisaban claramente su dependencia de ovario (fig. 1).
Fig. 1. Imagen de TAC abdominopélvica en la que se aprecia una imagen de 35320mm en zona anerial izquierda, sin precisar claramente su dependencia.
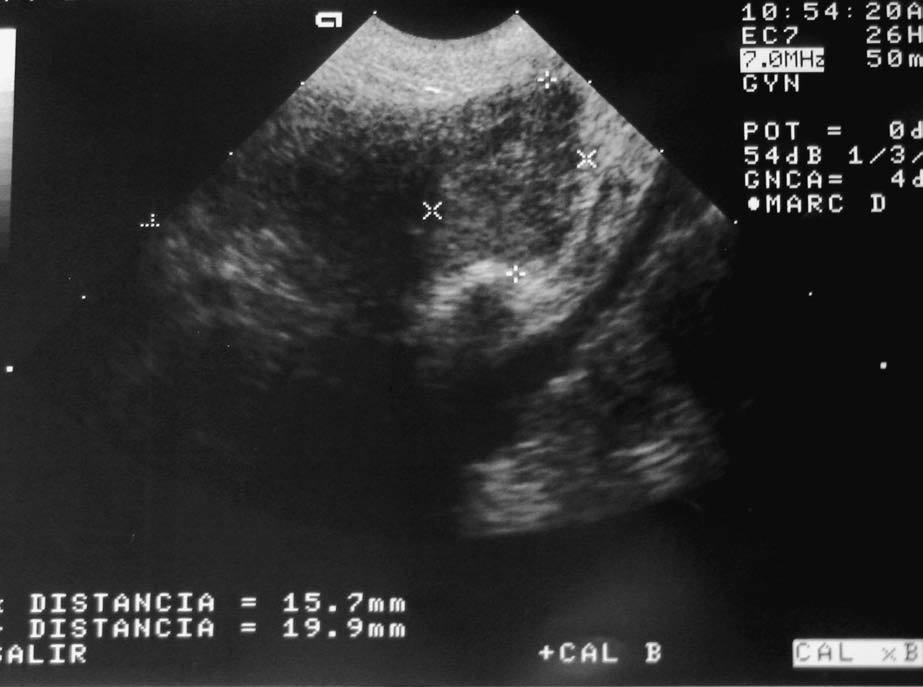
En la ecografía ginecológica se observa: útero en retroversión de 54 3 25 mm con línea endometrial de 2 mm; ovario derecho de 21 3 14 mm de aspecto sólido; ovario izquierdo de 19 3 16 mm de aspecto sólido con vascularización central intensa y con índices de resistencia de 0,50 (fig. 2). Sin líquido libre en Douglas.
Fig. 2. Imagen de ecografía ginecológica. Ovario izquierdo de 19316mm, de aspecto sólido
Ante la sospecha de neoplasia de origen ovárico se realiza laparotomía exploradora, en la que ambos ovarios son normales, aunque al despegar el anejo izquierdo se desprende un nódulo procedente de la fimbria que hace sospechar metástasis. El anejo derecho es normal a la inspección, pero al tacto es friable. Se realiza histerectomía con doble anexectomía más apendicectomía con revisión de cavidad abdominal. En el estudio anatomopatológico intraoperatorio de ambos ovarios se observa carcinoma indiferenciado de probable origen metastásico.
La anatomía patológica informa de adenocarcinoma seroso poco diferenciado de ovario derecho, ovario izquierdo y nódulo en trompa de Falopio izquierda; sin evidencia de malignidad en la trompa de Falopio derecha, el útero y el apéndice cecal.
Se desaconseja quimioterapia complementaria y se remite a cuidados paliativos.
DISCUSIÓN
Se presenta el caso de una degeneración cerebelosa paraneoplásica (DCP) asociada a un cáncer de ovario.
El síndrome paraneoplásico se define como el conjunto de síntomas y signos que no están causados por un tumor primitivo ni sus complicaciones y que puede aparecer antes, durante o después que los síntomas y signos de este tumor1.
La aproximación al diagnóstico de un síndrome paraneoplásico depende del tipo de tumor y de cómo se desarrollen los síntomas. Se debería considerar la edad de la paciente: el desarrollo de una degeneración subaguda en pacientes de mediana edad sugiere paraneoplasia, mientras que en la infancia síntomas similares se deben habitualmente a procesos virales o metabólicos.
Las manifestaciones neurológicas de los síndromes paraneoplásicos en los tumores ginecológicos se caracterizan por la clínica asincrónica respecto al tumor primitivo2. La extirpación de dicho tumor no parece mejorar las lesiones o la evolución del síndrome paraneoplásico, excepto en estadios iniciales.
La DCP se asocia más frecuentemente a cánceres de ovario, mama y pulmón2.
En cuanto a su etiología, se han propuesto la liberación de sustancias tóxicas por el tumor, o la competición metabólica por nutrientes vitales, o infecciones oportunistas en el huésped inmunodeprimido que dañan el sistema nervioso. El descubrimiento de los anticuerpos antineuronales apunta a un mecanismo autoinmunitario1,3. La evidencia sugiere que la expresión de proteínas neuronales en el tejido tumoral puede desencadenar una respuesta autoinmunitaria que dañaría el sistema nervioso que contiene los mismos antígenos.
Se han encontrado diferentes anticuerpos en pacientes con distintos cánceres. Los anticuerpos anti-Hu se asocian frecuentemente a DCP y cáncer microcítico de pulmón. Los pacientes con DCP y cánceres ginecológicos, sobre todo de ovario, a menudo presentan anticuerpos anti-Yo. Los anti-Ri se asocian a cáncer de mama y los anti-Tr a linfoma de Hodgkin. La presencia de diferentes anticuerpos en pacientes con diferentes cánceres implicaría un mecanismo inmunológico diferente como causa de la DCP.
La presencia de una degeneración cerebelar subaguda y de anticuerpos anti-Yo es indicación de laparotomía, incluso sin otra evidencia clínica o radiológica del tumor primitivo.
Los estudios de anatomía patológica, en el caso de DCP, muestran la pérdida difusa de las células de Purkinje, de núcleos cerebelosos, de la oliva y de tractos espinocerebelosos de la médula espinal. Pueden aparecer infiltrados inflamatorios que envuelven los núcleos cerebelosos profundos, lo que sugiere que el cerebelo es la principal diana de una encefalitis multifocal.
La clínica de la DCP se caracteriza por un fallo progresivo subagudo bilateral y simétrico del cerebelo, con hipotonía y reflejos pendulares. Los síntomas iniciales suelen ser náuseas, vómitos, diplopía y dificultades en la marcha. Después de unos días el paciente desarrolla ataxia del tronco y extremidades, disartria y disfagia. El examen puede mostrar nistagmus3. Este cuadro clínico es similar para todos los tipos de degeneración cerebelosa paraneoplásica, independientemente del tipo de tumor o del anticuerpo asociado, aunque el curso de la enfermedad puede ser diferente dependiendo de la respuesta inmunitaria.
En los estadios iniciales, la resonancia magnética suele ser normal, pero en pocos meses presentan atrofia generalizada en el cerebelo. Esta prueba puede ser necesaria para excluir un tumor primario o metastásico en el cerebelo, infarto cerebeloso o absceso.
El líquido cefalorraquídeo (LCR) revela pleocitosis (particularmente en estadios iniciales), aumento de proteínas, bandas oligoclonales y síntesis intratecal de IgG. En la enfermedad más avanzada no se encuentran células, pero normalmente persisten valores elevados de IgG. También se pueden encontrar anticuerpos antineuronales que aparecen simultáneamente en el suero de la paciente.
La detección de anticuerpos en el suero o en el LCR confirma el origen paraneoplásico y centra la búsqueda del tumor primitivo en determinados órganos. Debe resaltarse que pueden haber anticuerpos antineuronales distintos de los paraneoplásicos que pueden aparecer en enfermedades virales (varicela zoster, Epstein-Barr) o en otras enfermedades no oncológicas.
Si los anticuerpos paraneoplásicos son negativos, hay otros marcadores tumorales (CA 125, CA 19.9, CA 15.3) que pueden apoyar la sospecha.
Debido a la asociación con cáncer de mama y ginecológico se debe realizar mamografía, TC y ecografía, y en este caso se debe resaltar el alto grado de fiabilidad diagnóstica de la ecografía vaginal, que demostró un ovario sólido con vascularización central intensa.
El tratamiento de la DCP es, en general, poco exitoso2. En algunos casos la resolución del síndrome paraneoplásico se consiguió tras el tratamiento del cáncer subyacente. La plasmaféresis y los inmunosupresores suelen producir una respuesta incompleta, pudiendo llegar en semanas o meses a la muerte o a déficit severos. En cuanto al tratamiento quirúrgico, se considera que en estadios tempranos debería realizarse linfadenectomía pélvica y paraaórtica (el 5% de las pacientes tendrán metástasis en ganglios retroperitoneales en el 33% de los ganglios no sospechosos clínicamente)4,5.