INTRODUCCIÓN
Durante el desarrollo embrionario, la vagina es una línea de epitelio glandular derivado de conducto mulleriano, que se reemplaza totalmente, durante el segundo trimestre de la gestación, por un epitelio escamoso poliestratificado. La vagina está, por tanto, fisiológicamente cubierta por un epitelio escamoso estratificado no cornificado. La aparición de epitelio glandular metaplásico en vagina se describió por primera vez por Von Preuschen1 en 1877, y el término de adenosis vaginal se acuñó por Kurman y Scully2 en 1974. La adenosis vaginal era un hallazgo inusual hasta 1971, cuando se diagnosticaron múltiples casos en mujeres jóvenes, las cuales se habían expuesto prenatalmente a dietilestilbestrol (DES). Dicha sustancia se sintetizó en 1938 y se usó ampliamente en los años cuarenta para el tratamiento de la amenaza de aborto y otras complicaciones obstétricas. La prevalencia de adenosis vaginal en mujeres expuestas a DES in útero, como se ha reportado en diferentes series, es variable (35-90%), probablemente dependiendo principalmente de la técnica diagnóstica usada (clínica, colposcopia y biopsia).
En 1974, el estudio de las autopsias de 100 fetos femeninos y de mujeres jóvenes menores de 25 años, que no se habían expuesto a DES in útero, reveló un 15% de prevalencia en sujetos menores de 1 mes, ausencia en prepuberales y un 13% en mujeres de 13-25 años2. De estos resultados se puede concluir que la adenosis vaginal se origina en los islotes remanentes de epitelio mulleriano en la vagina, los cuales pueden proliferar bajo la influencia de las hormonas sexuales, ya sean de origen materno in útero o por proliferación endógena después de la menarquia3.
CASOS CLÍNICOS
Caso 1
Mujer de 49 años, remitida a la unidad de patología cervical por lesión vaginal asintomática de 1,5 años de evolución. AG: P:2-2-0-0-2; menopausia: 48 años. AP: fumadora 1 paquete/día.
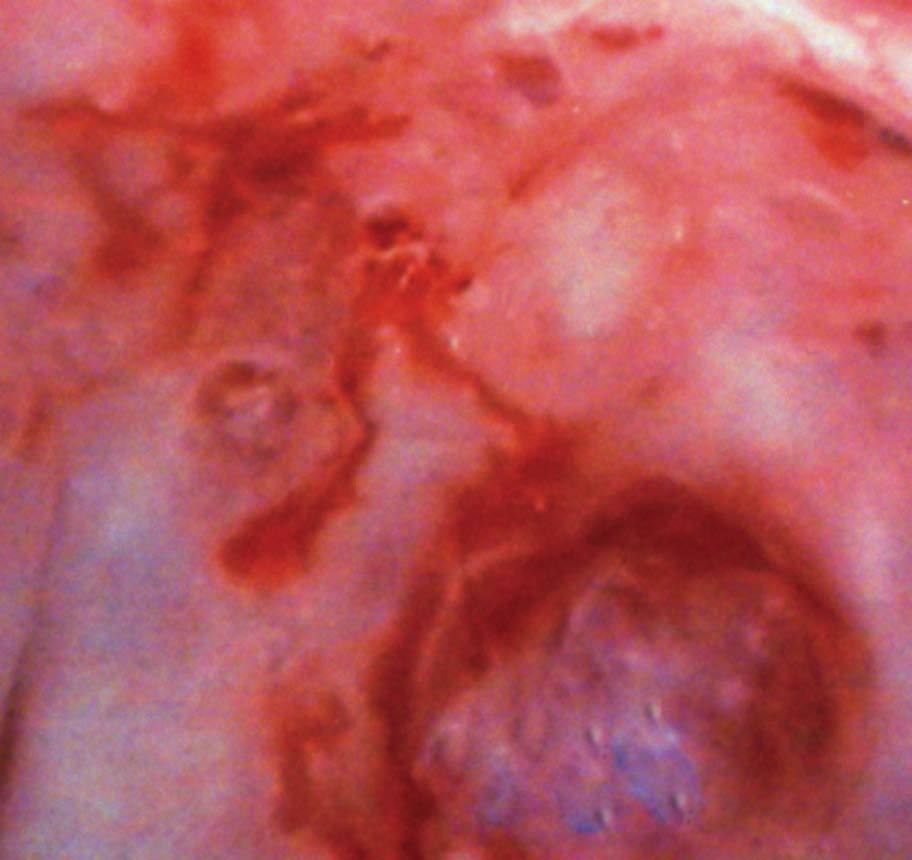
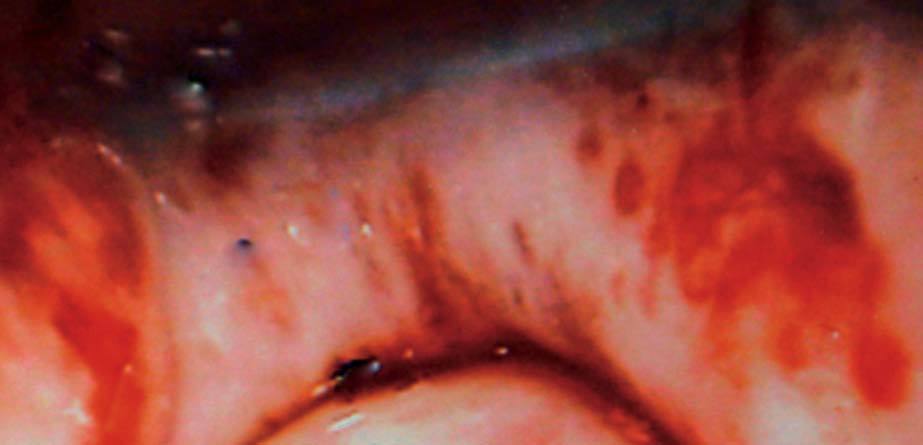
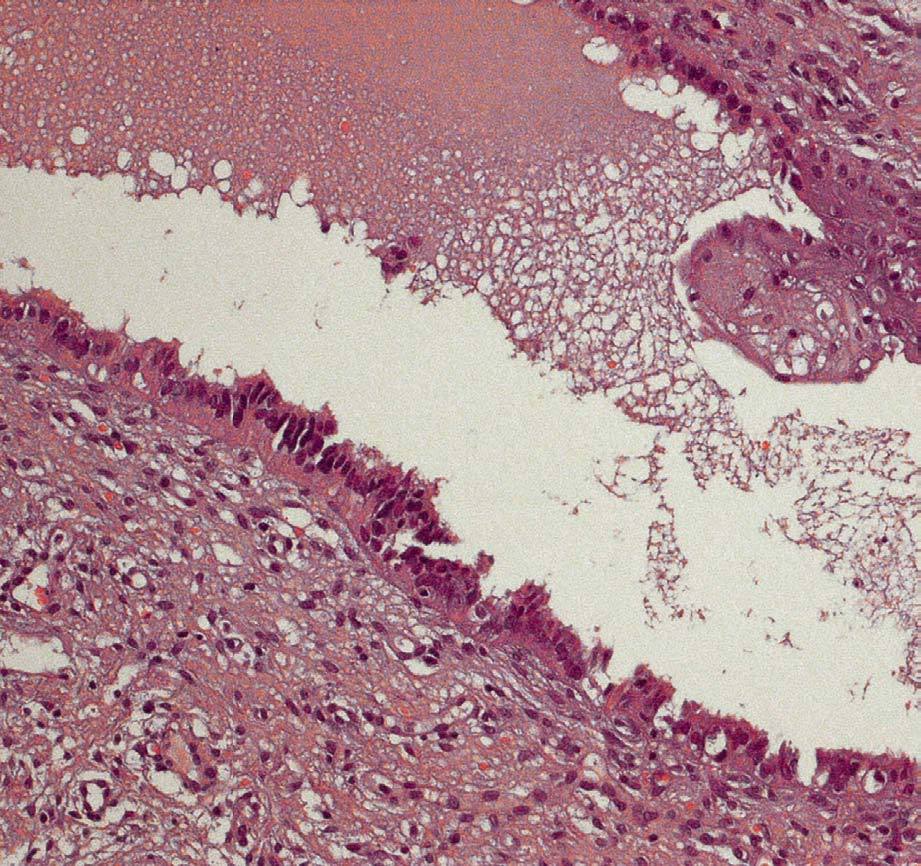
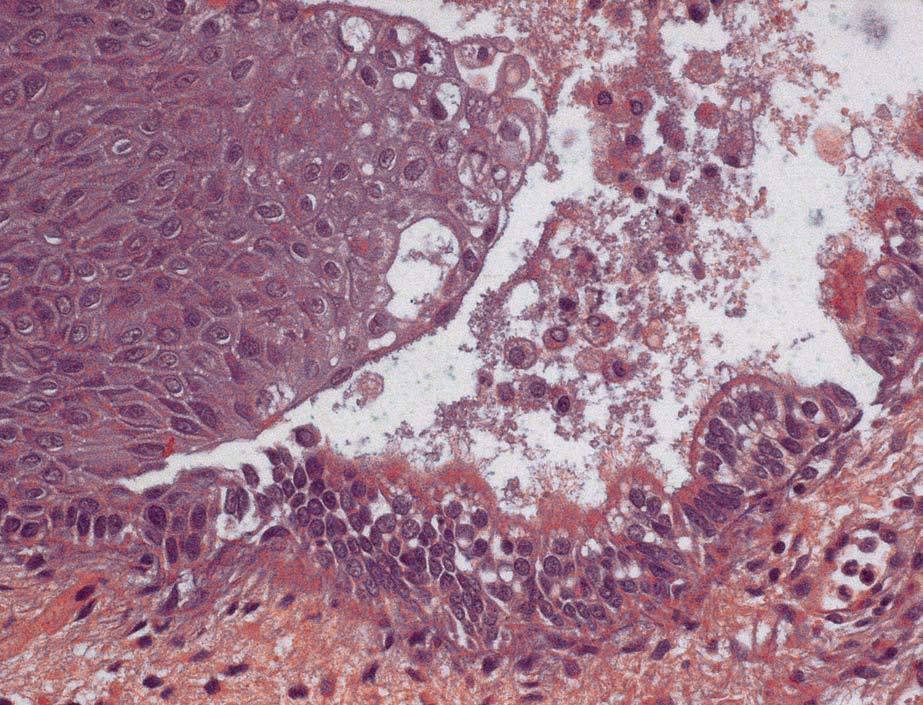
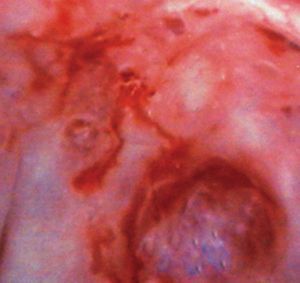
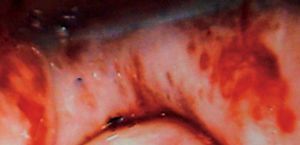
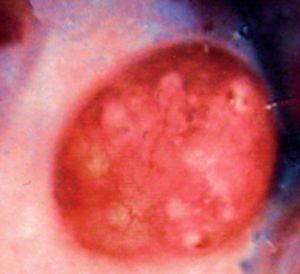
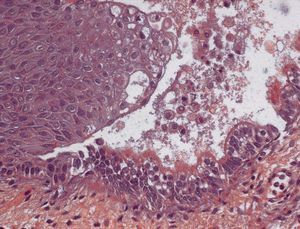
A la exploración se visualiza, en todo el tercio superior de vagina y que afecta a caras anterior, posterior y laterales (figs. 1 y 2), una lesión sobreelevada, abollonada, irregular, con micropapilas y que sangra al contacto. El cérvix y la vulva aparecen macroscópicamente sanos. Se toman múltiples biopsias de dichas lesiones vaginales, que informan como adenosis vaginal tipo tubárico con metaplasma escamosa extensa (fig. 3).
Fig. 1. Aspecto colposcópico de la cara anterior del tercio superior de la vagina (paciente 1).
Fig. 2. Aspecto colposcópico de la cara posterior del tercio superior de la vagina (paciente 1).
Fig. 3. Aspecto histológico de la adenosis vaginal tipo tubárico (paciente 1).
Caso 2
Mujer de 76 años, remitida por lesión vaginal asintomática. AG: P:6-6-0-0-6; menopausia: 54 años.
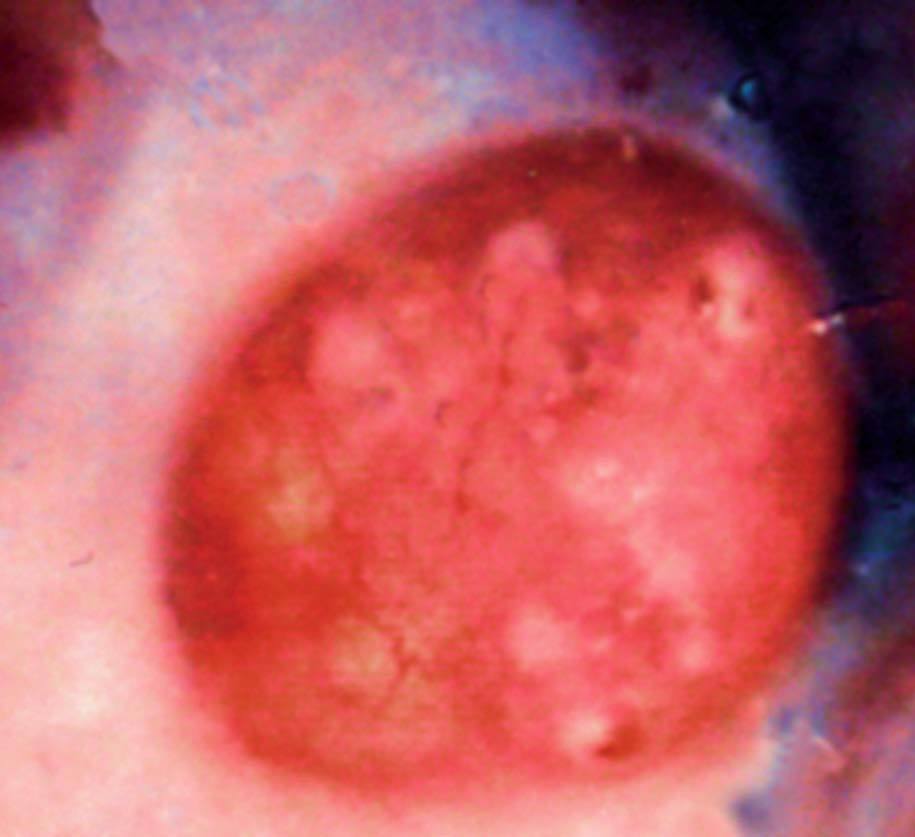
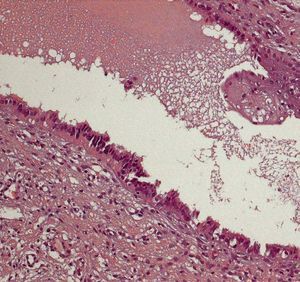
Se encontró un nódulo violáceo (fig. 4) de 1 cm en el tercio superior de la cara lateral de la vagina. Resto de vagina, vulva y cérvix de aspecto atrófico. La histología confirmó adenosis vaginal (fig. 5).
Fig. 4. Nódulo vaginal en la cara lateral vaginal (paciente 2).
Fig. 5. Aspecto histológico de la adenosis vaginal (paciente 2).
Ambas pacientes no referían haber estado expuestas prenatalmente a DES y fueron controladas colposcópicamente, se realizó biopsia de las zonas que resultaron sospechosas, a los 3, 6 y 12 meses tras el diagnóstico, sin que hayan aparecido cambios histológicos sobre las lesiones iniciales.
DISCUSIÓN
La apariencia clínica de la adenosis vaginal es variada, puede presentarse como parcheada o difusa, granular o nodular, única o múltiple, quistes, erosiones, úlceras o incluso como una protuberancia verrugosa. Ocasionalmente el proceso puede extenderse a la vulva. Los síntomas más frecuentes suelen ser escozor en vagina o introito, sangrado vaginal intermenstrual (frecuentemente ocasionado por relaciones sexuales) y una leucorrea mucosa importante3.
Hay 3 tipos morfológicos: oculto, quístico y superficial. En los 2 primeros, el epitelio glandular está cubierto por un epitelio escamoso intacto. En contraste, el tipo superficial se caracteriza por un epitelio columnar que reemplaza el epitelio fisiológico de la vagina. Las células glandulares pueden ser mucosas similares a las de endocérvix o células tuboendometriales como las del epitelio endometrial y el de las trompas de Falopio4. La ausencia de estroma endometrial es clave para hacer el diagnóstico diferencial con un foco de endometriosis3.
En función del origen de la adenosis se pueden distinguir 2 grupos de pacientes: uno «congénito», donde hay una proliferación de los restos de conducto mulleriano debido a la exposición intraútero a DES la prevalencia de adenosis vaginal en mujeres expuestas a DES in útero es variable (35-90%), y otro «adquirido», en el cual la causa puede ser: a) traumatismo e inflamación, que pueden ser causados por laser de CO2, 5-fluorouracilo4, compresas vaginales o el uso crónico de pesario; b) hormonas sexuales, como el tamoxifeno5, que estimulan los restos mullerianos; c) cambios espontáneos idiopáticos en los que no se ha identificado la causa.
La adenosis vaginal espontánea parece ser sorprendentemente frecuente, pero la mayoría son encuentros insignificantes, los cuales no daban clínica ni eran reconocidos en los exámenes rutinarios ginecológicos. Obviamente, no es una enfermedad progresiva en la mayoría de las pacientes. De acuerdo con la opinión general, eventualmente se transforma en epitelio maduro estratificado aunque puede ocasionalmente persistir después de la menopausia.
Es frecuente encontrar adenosis en la proximidad de adenocarcinomas vaginales, tanto en pacientes expuesta a DES como en no expuestas, lo cual sugiere que puede haber una transformación oncológica de dichas lesiones. Además, histológicamente no se ha visto una transición bien delimitada entre ambas lesiones. Sin embargo, basándonos en los datos que hay, no es posible establecer con qué frecuencia puede ocurrir.
La mayoría de las adenosis se resolverán de manera espontánea, incluso las asociadas a DES. Pero en las pacientes con sintomatología grave, que disminuye su calidad de vida, hay que plantearse un tratamiento. En la mayoría de las series recogidas en la bibliografía3,6,7 predomina el uso del láser de CO2 con una profundidad de 3-4 mm para destruir el epitelio metaplásico y provocar su sustitución por el epitelio escamoso fisiológico. El inconveniente es la alta tasa de recidiva debida, probablemente, a la presencia de nidos metaplásicos a más profundidad, y las consecuencias estenóticas sobre la vagina. La resección vaginal se podría considerar como la última opción terapéutica.