Los embarazos cursan simultáneamente con una masa anexial de forma inusual; y cuando lo hacen, son en su mayoría de manera asintomática. En casi el 25% identificaremos un teratoma quístico maduro. Tanto el diagnóstico, como el seguimiento y tratamiento de dichas tumoraciones pueden dificultarse en esta etapa y la valoración de los pros y contras para optar por un tratamiento quirúrgico durante la gestación suponen un dilema importante. Entre las características a valorar está el tamaño de la tumoración. Cuando dichas masas son mayores de 10 cm, a pesar de tener características ecográficas benignas, pueden estar enmascarando una neoplasia en uno de cada 10 casos; lo que haría considerar el tratamiento quirúrgico durante la gestación; y en estas ocasiones se opta con frecuencia por realizar un abordaje laparotómico para evitar, en la medida de lo posible, la rotura de dichas tumoraciones gigantes.
Presentamos el caso de una paciente gestante asintomática a la que se le diagnostica un quiste anexial gigante. Tras su estudio, se realiza una laparotomía exploradora en semana 16 de embarazo completando la anexectomía unilateral, con el diagnóstico definitivo de un teratoma quístico maduro. La recuperación posterior y la finalización a término de una gestación normoevolutiva se completa con éxito. Se hace una revisión del diagnóstico, seguimiento y abordaje quirúrgico de las masas anexiales encontradas durante la gestación.
It is rare for pregnancies to occur simultaneously with an adnexal mass, and when they do, they are mostly asymptomatic. In almost 25%, it is identified as a mature cystic teratoma. Both the diagnosis, monitoring, and treatment of these diseases can be difficult at this stage, and the assessment of the pros and cons for surgical treatment during pregnancy, which can lead to controversy, is a major problem. Among the characteristics to be assessed is the size of the tumour. When these masses are larger than 10 cm, despite having benign ultrasound characteristics, they may be masking a neoplasm in 1 out of 10 cases. In which case, surgical treatment would be considered during the pregnancy and a laparoscopy approach is often carried out to avoid, as far as possible, the rupture of these giant tumour masses.
The case is presented of an asymptomatic pregnant patient who is diagnosed with an adnexal giant cyst. After the work-up study, an exploratory laparotomy was performed in the 16th week of pregnancy, with a unilateral adnexectomy being performed, with the definitive diagnosis of a mature cystic teratoma. The subsequent recovery and the conclusion to full-term using standardised management was completed successfully. A review is presented on the diagnosis, follow-up and surgical approach of adnexal masses during pregnancy.
El diagnóstico de una masa anexial en la mujer embarazada se ha incrementado en los últimos años debido al control ecográfico más exhaustivo que se realiza en este periodo. Su incidencia descrita varía entre una de cada 76 a una de cada 2.328 embarazadas1.
Generalmente suponen hallazgos incidentales asintomáticos diagnosticados durante el estudio ecográfico obstétrico rutinario1,2, en torno a las 12 semanas (primera ecografía obstétrica estandarizada)3. La mayor parte de estas masas anexiales persistentes son benignas1, y los quistes dermoides representan el 25% de éstas4.
Las neoplasias malignas de ovario representan el 8% de las tumoraciones anexiales en el embarazo5, apareciendo en una de cada 12.000-47.000 gestantes. Su manifestación más frecuente es la existencia de una masa abdominal1.
La ecografía se considera el método de elección para el estudio inicial de las masas anexiales en la gestación, pero en los casos que exista una duda diagnóstica, o cuando no se puede contar con un ecografista experto, la resonancia magnética (RM) nuclear puede ayudarnos como estudio complementario, obteniéndose una mejor resolución6.
El uso de marcadores tumorales es limitado porque el propio embarazo puede alterar sus valores de referencia1, y no deben condicionar nuestra actitud de forma aislada.
En la mayoría de los casos, el seguimiento de estas tumoraciones anexiales es clínico y ecográfico. Se estima que en torno al 1-2,3% de estas masas requerirán su extirpación durante la gestación7, recomendándose dicha intervención en el segundo trimestre3,4,7. El tratamiento quirúrgico se plantearía en caso de grandes tumoraciones persistentes en segundo trimestre, en aquellas situaciones en las que no se pueda descartar su origen neoplásico o ante la aparición de complicaciones; donde el dolor es el síntoma asociado más frecuente2,4,7.
El presente artículo expone el caso clínico de una gestante con una masa ovárica gigante asintomática, que precisa de laparotomía exploradora y anexectomía unilateral programada preferente, identificándose un teratoma quístico maduro gigante; y se hace un repaso del diagnóstico, manejo y tratamiento de las masas anexiales encontradas durante la gestación.
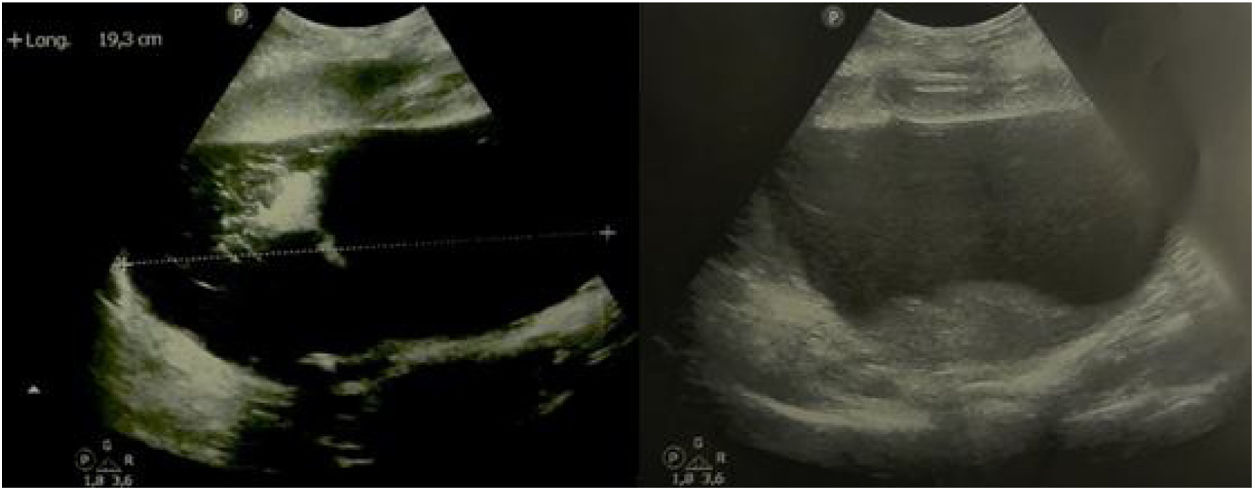
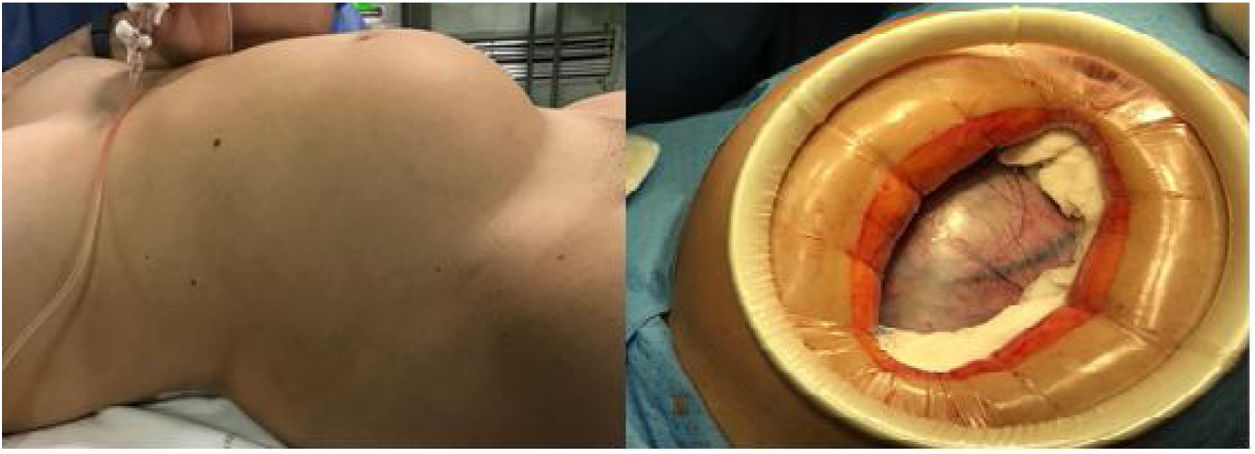
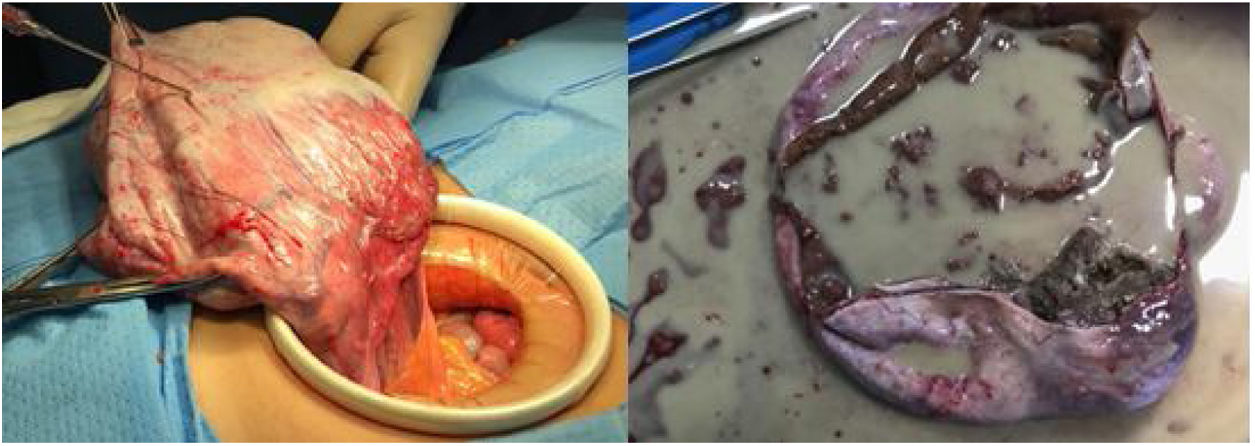
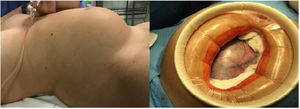
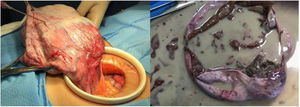
Cuadro clínicoPaciente mujer de 30 años, gestante de primer trimestre, que acudió a la primera consulta obstétrica en semana 12 + 4 de amenorrea. No destacaban antecedentes familiares ni personales de interés, siendo éste su primer embarazo y permaneciendo asintomática hasta el momento. Durante la exploración abdominal se palpó una masa centropélvica, dura y poco móvil, que sobrepasaba un través de dedo por encima del ombligo. La exploración se complementó con una ecografía abdominal y se completó con el abordaje vaginal, identificándose, además de una gestación simple evolutiva acorde con su amenorrea, en el ovario izquierdo, una formación quística biloculada gigante que ocupaba unas dimensiones máximas de 18 × 12,7 cm, con bordes regulares, tabique fino, contenido hipoecogénico homogéneo y presencia de sombra acústica posterior. En el polo inferior y más declive del lóculo mayor se identificaba una formación hiperrefringente irregular de 11 x 4 cm, score 1 (ausencia de captación Doppler), que podría corresponder a coágulos, sin poder descartar un componente sólido (fig. 1). La determinación de marcadores tumorales reveló cifras de alfa fetoproteína (αFP) de 23,5 ng/mL (0,1-10 ng/mL), carbohidrato antígeno 125 (CA-125) en 44,8 U/mL (5-35 U/mL), el carbohidrato antígeno 19,9 (CA-19,9) en valores de 64,3 U/mL (2-37 U/mL), una beta-gonadotropina coriónica humana (βhCG) de 55.737 mU/mL (< 5 mU/mL), y tanto el antígeno carcinoembrionario (CEA) como la proteína epididimal humana tipo 4 (HE4) fueron negativos (2,4 ng/mL y 35,8 pmol/L, respectivamente). Además el algoritmo de riesgo de malignidad ovárica (ROMA, Risk of Ovarian Malignancy Algorithm), fue de 3,70% (bajo riesgo). Dadas las dimensiones y características de la tumoración (multilocular mayor de 10 cm, con posible polo sólido irregular) y siguiendo los criterios del International Ovarian Tumor Analysis Group (IOTA) (por los que entraría a formar parte de una masa de significado incierto), la unidad de ginecología-oncológica decidió incluir a la paciente en lista de espera quirúrgica con código prioritario para realizar una laparotomía exploradora. Se solicitó una RM abdomino-pélvica preferente (por el dudoso componente sólido intraquístico) que no llegó a realizarse por la demora en la lista de espera requerida. En semana 16 + 6 de embarazo se realizó una laparotomía media infraumbilical y la extirpación anexial izquierda en bloque para su análisis en diferido, sin identificar ningún otro hallazgo patológico a nivel abdómino- pélvico (fig. 2). Se comprobó el bienestar fetal previo y postcirugía inmediata, con la realización de ecografías abdominales. Se administró cefazolina intravenosa como profilaxis antibiótica prequirúrgica y tromboprofilaxis durante los siete días postcirugía con heparina de bajo peso molecular. Dada la edad gestacional en el momento de la cirugía, no se consideró la evaluación de la longitud cervical ni la administración de medicación profiláctica para prevenir un trabajo de parto prematuro. La evolución posterior aconteció sin incidentes, con el alta hospitalaria al tercer día de la intervención. El estudio macroscópico de la pieza identificó un quiste de 16 × 14 × 12 cm y 480 g de peso, cuya superficie externa era lisa, brillante y blanquecina. En su interior existía un material gredoso, amarillento-parduzco con presencia de dientes, grasa y pelo que lo rellenaba casi en su totalidad (fig. 3); así como una trompa de falopio izquierda macroscópica y microscópicamente normal. El estudio anatomopatológico definitivo fue el de un teratoma quístico maduro. El control obstétrico posterior se realizó en la unidad de Alto Riesgo Obstétrico, con monitorización maternofetal con ecografías y valoración Doppler bisemanales, tras identificar un feto con un bajo peso para su edad gestacional con Doppler arteriales normales. Dada la ausencia de dinámica uterina en los registros cardiotocográficos y la ausencia de sintomatología, no se realizaron mediciones cervicales durante el control obstétrico. Con base en la estabilidad del cuadro, se alcanzó la gestación a término, desencadenándose el trabajo de parto espontáneo (sin precisar la inducción del parto programada), que finalizó con un parto eutócico de 40 + 1 semanas de gestación, y con el nacimiento de un varón de 2.900 g, Apgar 10-10-10. La recuperación postparto de la madre y el recién nacido fue excelente, siendo dados de alta hospitalaria a las 48 horas del parto. El control ginecológico posterior se realizó a los seis meses del parto, con una revisión ginecológica y ecografía transvaginal sin hallazgos patológicos, siendo dada de alta de nuestras consultas. Hasta el momento, y tras completarse dos años del parto, la paciente no ha requerido ninguna otra intervención ni ingreso hospitalario.
La presencia de una masa anexial puede asociarse con el 0,19 al 8,8% de los embarazos1.
En general, del 24 al 40% de las masas anexiales son tumores benignos5 y en el 31-72% de los casos se resuelven espontáneamente.
La aparición de cáncer en el embarazo es un evento infrecuente con una incidencia global estimada de 0,02 al 1%2. La «Red Internacional de Cáncer, Infertilidad y Embarazo» (INCIP) estima que a nivel global el cáncer más frecuente durante la gestación es el cáncer de mama (40%), seguido del linfoma (12%), cérvix (10%), leucemia (8%) y cáncer de ovario (7%)8.
Por ello, el cáncer de ovario (CO) es el segundo tumor ginecológico más frecuente que acontece durante la gestación, después del carcinoma de cervix8. Hasta el 8% de los tumores anexiales identificados en la gestación pueden representar una neoplasia maligna de ovario5, alcanzando una incidencia de CO de una de cada 12.000-47.000 gestantes1. Aunque el CO epitelial es el tipo de CO más agresivo y común fuera del embarazo, durante la gestación son más frecuentes los tumores de células germinales, con solo el 35% de los CO diagnosticados durante el embarazo de origen epitelial9.
A pesar de que las masas anexiales complicadas son menos frecuentes en pacientes embarazadas que en las no gestantes10, del 1 al 2,3% de las primeras requerirán cirugía por patología anexial durante esta etapa de su vida.
Está descrito que una de cada 500-635 mujeres requieren cirugía abdominal no obstétrica durante su embarazo, en su mayoría por un proceso de apendicitis aguda o colecistitis7.
DiagnósticoLas masas anexiales en las pacientes gestantes generalmente son diagnosticadas en los dos primeros trimestres de embarazo1-7, en su mayoría durante el primero (75,7%)2.
En nuestra paciente, dicha tumoración anexial fue descubierta en la primera visita obstétrica de la semana 12.
La ecografía es el método de evaluación estándar para el diagnóstico de las masas anexiales. Nos ayuda a diagnosticar su localización, tamaño, características y vascularización. Puede ayudar al ginecológo a discriminar que pacientes requieren seguimiento o cirugía, y a evaluar la regresión o progresión de las tumoraciones1,8,10.
La evaluación ecográfica también puede ayudarnos en el diagnóstico de complicaciones, como es en el caso de una torsión de ovario, al encontrarnos un estroma ovárico más ecogénico, folículos más dispersos en periferia, disminución de la vascularización del parénquima y el Whirpool sign (signo ecográfico producido por la torsión del pedículo vascular)2.
Las características ecográficas pueden ayudar a clasificar una tumoración anexial en función de su riesgo de malignidad. Esta valoración, junto con el IOTA es importante para la evaluación de tumoraciones anexiales en paciente pre y postmenopaúsicas, pero no hay estudios que demuestren la utilidad en embarazadas, aunque los criterios ecográficos de sospecha también son válidos en la gestación2. El IOTA nos clasificará la masa en benigna, maligna o indeterminada, atendiendo a sus características ecográficas (simple rules).
Existen muchos sistemas score que pueden ayudarnos a hacer un diagnóstico clínico de malignidad o benignidad. Entre las características ecográficas conocidas que impliquen un riesgo aumentado de malignidad destacan: los tumores sólidos irregulares, la presencia de componente sólido, los quistes multiloculares mayores de 6-10 cm, el gran tamaño de una masa anexial (> 50 mL), la existencia de paredes y septos gruesos (> 3 mm), de irregularidades internas en la pared del quiste, la presencia de al menos tres proyecciones papilares (proyecciones de más de 3 mm de alto que crecen hacia el interior del quiste), la vascularización abundante de la masa, así como la visualización de ascitis o masas peritoneales1,2,11. Los factores asociados con un mayor riesgo de malignidad en el embarazo incluyen un diámetro tumoral de 10 cm o más y una tasa de crecimiento tumoral > 3,5 cm/semana9.
A veces la evaluación ecográfica está limitada por el menor campo de visión, la dificultad para visualizar imágenes en úteros agrandados, o en pacientes obesas6. En torno a un 20% las masas anexiales no pueden visualizarse adecuadamente con el uso exclusivo de la ecografía1.
En estos casos, la RM puede ayudar a definir las características morfológicas de las lesiones1. Es posible su realización en cualquier edad gestacional. Ayuda a distinguir el contenido líquido de los quistes, a diferenciar quistes endometriósicos de dermoides, a definir las características de las partes sólidas de las tumoraciones6, así como a determinar la relación de la tumoración con las estructuras adyacentes2. En definitiva, supone una prueba de imagen complementaria a la ecografía, cuando ésta se ve limitada, inconclusa (o ambas cosas), así como ante hallazgos dudosos; pudiendo ser clave para decidir la necesidad de cirugía durante la gestación o posponerla tras el parto, o de finalización de la gestación para salvaguardar la salud de la madre6.
Es difícil distinguir la benignidad y malignidad de las masas anexiales durante el embarazo por el aumento masivo de vascularización a nivel pélvico10. La precisión en la distinción de la naturaleza benigna o maligna, en el caso de la RM, alcanza el 93%. Su realización es segura durante el embarazo, y no se han encontrado efectos adversos ni en la gestante ni en el feto. Sin embargo, el gadolinio (incluido en el contraste) ha demostrado aumentar el riesgo de defectos y malformaciones esqueléticas en estudios con animales (incluyéndose dentro de una categoría C farmacológica en el embarazo, según la U.S. Food and Drug Administration [FDA])1, por lo que no se recomienda su uso durante el mismo, salvo extrema necesidad, cuando se podría usar a discreción de un radiólogo experimentado6.
En el caso clínico expuesto previamente, las características ecográficas del quiste nos llevaron a clasificarlo como indeterminado, por lo que se indicó la realización de la RM. Finalmente se priorizó la cirugía frente a la RM, aunque es probable que dicha prueba de imagen nos hubiese dado información sobreañadida sobre el componente «sólido» del quiste, así como de su naturaleza benigna o maligna.
Es importante destacar, que aunque es poco común, una masa anexial ecográficamente benigna puede resultar maligna en el momento de la cirugía1.
El papel de los marcadores tumorales en el diagnóstico de masas anexiales en el embarazo es limitado debido a su naturaleza no específica y a las variaciones producidas por la propia gestación8-10. Sabemos que el CA-125, la αFP, la LDH y la hCG generalmente se encuentran elevadas durante el primer trimestre del embarazo (relacionadas con el desarrollo, diferenciación y maduración fetal), lo que limita su eficacia potencial1,2. El CA125 puede estar elevado en el primer trimestre y posparto de embarazos normales; aunque elevaciones importantes (1.000-10.000 U/mL) pueden aumentar erróneamente la sospecha de malignidad10. En nuestro caso, todos los marcadores tumorales anteriores se encontraban elevados.
Diagnóstico diferencialEn cuanto al diagnóstico diferencial de las masas anexiales en el embarazo cabe destacar la necesidad de incluir procesos anexiales (benignos y malignos), paraanexiales (quistes de paraovario y leiomiomas), procesos inflamatorios e infecciosos (enfermedad pélvica inflamatoria con absceso tubo-ovárico), así como también etiologías no ginecológicas (apendicitis, diverticulitis)1.
Aquellas formaciones anexiales que persisten más allá de las 16 semanas, siendo benignas en su gran mayoría1, están representadas en orden de frecuencia, por el teratoma benigno (7-37%), el cistoadenoma seroso (5-28%), el cistoadenoma mucinoso (3-24%), el endometrioma (0,8-27%), el quiste de paraovario (<5 %) y el leiomioma (1-2,5%)10. Koo et al.11 en su estudio realizado durante 10 años sobre masas anexiales en gestantes, solo identificaron etiología maligna en el 4% de casos.
Los teratomas maduros, también llamados quistes dermoides, representan casi el 25% de las formaciones quísticas ováricas encontradas durante la gestación. Suelen ser de crecimiento lento y unilateral, y es poco frecuente su presencia bilateral (10%). Tras la menarquia, presumiblemente por la estimulación hormonal de las glándulas sebáceas, pueden incrementar su tamaño, aunque este crecimiento suele ser lento. Existen casos descritos de teratomas con receptores hormonales positivos que experimentaron un crecimiento importante durante la gestación, pudiendo asociarse el propio embarazo y el estado hiperestrogénico con una estimulación en el crecimiento rápido de este tipo de quistes. Cuando el tamaño inicial de estos quistes es menor a 6 cm, no es probable esperar un crecimiento acusado durante la gestación ni complicaciones asociadas con los mismos4. En la paciente expuesta en el caso clínico no existían datos de un quiste dermoide conocido previo al embarazo, y ya en el momento del diagnóstico, esta tumoración superaba los 10 cm, a pesar de ser asintomática.
Por otro lado, los quistes del cuerpo lúteo componen otro gran grupo de las masas quísticas encontradas durante el embarazo (13-17%). Se forman tras la ovulación y persisten durante las primeras 8-9 semanas produciendo progesterona, pudiendo permanecer en forma de quistes posteriormente4, englobándose en el grupo de quistes inespecíficos.
Los leiomiomas uterinos forman parte del grupo más amplio de neoplasias sólidas encontradas durante la gestación, y en ocasiones, especialmente cuando son pediculados, pueden simular masas sólidas anexiales4.
Todas estas lesiones que podemos encontrarnos en el embarazo son generalmente benignas, con una tasa de transformación maligna en carcinoma escamoso invasivo menor del 2%1.
La mayoría de los tumores de ovario durante la gestación se diagnostica en estadíos precoces (80% en estadío I de la International Federation of Gynecology and Obstetrics [FIGO], con una gran proporción de tumores borderline [en más de la mitad de los casos]) frente al diagnóstico en estadíos avanzados en pacientes no gestantes2; y aunque las neoplasias epiteliales son la estirpe más común en la población general, el disgerminoma es la neoplasia maligna más frecuente durante este periodo. Tanto el dolor asociado, como las grandes dimensiones del quiste, son características que pueden hacer sospechar una posible naturaleza neoplásica1,11. Y es que en tumores que alcanzan o superan los 10 cm el riesgo de malignidad es importante, rebasando el 10%11. Éste es el motivo por el que se planteó la intervención programada preferente en la paciente presentada en el caso clínico, a pesar de no encontrar otros signos de sospechosos de malignidad asociados con esa masa anexial gigante.
Clínica y complicacionesLa mayoría de las masas anexiales diagnosticadas en el embarazo son asintomáticas, y suponen hallazgos incidentales identificados durante el control ecográfico obstétrico rutinario1,2. Un gran porcentaje de estas tumoraciones ováricas se resuelven espontáneamente durante el primer trimestre de gestación, ya que muchas son funcionales. Entre el 65 y el 80% de las pacientes permanecen asintomáticas1.
Pero existen otras, que persisten y requieren cirugía por el riesgo de torsión (1-22%), rotura (0-9%), obstrucción al parto (2-17%), además de poder representar un proceso neoplásico (2-6%)4. En caso de ser sintomáticas, es el dolor el síntoma más frecuente asociado con una masa anexial durante la gestación.
La localización de dichas masas, a medida que el útero aumenta de tamaño se desplazan cranealmente fuera de la pelvis, o en ocasiones se alojan en el Douglas pudiendo provocar síntomas por compresión2. Las pacientes embarazadas tienen un aumento del 1% en el riesgo de torsión ovárica, siendo la complicación más frecuente. Este evento, en el caso de producirse, suele ocurrir entre las 10 y las 17 semanas de gestación en el 60% de pacientes; y solo en el 5,9% de ellas ocurre tras las primeras 20 semanas11. Es más habitual que ocurra en masas de entre 6 y 10 cm, y en casos de estimulación ovárica (el 73% de los casos de torsión se asocian con técnicas de reproducción asistida)2; y posteriormente este riesgo disminuye ya que la movilidad de los ovarios también lo hace a medida que crece el útero11. Los síntomas asociados con este cuadro son bien conocidos: dolor, náuseas, vómitos y eventualmente fiebre y leucocitosis2.
En cuanto al riesgo de recurrencia de una masa anexial, Harada et al.12 sugieren que es mayor si el tumor se presenta en mujeres menores de 30 años, con quistes mayores de 8 cm y de forma bilateral. La recurrencia de un teratoma en el mismo ovario es rara (3-4%)4.
TratamientoEl manejo de las masas anexiales durante el embarazo es controvertido. A veces es problemático decidir el tipo de tratamiento y la necesidad de intervenir a la paciente por las posibles complicaciones inherentes a la cirugía, las que implican al binomio maternofetal, las derivadas del retraso en el diagnóstico de una neoplasia, o las resultantes de la no intervención y el eventual desarrollo de complicaciones derivadas del mismo (rotura, torsión, abdomen agudo asociado o todas ellas). Es importante además considerar la edad gestacional, la edad materna y la probable naturaleza de la tumoración3.
Unos abogan por la cirugía y otros por la observación (ya que refieren que la mayor parte de dichas tumoraciones se resolverán espontáneamente durante o tras la gestación)1.
El manejo expectante con observación, se ha de fomentar en masas anexiales asintomáticas con baja sospecha de malignidad (con criterios ecográficos de benignidad) y en aquellas que se prevean bajo riesgo de complicaciones2; considerándose razonable la reevaluación en la siguiente exploración de la anatomía fetal (18–22 semanas de gestación)1. Cuando dichas masas persisten (el tamaño mayor de 5 cm supone un predictor de persistencia), pero siguen reuniendo criterios de benignidad, se ha de sopesar los riesgos derivados de sus posibles complicaciones frente a la cirugía antenatal, pudiendo considerarse el tratamiento quirúrgico en el postparto como ha sido reportado en estudios retrospectivos2. En las masas descubiertas en el segundo trimestre, se puede aplicar un plan de manejo similar, con reevaluación a las 32–36 semanas de gestación. Finalmente, las masas descubiertas en el tercer trimestre sin evidencia de malignidad, se pueden manejar en el momento de la cesárea (si hay una indicación obstétrica de la intervención) o seis semanas después del parto1.
La mayoría de las referencias aconsejan tratar quirúrgicamente aquellas masas gigantes, o que crezcan por encima de los 6 cm y persistan en la semana 16, ante sospecha de malignidad, o si son sintomáticas o se asocian con complicaciones (hemorragia, torsión, rotura, abdomen agudo o varias de ellas) y hacerlo de forma reglada, preferiblemente en el segundo trimestre (16-20 semanas)1,2,4,7. Los procedimientos quirúrgicos a realizar pueden ir desde la resección del tumor, ooforectomía o salpingooforectomía, etcétera. El mejor enfoque quirúrgico para un embarazo con masas anexiales sigue siendo controvertido7.
Sin embargo, la clínica de abdomen agudo asociada con una masa anexial se debe tratar quirúrgicamente de forma urgente sin demorar la intervención1.
Ante la sospecha o diagnóstico de torsión ovárica, la cirugía debe ser urgente, para detorsionar el ovario y valorar su viabilidad. En caso de persistir signos de isquemia, está indicada la anexectomía2.
Cuando existe sospecha de malignidad, se han de valorar variables como la edad gestacional y el posible estadío de la enfermedad para programar la cirugía. En estos casos normalmente se opta por realizar una laparotomía (para evitar la rotura del quiste durante su manipulación)2; principios que se siguieron en el tratamiento quirúrgico de la paciente de este caso clínico.
Debido a la baja sensibilidad de la citología para detectar tumores malignos (25-82%) y al eventual riesgo de diseminación celular en caso de malignidad, no se recomienda la aspiración de los quistes1.
Son bien conocidos los beneficios de la cirugía laparoscópica frente a la laparotomía (recuperación postquirúrgica precoz, menor riesgo de trombosis, menor estancia hospitalaria) en la población general. Sin embargo, el papel del CO2 utilizado en la realización del neumoperitoneo y su relación con una posible hipoperfusión placentaria y el desarrollo de acidosis fetal es controvertida y requiere más investigación. Aunque se considera seguro trabajar a presiones de 10-15 mmHg, se debe monitorizar el CO2 en sangre1,2. Con presiones inferiores a 12 mmHg y duración de la cirugía inferior a 30 min no existen efectos adversos sustanciales en el feto7.
Se deberían tener en cuenta aspectos para realizar una laparoscopia con seguridad en una embarazada, a saber: colocar a la paciente en decúbito lateral izquierdo (para disminuir la compresión sobre la vena cava, especialmente en el tercer trimestre) y acceder al abdomen mediante entrada abierta (Hasson), con trocar óptico o con aguja de Veress tras valorar previamente la situación del fondo uterino (para minimizar el riesgo de posible perforación uterina). Debe garantizarse la monitorización fetal y tocográfica (según la edad gestacional), el uso de tocolíticos previos a la cirugía si existen signos de amenaza de parto prematuro, la profilaxis de la trombosis venosa profunda, y el control adecuado del dolor. Se recomiendan también medidas de compresión mecánica intra y postquirúrgicamente2,13.
En la paciente expuesta en el caso clínico se tuvieron en cuenta todas estas premisas, a excepción del uso de tocolíticos, que se desestimó dado que en el momento de la cirugía no se habían alcanzado las semanas de gestación para considerar la viabilidad fetal.
De los 985 pacientes con masas anexiales intervenidas durante la gestación recogidas en el metaanálisis de Ye et al.7, 549 se sometieron a cirugía laparoscópica y 436 a laparotomía.
El 80% de cirugías realizadas por Koo et al.11 fueron intervenidas por laparotomía, el 92% de forma programada, y el 90% realizadas con anestesia general.
Un estudio retrospectivo realizado por Koo et al.13 en un total de 152 gestantes intervenidas por masas anexiales, en el 78,9% se planteó cirugía por tamaños de > 6 cm o sospecha de malignidad, y solo en el 21,1% de casos se realizó una cirugía urgente por un cuadro de abdomen agudo asociado con una masa anexial. El 98,7% de las cirugías se realizaron en el primer y segundo trimestre y únicamente el 1,3% se practicó en el tercer trimestre, debido a un abdomen agudo. En el 77,6% de las cirugías se optó por realizar una laparotomía y en el 22,4% se resolvió por laparoscopia. Fue significativamente diferente el afrontamiento del tamaño tumoral y la edad gestacional en el caso de la laparoscopia frente a la laparotomía. La laparoscopia supuso la vía de abordaje en caso de tumoraciones de menor tamaño (7,7 ± 2,9 cm) y edades gestacionales más precoces (el 73,5% en el primer trimestre). Sin embargo, el 75,4% de las laparotomías se realizaron en el segundo trimestre y en el caso de mayores tumoraciones (9,3 ± 3,9 cm). Es de destacar la disminución del tiempo de ingreso hospitalario en el caso de las laparoscopias (reducido a la mitad).
Complicaciones obstétricasLa cirugía anexial durante la gestación es segura y comporta baja tasa de complicaciones maternofetales7. Se prioriza su realización en el segundo trimestre (16-20 semanas) para evitar o minimizar los riesgos de aborto involuntario y teratogenicidad, si se realiza antes, o de parto prematuro, si se realiza más adelante1,2,4,7. Las tasas de pérdida gestacional tras una cirugía anexial se estiman en un 2,8-12% (12% en el primer trimestre y 5,6% en el segundo)7, y el parto pretérmino puede desencadenarse en el 5,8-10,4%2.
En caso de apendicitis perforada, la pérdida gestacional se eleva al 20%, siendo solo del 1,5% en caso de apendicitis no complicada7. El riesgo de muerte fetal podría aumentar cuando se realiza una cirugía urgente por debajo de las 10 semanas de gestación, especialmente en casos de teratoma maduro11, siendo este tipo de tumor propenso a la torsión en el primer trimestre3. También se ha observado un aumento significativo del riesgo de prematuridad en recién nacidos de gestantes con masas anexiales de naturaleza maligna1.
Al-Fozan et al.14 reportaron una tasa de aborto del 5,9% en caso de cirugía anexial electiva frente al 10% en caso de cirugía urgente por torsión ovárica (complicación más frecuente). En el estudio de Koo et al.13 mencionado anteriormente solo en dos de las 152 gestantes sometidas a cirugía anexial, una tras laparotomía y otra tras un abordaje laparoscópico, se produjo un aborto involuntario (uno el día posterior a la laparotomía, en la semana 16 de la gestación; y el segundo en la semana 6 + 5, cuatro días tras la laparoscopia), suponiendo menores cifras de pérdida gestacional (1,8%) que las publicadas. Las tasas de trabajo de parto prematuro alcanzaron el 10,2% tras la cirugía electiva y en el 30,4% asociada con cirugía urgente, en el estudio de Koo YJ et al.13.
La intervención por vía laparoscópica parece ser tan segura como la laparotomía en la embarazada sin diferencias en tasas de aborto, trabajo de parto prematuro, restricción del crecimiento intrauterino, muerte perinatal y anomalías fetales7,15; con tendencia a menores tasas de pérdida gestacional y de trabajo de parto prematuro (no estadísticamente significativas) en el caso de la laparoscopia16. Los resultados fetales se afectan muy raramente por la presencia de una masa anexial16.
Para finalizar, la escasez de guías de actuación disponibles ante masas anexiales durante el embarazo, hace relevante el tratamiento del caso expuesto, por las posibles complicaciones que se deriven del mismo y el riesgo de malignidad, y a la vez salvaguardando la seguridad y viabilidad fetal1.
ConclusionesEl correcto diagnóstico y apropiado tratamiento de cada gestante con una masa anexial suponen un amplio debate y campo de conocimiento del que nos quedan muchas cuestiones por resolver. La visualización de los anejos en la primera visita gestacional, el diagnóstico de tumoraciones anexiales que podamos encontrar, y el control y tratamiento de los mismos, suponen un reto para el ginecólogo obstetra. No debemos olvidar, que aunque es poco común, una masa anexial ecográficamente benigna puede ser maligna en el momento de la cirugía y que dicho riesgo está aumentado en tumoraciones mayores de 10 cm. Por ello, hemos de realizar una aproximación individualizada de cada paciente y en muchas ocasiones hacer un manejo multidisciplinar, para intentar que el binomio bienestar maternofetal esté bien equilibrado.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en animales. En este trabajo participan pacientes humanos por lo que fue aprobado por el Comité de Ética del Hospital Universitario Virgen Macarena de Sevilla.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes y sí cuentan con su consentimiento informado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.