Protocolo de diagnóstico prenatal de los defectos congénitos y cribado de las anomalías cromosómicas. Forma parte de los Protocolos y Guías de Actuación Clínica en Ginecología y Obstetricia promovidos por la Sociedad Española de Ginecología y Obstetricia (SEGO) y ha sido actualizado en noviembre del 2010. Disponible en la web de la sociedad referida (www.prosego.es).
Publicado con la autorización de la Sociedad Española de Ginecología y Obstetricia (SEGO) (www.sego.es) (junio 2012).
This protocol for prenatal diagnosis of birth defects and screening for chromosomal abnormalities is part of the Protocols and Guidelines of Clinical Practice in Gynaecology and Obstetrics sponsored by the Spanish Society of Gynaecology and Obstetrics (SEGO). Updated in November 2010. It is available on the website of the aforementioned society (www.prosego.es).
Published with the permission of the Spanish Society of Gynaecology and Obstetrics (SEGO) (www.sego.es) (June 2012).
El término «diagnóstico prenatal» agrupa todas aquellas acciones diagnósticas encaminadas a descubrir durante el embarazo un «defecto congénito», entendiendo por tal «toda anomalía del desarrollo morfológico, estructural, funcional o molecular presente al nacer (aunque puede manifestarse más tarde), externa o interna, familiar o esporádica, hereditaria o no, única o múltiple» (Comités de Trabajo de la OMS, 1970, 1975, 1982).
El diagnóstico prenatal tiene como finalidad diagnosticar con la mayor precocidad posible un defecto congénito o bien establecer la ausencia del mismo, ya que la confirmación de la normalidad contribuye a reducir la ansiedad materna durante el resto de la gestación.
Ámbito del diagnóstico prenatalAlrededor del 3% de los nacidos vivos presentan algún tipo de anomalía, pero esta cifra se incrementa hasta el 4-7% al año de vida. De acuerdo con la causa subyacente, se distinguen en la práctica:
- –
Enfermedades hereditarias mendelianas o monogénicas, presentes en el 1-1,5% de nacidos y responsables de alrededor del 25% de las anomalías. Los mecanismos de transmisión responden a su carácter recesivo, dominante, autosómico o ligado a los cromosomas sexuales. Aunque individualmente son poco frecuentes, en conjunto incluyen un gran número de errores metabólicos congénitos, aunque sus frecuencias varían en distintas poblaciones. En nuestro medio se dan con mayor frecuencia relativa la fibrosis quística, distrofia miotónica, riñón poliquístico y neurofibromatosis. El riesgo de recurrencia oscila entre el 25 y el 50%.
- –
Enfermedades multifactoriales, en las que hay participación combinada de factores genéticos y ambientales. Son las más frecuentes y responsables de buen número de las malformaciones. El riesgo de recurrencia es muy inferior al de las enfermedades monogénicas. Entre ellas pueden citarse los defectos del tubo neural.
- –
Malformaciones por efecto ambiental teratogénico en las que participan distintos factores (fármacos, infecciones, tóxicos ambientales, radiaciones ionizantes).
- –
Anomalías cromosómicas, reconocibles en alrededor del 0,5-0,7% de los fetos y responsables del 12-14% de los defectos congénitos. Estas anomalías pueden ser numéricas o estructurales y afectar a los autosomas o a los cromosomas sexuales. En cualquier caso, se encuentra un desequilibrio genómico, por defecto o por exceso, como causa de expresión de la(s) anomalía(s).
Dado el coste económico de las técnicas de diagnóstico prenatal y el hecho de que algunas llevan implícito un riesgo de pérdida fetal (técnicas invasivas), no es posible universalizar su uso. De ahí la necesidad de establecer criterios para efectuar una selección de la «población de riesgo».
- 1.
Constituyen grupo de riesgo de enfermedades hereditarias todas aquellas gestantes cuyos antecedentes familiares hacen pensar en una herencia autosómica o ligada al sexo. Estas gestantes deberían ser valoradas en una consulta genética especializada y muy probablemente ser sometidas a la técnica invasiva más idónea que permita conocer si el nuevo feto tiene esa determinada enfermedad o no.
- 2.
El grupo de riesgo para las malformaciones congénitas lo constituyen el 100% de las mujeres embarazadas, dado el carácter primordialmente esporádico de dichas malformaciones. No obstante, las parejas que hayan tenido un hijo previo afectado de una malformación, por ejemplo, cardíaca, o que alguno/s de sus miembros sea/n portador/es de algún defecto congénito, sí pueden tener un riesgo incrementado de que se repita el mismo problema u otro similar y, por tanto, deberán ser vigiladas de forma exhaustiva en el siguiente embarazo (p. ej., a través de un examen morfológico fetal precoz).
- 3.
El grupo de alto riesgo de presentar cromosomopatías está constituido por aquellas gestantes que tengan:
- –
Factores de riesgo preconcepcionales: hijo previo con cromosomopatía documentada, progenitor portador de una anomalía cromosómica (translocaciones equilibradas, translocaciones pericéntricas, fragilidad cromosómica, inversiones, etc.), edad materna ≥ 40 años. Otros potenciales factores de riesgo preconcepcionales, como el aborto de repetición, pueden considerarse indicación de estudio invasivo cuando el estudio del material abortivo y/o de los padres muestre la existencia de una anomalía cromosómica.
- –
Factores de riesgo intragestacionales: sospecha de la existencia de una cromosomopatía fetal a partir de la aplicación de un programa de cribado prenatal de alteraciones cromosómicas fetales.
- –
Estas gestantes de riesgo deberían ser valoradas en una consulta especializada.
Cribado prenatal de alteraciones cromosómicas fetalesDentro de este apartado es conveniente distinguir las aneuploidías fetales más comunes, para las que en la actualidad se dispone de métodos efectivos de cribado que combinan información clínica, bioquímica y ecográfica de cada gestante de aquellas alteraciones cromosómicas en las que dicho cribado solo se basa en la información proporcionada por la ecografía junto a datos clínicos de la embarazada.
Cribado prenatal de las aneuploidías fetales más comunesAquí se incluyen las trisomías de los pares 21, 18 y 13. En el ámbito de la detección de las cromosomopatías fetales, la trisomía 21 o síndrome de Down ha sido uno de los objetivos prioritarios por tratarse de la aneuploidía más frecuente en recién nacidos vivos y la causa más frecuente de retardo mental severo. En la actualidad, se observa un incremento de su prevalencia a causa, fundamentalmente, del incremento de la edad de las gestantes (aproximadamente un 1,8%).
Dada la estrecha relación existente entre cromosomopatía fetal y edad materna, esta se ha empleado como criterio para la selección de las gestantes candidatas a una técnica invasiva y, de hecho, hasta hace poco tiempo ha sido el método más empleado, ofreciéndose generalmente una técnica invasiva cuando la gestante tenía una edad ≥ 35 años. Sin embargo, dependiendo del punto de corte empleado, la tasa de detección de este tipo de cribado es solo del 30% para una tasa de falsos positivos del 5% y del 50% para una tasa de falsos positivos del 15%1, de modo que aunque permite disminuir la prevalencia posnatal de trisomía 21 de las madres de mayor edad, la de madres más jóvenes no se ve alterada. Este fue el motivo que hizo necesaria la puesta en marcha de programas de cribado coordinado y comunitario que permitieran detectar de manera específica y más precisa los embarazos de riesgo elevado de alteración cromosómica.
Se acepta generalmente que un cribado poblacional debe tener como mínimo una tasa de detección del 75%, con una tasa de falsos positivos del 5%. Este es el motivo por el cual se recomienda no realizar el cribado únicamente por edad. En la actualidad se recomienda utilizar nuevos métodos de cribado que calculen el riesgo de síndrome de Down teniendo en cuenta no solo la edad de la gestante, sino también las características fenotípicas ecográficas del feto (marcadores ecográficos) y los marcadores bioquímicos de cromosomopatía en sangre materna. La evidencia científica destaca la necesidad de combinar técnicas ecográficas y técnicas bioquímicas para conseguir los mejores resultados. Estos programas de cribado permiten un cálculo del riesgo de síndrome de Down específico para cada gestante en función de los valores obtenidos para dichos marcadores2,3. Con ello se establecen gestaciones de alto o de bajo riesgo de presentar trisomía 21. En los casos de alto riesgo, es potestad de la gestante decidir si desea o no realizarse una técnica invasiva para el diagnóstico.
Marcadores ecográficosEl mejor marcador ecográfico de las aneuploidías fetales más comunes, y en especial del síndrome de Down, es, sin duda, la translucencia nucal (TN), o grosor de la zona econegativa de la nuca del feto4. El incremento del grosor de la TN, medida entre las semanas 11 y 14, se correlaciona con la presencia de aneuploidías y fundamentalmente con la trisomía 215. Es el marcador ecográfico que presenta mayor efectividad para tal fin y, por tanto, la ecografía del i trimestre desempeña un papel muy importante en el cribado prenatal de las aneuploidías. La valoración de la TN debe ser realizada por un ecografista suficientemente entrenado o adecuadamente supervisado. El ecógrafo utilizado deberá ser de gama medio-alta y deberá disponer de «cine-loop» para poder recuperar imágenes previas y poder tomar las medidas con precisión. El tiempo de exploración asignado en la programación deberá ser de alrededor de 15 min.
La TN debe ser medida utilizando los criterios de la Fetal Medicine Foundation (www.fetalmedicine.com). Para ello debe realizarse un corte sagital y medio embrionario, y preferentemente el embrión debe hallarse en posición horizontal en referencia a la pantalla del ecógrafo. La ampliación de la imagen debe ser suficiente para que en la pantalla se visualicen la cabeza y el tórax del embrión. La medición de la TN solo puede realizarse estando el embrión en posición neutra (ni en hiperflexión, ni en hiperextensión). Debe medirse toda la zona econegativa, distinguiendo la piel de las membranas amnióticas. Los calipers serán colocados midiendo solo la zona econegativa de máximo grosor6.
Los fetos afectados de trisomía 13 (síndrome de Patau) y trisomía 18 (síndrome de Edwards) también suelen presentar un incremento de la TN y, por lo tanto, esta también se utiliza como marcador para estas cromosomopatías7,8.
La misma técnica debe ser utilizada para la valoración de la TN en gestaciones múltiples, aunque generalmente su realización es más compleja9.
Asimismo, es recomendable que la ecografía del i trimestre incluya una primera valoración morfológica básica del embrión que incluya cabeza, tronco y extremidades, a pesar de que la ecografía de las 20 semanas siga siendo la ecografía básica para el cribado de las anomalías morfológicas fetales.
La ecografía morfológica de la semana 20 debe ser realizada siguiendo los criterios de la Sociedad Española de Ginecología y Obstetricia (SEGO) (véase protocolo de ecografía obstétrica). Es importante recordar que las gestaciones con una TN > al percentil 99 o superior a 3,5mm que presenten un cariotipo normal son susceptibles de la realización de una ecografía morfológica precoz que incluya una valoración cardíaca. También debería realizarse una revaloración exhaustiva de la anatomía fetal a las 20 semanas, con eventual medición del grosor nucal10-12.
Marcadores bioquímicosLos marcadores bioquímicos son proteínas detectadas en la sangre materna y cuyo aumento o disminución, según el marcador, se correlaciona con la presencia de trisomía 21, motivo por el que son muy útiles en el establecimiento de un índice de riesgo de síndrome de Down. Según la edad gestacional en la que presentan su mejor tasa de detección, se distinguen 2 tipos de marcadores bioquímicos: del i y del ii trimestre.
Son marcadores bioquímicos del i trimestre:
- –
Fracción ß libre de la gonadotropina coriónica (fß-HCG), que está elevada en la trisomía 2113.
- –
Proteína plasmática asociada al embarazo (PAPP-A), que está disminuida en la trisomía 2114.
Son marcadores bioquímicos del ii trimestre:
- –
Alfafetoproteína (AFP), disminuida en la trisomía 21.
- –
fß-HCG, aumentada en la trisomía 21.
- –
Estriol no conjugado (uE3), disminuido en la trisomía 21.
- –
Inhibina A, aumentada en la trisomía 21.
La estimación del riesgo de que una gestante sea portadora de un feto con trisomía 21 se lleva a cabo una vez se han determinado los marcadores bioquímicos mediante un programa (software) específico, al que se añaden los marcadores ecográficos cuando se realiza en el i trimestre. El cálculo del riesgo se basa en la modificación del riesgo «a priori» de una determinada trisomía definido por la edad materna, así como las ratios de verosimilitud (likelihood ratios) derivadas de los valores de los marcadores empleados, obteniéndose un riesgo «a posteriori».
Este cociente (likelihood ratio) nos informará sobre la probabilidad de que se trate de una gestación afectada más que de una no afectada. Su cálculo se realiza mediante unas fórmulas matemáticas que combinan los valores de los distintos marcadores. Los factores que afectan al valor atribuido al riesgo «a priori» son: la edad materna, la edad gestacional, la gestación previa afectada y la edad de la donante de ovocitos en las técnicas de reproducción asistida15-17. En los casos de gestaciones conseguidas mediante la donación de ovocitos el cálculo tendrá en cuenta la edad de la donante y no la edad materna.
El software utilizado por el laboratorio debe introducir factores de corrección para distintas variables que afectan a los niveles de los marcadores (peso materno, grupo racial o étnico, consumo de tabaco, diabetes dependiente de la insulina, gestación gemelar, etc.), por lo que tales datos deben figurar en la solicitud de análisis bioquímico18-20.
Algunos programas permiten además el cálculo del riesgo con un algoritmo específico para otro tipo de cromosomopatías21-26, fundamentalmente para trisomía 18 y en ocasiones también para la trisomía 13. Cabe destacar que este riesgo debe ser el de la gestación a término, dada la tasa elevada de pérdidas fetales intrauterinas de las gestaciones cuyo feto presenta un síndrome de Edwards27,28.
Es conveniente que, según su población y el método analítico empleado, cada laboratorio de cribado calcule y actualice periódicamente los cálculos de los múltiplos de la mediana (MoM) de los distintos marcadores, a partir de un mínimo de 100 muestras para cada semana de gestación en las que se realice el cribado. Por ello se exige del laboratorio un control de calidad interno y de una agencia externa.
La necesidad de establecer unas condiciones para el programa está justificada por la amplia variabilidad que se observa en los resultados obtenidos con los distintos programas disponibles. Los programas deben cumplir las leyes vigentes sobre medidas de seguridad de los ficheros automatizados que contengan datos de carácter personal (Real Decreto 994/1999 y 195/2000). Es necesario que los resultados que ofrece el software hayan sido contrastados con un programa informático independiente y de referencia (DS-QA Tools, Reino Unido, etc.). La certificación de la Comunidad Europea (CE) según la legislación vigente (Directiva 98/79/CE y Real Decreto 1662/2000 sobre productos sanitarios para diagnóstico «in vitro») es obligatoria desde el año 2005.
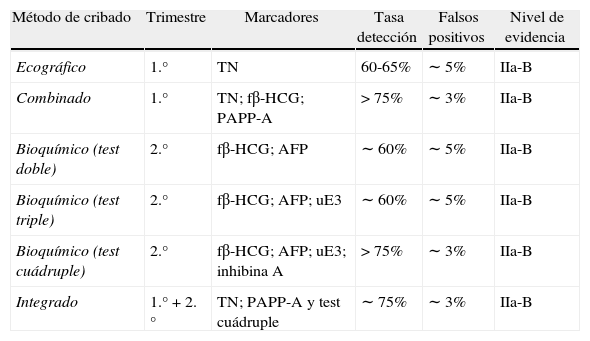
Estrategias de cribado prenatal para las aneuploidías fetales más comunesExisten distintas estrategias de cribado que utilizan marcadores ecográficos y bioquímicos (aislados o de manera combinada) en función del momento de la gestación en el que se realice. Las principales estrategias de cribado son (tabla 1):
- 1.
Cribado ecográfico del i trimestre: se basa fundamentalmente en el valor de la TN. Su tasa de detección se sitúa en el 60-65%, con una tasa de falsos positivos del 5%5 (NE = IIa-B).
- 2.
Cribado combinado del i trimestre: combina la TN como marcador ecográfico y 2 marcadores bioquímicos del i trimestre, la fß-HCG y la PAPP-A. Su tasa de detección es superior al 75%, con una tasa de falsos positivos próxima al 3%29,30 (NE = IIa-B).
- 3.
Cribado bioquímico del iitrimestre mediante test doble: se basa en la cuantificación de 2 marcadores bioquímicos (AFP y fß-HCG) y no considera ningún marcador ecográfico. Su tasa de detección se sitúa alrededor del 60%, con una tasa de falsos positivos del 5%31 (NE = IIa-B).
- 4.
Cribado bioquímico del ii trimestre mediante el test triple: se basa en la cuantificación de 3 marcadores bioquímicos (AFP, fß-HCG y uE3) y no considera tampoco ningún marcador ecográfico. Su tasa de detección es del 60%, con una tasa de falsos positivos del 5%31-33 (NE = IIa-B).
- 5.
Cribado bioquímico del ii trimestre mediante el test cuádruple: se basa en la cuantificación de 4 marcadores bioquímicos (AFP, fß-HCG, uE3 e inhibina A), sin tener en cuenta ningún marcador ecográfico. Su tasa de detección es superior al 75%, con una tasa de falsos positivos menor del 3%34 (NE = IIa-B).
- 6.
Cribado integrado: combina marcadores bioquímicos y ecográficos del i trimestre (PAPP-A y TN) con marcadores bioquímicos del ii trimestre (test cuádruple). El resultado del cálculo de riesgo se proporciona al final, durante el ii trimestre. Su tasa de detección es superior al 75% y su tasa de falsos positivos es del 3%32-36 (NE = IIa-B).
Estrategias de cribado prenatal para las aneuploidías fetales más comunes
| Método de cribado | Trimestre | Marcadores | Tasa detección | Falsos positivos | Nivel de evidencia |
| Ecográfico | 1.° | TN | 60-65% | ∼ 5% | IIa-B |
| Combinado | 1.° | TN; fβ-HCG; PAPP-A | > 75% | ∼ 3% | IIa-B |
| Bioquímico (test doble) | 2.° | fβ-HCG; AFP | ∼ 60% | ∼ 5% | IIa-B |
| Bioquímico (test triple) | 2.° | fβ-HCG; AFP; uE3 | ∼ 60% | ∼ 5% | IIa-B |
| Bioquímico (test cuádruple) | 2.° | fβ-HCG; AFP; uE3; inhibina A | > 75% | ∼ 3% | IIa-B |
| Integrado | 1.° + 2.° | TN; PAPP-A y test cuádruple | ∼ 75% | ∼ 3% | IIa-B |
| Clasificación de las recomendaciones en función del nivel de evidencia (NE) disponible | |
| Ia | La evidencia científica procede a partir de meta-análisis de ensayos clínicos controlados y aleatorizados |
| Ib | La evidencia científica procede de al menos un ensayo clínico controlado y aleatorizado |
| IIa | La evidencia científica procede de al menos un estudio prospectivo controlado, bien diseñado y sin aleatorizar |
| IIb | La evidencia cientifica procede de al menos un estudio casi experimental, bien diseñado |
| III | La evidencia científica procede de estudios descriptivos no experimentales, bien diseñados como estudios comparativos, de correlación o de casos y controles |
| IV | La evidencia científica procede de documentos u opiniones de expertos y/o experiencias clínicas de autoridades de prestigio |
| Grados de recomendación | |
| A | Existe buena evidencia en base a la investigación para apoyar la recomendación. (Recoge los niveles de evidencia científica Ia y Ib) |
| B | Existe moderada evidencia en base a la investigación para apoyar la recomendación (Recoge los niveles de evidencia científica IIa, IIb y III) |
| C | La recomendación se basa en la opinión de expertos o en un panel de consenso. (Recoge el nivel de evidencia IV) |
Los Protocolos Asistenciales de la Sociedad Española de Ginecología y Obstetricia pretenden contribuir al buen quehacer profesional de todos los ginecólogos, especialmente los más alejados de los grandes hospitales y clínicas universitarias. Presentan métodos y técnicas de atención clínica aceptadas y utilizadas por especialistas en cada tema. Estos protocolos no deben interpretarse de forma rígida ni excluyente, sino que deben servir de guía para la atención individualizada a las pacientes. No agotan todas las posibilidades ni pretenden sustituir a los protocolos ya existentes en departamentos y servicios hospitalarios.
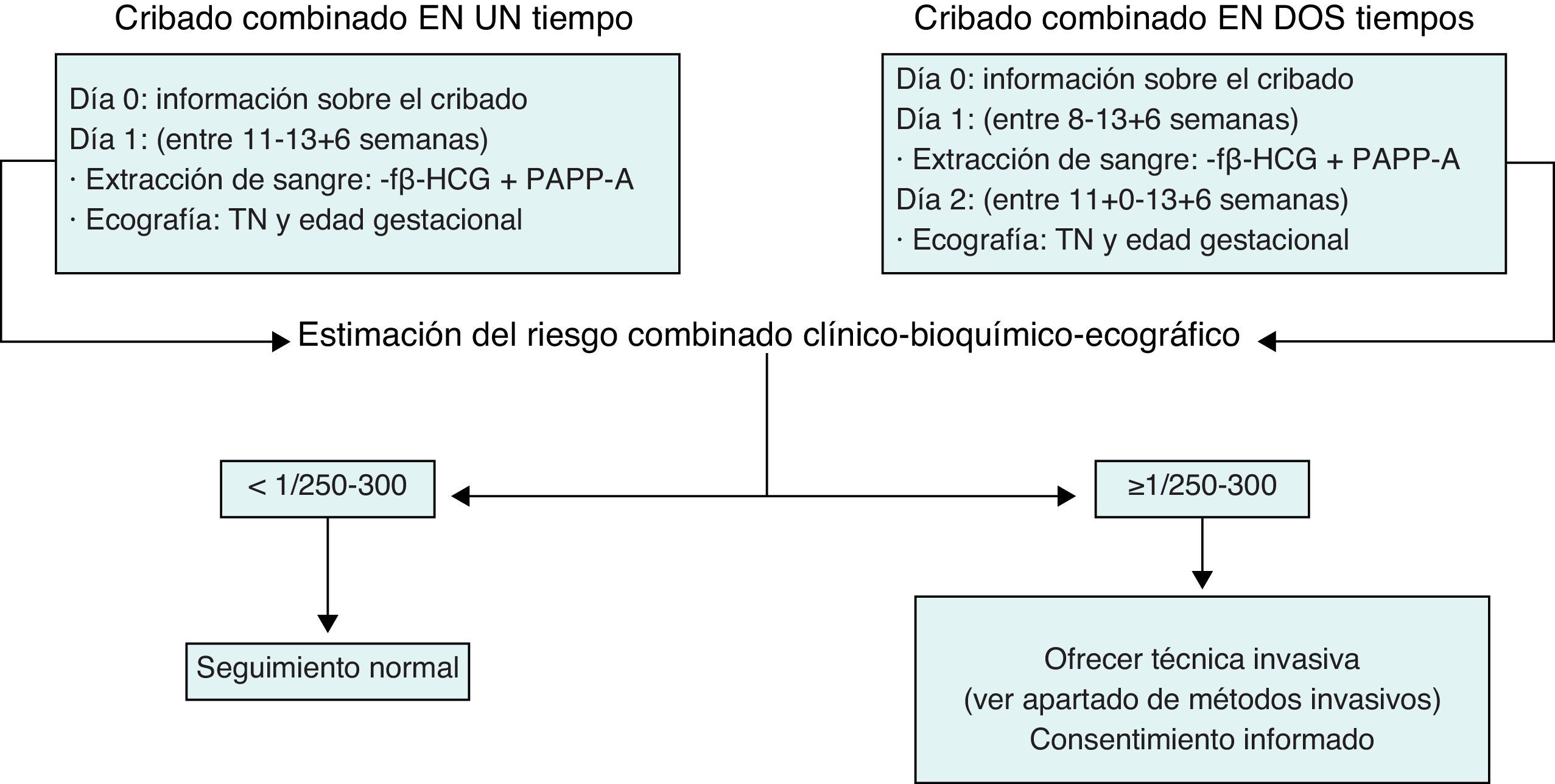
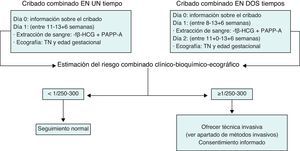
La propuesta de cribado más adecuada en la actualidad es el cribado combinado del i trimestre. Este cribado se aplica entre las semanas 8 y 13 (fig. 1). Puede realizarse en un solo tiempo (valoración ecográfica y bioquímica el mismo día) o en 2 tiempos (determinación bioquímica entre las 8-13 semanas y ecografía entre las 11 + 0 y la 13 + 6). Sus principales ventajas son su elevada sensibilidad y la precocidad con la que permite conocer qué gestaciones son de alto riesgo. De esta manera, abre la posibilidad tanto de aplicar técnicas invasivas de manera precoz, principalmente la biopsia corial (BC), como de interrumpir las gestaciones afectadas de manera precoz. Este cribado debe ser ofrecido a todas las gestantes, independientemente de su edad, puesto que la edad materna ya entra como variable en el programa de cálculo. De existir algún factor de riesgo preconcepcional que haga recomendable la realización de una técnica invasiva, la realización previa del cribado combinado, aunque es opcional, sí es recomendable dada la información que proporciona.
El cálculo del riesgo del cribado combinado del i trimestre se establece teniendo en cuenta los valores obtenidos en la determinación de los marcadores bioquímicos y el valor de la TN obtenida por ecografía. Tal y como se mencionaba anteriormente, el programa estadístico que realiza el cálculo debe tener en cuenta unos determinados factores de corrección: peso materno, consumo de tabaco, grupo racial-étnico de la madre, diabetes mellitus dependiente de la insulina, gestación gemelar, etc. Una vez introducida toda la información, el programa establece un índice de riesgo para trisomía 21. El punto de corte para recomendar un estudio invasivo se ha situado convencionalmente entre 1/250 y 1/300, habiéndose fijado en muchos centros en 1/270. Si el riesgo es ≥ 1/250-1/300 se considerará que la gestación es de riesgo elevado y se ofrecerá a la gestante la posibilidad de realizar una técnica invasiva para el diagnóstico de síndrome de Down. Por el contrario, si el riesgo es menor, se ofrecerá a la gestante el seguimiento ecográfico habitual y no se recomendará la realización de ninguna prueba invasiva.
Si el método de cribado es el combinado del i trimestre, no se han de tomar decisiones sobre la base de la TN de manera exclusiva, sino sobre la base de la combinación de la TN con el resto de la información, clínica y bioquímica.
Mención especial merece el cribado del i trimestre en las gestaciones gemelares. En este caso se valorará la TN de cada uno de los embriones. En las gestaciones bicoriales se establecerá un riesgo para cada embrión, mientras que en las monocoriales se calculará un solo riesgo (ya que se trata de gemelos monocigóticos), teniendo en cuenta la TN superior. La edad gestacional de toda gestación múltiple se establecerá sobre la base de la longitud céfalo-nalga superior, ya que en el i trimestre se considera posible una restricción precoz del crecimiento fetal, pero no una macrosomía. En caso de TN aumentada con cariotipo normal en una gestación monocorial, debe pensarse en un signo precoz de transfusión feto-fetal (TFF) y la gestación debe ser controlada exhaustivamente en busca de signos de TFF severa9,37.
Si la gestante consulta a partir de la semana 14 y hasta la semana 17, puede realizarse, si está disponible, un cribado bioquímico del ii trimestre34, que preferentemente estará constituido por el test cuádruple, dada su mayor eficacia. Es importante recordar en estos casos la relación existente entre niveles elevados de AFP en el suero materno y los defectos del tubo neural fetal. El rendimiento del resto de los programas, incluida la ecografía genética, no es lo suficientemente elevado como para depositar en ellos la decisión final de recomendar o no una técnica invasiva. Por ello, cuando a una gestante no se le haya podido hacer cribado combinado del i trimestre ni tampoco el cuádruple del ii trimestre, puede seguir considerándose la edad materna como criterio para indicar la realización de dicho estudio invasivo, quedando a criterio del centro el establecimiento del punto de corte (≥ 35 años vs. ≥ 38 años). En todos los casos, es esencial la adecuada datación ecográfica de la gestación puesto que ello influye de modo sustancial en la valoración de los marcadores bioquímicos.
Posteriormente, el riesgo de aneuploidía fetal en cada gestante será revaluado en el ii trimestre, al realizar la ecografía morfológica de la semana 20.
El hallazgo de una malformación estructural en dicha ecografía morfológica fetal puede hacer recomendable la realización de una técnica invasiva para estudio del cariotipo fetal, independientemente de cuál haya sido el resultado del programa de cribado al que la gestante haya sido sometida previamente.
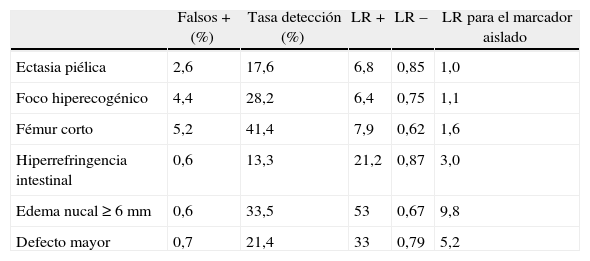
Sin embargo, el hallazgo aislado de marcadores ecográficos de cromosomopatía tales como engrosamiento nucal ≥6mm, hiperrefringencia intestinal (refringencia igual o superior a la de la columna), fémur corto (< percentil 5), ectasia piélica y foco hiperecogénico intracardíaco1,10-12, en una gestante sometida previamente a un programa de cribado sólido y fiable, no constituye indicación de estudio citogenético, sino que se recomienda tener en cuenta el riesgo estimado previamente y recalcular el riesgo a tenor de las likelihood ratios de cada uno de los marcadores (tabla 2). Cabe destacar que la ectasia piélica y el foco hiperecogénico intracardíaco presentan una likelihood ratio de 1 y que, por tanto, no modifican el riesgo previo de trisomía 21. Otra manera de recalcular el riesgo sería multiplicar el riesgo basal por 10 en el caso de 2 marcadores y por 115 en el caso de 3 o más marcadores. La ausencia de marcadores ecográficos, a su vez, reduce en un 0,4 el riesgo de trisomía 21. No obstante, si la paciente no ha sido sometida previamente a dicho programa de cribado, la identificación de estos marcadores del ii trimestre sí puede aconsejar la realización de una técnica invasiva.
Rendimiento diagnóstico de los marcadores ecográficos del ii trimestre
| Falsos + (%) | Tasa detección (%) | LR + | LR – | LR para el marcador aislado | |
| Ectasia piélica | 2,6 | 17,6 | 6,8 | 0,85 | 1,0 |
| Foco hiperecogénico | 4,4 | 28,2 | 6,4 | 0,75 | 1,1 |
| Fémur corto | 5,2 | 41,4 | 7,9 | 0,62 | 1,6 |
| Hiperrefringencia intestinal | 0,6 | 13,3 | 21,2 | 0,87 | 3,0 |
| Edema nucal ≥ 6 mm | 0,6 | 33,5 | 53 | 0,67 | 9,8 |
| Defecto mayor | 0,7 | 21,4 | 33 | 0,79 | 5,2 |
LR: likelihood ratio.
Es importante recordar que cuando el índice de riesgo calculado a través de un programa de cribado, independientemente de cuál sea este, señale que la probabilidad de aneuploidía fetal es baja, no debe considerarse que existe una contraindicación para la realización de la técnica invasiva. Esta se podrá realizar, si la pareja así lo desea, aunque en estos casos será especialmente importante advertirles que los riesgos de la misma superan a sus posibles beneficios.
Cribado prenatal del resto de las alteraciones cromosómicas fetalesTal y como comentábamos anteriormente, para estas no se dispone de programas específicos de cribado, residiendo su diagnóstico básicamente en la detección de malformaciones estructurales y/o marcadores en las diferentes ecografías realizadas a lo largo del embarazo. Así, por ejemplo, destaca la relación existente entre el higroma quístico y la monosomía XO, o entre el retraso del crecimiento precoz y la triploidía. Dado el elevado número de alteraciones cromosómicas fetales potencialmente detectables y la heterogeneidad de su expresividad ecográfica, la recomendación de realizar a una determinada gestante una técnica invasiva habrá de estar basada en una valoración individualizada en función de los hallazgos ecográficos, pudiendo ser relevante la contribución del genetista clínico.
Del mismo modo, la relación existente entre la edad materna y la presencia de alguna de estas anomalías cromosómicas, para las que no disponemos de programas de cribado como los anteriormente citados, puede hacer recomendable ofrecer estudio invasivo a aquellas gestantes ≥ 40 años, pues a partir de esta edad la probabilidad de que el feto tenga alguna anomalía cromosómica es comparable o superior al riesgo de pérdida fetal por la prueba invasiva38-41. En cualquier caso, la decisión final de realizar o no dicho estudio invasivo residirá en la gestante. No todos los programas de cribado que actualmente están en marcha en nuestro país (de diferentes hospitales o de distintas comunidades autónomas) contemplan esta posibilidad.
Información, asesoramiento y aspectos ético-legales en el diagnóstico prenatalTodas las gestantes tienen derecho a una información objetiva y clara sobre el riesgo de trisomía 21 y sobre las posibilidades actuales de las técnicas de diagnóstico prenatal. La información sobre las técnicas actuales de diagnóstico prenatal debe incluir sus indicaciones y sus riesgos específicos, así como sus posibles alternativas, y debe realizarse en la primera visita de la gestación. Sería recomendable proporcionar esta información por escrito.
Todas las gestantes deben ser informadas del resultado del test de cribado. Las que tengan un resultado positivo (alto riesgo de trisomía 21) deberán ser informadas de los pasos siguientes del proceso diagnóstico y de las características de las técnicas invasivas. En caso de detección de una cromosomopatía, la gestante deberá ser informada del significado y pronóstico de la alteración. La información deberá ser adecuada, respetando el deseo de la gestante sobre las posibilidades que el servicio sanitario les ofrece en relación con la continuidad de la gestación o bien la interrupción de la gestación de acuerdo con los supuestos que establece la ley. Si la gestante opta por la interrupción del embarazo, deberá recibir toda la información necesaria y firmar el consentimiento informado.
Técnicas invasivasLas técnicas invasivas permiten completar el diagnóstico de numerosas afecciones fetales y, por ello, su implantación en los países desarrollados es muy amplia. Por su carácter invasivo, no están exentas de complicaciones y conllevan cierto riesgo de interferir en la evolución de la gestación. Por tanto, es esencial seleccionar las gestaciones que pueden beneficiarse de su realización. A pesar de esta selección, aproximadamente el 5% de las gestantes recibirán la recomendación de someterse a una técnica invasiva. La indicación más común es el diagnóstico de las aneuploidías. Las técnicas invasivas más empleadas son la BC, la amniocentesis, fundamentalmente su forma clásica (AC) o del ii trimestre y la cordocentesis.
Experiencia del operadorAl igual que cualquier otra técnica, su práctica adecuada exige habilidad adquirida mediante experiencia. Diferentes estudios han analizado este aspecto y en todos se llega a la conclusión de que cuanto mayor sea la experiencia del operador, mayor es la tasa de éxito en la obtención de muestra adecuada en un primer intento, y menores las tasas de intentos fallidos y de pérdidas fetales42-49 (NE = III-B). También se ha constatado la relación inversa existente entre el número de procedimientos realizados en un centro y la tasa de pérdidas fetales50.
Para la realización de técnicas invasivas en diagnóstico prenatal son de crucial importancia los siguientes puntos:
- –
El operador debe adquirir los conocimientos necesarios y recibir el entrenamiento adecuado en el ámbito de instituciones avaladas por su trayectoria y casuística. No es posible fijar un número preciso y necesario de procedimientos supervisados que asegure que el especialista se considere competente para la práctica de las distintas técnicas invasivas. Obtener esta competencia es resultado del entrenamiento y de habilidades que pueden variar individualmente. Por ello, los centros de preparación, deben disponer de expertos en técnicas invasivas con un número mínimo de 100 técnicas invasivas al año, y contar con sistemas de entrenamiento y evaluación individual, cualificados y avalados por la administración sanitaria.
- –
Aunque no existe un criterio establecido de formación, la secuencia lógica en este proceso sería: 1) observación de procedimientos; 2) realización de técnicas bajo supervisión directa de un operador experimentado, y 3) realización sin supervisión en el propio centro con monitorización estricta de resultados.
- –
La monitorización de resultados debe incluir: índice de pérdidas fetales posprocedimiento, éxito en la obtención de muestra adecuada después de uno o 2 intentos, evaluación cuantitativa y cualitativa de las muestras y porcentaje de amniocentesis post-BC indicadas a causa de muestras inadecuadas.
- –
Mantener la práctica continuada en los distintos procedimientos. Tampoco es posible establecer el número mínimo de técnicas que deben practicarse al año para mantener la competencia, aunque, arbitrariamente, algunas instituciones lo han fijado en 3048,51.
Sería ideal disponer de un sistema de auditoría personal, de modo que el especialista que realice técnicas invasivas vea periódicamente evaluados sus resultados y complicaciones. Siempre se tendrá en cuenta la indicación de la técnica invasiva, porque en el contexto de determinadas anomalías fetales es esperable una mayor tasa de abortos espontáneos no relacionados con el procedimiento. Los centros en los que se realicen estas técnicas deberían disponer de un sistema operativo fiable de monitorización y registro de datos.
Biopsia corialConsiste en la extracción de una muestra de trofoblasto por vía transcervical (BC-TC) o transabdominal (BC-TA). Permite estudios citogenéticos, moleculares y bioquímicos52. La transición que ha experimentado en los últimos años el cribado prenatal de las aneuploidías desde el ii hasta el i trimestre de la gestación ha generado un incremento en la práctica de la BC, exigiendo más personal entrenado para su realización y más laboratorios preparados para el estudio citogenético en vellosidades coriales. En la actualidad se considera que es la técnica de elección cuando es necesario estudiar el cariotipo fetal antes de la semana 15 de gestación53.
Técnica: sus aspectos principales están resumidos en la tabla 351,54.
Principales aspectos técnicos de la biopsia corial y de la amniocentesis
| BC | AC | Cordocentesis | |
| Consentimiento informado | Obligatorio: debe constar: indicación del estudio y qué información se espera que proporcione, cómo, cuándo y por quién será realizada la técnica invasiva, tasas local y global de complicaciones de la misma, tasas de precisión diagnóstica del laboratorio y de fallos del cultivo, tiempo necesario para llegar al diagnóstico, forma de comunicar los resultados y qué signos o síntomas deben alertar a la paciente tras la prueba para buscar atención médica. Debe quedar copia en la historia clínica. Si la paciente de riesgo rechaza la técnica invasiva, debe firmar el documento de denegación | ||
| Edad gestacional idónea (semanas) | 10+0-14+6. Nunca antes de las 10+051 (NE = III-B) | ≥ 15+0. Nunca antes de las 15+051. (NE=Ib-A) | ≥ 20+0. En casos favorables ≥ 18+0 |
| Examen ecográfico previo | Localizar el máximo grosor corial, diseñando la estrategia de la BC | Localizar la placenta y las lagunas mayores y/o más accesibles de líquido amniótico y decidir la trayectoria de la punción | Localizar la inserción placentaria del cordón y decidir la trayectoria de la punción |
| Lugar | Son siempre procedimientos ambulatorios | ||
| Ruta | Transabdominal (BC-TA), transcervical (BC-TC) | Transabdominal | |
| Control | Ecográfico transabdominal continuo51 (grado de recomendación B) | ||
| Antibióticos antisepsia | No precisan profilaxis antibiótica, pero sí medidas antisépticas en el lugar de entrada o punción | ||
| Técnica | BC-TA: el operador maneja el transductor y la aguja y un ayudante realiza la aspiración de las vellosidadesBC-TC: el operador maneja la pinza y realiza la extracción del material mientras que el ayudante guía el procedimiento con ecografía | El operador maneja el transductor y la aguja y un ayudante aspira el líquido amniótico. Así aumenta la seguridad de la AC y disminuyen las contaminaciones hemáticas en comparación con las AC en las que el ligar de punción se elige con ecografía pero la aguja se introduce sin control ecográfico48,51,70 (NE = III-B) | El operador realiza la punción aspiración de la sangre mientras que otro ecografía guía el procedimiento con la ecografíaEl que realiza la punción mantiene el transductor coordinando los movimientos tanto de este como de la aguja y un ayudante realiza la aspiración de la sangre |
| Vía de acceso | Depende de la localización y accesibilidad del corion y de las preferencias del operador | Aunque la tasa de pérdidas fetales no aumenta, si la AC es transplacentaria, la placenta se atravesará, si no, existe otra opción mejor, haciéndolo por su parte más fina71 (NE = IIb-B) | Dependiendo de la ubicación de la placenta y de la inserción del cordón, la punción puede ser trans o extraplacentaria. El lugar ideal de punción es la vena umbilical, a 1 cm de la inserción placentaria |
| Material | BC-TA: pueden emplearse agujar sencillas (18 G, 20G) o dobles (17/19 G, 18/21 G), de 8-12 cm de longitud, y diferentes sistemas de aspiración o tracción de las vellosidades (presión negativa mediante jeringa o con sistema de vacío, pinza fórceps de biopsia)BC-TC: con pinza fórceps de biopsia o con cánula de aspiración | Aguja del calibre 20 o 22 G y entre 8-15 cm de longitudJeringas de 2-10 cc para aspiración | |
| Anestesia local | No es precisa, excepto para la BC-TA, sobre todo si se emplean las agujas de mayor calibre | ||
| Volumen de muestra | Comprobar in situ (mejor con microscopio) que hay suficientes vellosidades en el material extraído | 15-20 cc.1 cc LA/sem. de gestación10-15% del volumen total de LA | 2-4 cc. Comprobar que es sangre fetal (test de Kleihauer-Betke, hemograma-voumen corpuscular medio) |
| Éxito técnico | ∼ 99% en manos expertas. No hay diferencias significativas en el volumen de muestra entre la BC-TA y la BC-TC | ∼ 100% en manos expertas. Desechar el primer cc de LA no reduce las contaminaciones maternas de la muestra | ∼ 97% en manos expertas. La pureza de la muestra (evitando contaminación con LA o sangre materna) es esencial |
| Precaución | No repetir > 3 veces la introducción de la aguja/pinza ×10 la tasa de pérdidas fetales | Si el primer intento fracasa puede repetirse una vez más y si este fracasa, demorar la AC una semana y/o remitir la paciente a otro especialista más experto | Una vez que la aguja ha entrado en la cavidad amniótica pueden extraerse 15-20 cc de LA, asegurando así muestra biológica para el estudio. Tras retirar la aguja del cordón, monitorizar el lugar de punción hasta constatar el cese sangrado |
| Finalización | Limpieza y reaseptización de la zona | ||
| Reposo | Es recomendable mantener reposo relativo las primeras 24 h | ||
| Prodilaxis anti-D | En todas las pacientes Rh (–) con test de Coombs indirecto negativo (NE = Ia-A) | ||
AC: amniocentesis clásica; BC: biopsia corial.
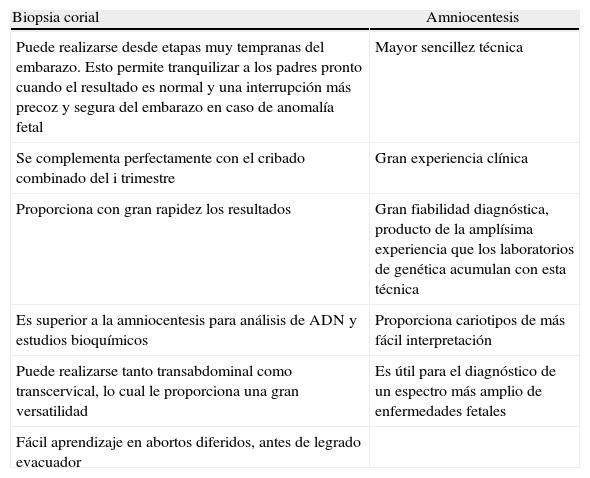
Ventajas: las más importantes aparecen reflejadas en la tabla 4.
Principales ventajas de la biopsia corial y de la amniocentesis
| Biopsia corial | Amniocentesis |
| Puede realizarse desde etapas muy tempranas del embarazo. Esto permite tranquilizar a los padres pronto cuando el resultado es normal y una interrupción más precoz y segura del embarazo en caso de anomalía fetal | Mayor sencillez técnica |
| Se complementa perfectamente con el cribado combinado del i trimestre | Gran experiencia clínica |
| Proporciona con gran rapidez los resultados | Gran fiabilidad diagnóstica, producto de la amplísima experiencia que los laboratorios de genética acumulan con esta técnica |
| Es superior a la amniocentesis para análisis de ADN y estudios bioquímicos | Proporciona cariotipos de más fácil interpretación |
| Puede realizarse tanto transabdominal como transcervical, lo cual le proporciona una gran versatilidad | Es útil para el diagnóstico de un espectro más amplio de enfermedades fetales |
| Fácil aprendizaje en abortos diferidos, antes de legrado evacuador |
Las técnicas de laboratorio aplicadas actualmente pueden ser el método directo (procesamiento inmediato) o semidirecto (incubación entre 24 h y 3 días), que estudian células ya en división presentes en el trofoblasto, o el cultivo largo, que genera células procedentes del mesénquima vellositario y que puede prolongarse entre 2 y 3 semanas.
El estudio realizado a partir de las vellosidades coriales proporciona un resultado válido en el 99% de los casos y tiene un elevadísimo grado de precisión, especialmente para el diagnóstico de las aneuploidías más comunes55,56. Solamente es preciso recurrir a otra técnica invasiva en el 1% de las BC, bien por contaminación materna, por fracaso del cultivo o por tener resultados citogenéticos ambiguos.
A pesar de que las muestras obtenidas en las BC son una mezcla de vellosidades coriales y decidua materna, la contaminación materna es poco frecuente y solo ocurre en el cultivo largo, ya que las células maternas pueden mostrar solo mitosis generadas en cultivo. La manipulación de las muestras por personal experto, que proceden a su limpieza y a la elección con microscopio de las vellosidades más nítidas, rechazando las pequeñas y los fragmentos atípicos, minimiza este problema57. Además, la detección de la contaminación materna en el laboratorio es sencilla y, por tanto, es excepcional que haya errores clínicos de relevancia por este problema.
La segunda fuente potencial de errores diagnósticos es la existencia de un mosaicismo confinado a la placenta. Esta discordancia es poco frecuente, observándose en el 1-2% de cultivos cortos y el 0,1% de cultivos largos. Los mosaicismos encontrados al analizar tejido mesenquimal cultivado de las BC (cultivo largo) tienen más probabilidades de ser un mosaicismo verdadero en el feto que los obtenidos en cultivo corto (directo o semidirecto). Su conocimiento ha permitido explicar algunos casos de pérdidas fetales y del retraso del crecimiento intrauterino. El mecanismo último por lo que esto sucede no está bien establecido y no se produce con todos los cromosomas pero, por ejemplo, cuando el cromosoma 16 es el implicado, en la mayoría de los casos tiene lugar un retraso grave y precoz del crecimiento58-60. Estos mosaicismos son confirmados en el feto en el 10-40% de los casos, dependiendo esta tasa del tejido analizado y del cromosoma involucrado. Los mosaicismos encontrados al analizar tejido mesenquimal cultivado de las BC tienen más probabilidades de ser un mosaicismo verdadero en el feto. Por otra parte, los mosaicismos que afectan a los cromosomas 13, 18 y 21 se confirman en el 19% de los casos, mientras que los que afectan a cromosomas cuyas alteraciones son más raras se confirman solo en el 3%. En cualquier caso, cuando se diagnostique un mosaicismo tras el análisis del material cultivado, debe ofrecerse una AC que, en la mayoría de los casos, informará del cariotipo real del feto. No obstante, con la AC también cabe la posibilidad de encontrar resultados falsos positivos y falsos negativos. Dadas estas limitaciones, en todos estos casos debe realizarse una ecografía minuciosa, que puede avalar el diagnóstico del mosaicismo al revelar anomalías compatibles con la cromosomopatía detectada. En última instancia, puede ofrecerse la posibilidad de analizar la sangre fetal obtenida por cordocentesis.
Riesgos- –
El principal riesgo es la pérdida de la gestación. Desafortunadamente, no hay estudios que comparen las pérdidas en un grupo sometido a BC con las de un grupo control de gestantes no sometidas a ninguna técnica invasiva. La mayor parte de los estudios han comparado la BC frente a la AC. En este sentido, para evitar el sesgo que se introduce al comparar las técnicas que se realizan a diferente edad gestacional, es importante el reclutamiento de las pacientes de cada grupo en un momento de la gestación previo al de la realización de la BC para después comparar la tasa total de pérdidas en cada grupo, incluyendo tanto las espontáneas como las inducidas por la técnica y por un resultado citogenético desfavorable. Así se han realizado amplios estudios prospectivos donde no se han encontrado diferencias significativas en las pérdidas tras la BC y la AC, situándose en ambos casos en una pérdida fetal cada 100-150 procedimientos (NE = Ib-A). La conclusión razonable sería que la BC, tanto BC-TA como BC-TC, y la AC son técnicas igualmente seguras y sus pérdidas fetales son similares50,61-64, siempre y cuando estén realizadas por personal experimentado54 (grado de recomendación B).
- –
Es importante destacar que la curva de aprendizaje para realizar una BC con el menor riesgo es significativa (esta curva parece estabilizarse a partir de los 175 procedimientos)49, especialmente para la BC-TC y, por ello, los riesgos de estas técnicas, BC y AC, solo se igualan en centros con experiencia44,47. Esto es lo que ha llevado a algunos autores a seguir considerando que, si el grado de experiencia no es similar, la BC tiene un riesgo ligeramente superior a la AC51 (NE = Ib-A).
- –
La infección aguda después de una BC es rara, menor del 0,5%65. No existen diferencias entre la BC-TC y la BC-TA. Si hay una infección vaginal activa en el momento de la BC-TC, debe demorarse el procedimiento o recurrirse a la BC-TA.
- –
Tras una BC-TC es común (32%) la existencia de una pérdida hemática que suele ser escasa y solo en el 7-10% es significativa. En la inmensa mayoría de los casos es un sangrado autolimitado. Esta complicación es mucho más rara con la BC-TA.
- –
Aunque se ha atribuido a la BC la aparición de síndromes oromandibulares o de anomalías musculoesqueléticas o reduccionales de los miembros66-68, la BC no se asocia a la aparición de esta enfermedad fetal cuando se realiza después de la semana 9 + 0 de gestación, por lo que no debe practicarse antes de esta semana (NE = III-B).
Gestantes con infección crónica, como hepatitis B, hepatitis C o VIH: No hay suficiente información referente al riesgo de transmisión vertical al feto tras una BC cuando la madre es portadora del antígeno de superficie de la hepatitis B o en mujeres positivas para la hepatitis C. Para el VIH, se ha comprobado que la BC no aumenta el riesgo de transmisión vertical cuando la paciente recibe tratamiento antirretroviral69. Dada la escasa información disponible del riesgo de las técnicas invasivas en estas pacientes, especialmente para la BC, es recomendable en todas estas situaciones extraer la máxima información proporcionada por los métodos no invasivos antes de indicar la realización y elección de una técnica invasiva, cuyas ventajas y riesgos habrán de ser detenidamente discutidos con la pareja.
Gestación múltiple: se precisa un operador experto que evalúe correctamente la variedad y localización de las placas coriales, y asegure que toma muestras individuales de cada una.
AmniocentesisSe distinguen 2 tipos: la precoz (AP) o del i trimestre, que se realiza entre las semanas 11 y 14 + 6, y la clásica (AC) o del ii trimestre, que se realiza de la semana 15 + 0 en adelante.
Técnica: sus aspectos principales están resumidos en la tabla 348,51,70-72.
En la AP con frecuencia hay que atravesar el espacio celómico, con el amnios y el corion aún no fusionados, lo que dificulta la llegada a la cavidad amniótica; la punta de la aguja rechaza el amnios sin perforarlo. Para evitar esta dificultad, denominada «efecto de tienda de campaña», es recomendable un golpe seco que suele facilitar la perforación del amnios.
Entre las dificultades técnicas destacan la obesidad de la paciente, la falta de fusión del amnios, la retroposición uterina y la interposición de asas intestinales. En estos casos, basta con demorar la punción 2 o 3 semanas para que sea técnicamente posible su realización.
Ventajas: las más importantes aparecen reflejadas en la tabla 4.
Fiabilidad del diagnóstico citogenético- –
La eficacia de la AC ha sido demostrada en varios estudios multicéntricos en los que se ha comprobado que la precisión diagnóstica está por encima del 99%65,73.
- –
Son raros los fracasos de cultivo, complicación cuya frecuencia se sitúa en la mayoría de los laboratorios con experiencia por debajo del 1%. La tasa de mosaicismos es menor que para la BC y se sitúa alrededor del 0,25%, pero la mayoría (70%) se confirma en el feto65.
- –
Para la AP la tasa de éxitos con la primera punción oscila entre el 98-100% y su fiabilidad diagnóstica es comparable a la de la AC74-76.
- –
La tasa de pérdidas fetales clásicamente atribuida al procedimiento ha sido del 1%. Sin embargo, esta cifra procede de un estudio realizado en una etapa anterior al uso de la ecografía de alta resolución y, por tanto, debería ser revisada. A pesar de ello, este dato numérico, fácil de memorizar, sigue siendo muy utilizado hoy en día al informar de los riesgos de una AC.
En cualquier caso, probablemente lo primero que se debería hacer sería definir qué se entiende por pérdida fetal atribuible a la amniocentesis. Y en este sentido destaca la ausencia de consenso, de modo que en algunas series se contabilizan las pérdidas habidas en las primeras 2 semanas post-AC, en otras las 4 primeras, en otras las habidas hasta la semana 20 o hasta la 28 y, en otras, todas, incluidas las neonatales. Con los 2 primeros puntos de corte, podrían no contabilizarse pérdidas ocurridas entre las semanas 20 y 22, momento en el cual se ha podido comprobar que se acumulan algunas pérdidas fetales tanto espontáneas como post-AC, producto probablemente de un proceso infecto-inflamatorio77-79. Del mismo modo, algunos estudios contemplan solo las pérdidas espontáneas y otros incluyen todas, también las inducidas o voluntarias.
En una reciente revisión sistemática, que también enfatiza estas dificultades y que incluye artículos publicados mayoritariamente en la última década, se observa que la AC se acompaña de una tasa de pérdidas en los primeros 14 días post-AC del 0,6% (IC del 95%, 0,5-0,7), que asciende hasta el 0,9% (IC del 95%, 0,6-1,3) si se incluyen las pérdidas hasta la semana 24 y hasta el 1,9% (IC del 95%, 1,4-2,5), si se incluyen todas las pérdidas fetales61. En el único estudio en que se ha comparado una población sometida a AC con un grupo control no sometido a técnica invasiva, se ha comprobado que el riesgo de pérdida fetal asociado a la AC es inferior al 176. Esta afirmación es sólida, dado el número de pacientes reclutadas y se correlaciona bien con los resultados de la mayoría de los estudios recientes y que atribuyen a la AC un aumento en la probabilidad de pérdida fetal entre el 0,6 y el 0,8%, es decir, una pérdida fetal cada 125-175 procedimientos, pero que puede ser tan baja como del 0,2% (1/500) o tan alta como del 1,5% (1/67), sobre la base de los IC observados64,65,70,76-85. La variabilidad en los criterios empleados en los diferentes estudios explica este rango.
En cualquier caso, a pesar de esta disparidad de criterios, se puede concluir que la AC tiene un elevado índice de seguridad51 (NE = Ib-A).
El riesgo de pérdida fetal está condicionado por muchos factores, relacionados tanto con características de la gestación como del procedimiento en sí (tabla 5)43,72,75,83,86-93. Esto debería llevar a intentar establecer en cada gestación el riesgo individualizado de pérdida tras una AC, riesgo del que, evidentemente, la pareja debería ser informada antes de la prueba.
Factores de riesgo de pérdida fetal tras una amniocentesis
| Factor de riesgo | Resultado |
| Edad materna ≥ 40 vs. 35 años89,91 | RR = 2,03 (IC del 95%, 1,26-3,33) |
| Edad paterna ≥ 40 vs. 25-29 años90 | RR = 1,6 (IC del 95%, 1,2-2,0) |
| Enfermedades maternas coincidentes con la gestación | |
| Metrorragia previa durante la gestación91 | RR = 2,4 (IC del 95%, 1,69-3,42) |
| Abortos espontáneos o inducidos previos87,91 | RR = 3,03 (IC del 95%,1,92-4,79) |
| Embarazo gemelar expuesto a AC vs. gemelar no expuesto105 | RR = 2,42 (IC del 95%, 1,24-4,74) |
| Gestación única obtenida por FIV vs. espontánea86,88 | RR = 1,68 (IC del 95%,1,11-2,55) |
| Existencia de marcadores ecográficos de cromosomapatía78 | RR = 4,9 (IC del 95%, 3,2-7,6) |
| Experiencia del operador (< 10 AC/año vs. > 50 AC/año)43,72 | 3,7% vs. 0,3% |
| Punción hemática85 | RR = 6,48 (IC del 95%, 1,91-21,96) |
| Feto femenino85 | RR = 2,39 (IC del 95%, 1,34-4,25) |
| Aspiración de líquido amniótico pardusco78,92 | RR = 5,9 (IC del 95%, 3,2-10,9) |
AC: amniocentesis.
La tasa de pérdidas fetales asociadas a la AP, que triplica la asociada a la BC y a la AC, impiden considerarla una alternativa válida a la BC y aquellos centros en los que no se oferte la BC deben reservar la AP solo para casos excepcionales, informando a la pareja de sus potenciales riesgos y complicaciones74,75,94,95 (NE = Ib-A).
- –
El 1-2% de las mujeres tienen una pequeña pérdida hemática o de líquido amniótico en los días siguientes a la amniocentesis. En la mayoría de los casos la amniorrea es transitoria y cede en pocos días. La supervivencia perinatal en estos casos es superior al 90%96. El desarrollo de una corioamnionitis es rara (< 1/1.000). Las hemorragias francas post-AC son excepcionales.
- –
La tasa de malformaciones en fetos sometidos a una amniocentesis es similar a la de la población general. Sin embargo, cuando existe una pérdida de líquido amniótico postamniocentesis y su normalización se demora unas semanas, existe un aumento en la incidencia de pies equino-varos y luxaciones congénitas de cadera. De hecho, la mayor frecuencia de pérdidas de líquido amniótico tras una AP, en ocasiones subclínicas, permite explicar que tras una AP sea 10 veces mayor la tasa de pies equino-varos (1,4%)65,75,97 y también en comparación con la BC (18% vs. 0,2%; RR = 6,43; IC del 95%, 1,68-24,64).
En un reciente y amplísimo estudio sueco se ha podido constatar también cómo la AP realizada por debajo de la semana 14 + 0 aumenta significativamente el riesgo de anomalías musculoesqueléticas como la luxación de cadera, rodilla o artrogriposis congénita (RR = 1,34; IC del 95%, 1,02-1,76) y anomalías posturales de los pies (RR = 1,76; IC del 95%, 1,11-2,80), complicaciones que no suceden con la BC, aunque ambas, AP y BC, se realizan en el mismo período, con lo que es la invasión de cavidad amniótica y la retirada de líquido amniótico lo que altera el normal desarrollo de los miembros inferiores. En este mismo estudio se observó que la AP realizada en la semana 14 aumenta el riesgo de complicaciones respiratorias en el recién nacido (RR = 1,21; IC del 95%, 1,06-1,39), probablemente por interferir en el crecimiento y/o el desarrollo pulmonar98. Por todo ello, a pesar de las ventajas que en términos de precocidad diagnóstica ofrece la AP, sus numerosas limitaciones han llevado a desaconsejar formalmente su empleo (NE = Ib-A).
- –
En algunos casos puede plantearse la necesidad de realizar una amniocentesis en el iii trimestre. No incrementa el riesgo de complicaciones graves, aunque son más frecuentes las punciones fallidas y las contaminaciones hemáticas99,100 (NE = IIb-B).
- –
Aunque teóricamente podría producirse una lesión fetal directa con la aguja durante una amniocentesis, su realización bajo control ecográfico continuo hace que esta posibilidad sea absolutamente excepcional, existiendo solo algunos casos aislados descritos70.
- –
Por último, la amniocentesis también se ha relacionado con un discreto aumento en la aparición de complicaciones del iii trimestre de la gestación como parto pretérmino (RR = 1,5), rotura prematura de membranas u oligohidramnios (RR = 1,2), probablemente a través de un mecanismo infecto-inflamatorio o una pérdida subclínica y mantenida de líquido amniótico101,102.
Gestantes con infección crónica, como hepatitis B, hepatitis C o VIH: aunque la experiencia acumulada es todavía limitada, puede considerarse que el riesgo de transmisión vertical al feto de los virus B o C tras una AC realizada a gestantes con hepatitis B o C crónica es muy bajo y, por ello, estas infecciones no suponen una contraindicación formal para la realización de una AC. Por el contrario, en las gestantes con VIH que no reciben tratamiento antirretroviral la AC sí aumenta el riesgo de transmisión vertical al feto93, cosa que no sucede cuando la paciente sí recibe dicha terapia69 y la carga viral es baja103 En cualquier caso, y como se decía para la BC, en estas pacientes es recomendable extraer la máxima información posible de los métodos no invasivos antes de indicar la realización y elección de una técnica invasiva, cuyas ventajas y riesgos habrán de ser detenidamente discutidos con la pareja.
Gestación múltiple: plantea unos retos específicos al tener no solo que hacer más de una punción, sino también tener que asegurar que todos los fetos son estudiados y que las muestras obtenidas son correctamente asignadas. Esta asignación es fácil cuando los fetos son discordantes en anatomía, biometría y/o sexo, pero puede ser extremadamente difícil si no se tiene la precaución de tomar otras referencias topográficas fetales y/o placentarias en el momento de hacer la AC o la BC104.
Por ello, las técnicas invasivas en gestaciones múltiples deberían quedar reservadas para aquellos especialistas dispuestos a asumir los resultados del estudio, es decir, que estén preparados y dispuestos a hacer una terminación fetal selectiva cuando el resultado del estudio es desfavorable.
La tasa de pérdidas gestacionales tras una amniocentesis realizada en una gestación gemelar es del 3,5%, superior por tanto a la existente para gestaciones únicas. En una reciente revisión sistemática se ha constatado que, en comparación con gestaciones gemelares no expuestas a la amniocentesis, la realización de la misma en un embarazo gemelar incrementa el riesgo de pérdida fetal antes de la semana 24 (RR = 2,42; IC del 95%, 1,24-4,74)105. Esta mayor tasa de pérdidas fetales tras una amniocentesis en un embarazo gemelar es producto tanto de la mayor complejidad técnica, como del mayor número de punciones (al menos una por saco).
Una vez reconocida la membrana de separación entre los diferentes sacos, se elige el punto de entrada en cada saco y se procede a la punción, no siendo necesaria la introducción de contraste en el primero de los sacos amnióticos para estar seguros de que ambos son puncionados. En algunos casos, una vez extraída la primera muestra, puede atravesarse la membrana intergemelar y penetrar en el otro saco, con lo que se obtienen las 2 muestras con una sola punción. En el caso de las gestaciones monocoriales sin discordancia anatómica entre los fetos, sería suficiente con estudiar el cariotipo de uno de ellos. Por ello, resulta esencial establecer la corionicidad de la gestación, algo que puede conseguirse con una fiabilidad próxima al 100% cuando se realiza antes de la semana 14105. Cuando en una gestación monocorial los fetos son discordantes anatómicamente (uno tiene una malformación y el otro no), debe estudiarse el cariotipo de ambos, ya que existe la posibilidad de que también sean discordantes para este.
CordocentesisEs el método más utilizado para la obtención de sangre fetal.
Técnica: sus aspectos principales están resumidos en la tabla 351.
DificultadesVienen dadas por la edad gestacional, por las características del embarazo, de la madre y del operador, siendo la técnica invasiva más difícil. Cuando la placenta está en la cara posterior y el feto tapa la inserción placentaria, puede ser imposible su realización, más aún si existe poco líquido amniótico, aunque en estos casos puede intentarse la punción en un asa libre o en la inserción fetal del cordón.
Otra opción es la punción de la vena umbilical en su trayecto intrahepático. Técnicamente, es más compleja que la punción del cordón propiamente dicho pero aporta 3 ventajas: en primer lugar, se evita la punción de las arterias umbilicales. En segundo lugar, la sangre obtenida es, con toda seguridad, de origen fetal mientras que cuando se punciona la inserción placentaria del cordón en ocasiones se extrae sangre materna.
Por último, el sangrado pospunción tiene lugar en la cavidad abdominal del feto y el peritoneo puede reabsorber esta sangre, evitando la anemización fetal tras hemorragias cuantiosas. No obstante, la tasa de pérdidas fetales es algo superior a la punción del cordón y por ello es de segunda elección106.
La punción del cordón puede resultar imposible en el ii trimestre en mujeres muy obesas y más aún si la placenta es posterior. En estos casos, la cardiocentesis puede ser una alternativa válida, siendo preferible puncionar el ventrículo derecho. Su tasa de pérdidas fetales es superior a la de la cordocentesis. Estas dificultades se presentan también si existe un polihidramnios, facilitando mucho la cordocentesis la realización de un amniodrenaje.
IndicacionesLa posibilidad de acceder al territorio vascular fetal abre la posibilidad de diagnosticar numerosas entidades (tabla 6). Sin embargo, el desarrollo de las nuevas técnicas de biología molecular ha hecho posible diagnosticar muchas de estas enfermedades utilizando vellosidades coriales o líquido amniótico. Ello permite hacer diagnósticos más precozmente dado que no es posible obtener sangre fetal antes de la semana 18 y, por otro lado, mayor facilidad técnica para realizar una BC o una AC que una cordocentesis. Por último, la sensibilidad diagnóstica para algunas entidades es superior en el líquido amniótico que en la sangre fetal107.
Entidades que pueden ser diagnosticadas mediante el acceso al territorio vascular fetal mediante cordocentesis
| Estudio cromosómico |
| Diagnóstico de infecciones |
| Toxoplasmosis |
| Rubéola |
| CMV |
| Varicela |
| Parvovirus B19 |
| Diagnóstico de la anemia |
| Origen inmunológico |
| Origen no inmunológico |
| Infección por parvovirus B19 |
| Síndrome transfusión gemelo-gemelo |
| Hemorragia feto-materna |
| Hemorragia fetal intracraneal |
| Trastornos mieloproliferativos fetales |
| α-talasemia |
| Síndrome de Kassabach-Merrit |
| Síndrome de Blackfan-Diamond |
| Síndrome de Aase |
| Déficit de piruvato-cinasa |
| Déficit de glucosa-6-fosfato deshidrogenasa |
| Déficit de glucosa fosfato isomerasa |
| Estudio de las coagulapatías |
| Hemofilias A y B |
| Enfermedad de von Willebrand |
| Déficit de factores de coagulación |
| Estudio de las inmunodeficiencias |
| Inmunodeficiencias combinadas severas |
| Enfermedad granulomatosa crónica |
| Síndrome de Chediak Higashi |
| Ataxia telangiectasia |
| Déficit homocigoto C3 |
| Estudio de las alteraciones plaquetarias |
| Trombocitopenia aloinmunitaria |
| Trombocitopenia autoinmunitaria |
| Otras |
| Hipercolesterolemia familiar |
| Hierfenilalaninemia |
| Síndrome de Farber |
Sin embargo, desde el punto de vista diagnóstico, la cordocentesis aporta un matiz cualitativamente muy importante cuando lo que se pretende es estudiar el grado de afectación fetal en gestaciones en las que hay un riesgo de trastorno hematológico fetal (anemias, trombopenia), en cuyo caso la sangre fetal es una fuente insustituible de información.
La mayoría de las cordocentesis siguen haciéndose para el estudio del cariotipo fetal cuando, por el motivo que sea, la sospecha de cromosomopatía se establece tardíamente. Aunque este estudio puede hacerse también tanto en el líquido amniótico como en vellosidades, la sangre fetal proporciona resultados completos en un menor espacio de tiempo. En otras ocasiones, la sangre fetal puede permitir resolver dudas diagnósticas generadas tras una BC o una AC, tal y como se comentó en apartados previos, dado que la seguridad diagnóstica que proporciona el análisis de la sangre fetal es, sin duda, mayor que la de las vellosidades coriales y el líquido amniótico.
ComplicacionesEn manos expertas la tasa de pérdidas fetales no difiere significativamente de la del resto de las técnicas invasivas y oscila entre el 1 y el 3%108-110. La situación fetal precordocentesis es muy importante, de modo que cuanto más precario sea el grado de bienestar fetal, mayor es la probabilidad de pérdida fetal. Es muy común (> 80%) que se produzca una hemorragia en la zona de punción, cuya duración por lo general oscila entre 15 y 120 s. La hemorragia cede prácticamente siempre espontáneamente y son excepcionales las muertes producidas por la misma. La hemorragia es más común y prolongada cuando el vaso puncionado es la arteria umbilical.
La bradicardia es también frecuente y puede llegar a ser inferior a 50 lpm. Una complicación grave pero poco frecuente es la trombosis del vaso puncionado que, al igual que los hematomas acumulados en la gelatina de Wharton, puede comprometer la circulación de los vasos funiculares. Otras complicaciones, como la infección o el abruptio placentae, son excepcionales. La cordocentesis no se asocia a un aumento del riesgo de parto pretérmino.Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Publicado con la autorización de la Sociedad Española de Ginecología y Obstetricia (SEGO) (www.sego.es) (junio 2012).
Elaborado por Miembros de la Sociedad Española de Ginecología y Obstetricia (SEGO): Elena Carreras, Alberto Fortuny, Rafael González de Agüero, Carlos López Ramón y Cajal y Alberto Galindo.