Comprobar la eficacia de la incorporación de la inhibina A en el cribado de segundo trimestre del síndrome de Down en términos de tasa de detección y porcentaje de cribados positivos.
MétodosEstudio retrospectivo de 3.380 embarazadas, que se sometieron al cribado de segundo trimestre, clasificadas en 2 grupos en función de la incorporación de la inhibina A (1.921 mujeres) o no (1.459 mujeres)
ResultadosLa tasa de detección con un punto de corte de 1:250 fue del 90% en el grupo de inhibina A y 84,6% sin inhibina A, pero con un porcentaje de cribados positivos significativamente menor en el primero (11 vs. 15,9%; p < 0,001). Este concepto también se refleja al comparar el likelihood ratio positivo entre ambos grupos (8,47 vs. 5,54; p <0,001)
ConclusiónEs aconsejable la incorporación de la inhibina A en el cribado de segundo trimestre, ya que se observa un menor porcentaje de casos positivos, con la consiguiente reducción en el número de amniocentesis a realizar.
To evaluate the efficacy of inhibin A in second trimester screening of Down's syndrome in terms of detection rate and percentage of positive results.
MethodsA retrospective study of 3380 pregnant women who underwent second trimester screening, classified into 2 groups, one which included inhibin A (1921 pregnant women) and one that did not (1459 pregnant women)
ResultsThe detection rate (cut-off: 1:250) was 90% in the group with inhibin A and 84.6% in the other group, but the percentage of positive results was significantly lower in the first group (11% vs. 15.9%, P<.001). The results were similar if we compared the positive likelihood ratio between groups (8.47 vs. 5.54, P<.001).
ConclusionInhibin A is a useful marker in second trimester screening due to the low percentage of positive cases observed, thereby reducing the number of amniocentesis.
Existe un patrón específico en las concentraciones de diversos analitos en el suero de las mujeres embarazadas de un feto afecto de síndrome de Down1–4. En el segundo trimestre del embarazo, la combinación de la edad materna con la concentración expresada en múltiples de la mediana (MoMs) de alfa-fetoproteína (AFP), estriol no conjugado (E3), y gonadotrofina coriónica humana (hCG) detecta las embarazadas con mayor riesgo de tener un feto con síndrome de Down1–4. La validez de este triple test se ha probado en múltiples estudios, obteniendo sensibilidades de alrededor del 70-80% y tasas de falsos positivos de alrededor del 10%1,3–7.
La incorporación de la inhibina A (InhA) en el cribado de segundo trimestre la propusieron por primera vez Van Lith et al.8. Estudios posteriores parecen mostrar que su incorporación mejora la tasa de detección y reduce los falsos positivos3,4,7–19.
El objetivo de este artículo es mostrar nuestra experiencia en el cribado de segundo trimestre de 3.366 mujeres, comparando los resultados entre aquellas a las que se les incluyó la InhA (1.923) y aquellas a las que no (1.459).
MétodosSe ha llevado a cabo un análisis retrospectivo de todas las mujeres embarazadas, visitadas en la región de Barcelona durante el año 2010, a las que se les realizó un cribado de síndrome de Down de segundo trimestre por presentarse entre 14 y 20 semanas de gestación en el momento del cribado. No se observaron diferencias estadísticamente significativas entre ambos grupos en la media de edad (29,4 vs. 29,3 años), peso (66,4 vs. 65,1kg), etnia (caucásicas: 59,7% vs. 61,2%) ni porcentaje de fumadoras (9,4% vs. 8,8%) entre los grupos con InhA o sin ella, respectivamente.
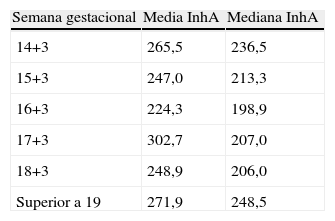
AFP, E3 y hCG en suero se determinaron mediante el inmunoensayo Delfia Xpress 6000 (Perkin Elmer, Walham, MA, EE.UU.) y la InhA mediante el inmunoensayo Inhibina A ELISA (Beckman Coulter, Brea, CA, EE:UU) en el analizador automático BEST 2000 (Biokit, Barcelona, España). En la tabla 1 se puede observar la distribución de la InhA en función de la semana gestacional.
Los resultados se ajustaron mediante el programa informático LifeCycle.ADP vs. 3.1 (Perkin Elmer, Walham, MA, EE.UU.) según la edad, el peso y la raza materna con el fin de obtener un riesgo de síndrome de Down. A las mujeres con un riesgo igual o mayor de 1:250 se les propuso la realización de un estudio citogenético del líquido amniótico obtenido por amniocentesis.
El análisis estadístico se llevó a cabo mediante el programa informático SPSS 15.0 (SPSS Inc, Chicago, IL, EE.UU.). Se usó el estadístico t-Student para la comparación de medias y el chi-cuadrado con la correción de Fisher para la comparación de porcentajes. Un valor de p<0,05 fue considerado estadísticamente significativo.
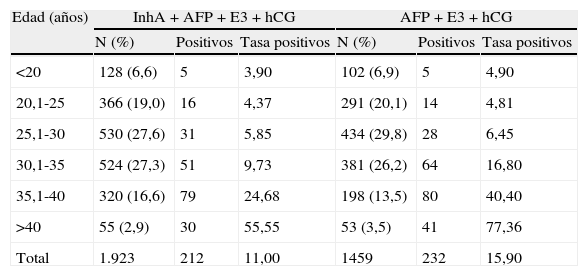
ResultadosDe las 3.380 mujeres a las que se les realizó el cribado de segundo trimestre, a 1.923 se les hizo el cuádruple test incluyendo la InhA, mientras que a 1.459 se les estimó el riesgo de síndrome de Down incluyendo la AFP, E3 y hCG. La distribución por razas fue equitativa entre los diferentes grupos con los siguientes porcentajes: 62,2% caucásica; 16,3% magrebí; 9,7% afro-caribeña; 5,9% oriental y 5,9% otras. En la tabla 2 podemos observar la distribución por edades de la tasa de positivos entre los grupos según los marcadores serológicos usados en la estimación del riesgo de síndrome de Down.
Distribución por edades de la tasa de positivos en función del uso de inhibina A en el cribado de segundo trimestre
| Edad (años) | InhA + AFP + E3 + hCG | AFP + E3 + hCG | ||||
| N (%) | Positivos | Tasa positivos | N (%) | Positivos | Tasa positivos | |
| <20 | 128 (6,6) | 5 | 3,90 | 102 (6,9) | 5 | 4,90 |
| 20,1-25 | 366 (19,0) | 16 | 4,37 | 291 (20,1) | 14 | 4,81 |
| 25,1-30 | 530 (27,6) | 31 | 5,85 | 434 (29,8) | 28 | 6,45 |
| 30,1-35 | 524 (27,3) | 51 | 9,73 | 381 (26,2) | 64 | 16,80 |
| 35,1-40 | 320 (16,6) | 79 | 24,68 | 198 (13,5) | 80 | 40,40 |
| >40 | 55 (2,9) | 30 | 55,55 | 53 (3,5) | 41 | 77,36 |
| Total | 1.923 | 212 | 11,00 | 1459 | 232 | 15,90 |
AFP: alfa-fetoproteína; E3: estriol no conjugado; hCG: gonadotrofina coriónica humana; InhA: inhibina A.
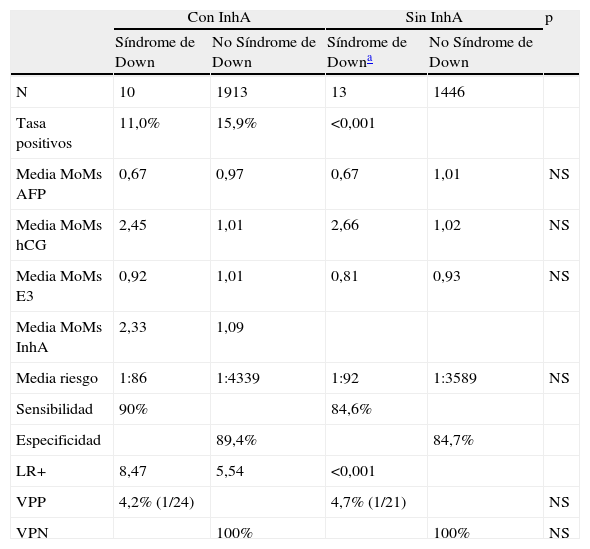
En la tabla 3 se puede observar cómo, con un punto de corte de 1:250, la tasa de detección al incluir la InhA es ligeramente superior. La principal diferencia se encuentra en la tasa de positivos, significativamente menor (p <0,001) al incluir InhA. Todo ello conlleva un significativamente mayor likelihood ratio+ en el grupo con InhA, lo que refleja la mejor sensibilidad y especificidad que implica su inclusión.
Resumen de los resultados del cribado de segundo trimeste según se use o no la inhibina A
| Con InhA | Sin InhA | p | |||
| Síndrome de Down | No Síndrome de Down | Síndrome de Downa | No Síndrome de Down | ||
| N | 10 | 1913 | 13 | 1446 | |
| Tasa positivos | 11,0% | 15,9% | <0,001 | ||
| Media MoMs AFP | 0,67 | 0,97 | 0,67 | 1,01 | NS |
| Media MoMs hCG | 2,45 | 1,01 | 2,66 | 1,02 | NS |
| Media MoMs E3 | 0,92 | 1,01 | 0,81 | 0,93 | NS |
| Media MoMs InhA | 2,33 | 1,09 | |||
| Media riesgo | 1:86 | 1:4339 | 1:92 | 1:3589 | NS |
| Sensibilidad | 90% | 84,6% | |||
| Especificidad | 89,4% | 84,7% | |||
| LR+ | 8,47 | 5,54 | <0,001 | ||
| VPP | 4,2% (1/24) | 4,7% (1/21) | NS | ||
| VPN | 100% | 100% | NS | ||
AFP: alfa-fetoproteína; E3: estriol no conjugado; hCG: gonadotrofina coriónica humana; InhA: inhibina A; LR+: likelihood ratio + (S/(1+E)); NS: no significativo; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
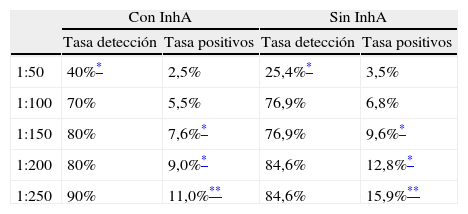
En la tabla 4 se observa que la tasa de detección es similar hasta puntos de corte de 1:100, pero significativamente superior (p<0,05) si usamos un punto de corte de 1:50. La tasa de positivos es inferior en el grupo con InhA independientemente del punto de corte, siendo estadísticamente significativa hasta llegar al punto de corte de 1:150.
Tasa de detección y tasa de positivos según el punto de corte
| Con InhA | Sin InhA | |||
| Tasa detección | Tasa positivos | Tasa detección | Tasa positivos | |
| 1:50 | 40%* | 2,5% | 25,4%* | 3,5% |
| 1:100 | 70% | 5,5% | 76,9% | 6,8% |
| 1:150 | 80% | 7,6%* | 76,9% | 9,6%* |
| 1:200 | 80% | 9,0%* | 84,6% | 12,8%* |
| 1:250 | 90% | 11,0%** | 84,6% | 15,9%** |
InhA: inhibina A.
Realizar comparaciones de sensibilidad entre los grupos en estudios de cribado prenatal es problemático debido al reducido número de casos de síndrome de Down encontrados por la baja prevalencia de esta enfermedad en la población. En nuestra revisión hemos observado cómo la sensibilidad es superior al incluir la InhA. Estudios previos muestran sensibilidades similares o incluso superiores al incluir la InhA, en función del tamaño de la población estudiada3,4,7–9,12,14,16,17,19.
En el punto en el que se demuestra la importancia de la inclusión de la InhA en el cribado de segundo trimestre es en la tasa de positivos, significativamente menor si incluimos la InhA. Esto concluye en un uso más efectivo de la amniocentesis que se ofrece a las mujeres de riesgo, con la reducción en el coste económico global del programa de cribado3,4,7,8,10,11,14–20.
A tenor de los resultados observados en esta revisión, principalmente los relativos a la reducción de la tasa de positivos, se puede concluir que la InhA se debería usar en el cribado de segundo trimestre del síndrome de Down.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
E. Casals e I. Mercadé (Hospital Clínic-Barcelona)
C. Aulesa y J. Ramis (Hospital Vall d’Hebrón-Barcelona)
M. Alsina (CATLAB-Hospital Universitari Mútua de Terrassa-Barcelona)
M. Sabaté (Hospital de Santa Tecla-Tarragona)
A. Esquerda (Hospital Arnau de Vilanova-Lleida)
C. Peña (CLI-Barcelona)
N. Serrat (Hospital Joan XXIII-Tarragona)
D. Cabrero (Hospital Universitari Josep Trueta-Girona)
M. Llovet (Hospital Verge de la Cinta-Tortosa)
M. Jané (Direcció General de Salut Pública de la Generalitat de Catalunya)
En el Anexo 1 se incluye los componentes del grupo.