El objetivo de elaborar este consenso fue colaborar con el nefrólogo en el manejo del metabolismo mineral del paciente con ERC.
Para su realización partimos de formular preguntas de las que necesitamos respuestas para el manejo clínico de nuestros pacientes, se consultaron fuentes bibliográficas y guías internacionales intentando adaptarlas a la realidad de nuestro país.
Hemos tenido en cuenta las nuevas definiciones y el sistema de clasificación más integrado que recientemente propuso la Fundación KDIGO (Kidney Disease). Se desarrolla el capítulo séptimo que versa sobre la paratiroidectomía en la enfermedad renal crónica, con un apéndice 2 sobre la biopsia ósea.
The aim of designing this consensus document was to collaborate with nephrologists in the management of mineral metabolism in patients with chronic kidney disease. To do this, we formulated questions requiring answers for the clinical management of our patients and consulted bibliographic sources and international guidelines with the aim of adapting them to the Argentine situation. The new definitions and the more integrated classification system recently proposed by the Kidney Disease Improving Global Outcomes (KDIGO) Foundation have been taken into account. Chapter VII on parathyroidectomy in chronic kidney disease is presented, with appendix 2 on bone biopsy.
- 1.
Indicaciones de paratiroidectomia (PTx). La Ptx debe ser indicada en los pacientes con HPT 2 severo con PTH > 1.000 pg/ml (quimioluminiscencia) en forma persistente mantenida más de 6 meses (más de dos determinaciones separadas por un intervalo de tres meses) asociado a uno o más de los siguientes ítems:
- 1.1.
Hipercalcemia y/o hiperfosfatemia refractaria al tratamiento.
- 1.2.
Hipercalcemia y/o hiperfosfatemia durante el tratamiento con calcitriol o análogos de vitamina (paricalcitol, doxercalciferol), a pesar de la utilización de quelantes del fósforo sin calcio.
- 1.3.
Presencia de glándulas paratiroideas de un tamaño ≥ a 0,5cm3 de volumen o ≥ 10mm de diámetro medida por ecografía.
- 1.4.
Se considerará criterios especiales a tener en cuenta para adelantar o realizar la Ptx de urgencia el diagnóstico de:
- 1.4.1.
Calcificaciones extraóseas (tejidos blandos y/o cardiovascular) progresivas o calcifilaxis.
- 1.4.2.
En pacientes en lista de espera, previo al Tx renal con los criterios antes mencionados.
- 1.5.
En el transplante renal funcionante la PTx esta indicada con HPT persistente (PTH elevada en relación con el estadio de enfermedad renal crónica) después de un año, asociado a hipercalcemia persistente. También puede estar indicada antes del año de Tx si está asociada a hipercalcemia con pérdida progresiva e inexplicada de la función del injerto.
- 1.4.1.
- 1.1.
- 2.
Tipos de cirugía.
- 2.1.
Las PTx que se pueden realizar son subtotal, total con AI (músculo esternocleidomastoideo, antebrazo, grasa preesternal) y total.
- 2.2.
Ventajas y desventajas de tipo de PTx: no hay evidencia de que la PTx total con AI sea superior a Ptx ST. La PTx total sin AI está contraindicada en pacientes con ERC estadio 5 en lista de espera de Tx.
- 2.3.
Medición de PTH intraoperatoria: es beneficioso para evitar la persistencia. Los valores de PTHi 1-84 por debajo de 45 pg/ dl a los 30 minutos asegura la efectividad de la cirugía.
- 2.1.
- 3.
Estudios pre-PTx.
3.1. La cografia y sestamibi deben realizarse siempre que sea posible para valorar el tamaño, la situación y la localización de glándulas, siendo imprescindibles en la reintervención. La asociación de ambos métodos mejora la sensibilidad y especificidad diagnóstica.
- 4.
Preparación pre-PTx.
4.2. Para la preparación prequirúrgica se recomienda administrar 1-2μg de calcitriol posdiálisis en las tres sesiones previas a la PTx para prevenir la hipocalcemia poscirugía.
- 5.
Seguimiento post-PTx inmediato.
- 5.1.
Para el seguimiento post-PTx inmediato se recomienda realizar calcemia de 2 a 6 veces/ día las primeras 72 horas, después dos veces al día hasta que los valores de Ca+ se mantengan estables. En pacientes trasplantados monitorizar también P y Mg.
- 5.2.
Se debe iniciar infusión de gluconato de Ca+ IV inmediatamente después de la cirugía a una dosis de 1 a 2g de Ca+ elemental (1 amp 10% de 10ml=90mg Ca) para mantener los niveles de Ca plasmático > 7,5mg/ dl.
- 5.3.
Cuando la vía oral sea posible iniciar carbonato de Ca+ a dosis de 2- 6g/día de calcio elemental VO, dividida en 3-5 tomas, lejos de las comidas y ajustada de acuerdo a los valores de laboratorio.
- 5.4.
Administrar conjuntamente con el calcio (IV/ VO), calcitriol 1-2μg/día y ajustada de acuerdo a las necesidades.
- 5.5.
Aumentar concentración de Ca+ en el dializante a 3,5 mEq/l o administrar una ampolla de gluconato de calcio en la última hora de diálisis (opinión).
- 5.6.
Los quelantes del fósforo deben ser suspendidos después de la PTx, incluso algunos pacientes pueden requerir suplementación de fósforo.
- 5.1.
- 6.
Seguimiento post-PTx alejado.
- 6.1.
Para el seguimiento alejado se recomienda monitorizar los niveles de calcio y fósforo semanal o quincenalmente los dos primeros meses, o hasta obtener valores estables. Posteriormente la determinación debe realizarse una vez al mes.
- 6.2.
El calcitriol debe administrarse conjuntamente con carbonato hasta la normalización de los valores de fosfatasa alcalina.
- 6.3.
Persistencia: se define la persistencia del hiperparatiroidismo cuando el valor de PTH obtenido después del primer o segundo dia del postoperatorio es > 60 pg/ ml.
- 6.4.
Recurrencia: se define la recurrencia del hiperparatiroidismo cuando el valor de PTH es >250 pg/ ml después de 6 meses de la cirugía y que requiera en su evolución nueva PTx.
- 6.5.
Tratamiento de persistencia y recurrencia: primero es médico con vitamina D o análogos y calcimiméticos. Si no se obtiene la respuesta esperada, se llevará a cabo cirugía con previa realización de sestamibi con 99Tc para localizar la glándula remanente.
- 6.1.
El tratamiento médico del hiperparatiroidismo puede no ser efectivo para su adecuado control, generando una condición de refractariedad al mismo, por lo que el tratamiento quirúrgico puede proveer una efectiva reducción de los niveles de PTH1–4.
Las indicaciones de paratiroidectomía no han sido bien definidas en cuanto a los valores de laboratorio absoluto, es decir, el punto de corte entre el tratamiento medico y el quirúrgico.Se debe también tener en cuenta la metodología de determinación de PTH, ya que recientemente se ha reportado una gran variabilidad entre las diferentes determinaciones5. La hipercalcemia e hiperfosfatemia persistente que acompaña al hiperparatiroidismo severo limitan el tratamiento con activadores del receptor de vitamina D para disminuir los niveles de PTH6; en esta circunstancia la paratiroidectomía es una opción terapéutica efectiva. El tamaño y peso de la glándula paratiroidea medida por ecografía tiene una correlación negativa con el receptor de vitamina D, y el peso glandular mayor a 500mg puede ser patognomónico de hiperplasia nodular. Por lo tanto, el tamaño y peso de la glándula paratiroidea medida por ecografía es un criterio importante para la indicación de paratiroidectomía7,8. Una situación clínica especial es la presencia de calcifilaxis con hiperparatiroidismo (PTH > 500 pg/ml), constituyendo una prioridad el tratamiento quirúrgico1,2,9. En los pacientes en lista de espera de trasplante renal es mandatorio realizar la PTx antes del Tx si presentan los criterios antes mencionados. Otra situación especial son los pacientes Tx con injerto funcionante. Después del Tx la PTH muestra un descenso bifásico: un rápido descenso del 50% en los 3-6 primeros meses, atribuido a una disminución de masa funcionante paratiroidea seguida de una declinación más gradual. Sin embargo, un 25% de los pacientes Tx presentan PTH elevada un año después del trasplante renal10–13. No hay acuerdo de cuáles son los valores de PTH postrasplante que indiquen la PTx, pero cuando la elevación de PTH se acompaña de hipercalcemia es aconsejable realizar la cirugía de paratiroides, debido a que la hipercalcemia severa puede inducir alteraciones hemodinámicas, tales como hipertensión arterial y deterioro de la función del injerto13.
Los tipos de paratiroidectomia que se pueden realizar son tres: total, total con autoimplante o subtotal. Le elección del tipo de paratiroidectomía dependerá de la experiencia del equipo quirúrgico. Sin embargo, en los pacientes trasplantados y en lista de espera estaría contraindicada la paratiroidectomia total por la alta incidencia de hipoparatiroidismo14. La persistencia y recidiva en la paratiroidectomía subtotal y total con autoimplante difieren según las series publicadas; sin embargo, no se evidencian mejores resultados con una u otra técnica quirúrgica15–21. La monitorización intraoperatoria de la PTH es beneficiosa para evitar la persistencia. Los valores de PTH 1-84 por debajo de 45 pg/ dl a los 30 minutos de extirpar la última glándula aseguran la efectividad de la cirugía22–24.
Los estudios preoperatorios tales como la ecografía de paratiroides y el sestamibi con 99Tc deben realizarse siempre que sea posible para valorar el tamaño, la situación y la localización de glándulas, siendo imprescindibles en la reintervención. La asociación de ambos métodos mejora la sensibilidad y especificidad diagnóstica26–29. La positividad de sestamibi con 99Tc puede sugerir que el subtipo histológico sea con más probabilidad hiperplasia nodular que hiperplasia difusa25.
La hipocalcemia posparatirodectomía (hueso hambriento) es una hallazgo muy frecuente en los pacientes con enfermedad renal crónica30,31. Después de la paratiroidectomía exitosa, en los primeros días se observa hipocalcemia, hipofosfatemia y elevación de la fosfatasa alcalina. La medicación prequirúrgica es importante para la prevención de la hipocalcemia posparatiroidectomía. La suplementación de calcio y calcitriol puede prevenir la hipocalcemia severa y sintomática32. La utilizaciónn de pamindronato prequirúrgico puede prevenir la hipocalcemia sintomática postcirugía, sin embargo, a largo plazo, puede potencialmente retardar el remodelado óseo33.
En el postoperatorio inmediato se debe monitorizar calcio, fósforo, magnesio, potasio, fosfatasa alcalina, PTH y es necesario la reposición de calcio y vitamina D por un periodo que varía desde los primeros días hasta meses después del alta del paciente. Sin embargo, la reposición IV de grandes cantidades de calcio es controvertida en la literatura. La gran mayoría de los pacientes, principalmente aquellos con hiperparatiroidismo muy severo, desarrollan hipocalcemia sintomática, siendo necesaria su indicación34,35. Durante el periodo de hueso hambriento se debe poner especial atención a las determinaciones de potasio sérico, porque un significativo porcentaje de pacientes puede desarrollar hipercalemia, secundaria al intercambio óseo entre el calcio y potasio, requiriendo diálisis de emergencia35. La hipofosfatemia posparatiroidectomía también es frecuente, pero sólo en raras ocasiones es grave y sintomática, pudiendo desarrollar rabdomiólisis cuando llega a niveles menores a 1mg/ dl36.
Después del segundo mes de la paratiroidectomía se debe medir mensualmente el calcio y el fósforo, y adecuar la dosis de calcio oral y calcitriol a las necesidades individuales. La determinación de PTH se debe realizar a las 24-48 horas, a los 7 días del postoperatorio y después por lo menos cada tres meses, lo que nos permitirá evaluar el resultado de la cirugía e intervenir precozmente en caso de posibles elevaciones de la hormona o de niveles muy bajos de la misma. No existe acuerdo en la literatura de cuáles son los valores de PTH para definir la persistencia. Tampoco hay acuerdo con respecto a los niveles de PTH en la recurrencia. En ambos casos puede requerir el paciente una nueva intervención quirúrgica, siendo imprescindible en esta situación la realización de sestambi 99Tc para la localización de glándulas ectópicas o supernumerarias15–17,20,21,37–39.
- 1.
¿Cuál es el valor de PTH con el que se debe indicar la Ptx? Indicaciones de Ptx postTx. ¿Cuánto tiempo post-Tx debo esperar hasta decidir Ptx?
- 2.
¿El valor de PTH debe ir acompañado de otras manifestaciones de laboratorio o clínicas?
- 3.
¿Qué tipo de Ptx se pueden realizar? ¿Cuáles son las ventajas y desventajas de cada una?
- 4.
¿Qué estudios son imprescindibles realizar antes de Ptx?
- 5.
Preparación pre-quirúrgica ¿medicación pre-Ptx: vitamina D, pamindronato, nada?
- 6.
Mediciones de PTH intraoperatoria para evitar persistencia ¿sirve o no?
- 7.
Seguimiento posquirúrgico inmediato que debo hacer en lo referente a: a) dosis de Ca IV; b) dosis de Ca VO; y c) dosis de calcitriol.
- 8.
Seguimiento después del primer mes de la Ptx: a) cómo adecúo la dosis de Ca; b) hasta cuándo le indico calcitriol; y c) a qué laboratorio pedir y con qué frecuencia.
- 9.
Recurrencia y persistencia: ¿qué niveles de PTH hacen Dx?, ¿cómo tratar la persistencia y recurrencia?
La evaluación y diagnóstico definitivo de la osteodistrofia requiere de realización de la biopsia ósea (BO).
La histomorfometría no es esencial para el diagnóstico clínico, pero debe ser realizado en estudios de investigación.
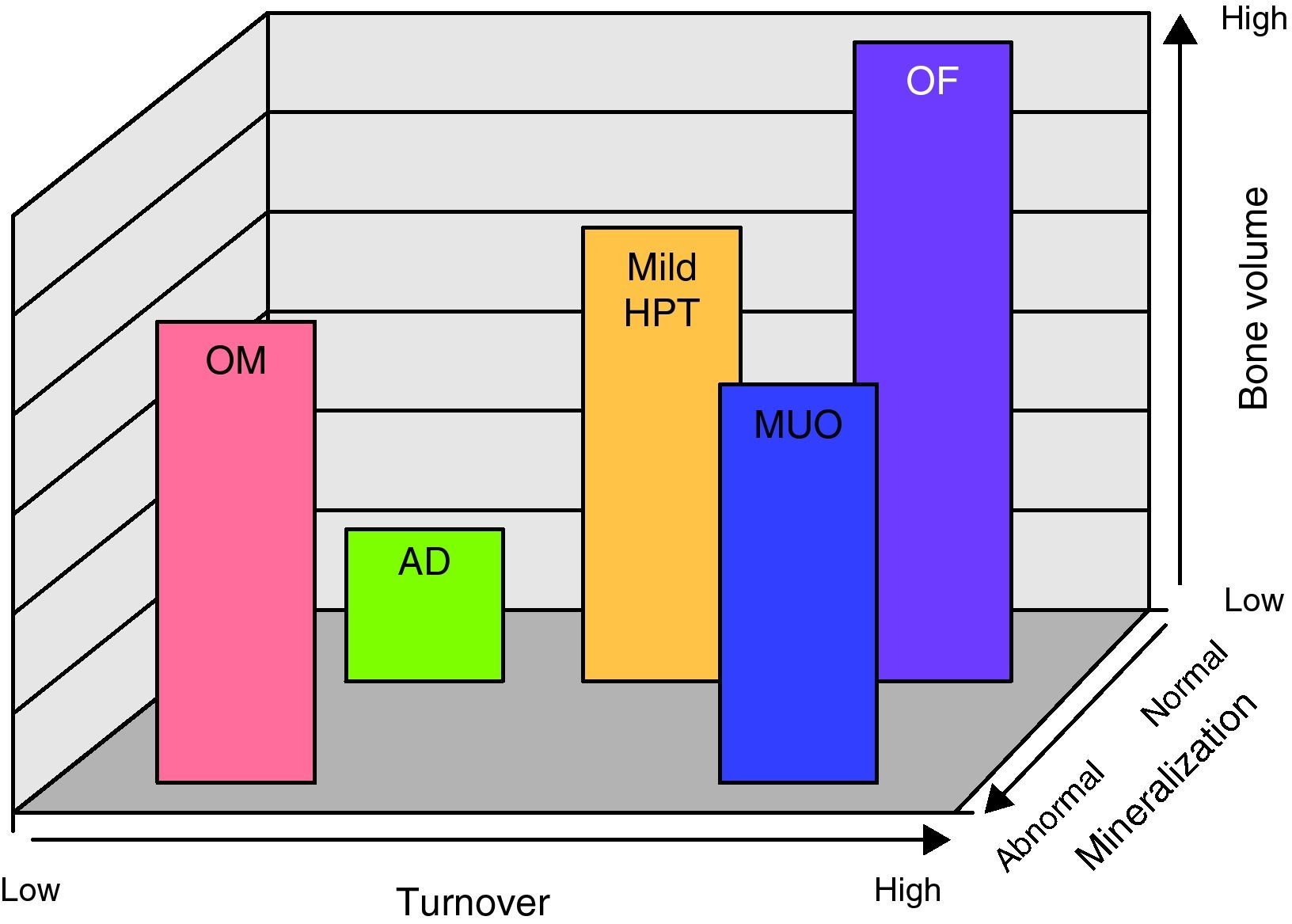
Para la interpretación de la BO se acordó la utilización de tres descriptores histológicos1,2: turnover óseo (T), mineralización ósea (M) y volumen óseo (V).
Esta clasificación aporta una descripción clínicamente relevante de la patología ósea subyacente, ayuda a definir la fisiopatología, guía las decisiones terapéuticas, realizándose a través de la aplicación de la descripción histológica del sistema TMV (turnover, mineralización y volumen óseos).
Turnover óseoRefleja el remodelado esquelético. Proceso acoplado de formación y resorción ósea. Se valora con histomorfometría dinámica utilizando técnicas con doble marcado con tetraciclinas. El nivel de formación ósea (BFR) y la frecuencia de activación representan parámetros aceptables para valorar el turnover óseo (recambio óseo).
El turnover óseo es afectado por: hormonas, citoquinas, estímulos mecánicos y factores de crecimiento. Un disbalance entre formación y resorción puede afectar el volumen óseo.
Mineralización óseaRefleja el grado con que el colágeno óseo se calcifica durante la fase de formación del remodelado esquelético. Es valorada por histomorfometría estática (medición del volumen y el espesor osteoide) y dinámica (medición con tetraciclinas del tiempo de mineralización, tiempo de aposición y tiempo de maduración osteoide).
Las causas que afectan la mineralización ósea son: niveles inadecuados de vitamina D, deficiencia de calcio y/ o fósforo, acidosis y la toxicidad ósea por aluminio.
Volumen óseoIndica la cantidad de hueso por unidad de volumen tisular. Se valora con histomorfometría estática midiendo el volumen óseo en el hueso trabecular.
Los determinantes del volumen óseo en la población general, como en pacientes con ERC, incluyen la edad, sexo, raza, factores genéticos, nutrición, desórdenes endocrinológicos, estímulos mecánicos, factores de crecimiento y citoquinas (fig. 1).
Sistema de clasificación TMV para histomorfometría ósea. En el gráfico están representados los 3 aspectos de la clasificación TMV (turnover, mineralización y volumen óseos). De acuerdo a estos la patología ósea se la clasifica como: OM (osteomalacia), AD (hueso adinámico), MILD HPT (hiperparatiroidismo moderado), OF (osteítis fibrosa o hiperparatiroidismo avanzado) y MUO (osteodistrofia urémica mixta).
La BO no está recomendada como parte de la evaluación de rutina del metabolismo mineral en el paciente con enfermedad renal. Sin embargo, es una herramienta diagnóstica importante en la evaluación clínica y diagnóstico diferencial de la enfermedad ósea en pacientes seleccionados con ERC. Las indicaciones de BO incluyen las siguientes situaciones:
- 1.
Inconsistencia entre parámetros bioquímicos que dificultan una interpretación definitiva.
- 2.
Fracturas óseas no explicadas o dolor óseo persistente.
- 3.
Hipercalcemia no explicable.
- 4.
Calcificaciones vasculares severas y progresivas.
- 5.
Sospecha de sobrecarga o toxicidad por aluminio y posiblemente por otros metales.
- 6.
Previo a la PTX si hubo exposición significante al Al en el pasado.
- 7.
Los resultados bioquímicos no son consistentes con HPT avanzado.
- 8.
Considerarla previo al tratamiento con bifosfonatos.
El Grupo de Trabajo del Metabolismo Óseo Mineral, perteneciente a la Sociedad Argentina de Nefrología, ha realizado los esfuerzos posibles para evitar cualquier situación en relación a potenciales conflictos de intereses que puedan haber ocurrido como resultado de una relación externa de tipo personal, profesional o de interés de negocios de cualquier miembro del Grupo de Trabajo.
A todos los socios de la Sociedad Argentina de Nefrología que participaron con sus opiniones a través de la encuesta.
A las autoridades de la Sociedad Argentina de Nefrología, siendo Presidente el Dr. Walter Douthat.
Al Dr. Julen Ocharan-Corcuera, por su publicación en esta revista.
Comisión directiva de la Sociedad Argentina de Nefrología
Presidente: Dr. Walter DouthatSecretario: Dr. Claudio MascheroniTesorero: Dr. Juan José Di Bernardo
Vocales:Buenos Aires: Catamarca Mendoza SaltaDr. Bruno Lococo, Dr. Segundo Fernández, Dr. Jose Ascar, Dra. Nora Marcheta, Dra. Mónica Calvo, Dr. Carlos Abate, Dr. Heriberto DemicheliCórdoba NordesteDr. Helio Geandet, Dr. Sergio Boni, Dr. Marcelo Ferreyra San Juan, Dra. Mirta López, Dr. Nestor García, Dr. Raúl Morales, Dr. Hugo Ramírez, Dra. Sandra Méndez, Dr. Marcelo Orias, Dra. Silvia RussomandoNoroeste Santa FeDr. Daniel D’Errico
Entre RíosDra. Mariela Sal, Dr. Alberto Alles, Dr. Rodolfo Piscitelli, Dr. Eugenio Bernhardt, Dra. Sara Muhamad, Dra. María Inés Marone
NorpatagoniaDr. Eduardo Sanguinetti, Dra. Beatriz Rizzo
Vocales SuplentesBuenos Aires. NoroesteDra. Olga Guardiã, Dr. Norberto Gómez