Corrosion is a process that can bring direct or indirectly countless prejudice to society. However, there are some forms to avoid or if nothing else to decrease corrosion effects. In doing so, this article proposes a trial based on solving problems through an investigative case of level two (Tamir, 1991), enabling to explore different methods aimed at minimizing the corrosive processes. Some basic principles of anticorrosion methods are discussed in order to guide the teacher to conduct pre and post lab activities from the proposed problem.
La corrosión es un proceso que trae un sinnúmero de perjuicios a la sociedad, ya sea directa o indirectamente. No obstante existen muchas formas de evitarla o, en todo caso, de disminuir los efectos de la corrosión. Para lograrlo, este artículo propone una experimentación basada en resolución de problemas a través de un caso de investigación del nivel dos (Tamir, 1991), en el que se exploran diversos métodos con el propósito de minimizar el proceso corrosivo. Se discuten algunos principios básicos de los métodos anticorrosivos con el propósito de guiar al profesor para llevar a cabo actividades pre y post laboratorio para atacar el problema propuesto.
Sem dúvidas a frase “é de conhecimento dos profes sores de ciências o fato de a experimentação despertar um forte interesse entre alunos de diversos níveis de escolarização” (Giordan, 1999, p. 43) está enraizada no ensino de ciências e entre os professores do ensino médio e superior. No entanto, achar que a partir da experimentação a aprendizagem será favorecida e conside rá-la naturalmente motivadora, muitas vezes não condiz, pois tais aspectos dependerão de como o professor conduz e planeja as atividades experimentais. Isto porque muitos alunos não gostam de realizar experiências, pelo simples fato de não ver nada de novo. Mas será que esses estudantes não gostam da experimentação por si só, ou estão literalmente cansados de roteiros pré-estabelecidos e de experimentos repetitivos e sem concretude? Tal questionamento vai ao encontro das concepções pontuadas por Hodson (1994), sobre como motivar os estudantes em um trabalho experimental.
Tais aspectos são mais alarmantes quando se trata de ex perimentação no ensino superior, pois na maioria das vezes os experimentos feitos são os mesmos há muito tempo, sem incitações para uma boa discussão ou estímulo ao pensa mento crítico e ao desenvolvimento de habilidades essen ciais para a formação acadêmica. Independentemente dos objetivos do ensino prático, “a ideia central é que qualquer que seja o método de ensino/aprendizagem escolhido, ele deve mobilizar a atividade do aprendiz, em lugar de sua passividade” (Borges, 2002, p. 294).
Guimarães (2009) aponta que o uso da experimentação pode ser uma estratégia eficaz e promissora para a elabora ção de problemas reais, propiciando discussões acerca de aspectos investigativos e cotidianos. Francisco (2012) de monstrou que o processo de aprendizagem de estudantes do ensino superior foi beneficiado com o uso de um problema sobre métodos eletrolíticos, no qual a resolução perpas sava pela experimentação investigativa.
Na maioria das vezes, a utilização de atividades práticas com fins didáticos envolve experimentos que buscam pro var ou ilustrar a teoria, assim como ensinar o chamado “método científico”. Ademais, as metodologias aplicadas na experimentação tradicional tendem a distorcer a visão da ciência, uma vez que muitos estudantes acham que fazer ci ência é comprovar leis e teorias e fazer descobertas. Diante disso, é necessário que seja feita uma análise mais cuidadosa da relação entre observação, experimento e teoria, plane jando atividades experimentais que façam com que os estu dantes relacionem essa tríade.
É importante que os estudantes desenvolvam atividades, cuja construção do conhecimento seja feita por meio de suas ações, além das (inter)ações entre os sujeitos pela lin guagem científica. Nesta abordagem, o professor tem o papel de planejar as atividades experimentais de modo que favoreça o processo de aprendizagem do estudante. O que se defende aqui é utilizar a experimentação por meio de re soluções de problemas, mas acima de tudo, que os estudantes se sintam desafiados e incitados a resolver esse problema. Para que isso aconteça, os problemas devem abranger situações que estejam próximas da realidade dos estudantes.
Considerações teóricas sobre os “problemas”Borges (2002) aponta que: Um problema, diferentemente de um exercício experimental ou de um de fim de capítulo do livro-texto, é uma situação para a qual não há uma solução imediata obtida pela aplicação de uma fórmula ou algoritmo. Pode não existir uma solução conhecida por estudantes e profes sores ou até ocorrer que nenhuma solução exata seja possível. Para resolvê-lo, tem-se que fazer idealizações e aproximações (Borges, 2002, p. 303).
No mesmo raciocínio, Echeverría e Pozo (1998) afirmam que uma situação só pode ser considerada um problema quando quem tem que resolvê-la precisa utilizar estratégias para solucioná-los que não estão disponibilizadas na forma de procedimentos automáticos. Igualmente, Echeverría e Pozo (1998, p. 16) afiançam que “um problema é, de certa forma, uma situação nova ou diferente do que já foi aprendido, que requer a utilização estratégica de técnicas já con hecidas”.
No entanto, utilizar um problema de qualquer forma para explorar a experimentação pode não adiantar nada. O que é feito na experimentação dita tradicional é empregar problemas do tipo fechado que apresentam roteiros pré-es tabelecidos de como e o que fazer, onde os estudantes já sa bem o que medir, o que analisar, o que discutir e por muitas vezes o que acontecerá no experimento. Segundo Hodson (1994), esta abordagem não motiva os estudantes, não auxilia na compreensão dos conceitos científicos e pode demonstrar uma concepção de ciência totalmente distorcida. Visto isso, uma estratégia interessante e defendida neste artigo é trabalhar com problemas abertos ou semiabertos, onde os alunos são mais autônomos durante toda a ativida de e o professor possui um papel de mediar toda a execução e discussão.
Problemas do tipo aberto são aqueles passíveis de inter pretação de uma determinada situação, onde os estudantes podem utilizar de diferentes estratégias para resolvê-los. Já um problema semiaberto contém informações que exploram a capacidade de concentração dos estudantes em cima da resolução, mas permitem também alçar voos além do enunciado para projetar e definir ideias para resolver os problemas (Pozo e Crespo, 1998). Esta abertura se torna es sencial no processo de ensino/aprendizagem, visto que é possível incutir aspectos sociais, econômicos, ambientais, tecnológicos, éticos, políticos, humanísticos etc, ligados ao conhecimento científico.
Segundo Borges (2002) a concepção em uma investiga ção aberta ou semiaberta está relacionada ao estudante, en volvendo: Desde a percepção e geração do problema; sua formula ção em uma forma suscetível de investigação; o planeja mento do curso de suas ações; a escolha dos procedi mentos, a seleção dos equipamentos e materiais, a preparação da montagem experimental, a realização de medidas e observações necessárias; o registro dos dados em tabelas e gráficos; a interpretação dos resultados e enumeração das conclusões (Borges, 2002, p. 304).
Borges (2002) aponta ainda a necessidade da enumeração de atividades pré e pós-laboratório, sendo elas planejadas pelo professor de modo a alcançar os objetivos propostos inicialmente e que também favoreçam o processo de apren dizagem dos estudantes. Como atividades pré-laboratório, o professor deve dar significados às observações que serão feitas e promover discussões prévias com os estudantes sobre as possíveis interpretações. Na fase pós-laboratório faz-se a discussão ampla e em conjunto, destacando a dia logicidade a partir de todas as observações, resultados e interpretações obtidos, tentando reconciliá-las com as pre visões feitas inicialmente. Esta etapa é um excelente mo mento de se discutir as falhas e limitações da atividade prá tica (Gunstone, 1991).
Assumindo os princípios teóricos do uso de problemas para o ensino prático de ciências e buscando apresentar di ferentes alternativas para a experimentação em química, é que se centra o objetivo deste trabalho. A seguir será apre sentada uma possibilidade para uma abordagem experi mental via resolução de problemas com ênfase em técnicas para evitar ou minimizar a corrosão de materiais. Serão dis cutidos também os conceitos químicos envolvidos nas téc nicas e as alternativas de discussão para o professor, assim como um breve apontamento dos aspectos teóricos sobre os níveis de investigação propostos por Tamir (1991).
A experimentação por meio de problemas abertos e semiabertosDe acordo com Gentil (1989), a corrosão é um processo des trutivo que resulta da ação química ou eletroquímica de um dado meio sobre um determinado material, podendo ainda estar aliada ou não a esforços mecânicos. Por ser um pro cesso espontâneo, o efeito da corrosão influencia a durabi lidade e o desempenho dos materiais, podendo ocasionar graves acidentes e enormes gastos diretos ou indiretos. Esse prejuízo econômico e social faz do processo corrosivo um dos principais alvos de estudos das ciências dos materiais atualmente. Tais estudos intentam minimizar ou, pelo me nos, controlar os danos e as perdas.
Você consegue uma entrevista em uma empresa que utiliza o processo de decapagem química. Durante a entrevista, o gerente lhe entrega um problema e diz que é uma das etapas que deve ser desenvolvida imediatamente. Você recebe o problema e lê: “A decapagem química é feita em todo aço aqui produzido visando à remoção de oxidações e impurezas inorgânicas sobre sua superfície. As chapas são mergulhadas em tanques com solução de ácido clorídrico concentrado a uma temperatura de 85 °C, durante um minuto. Após esta etapa as chapas de aço devem ser protegidas imediatamente para poderem ser estocadas. Sabendo que todo o processo é mecanizado e que há outros tanques disponíveis para utilização, além de outras possibilidades, que processo poderia ser feito para a proteção dessas placas de aço a fim de evitar sua corrosão durante a estocagem?”
Muitos dos materiais empregados industrialmente e co mercialmente como armações de ferro para construção, grades, portões, reboco, dentre outros, possuem baixa re sistência à corrosão na maioria dos meios, sobretudo quan do expostos ao ar e/ou umidade. Tal resistência pode ser melhorada ou ampliada utilizando-se técnicas ou métodos anticorrosivos. A utilização de métodos para combate à cor rosão pode ser conseguida de diferentes formas e com diversas técnicas, incluindo processos físicos e químicos, além de empregar distintos materiais para tal fim. Dentre essas técnicas ou métodos, as mais aplicadas são: as barrei ras protetoras (revestimentos), a proteção catódica e anódi ca, os inibidores de corrosão e a passivação.
A proposta sugerida é apresentada no Quadro 1. Trata-se de um problema que propõe aos estudantes apresentar e discutir meios de proteção contra a corrosão de chapas de aço que serão estocadas. Para que o estudante se sinta de safiado a resolver o problema proposto, a situação discorre sobre uma possibilidade de emprego caso a solução seja adequada e viável. Considera-se importante que os proble mas incitem e provoquem os estudantes, a fim de que eles possam se sentir motivados a resolvê-los.
Tamir (1991) propõe uma categorização para as ativida des experimentais investigativas em quatro níveis. O nível zero (N0) corresponde praticamente ao chamado problema fechado muito utilizado na experimentação tradicional, onde são dados o problema, os procedimentos e o que se de seja observar e/ou verificar durante a tarefa. A única função dos estudantes é coletar os dados que também são pré-es tabelecidos e confirmar ou não as conclusões. No nível um (N1), o professor define previamente o problema e os proce dimentos, estabelecendo um roteiro de instruções. Cabe ao estudante realizar a coleta dos dados indicados, discutir e concluir os resultados. Para o nível dois (N2), o problema é dado e os estudantes devem planejar uma estratégia experi mental, incluindo procedimentos, tipos de medidas, coleta de dados e por fim concluir os resultados obtidos. Por último se encontra o nível três (N3), caracterizado como o nível mais aberto de investigação onde o estudante é responsável por todas as etapas, desde a formulação do problema até chegar às conclusões.
Dentro desta classificação, o problema proposto no qua dro 1 é categorizado como de nível 2 de investigação. Borges (2002) verificou que muitos estudantes possuem dificulda des em entender uma abordagem experimental no nível 2 e principalmente no nível 3. Desta forma, é importante que o professor realize atividades pré-laboratório para tecer al gumas explicações e esclarecimentos sobre a proposta, para que os estudantes possam desenvolver a prática. Francisco (2012) trabalhando com um problema de nível dois e realizando uma discussão prévia com os estudantes, obteve bons resultados em relação ao processo de aprendizagem.
Particularmente no problema exposto no quadro 1, cada estudante ou grupo de estudantes poderá propor a solução que achar mais adequada, pois neste caso podem existir di versas técnicas aplicáveis para a proteção à corrosão. Neste sentido, alguns apontamentos sobre essas possíveis técni cas serão apresentadas a seguir com o intuito de fornecer um guia para o professor desenvolver e planejar as ativida des pré e pós-laboratório.
Orientações para as possíveis soluções do problema propostoExistem muitos meios para o controle da corrosão de mate riais, assim como para evitar ou minimizar o efeito corrosi vo. Devida a essa gama de possibilidades, as quais serão discutidas a seguir, ao propor resoluções para o problema (Quadro 1), os estudantes podem eleger o método mais co nhecido e mais próximo da realidade deles. Assim, é impor tante que o professor planeje atividades pré-laboratório para esclarecer possíveis dúvidas dos estudantes e orientá -los para a resolução do problema. Essas atividades podem (ou devem) estar aliadas à apresentação e discussão de téc nicas que permitem controlar ou minimizar a corrosão. Nesse sentido, o professor pode propor algumas leituras e pesquisas que fornecerão informações para que os estu dantes desenvolvam as estratégias para a resolução do pro blema mediante a experimentação.
Uma das alternativas possíveis que os estudantes podem propor é o uso dos revestimentos, que são películas aplica das sobre a superfície do material de interesse, sendo ele metálico ou não, que impede o contato direto da superfície com o meio corrosivo e sua posterior degradação. No en tanto, um revestimento torna-se efetivo quando: o material revestido comportar-se como um bom isolante elétrico; e se o filme aplicado ser praticamente perfeito e contínuo. Essas condições do revestimento podem ser debatidas como uma atividade pós-laboratório, caso a resolução do problema perpasse por esse método de proteção.
Ainda nas atividades pós-laboratório, o professor pode explorar os tipos de revestimentos. Os revestimentos do tipo não metálicos podem ser inorgânicos, como os esmal tes vitrosos, os vidros, os cimentos, as porcelanas e os óxi dos, como por exemplo, o zarcão (nome comercial do tetra óxido de chumbo (Pb3O4), que é um pó vermelho, insolúvel em água e em ácidos, muito utilizado em tintas para a pro teção de superfícies de ferro contra a ferrugem); ou orgâni cos como as tintas do tipo epoxídicas (polímeros de con densação, que apresentam o grupamento epóxi; R – O – R), e os polímeros (Gentil, 1989). Neste tipo de proteção, os re vestimentos são depositados diretamente sobre a superfície do material de interesse ou são formados na superfície após alguma ação externa como calor ou oxidação com o ar.
Outra possibilidade são os revestimentos metálicos, que são usados tanto para evitar ou minimizar a corrosão quan to para fins decorativos. Tais revestimentos são feitos por metais mais nobres que o metal base ou o material de inte resse, ou seja, aqueles metais que apresentam o valor do potencial padrão de eletrodo (E °) superior ao metal base. Normalmente são utilizados os metais cromo, níquel e co bre para revestir um material feito de aço.
Nestes casos, os revestimentos retardam a ação corrosi va por tornar o processo termodinamicamente não espon tâneo. Porém, estes revestimentos devem ser isentos de po ros, trincas e/ou riscos, pois, como o metal de recobrimento é mais nobre, qualquer imperfeição provocará a corrosão do metal de base. As técnicas mais usadas para a aplicação de revestimentos metálicos são: cladização, imersão a quente, metalização, eletrodeposição e redução química. O profes sor pode, a partir dessas técnicas, aprofundar os conceitos científicos que estão envolvidos nas técnicas com os estu dantes, caso alguma resolução aborde essas técnicas ou não.
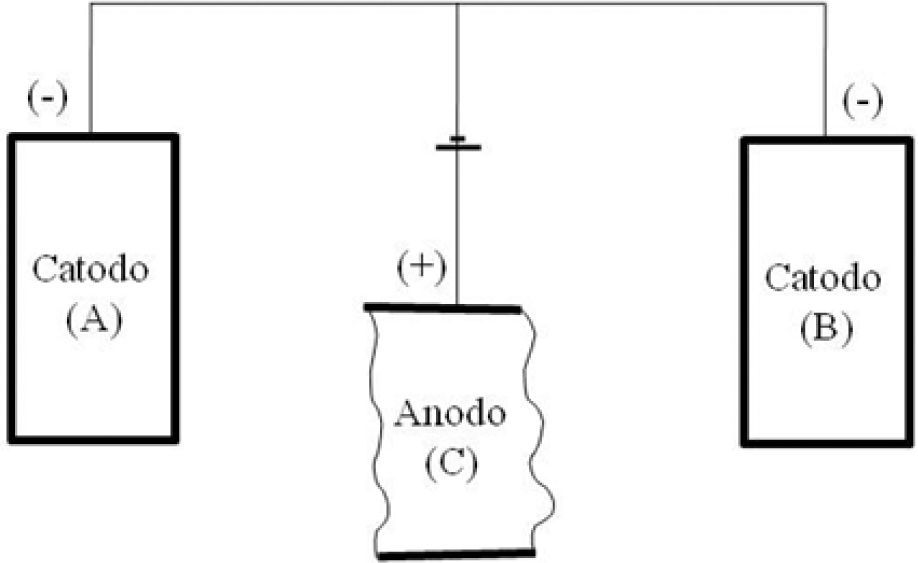
Outra alternativa para resolução do problema seria utili zar uma proteção catódica ou uma proteção anódica no material. Na proteção catódica, a estrutura a ser protegida se comportará como se fosse o catodo de uma célula galvâ nica (ou pilha) para evitar a oxidação do material base (Dutra e Nunes, 1987). Tal proteção é feita estabelecendo-se um novo circuito em relação ao material base, sendo esse novo eletrodo imerso na solução eletrolítica para funcionar como o anodo da célula (Figura 1).
Esquema representativo da proteção catódica (Gentil, 1989).
Esta nova célula altera o potencial que provoca a corro são do metal, alterando assim o fluxo de elétrons. Ou seja, os elétrons saem do novo metal e tem seu fluxo em direção aos dois catodos da célula. Assim, o metal que sofrerá a in fluência do meio corrosivo não será mais o metal base. Fre quentemente utilizam-se os metais magnésio ou alumínio que são dissolvidos (ou consumidos) aos poucos e, portan to, devem ser substituídos constantemente para que haja continuidade da proteção (Damaskin e Petri, 1985).
A proteção catódica é muito empregada em estruturas enterradas ou submersas que estão em contato constante com eletrólitos. Está sendo aplicada com sucesso no mundo inteiro e é cada vez mais utilizada no Brasil (Gentil, 1989). Neste momento, o professor pode explorar esta aplicação na forma de pesquisas e debates, caracterizando as ativida des pós-laboratório porque nem todos os estudantes esco lherão este método para resolver o problema.
Se a escolha for a proteção anódica, este método consiste em aplicar uma corrente anódica na estrutura a ser protegi da. Esta corrente induz a formação de uma película proteto ra no metal base, além de manter a estabilidade da mesma, pois origina uma polarização anódica que possibilita a pas sivação do material metálico (Ticianelli e Gonzales, 1998).
Neste caso existem duas reações anódicas possíveis na célula: a do metal base e do metal menos nobre (metal de sacrifício). Como a corrente anódica provoca a passivação no metal de interesse, a única reação anódica que ocorre é aquela do novo anodo, evitando assim a corrosão do mate rial (Ticianelli e Gonzales, 1998).
Por fim, mas não menos importante está o uso dos inibi dores de corrosão. Eles podem ser substâncias puras (inor gânicas ou orgânicas) ou podem estar em misturas. Tais substâncias promovem uma acentuada diminuição nos processos corrosivos, sobretudo, nos materiais metálicos (Brett e Brett, 1996). Normalmente são espécies que apre sentam em sua estrutura química átomos de nitrogênio ou enxofre e atuam bloqueando parcialmente a superfície, di minuindo a velocidade das reações (Ticianelli e Gonzales, 1998). O professor pode, como atividade pré-laboratório, debater a presença e a função desses heteroátomos na es trutura química dos inibidores de corrosão. Pode ser uma discussão dialógica ou uma indicação de leituras que insti garão os estudantes para propor a resolução do problema.
Os inibidores são classificados de acordo com o desloca mento do potencial que provoca a corrosão, existindo os inibidores catódicos, anódicos e de adsorção. Os inibidores anódicos são os que deslocam o potencial no sentido anó dico. Eles agem minimizando a reação que ocorre no anodo, reagindo com o produto formado pelo meio corrosivo e produzindo um filme aderente e insolúvel na superfície do metal. Alguns desses inibidores anódicos são os hidróxidos, os carbonatos, os silicatos, os boratos e os fosfatos terciá rios (Gentil, 1989).
Os inibidores catódicos reprimem as reações que ocor rem no catodo, fornecendo íons metálicos capazes de reagir com a basicidade catódica, ou seja, com os íons hidróxidos formados na reação que promovem a formação de compos tos insolúveis que protegem a região catódica. Isto impede a condução ou a transferência de elétrons para a reação de oxidorredução. Exemplos dessas substâncias são: sulfatos de zinco, de magnésio ou de níquel (Gentil, 1989).
Os inibidores de adsorção funcionam como uma película protetora na superfície metálica. Tais substâncias, sobretu do as orgânicas com grupos fortemente polares, são adsor vidas pelo metal, formando-se assim uma película protetora. Essa adsorção protege os metais contra ataques excessivos de ácidos, os quais provocam a liberação de gás hidrogênio, que é facilmente adsorvido por causa de seu pequeno volu me, fato que diminui a resistência mecânica da estrutura metálica (Gentil, 1989). Entre as substâncias mais usadas estão os coloides, os sabões de metais pesados e os com postos contendo átomos de oxigênio, nitrogênio ou enxofre.
Tais inibidores estão se constituindo na mais viável solu ção para se evitar ou minimizar a corrosão. Já existem vá rias pesquisas estimuladas por indústrias no sentido de desenvolvê-los e aperfeiçoá-los (Gentil, 1989). No entanto, para que a utilização dos inibidores seja satisfatória, de vem-se considerar alguns fatores como as causas da corro são que o sistema está sofrendo (de modo a conhecer qual inibidor empregar), o custo-benefício em relação ao preço dos inibidores e os danos causados pela corrosão sem a uti lização dos mesmos.
Cabe ressaltar que a proposta aqui apresentada busca utilizar a experimentação investigativa para promover a aprendizagem dos estudantes. Para tal, defende-se que o uso de atividades experimentais com nível de investigação dois e/ou três (N2 e/ou N3) aliado a atividades pré e pós-la boratório são essenciais para atingir tal objetivo. De início, o professor pode empregar a experimentação com nível de investigação dois para sentir as dificuldades dos estudantes. No decorrer do tempo é interessante explorar atividades de nível três, nas quais os estudantes desenvolverão todas as etapas experimentais.
Considerações finaisA corrosão e seus meios de proteção se apresentam em vários setores sociais e cotidianos, contudo são poucos explorados tanto em nível médio como em nível superior. Portanto, conhecer o uso de revestimentos, inibidores de orrosão e as proteções catódicas e anódicas são de extrema valia para essa discussão. Dessa maneira, a proposta de utilizar a experimentação investigativa com atividades que abordem diferentes níveis de investigação pode ser empregada pelo professor, principalmente o professor universitário, onde a experimentação é utilizada de forma arcaica e ateórica, com roteiros pré-estabelecidos e na maioria das vezes sem concretude e profundidade nas discussões dos resultados, com o intuito de promover uma formação mais crítica e sólida dos estudantes.
Apesar de ser proposto um tipo de problema, não neces sariamente o professor precisa utilizá-lo em sua aula. No entanto, o problema pode servir de modelo para que o pró prio professor e estudantes comecem a desenvolver proble mas que explorem não só conteúdos específicos, mas que problematizem a realidade de cada um. Assim, espera-se que tal abordagem possa proporcionar subsídios para uma fuga da tradicional experimentação apresentada nos cursos de ensino superior e também nos cursos de ensino médio.