The present paper shows how to teach quantum numbers. It demonstrates the use of an electronic configuration, from only two of the four existing quantum numbers. This didactic strategy works if simple and everyday-living concepts are applied, acting as a didactic tool for learning chemistry. The explanation of the four existing quantum numbers in the atom, its values, characteristics and roles, is attained.
La química es un tema difícil para los estudiantes. Las dificultades pueden ser propias del aprendizaje humano, así como de la naturaleza intrínsecamente abstracta de la asignatura (Johnstone, 2000, p. 9). La química es un mundo lleno de fenómenos interesantes, atractivas actividades experimentales y de conocimiento fructífero para la comprensión del mundo natural y artificial; sin embargo, es compleja (Chiu, 2005). Los dos autores nos muestran que la enseñanza y el aprendizaje de la química no es un proceso sencillo, ya que la motivación es un factor preponderante. A su vez diversos investigadores han manifestado en los últimos años los contenidos conceptuales básicos que creen deberían formar parte del currículo de química (Gillespie, 1997; Caamaño, 2003; Atkins, 2005). Padilla (2006) manifiesta y analiza la estructura de los conceptos centrales de la química en diferentes textos (Garritz y Chamizo, 2001; Caamaño y Obach, 2000; Quílez, 2006); asimismo, Atkins (2005) plantea una forma simple para abordar el problema de la enseñanza basada en la aplicación de la lógica disciplinar, pero finalmente la didáctica de la ciencia planteó una forma metodológica efectiva basada en la construcción de modelos químicos durante las clases (Justi y Gilbert, 2002; Halloun, 2007; Izquierdo y Aliberas, 2004; Gutiérrez, 2004). De hecho, suele considerarse importante que los alumnos que aprendan modelos, y que sean capaces de imaginarlos y usarlos, como también de reconstruirlos (Oliva y Aragón, 2009). Estos dos investigadores recogen un riguroso trabajo de la función de los modelos y la modelización en la enseñanza. Por su parte, Harrison y Treagust (2000), plantean que modelar es la instancia de pensar y trabajar científicamente, y de Gilbert (1993), tomamos la afirmación, de que la ciencia y sus modelos son inseparables, porque los modelos son los productos de la ciencia, y a la vez, son sus métodos y herramientas de trabajo.
Este enfoque busca que el educando logre interpretar los hechos e imaginar los procesos microscópicos que explican el mundo material macroscópico (Prieto, Blanco y González, 2000; Mortimer, 2000). Los modelos que se usan están impregnados de las teorías propuestas por sus creadores, para que sean instrumentos explicativos con diferentes grados de satisfacción para los educandos y se logre comprender de una mejor forma el contenido tratado.
ObjetivoDesarrollar un modelo físico, construido con materiales existentes en la vida diaria, que permite explicar didácticamente a los educandos las reglas de llenado de los estados electrónicos en el átomo, y cómo aplicarlas para construir la tabla periódica de los elementos.
Materiales- •
Trozo de madera
- •
Chinches de color
- •
Hilo
Este trabajo corresponde a una experiencia didáctica que se llevó a cabo con estudiantes de ingeniería, mientras se trataba la unidad de estructura atómica y tabla periódica, basándose en los siguientes pasos metodológicos:
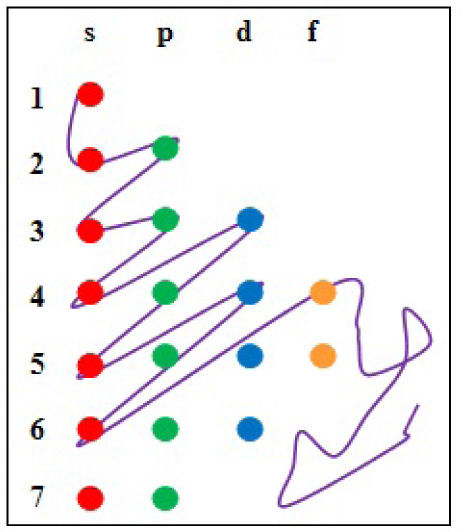
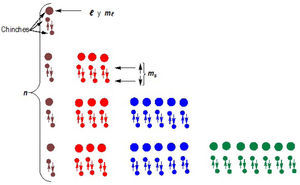
Diseño para el procedimental 1En un primer modelo se construirá un diagrama utilizando la regla de suma (n + l) o LSPT (Janet, 1929) o de Madelung (1922) (Stewart, 2010; Bent, 2006; Meek y Allen, 2002), considerando el principio de mínima energía y el principio de Aufbau o construcción progresiva, de Niels Bohr (Kotz, Trichel y Weaver, 2005; Engel y Reid, 2006; Santamaría, 1974; Garritz y Chamizo, 1994). Para ello se corta un trozo de madera y se dibujan los puntos de intersección de los números cuánticos n y l, donde en cada punto se pinchan chinches con cabeza de color, asegurándose que los orbitales s,p, d y f sean de distinto color. Con un hilo se ata el primer chinche y se desarrolla el proceso de llenado, según la cantidad de electrones del átomo a analizar (figura 1).
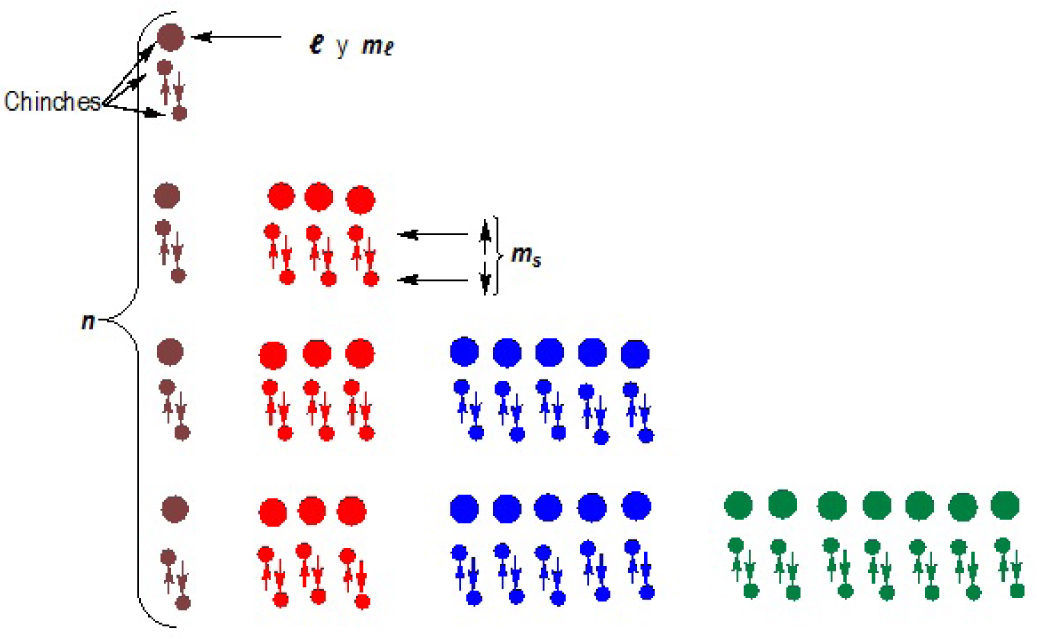
Con este modelo es factible explicar la ubicación del electrón de acuerdo con los números cuánticos n y l, pero no se evidencia a simple vista los demás números cuánticos, ml y ms, implicando que al modificar el diagrama, se describe la posición de los cuatro números cuánticos (n, l, ml y ms ), logrando ser localizados directamente, así como se observa en la figura 2 y en la tabla 1.
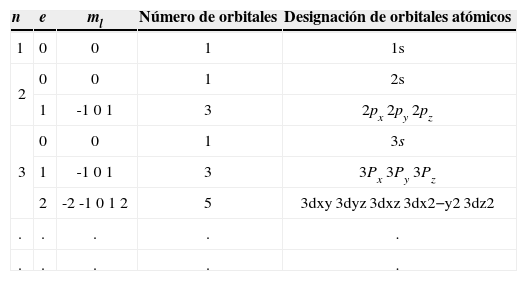
Relación entre los números cuánticos y los orbitales atómicos.
| n | e | ml | Número de orbitales | Designación de orbitales atómicos |
|---|---|---|---|---|
| 1 | 0 | 0 | 1 | 1s |
| 2 | 0 | 0 | 1 | 2s |
| 1 | -1 0 1 | 3 | 2px 2py 2pz | |
| 3 | 0 | 0 | 1 | 3s |
| 1 | -1 0 1 | 3 | 3Px 3Py 3Pz | |
| 2 | -2 -1 0 1 2 | 5 | 3dxy 3dyz 3dxz 3dx2−y2 3dz2 | |
| . | . | . | . | . |
| . | . | . | . | . |
Extraída del libro Química (Chang, 2007, p. 288, tabla 7.2).
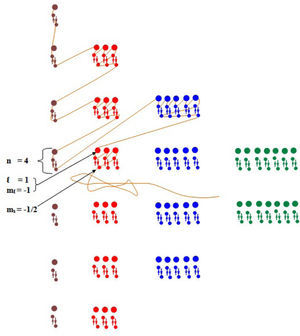
Utilizando el mismo tablero de madera de la figura 1 se pincharán en cada lugar donde se encuentren los números cuánticos l, ml y ms de la figura 2, chinches de colores como se presenta en la figura 3, para luego dibujar con lápices de colores flechas y formas, similares a los chinches, como se indica en la figura 4, formando un nuevo modelo.
Repetiremos el procedimiento para todas las posiciones de números cuánticos (figura 3).
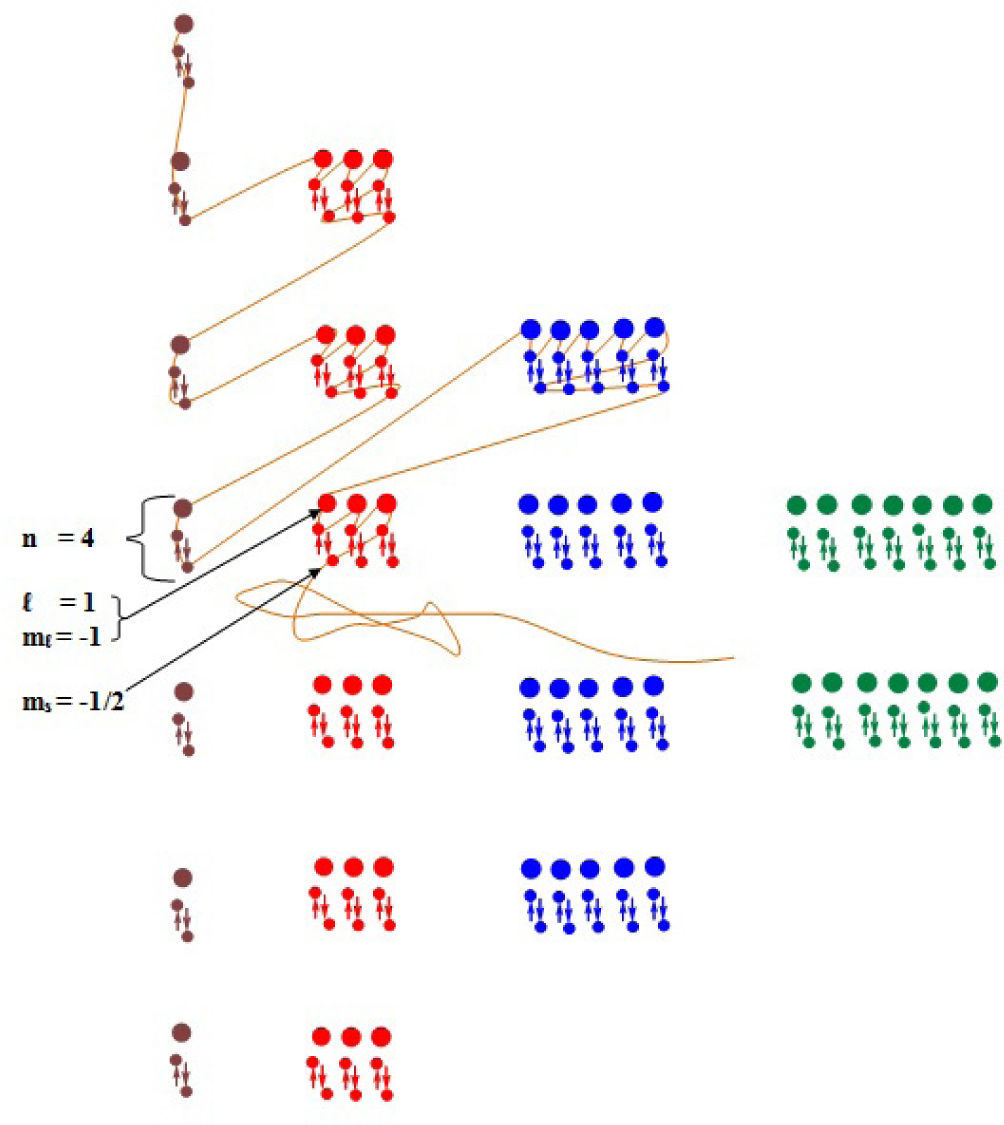
Construido el segundo modelo, ataremos un hilo en el primer chinche y comenzaremos el proceso de acuerdo al diagrama, tal como se indica en la figura 5, para el ejemplo 1; determinar los cuatro números cuánticos para el átomo Se = 34.
ConclusionesDe la figura 5, ejemplo 1, podemos concluir que el modelo explica las reglas de llenado de los estados electrónicos de los electrones, además describe de manera didáctica y simple los cuatro números cuánticos en el átomo de selenio (Se), implicando que de esta forma se puede orientar a los educandos sobre la posible ubicación del electrón en la órbita, como lo especifica el modelo de la tabla periódica.
En una experiencia realizada utilizando el modelo en clase de química general -cuando se trataba la unidad de estructura atómica y tabla periódica para alumnos de primer semestre de las carreras de ingeniería mecánica, ingeniería en construcción e ingeniería en mecatronica de la Universidad de Talca- se puede concluir que el total de alumnos existentes en la sala de clases comprendieron la ubicación de los números cuánticos, como también la ubicación del electrón dentro de los diferentes orbitales, para los distintos átomos analizados de la tabla periódica. En preguntas elaboradas tales como:
- 1.
Indique cuántos y cuáles números cuánticos es posible determinar en la estructura Na = 11 [Ne]10 3s1.
- 2.
Dada la siguiente configuración electrónica 1s2 2s2 2p6 3s23p1 indique el valor para cada uno de los números cuánticos.
- 3.
¿Qué tipo de orbital puede estar ocupado por un electrón con los números cuánticos n = 5, l = 3?, ¿Cuántos orbitales de este tipo pueden encontrarse en un átomo multielectrónico?
Usando el modelo y escribiendo la configuración electrónica normal para el átomo, nos da Se = 34 [Ar]18 4s2 3d10 4p4, significa que en su orbital mas externo presenta 4 electrones, implicando que el número cuántico principal toma el valor den = 4.
El número cuántico azimutal o de momento angular (l), toma el valor de l=1, debido a que el último subnivel involucrado es “p”. Ahora como l= 1, implicará entonces que el número cuántico magnético (ml), tomará los valores de -1, 0, +1, y de acuerdo a lo que indica el superíndicede la última capa (p4), son cuatro los electrones que se deben alojar en los tres orbitales p. Aplicando el principio de exclusion de Pauli y el principio de máxima multiplicidad de Hund, debemos decir entonces, que los tres primeros electrones se ubicarán uno en cada orbital, mientras que el cuarto se acomodará en el primero (de acuerdo con el supuesto que los valores 1-, 0, +1 se asignen a los suborbitales px, py, pz respectivamente), tal como se muestra en el modelo, resultando entonces que el valor de ml = −1.
Finalmente para asignar el valor del número cuántico de spin (ms), es vital tomar en consideración el signo que se le da al primer electrón de cada orbital (suponiendo al primero + ½), entonces “ms”, en este caso será −½, tal como lo muestra el modelo.
En resumen para el último electrón de 4p4, se obtienen los siguientes valores de los números cuánticos:
N=4 l=1 ml=-1 ms = −½
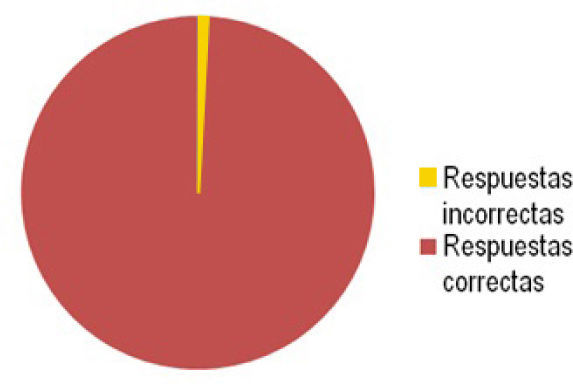
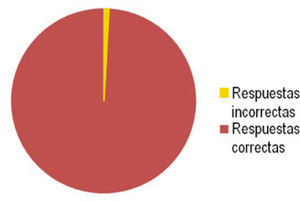
El 99,5% de un total de 147 alumnos de las tres carreras anteriormente mencionadas, respondieron en forma correcta, mientras que al 0,5% restante solo le falto indicar algunos valores (gráfico 1), de tal forma que se debió reforzar con una ayudantía (repetir la clase), concluyendo entonces que el modelo es efectivo, práctico y fácil de entender para los educandos.
El gráfico 1 muestra el resultado estadístico de las respuestas con base en las preguntas realizadas a los 147 estudiantes, participantes de esta actividad.