A ciência tem sido ensinada e compreendida pelos alunos como resultado de eventos lineares no tempo, sucessivos e interligados. Essa forma de pensar sobre o trabalho científico tem levado ao mau entendimento da natureza da ciência. Objetivando contribuir para combater essa distorção na percepção da ciência, o presente trabalho relata uma breve revisão bibliográfica sobre os conceitos de ácidos e bases, partindo‐se da análise do avanço dessas definições na história, especialmente no século XIX e XX, que é representada por meio de um mapa cronológico que interrelaciona as linhas de pesquisa científica dos principais pesquisadores que desenvolveram definições para ácidos e bases nessa área. O mapa cronológico pretende ser uma ferramenta didática eficiente para ilustrar a evolução da ciência no desenvolvimento das definições ácido‐base. Tem‐se como finalidade sua utilização em sala de aula, pois permite ao aluno compreender as conexões das definições científicas e analisar o perfil da evolução dos trabalhos científicos.
Science has been taught and understood by students as a result of events in linear time, successive and interrelated. This way of thinking about the scientific work has led to the misunderstanding of the nature of science. To contribute to combat this distortion in the perception of science, this study aims to report a literature review on the concepts of acids and bases, starting from the analysis of the progress of these theories in history, especially in the nineteenth and twentieth century. The progress of these theories is represented by means of a chronological map that interrelates the scientific research lines of the main researchers that have developed theories that area. The chronological map aims to be an effective teaching tool to illustrate the evolution of science in the development of acid‐base theories. It may be used in the classroom by allowing students to understand the connections of scientific theories and analyze the profile of developments in scientific work.
Embora as definições de ácidos e bases sejam tópicos presentes na maioria dos livros‐texto de química de ensino médio, suas abordagens em sala de aula estão limitadas a reproduções dos conteúdos dos livros didáticos. Esses, por sua vez, abordam meramente definições conceituais em uma sequência de eventos lineares e sucessivos, limitando‐se aos cientistas cujas linhas de pesquisas tiveram continuidade ao longo do século XX. Contudo, sabe‐se que nem sempre o avanço da ciência tem aspectos de uma construção coletiva harmoniosa. Pelo contrário, o estudo da história da ciência tem revelado que a ciência avança mais intensamente com divergências de interpretação de fenômenos (Chalmers, 2013; De Mello, Pietrocola e Andrade, 2011).
A apresentação dessas definições em salas de aula como um produto acabado, indiscutível, acumulativo, linear e neutro, promove o que Pérez, Montoro, Alís, Cachapuz e Praia (2001) caracterizam como as 7 visões distorcidas de ciência. O que, por sua vez, contribui para que muitos estudantes precocemente se desinteressem por entender ciência e o trabalho científico (Hodson, 1982).
Além disso, aqueles estudantes que conseguem superar as dificuldades de compreender ciência, prosseguem na área da química e ingressam na docência, normalmente reproduzem os conceitos de ciência da mesma maneira que aprenderam, originando‐se um círculo vicioso, muitas vezes prejudicial para a formação de novos alunos.
Com o intuito de combater essa visão distorcida do trabalho científico e as diferenças entre os textos originais e os apresentados nos livros didáticos, este trabalho descreve uma revisão panorâmica sobre as definições ácido‐base na história da química.
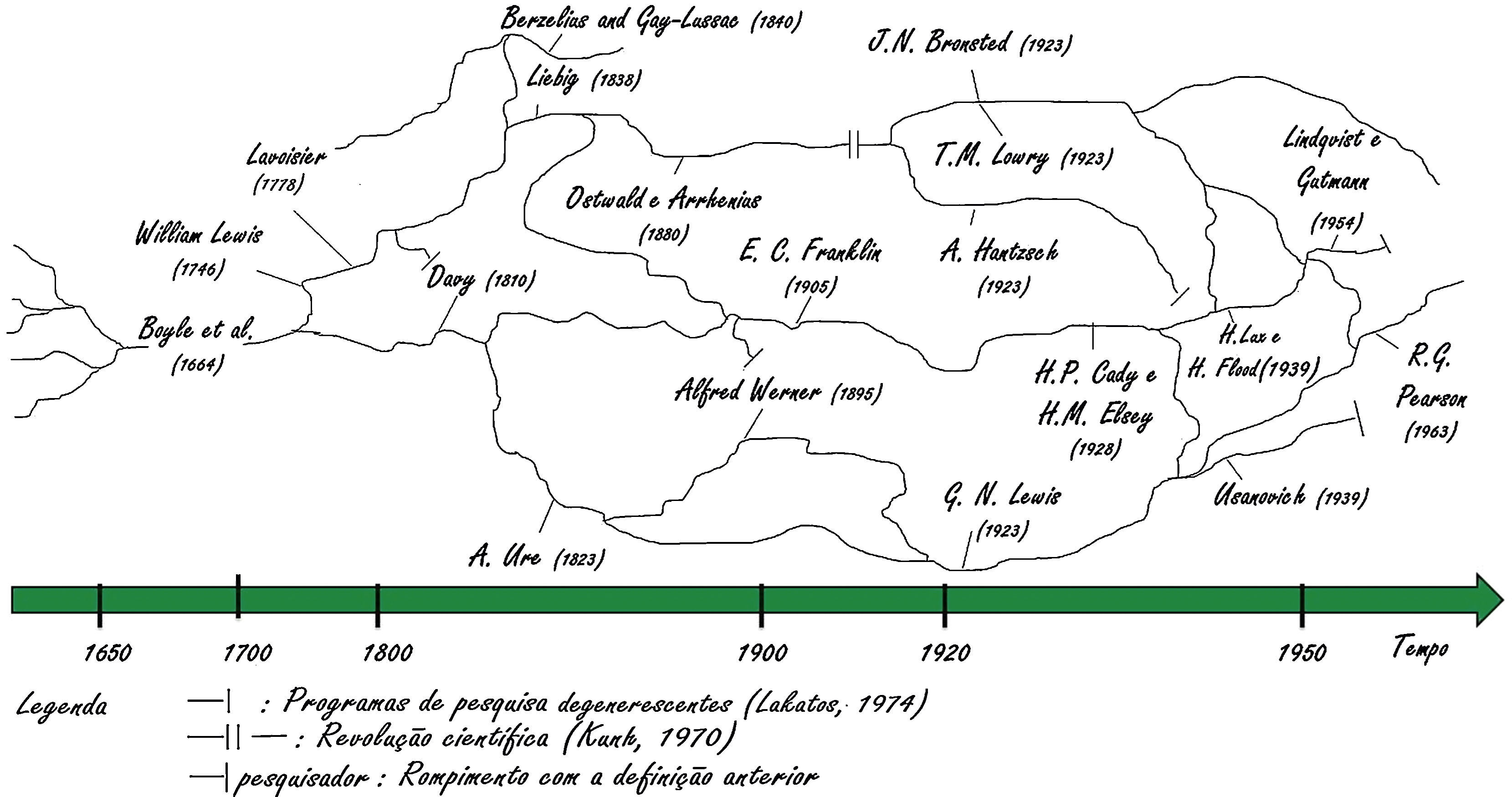
Representação no mapa cronológicoSão muitos os autores pela linha‐tempo que publicam trabalhos científicos para classificar, interpretar e definir um ácido ou uma base. A origem do termo ácido é do latim acidus, que significa azedo. A expressão base foi introduzida pelo francês H. L. Duhamel du Moncea (1700‐1782) em 1736, porém o conhecimento de substâncias com características opostas às dos ácidos já existia desde a antiguidade e eram designadas como álcali, do árabe al qaliy, que significa cinzas vegetais (Jensen, 1980).
Para entender as relações complexas das definições ácido‐base do passado até os dias de hoje, desenvolveu‐se um mapa cronológico, figura 1, que será discutido ao longo deste ensaio.
Para facilitar a leitura e compreensão do mapa faz‐se necessário compartilhar alguns códigos:
- ‐
As linhas sinuosas do mapa referem‐se aos trabalhos científicos que foram construídos por tentativa e erro, a partir dos quais pesquisadores criaram hipóteses, que são anteriores às observações e experimentos, defendidas previamente com argumentações incipientes, contraditórias à ciência da época e até filosóficas (Martins, 2006).
- ‐
As terminações com um traço indicam a parada daquela linha de pesquisa, ou seja, não houve mais adeptos a fim de publicar mais trabalhos nestas ideias iniciais. Essa simbologia refere‐se a pesquisas em degeneração. Compara‐se ao que Lakatos (1974) descreveu na sua filosofia da ciência sobre declínio de programas de pesquisa (programas de pesquisas degenerescentes) e isso acontece quando os ajustes no cinturão protetor são ad hoc, isto é, não contribuem em previsões de fatos inéditos.
- ‐
as ligações entre linhas com 2 traços seguidos indicam uma revolução científica ou rompimento com a anterior. Isso ocorreu quando os pesquisadores perceberam que as linhas de pesquisas que seguiam não conseguiam explicar fatos novos ou que eram incipientes para época. Mantiveram as ideias principais da definição anterior e propuseram novas hipóteses capazes de explicar novos fenômenos e se expandir. Esses eventos são comparáveis aos paradigmas de Kuhn (1970), que propõe que os cientistas, antes de aceitarem um novo paradigma, devem passar por um processo de rompimento com o antigo paradigma.
- ‐
As linhas sinuosas no mapa que terminam com um traço, que está em frente um nome de pesquisador tem o objetivo de indicar que o pesquisador criticou veementemente as definições proposta que seguiram a linha sinuosa até a terminação com o nome do pesquisador. Desta maneira, tais definições divergem das proposta de definição do pesquisador.
- ‐
Algumas conexões de linhas sinuosas entre pesquisadores contemporâneos não foram representadas para não deixar o mapa muito complexo e confuso. A ausência destas conexões não indica que estes pesquisadores não tinham conhecimento ou não receberam influência das propostas uns dos outros. Portanto, é possível que Gilbert Newton Lewis (1875‐1946) e outros pesquisadores poderiam ter em algum momento da sua vida, o conhecimento e a influência na sua linha de pesquisa de outros pesquisadores como Svante August Arrhenius (1859‐1927), Johannes Nicolaus Brönsted (1879‐1947), Thomas Martin Lowry (1874‐1936), entre outros, que no mapa não se apresentam conectados.
É provável que tenham havido inúmeros trabalhos anteriores ao de 1664, escrito por Robert Boyle (1627‐1691); porém, o mapa cronológico limita‐se aos trabalhos posteriores a ele. O livro «Experimental History of Colours» de Boyle tem um papel importante, porque contém resultados de trabalhos dos séculos anteriores ao XVII (Chagas, 2000) e contribui para a tese de que os trabalhos científicos são uma construção coletiva e que dificilmente um cientista começa um trabalho do acaso, queremos dizer, eles não inventam a roda, apenas entram nela.
Essa coletividade e influência de outros autores a Boyle estão representadas no mapa cronológico por ramificações e conexões anteriores à sua publicação. Após Boyle, no final do século XVII, demais pesquisadores definiram propriedades dos ácidos em frente a outras substâncias, por exemplo, em 1746, Willian Lewis1 (1708‐1781) caracterizou como propriedades de ácido gosto azedo e efervescência com cal, e as bases consequentemente foram classificadas com repostas contrárias à dos ácidos (Bell, 1947). A partir de uma teoria de combustão, em 1789, Antoine Laurent Lavoisier (1743‐1794) afirmou que «o oxigênio é o princípio acidificante», ou seja, substâncias ácidas deveriam apresentar na estrutura molecular o elemento oxigênio (Bell, 1947, p.113).
Um fato inusitado desta descrição de Lavoisier1,2 é que, 2 anos antes de sua afirmação, Claude Louis Berthollet2 (1748‐1822), em 1787, já havia descrito vários ácidos que não possuíam oxigênio, como cianeto de hidrogênio e sulfeto de hidrogênio3 (Jensen, 1980). Para nossa surpresa maior, a definição de Lavoisier foi apoiada por Jöns Jacob Berzelius4 (1779‐1848) e Joseph Louis Gay‐Lussac (1778‐1850) até 1840, apesar de vários trabalhos sobre ácidos ausentes de oxigênio já terem sido publicados no período. Esse episódio mostra como a ciência é conduzida por homens falíveis e que são influenciados politicamente, independentes de razões científicas, que muitas vezes apoiam teorias falseadas de cientistas famosos (Martins, 2006). Humphry Davy (1778‐1829) também descreveu vários ácidos que não contém oxigênio em 1810 (Chagas, 2000, p.128), mas antes mesmo de descrever ácidos já afirmava ser errado acreditar que o cloro5 tinha oxigênio porque era um ácido. Ele ainda fez a declaração que permeia nas bases das definições de ácidos atuais: «acidez não depende de qualquer substância elementarmente particular, mas depende do arranjo peculiar de várias substâncias» (Bell, 1947, p. 113). Embora tenha feito esta expressão de opinião, posteriormente estava em ascensão a ideia de que os ácidos contêm hidrogênio e H. Davy compartilhou desta descrição.
De uma extremidade a outraComo pode‐se observar, após o ano de 1800 surgem 2 pesquisadores representados no mapa cronológico em linhas distanciadas, que se devem ao fato de suas definições sobre ácidos serem antagônicas. De certa maneira, suas concepções influenciaram as definições que são empregadas nos dias atuais.
Em 1823, Andrew Ure6 (1778‐1857) escreveu: «.. não há um princípio [elemento] acidificador, nem critério absoluto da escala de força entre os diferentes ácidos... [acidez e alcalinidade dependem mais] do modo como os constituintes estão combinados que da natureza dos constituintes em si» (Chagas, 2000 p.128). Essa linha de pesquisa que A. Ure propôs tem influência nos conceitos empregados até atualmente. Observa‐se que essa linha do mapa constitui a «árvore cronológica» das definições de G. N. Lewis e M. I. Usanovich (1894‐1981) para ácidos e bases.
Na parte superior do mapa vê‐se Justus von Liebig7 (1803‐1873). Em 1838, ele escreveu que a classificação de ácidos como composto contendo hidrogênio estava de acordo com o comportamento de ácidos orgânicos, e ainda definiu os ácidos como «... compostos contendo hidrogênio, em que o hidrogênio pode ser substituído por metais...» (Bell, 1947, p. 114; Jensen, 1980, p.25).
É interessante observar que tanto J. V. Liebig quanto A. Ure receberam influências de H. Davy. No entanto, cada um segue uma postura diferente quanto à compreensão da natureza das substâncias ácidas e básicas. A. Ure, defensor da relatividade quanto à classificação e J. V. Liebig, defensor categórico da classificação de ácidos como compostos contendo hidrogênio. Nesse sentido, há um extremismo entre esses pesquisadores. Descreve‐se isso no mapa cronológico com o afastamento de suas linhas do tempo.
A teoria de dissociação eletrolíticaJ.V. Liebig e A. Ure tiveram prestígio até ao advento da teoria de dissociação eletrolítica. Esta foi escrita em 1880 por Friedrich Wilhelm Ostwald (1853‐1932) juntamente com S. A. Arrhenius, que abrangia um vasto campo de conhecimentos e possibilitava, na época, a expansão para outras linhas de pesquisas. As pesquisas de F. W. Ostwald e S. A. Arrhenius2 na dissociação eletrolítica, durante 1880‐1890, mostravam considerações que apenas as espécies hidrogenadas que produzem íons hidrogênio em solução aquosa podem dar origem a propriedades ácidas, bem como a constante de dissociação como um parâmetro da força do ácido (Arrhenius, 1903); (Arrhenius, Caldwell e Wold, 2008). Em nossa avaliação, a definição de S. A. Arrhenius apresenta contribuições do extremismo associado a J. V. Liebig com relação à definição de ácidos, por limitar ácidos apenas às espécies que em solução aquosa liberam íons hidrogênio.
Pouco tempo após a sua publicação, a definição de ácido e bases de S. A. Arrhenius, em 1895, foi contestada por Alfred Werner (1866‐1919), maior nome da química de coordenação, que fez uma série de críticas aos conceitos de S. A. Arrhenius e de J. V. Liebig (Jensen, 1980). Contudo, a definição de ácidos por S. A. Arrhenius tem sido ensinada e relatada em livros‐texto como a definição mais adequada. Constata‐se ainda atualmente, na maioria dos livros didáticos de química de ensino médio, que essa definição é apresentada sem qualquer consideração quanto às limitações de suas aplicações.
Outra definição de ácido‐base publicada em 1905, que competiu com a de S. A. Arrhenius, foi de Edward Curtis Franklin8 (1862‐1937), chamada de sistemas de solventes de ácidos e bases. Nela, a definição de ácidos e bases é modificada de acordo com o solvente a ser utilizado. Essa definição destaca‐se por não ser extremista e ser relativa, sendo diferente das que estavam em ascensão na época.
Segundo a definição de ácidos e bases de E. C. Franklin, ácido é tudo que faz aumentar a concentração do cátion característico do solvente e base é o que aumenta a concentração do ânion característico. A neutralização é a formação do solvente a partir destes cátions e ânions4. Essa definição foi posteriormente apoiada por Hamilton Perkins Cady (1874‐1943) e Howard McKee Elsey9 (1891‐1982), no ano de 1928, com baixíssimos acréscimos (Bell, 1947; Jensen, 1980).
O ano de 1923 mostrou ser o ano em que o assunto de definição de ácidos e bases estava em ascensão entre os cientistas. Foram apresentadas 4 definições ácido‐base independentemente das demais, em um curto espaço de tempo. Os autores foram J. N. Bronsted; T. M. Lowry; G. N. Lewis; e Arthur Rudolf Hantzsch10 (1857‐1935).
É importante destacar que o fato de 4 autores publicarem trabalhos distintos na mesma época mostra outra face do trabalho científico, que é o crescimento rápido de linhas de pesquisa dentro do mesmo tema. Constata‐se que cientistas são influenciados por grandes crises científicas do momento, ou seja, seus trabalhos refletem a busca por respostas de perguntas da sociedade. Esse cenário evidencia que pesquisadores não são pessoas isoladas e prisioneiros de laboratório, em torres inalcançáveis às demandas de sua sociedade (Pérez et al., 2001).
O dinamarquês J. N. Brönsted publicou os resultados de seus trabalhos na revista Recueil des Travaux Chimiques des Pays‐Bas com o título «Algumas observações sobre o conceito de ácidos e bases». Nesse trabalho, ele identificou as falhas na definição de S. A. Arrhenius e fez sugestões para acabar com a divergência entre cientistas. Acontecimento declarado em seu artigo científico. Desde a criação da teoria da dissociação eletrolítica por Arrhenius, a definição dominante de ácidos e bases como substâncias que podem dividir‐se em íons de hidrogênio ou hidroxila em solução nunca foi tão seriamente atacado no que se refere à definição (Brönsted, 1923, p. 718).
Mais adiante, J. N. Brönsted afirma no seu texto que para ele era inaceitável dizer que ácido ou base são características relativas aos solventes envolvidos na reação. Isso dá indícios dele ter conhecimento de outras linhas de pesquisa além do trabalho de S. A Arrhenius, no caso E. C. Franklin (1905), já mencionado anteriormente, mas que ele decidiu não seguir. Se aceitarmos o esquema (3)5como uma expressão adequada para caracterizar bases, seremos forçados a dar uma definição especial de uma base para cada solvente especial. No entanto, em princípio, propriedades ácidas e básicas são independentes da natureza do solvente, e os conceitos de ácidos e bases são, na verdade, características tão gerais que devemos considerá‐las um requisito necessário desse conceito geral para formular um padrão independente da natureza de um solvente arbitrário (Brönsted, 1923, p. 719).
No mapa cronológico destaca‐se o aspecto de parcialidade científica que é intrínseco na sua elaboração, justificando a posição de J. N. Brönsted em uma das extremidades, por causa da divergência com as definições que consideravam a relatividade dos ácidos frentes aos reagentes.
T. M. Lowry era um pesquisador inglês e publicou seu trabalho no periódico Journal of Society of Chemical Industry, com o título «The uniqueness of hydrogen» ou «A exclusividade do hidrogênio», e pretendia relacionar a diversidade de propriedades do hidrogênio. É notável que T. M. Lowry fazia muito o uso de conceitos cristalográficos para exemplificar e defender os resultados de sua pesquisa (Jensen, 2016).
Em nossa compreensão, J. N. Brönsted teve participação no que diz a respeito à formação de bases conjugadas e ácidos conjugados em reações químicas. Enquanto a definição de ácido ou base segundo liberação ou aceitação de próton deve‐se a publicações de Lowry, fazendo menção a outros participantes (Jensen, 2016; Lowry, 1923).
O pesquisador não muito conhecido atualmente é A. R. Hantzsch, de nacionalidade alemã. Ele produziu uma definição de pseudo‐ácidos com vários resultados experimentais que o fizeram ser citado pelos demais pesquisadores. Contudo, suas interpretações e termos foram contestados por vários autores (Bell, 1947, p. 121). O que provavelmente indicaria o motivo de não aprendermos suas definições nos livros‐texto do século XXI.
O último grande nome de 1923 foi G. N Lewis, cientista norte‐americano, que publicou um livro intitulado de «Valence and the structure of atoms and molecules». Nesse trecho ele faz várias possibilidade de definir ácidos e bases justificando seu uso e desuso, até chegar à definição que é adotada por ele como mais convincente e que conhecemos hoje (Hildebrand, 1958). No prefácio do livro, Lewis esclarece aos leitores que o livro é uma obra em conjunto de pesquisadores, e que os resultados e discussões advém do grupo de seu laboratório, sendo ele somente o editor do grupo. Para os meus colegas e alunos da Universidade da Califórnia, sem cuja ajuda este livro não teria sido escrito. Em nossos muitos anos de discussão sobre os problemas da estrutura molecular e atômica, algumas das ideias aqui apresentadas surgiram a partir do grupo em vez de partir de um indivíduo; de forma que eu estou agindo apenas como editor para este grupo (Lewis, 1923, p. 7).
Essa afirmação de Lewis contribui para uma visão mais complexa do trabalho científico que compartilhamos. Uma concepção que difere de uma visão distorcida da natureza da ciência, na qual se faz uso da história para heroificação tendenciosa de um único indivíduo, a fim de exaltá‐lo como descobridor ou inventor de algo solitariamente (De Mello et al., 2011).
É interessante ressaltar que J. N. Brönsted, T. M. Lowry e G. N. Lewis fizeram interpretações de suas definições baseados em soluções de amônia para justificar seus pontos de vistas. Esse fato pode ter advindo do «estrondo» que a descoberta do mecanismo da síntese da amônia por Fritz Haber, no ano de 1908, fez e que levou a sua premiação de Nobel em 1918. Com sua premiação e sua notabilidade chegando a nível mundial nos anos que antecederam às definições desses pesquisadores, possivelmente, o estudo da amônia era muito atual e estava «na moda».
Na sequência da descrição do mapa cronológico, chega‐se a H. P. Cady e H. M. Elsey em 1928, que propuseram uma definição de ácidos e bases baseados em ânions e cátions do solvente em questão. Mas eles não foram os únicos a investir nesses conceitos, nem os primeiros, porque sua definição é uma expansão da definição de sistemas de solvente de E. C. Franklin. Por isso, no mapa cronológico eles são representados em uma linha sequencial a E. C. Franklin. Contudo, as definições de H. P. Cady e H. M. Elsey não ganharam forças em nível mundial.
No ano de 1939, houve mais uma expansão quanto às definições de ácidos e bases, denominada «sistemas solventes», com influências da definição protônica. Referimo‐nos a definição de Hermann Lux (1904‐1999) e Hakon Flood11 (1905‐2001) que ampliava os sistemas de definições de ácidos e bases; porém, a entidade transferida é o ânion O2− ao invés do próton. De acordo com H. Lux e H. Flood, um ácido é o receptor do ânion óxido O2‐ e uma base é um doador desse ânion (Flood e Forland, 1947).
Uma nova definição ácido‐base que seguiu as características da definição de G. N. Lewis foi a de M. I. Usanovich12 (1894‐1981) do ano de 1939, que generalizava todas as demais anteriores. Descrevia um ácido como a espécie que reage com base para formar sais, doando cátions ou aceitando ânions ou elétrons, e base como a espécie que reage com ácidos para formar sais doando ânions ou elétrons, ou combinando com cátions. Embora ela tenha incluído todas as prerrogativas das definições anteriores, não ficou famosa quanto à de G. N. Lewis e Bronsted‐Lowry.
É conhecida ainda a definição de Fritz Ingvar Lindqvist (1921‐1991) e Viktor Gutmann13 (1921‐1998), postulada em 1954, que são conectadas as ideias principais das definições protônicas e de Lux‐Flood. Uma definição que podemos supor ser o recipiente onde se encontra o conjunto das demais linhas de pesquisa. Sua definição pouco acrescentou de novo ao conhecimento da época, não trouxe previsões nem questionamentos inéditos. Contudo, contribuiu para o estabelecimento da teoria eletrônica de G. N. Lewis (Chagas, 2000).
Em 1963, Ralph G. Pearson14 (1919‐1987) apresentou sua teoria de ácido‐base duros e moles, que estendeu ainda mais informações sobre ácidos e bases de Lewis frente a complexos metálicos. A sua teoria foi fortemente influenciada por Alfred Werner, G. N. Lewis, F. I. Lindqvist e muito outros pesquisadores, e trouxe contribuições para a área de ácidos e bases e, mais especificamente, a química de coordenação.
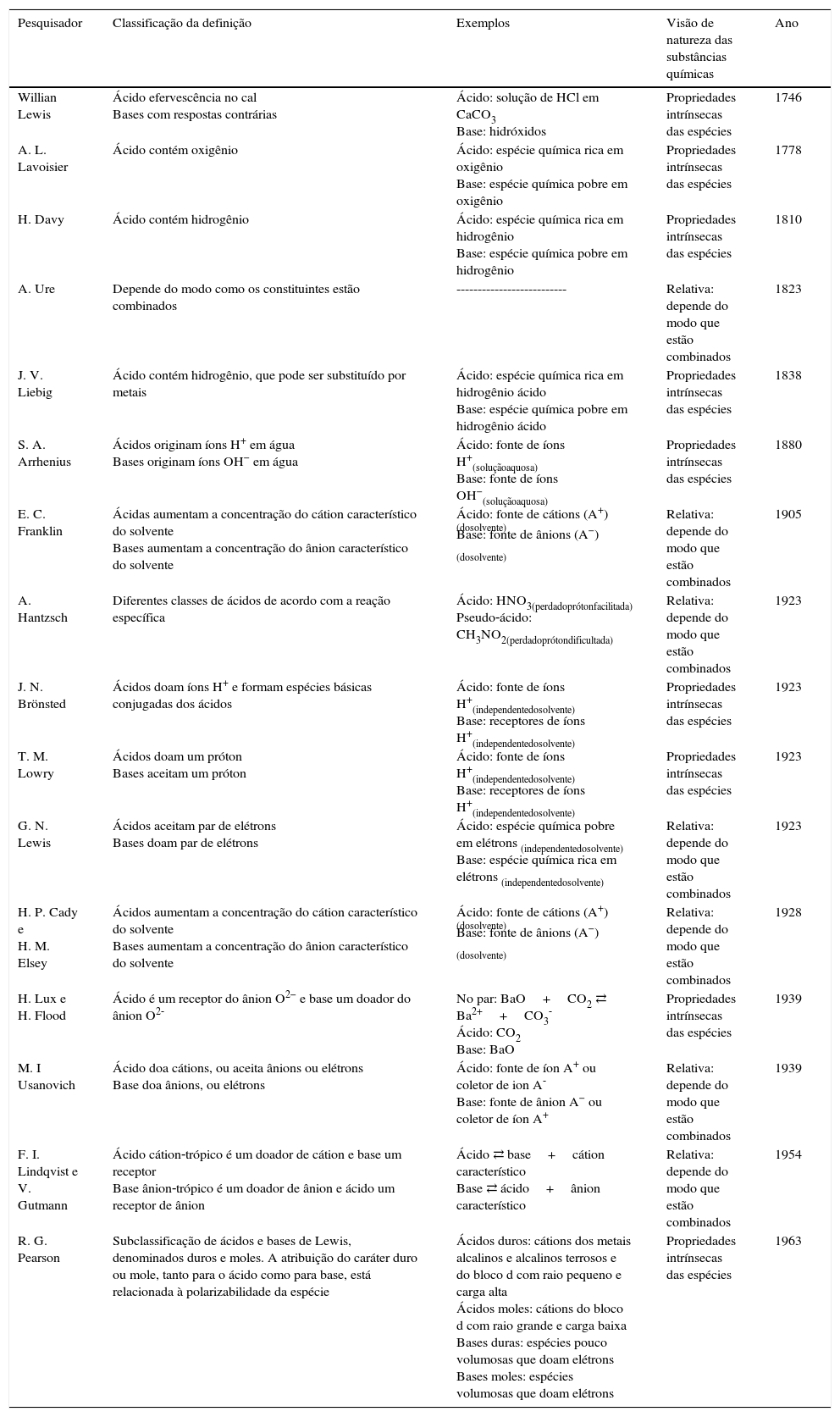
Com intuito de melhor compreensão dos conceitos de cada definição ácido‐base desenvolvida por cada pesquisador relatado no mapa, construiu‐se uma tabela. A tabela 1 está disposta em 3 colunas, onde a primeira referencia o pesquisador, a segunda a parte fundamental da definição ácido‐base proposta e a terceira coluna propõe a visão da natureza das espécies químicas de cada pesquisador. A tabela tem a função de auxiliar o leitor a relacionar o conceito de cada definição ácido‐base com as demais, além de perceber a visão de natureza das espécies que foram amplamente defendidas por diferentes grupos de pesquisadores, durante o tempo especificado.
Fundamentos das definições ácido‐base de cada pesquisador
| Pesquisador | Classificação da definição | Exemplos | Visão de natureza das substâncias químicas | Ano |
|---|---|---|---|---|
| Willian Lewis | Ácido efervescência no cal Bases com respostas contrárias | Ácido: solução de HCl em CaCO3 Base: hidróxidos | Propriedades intrínsecas das espécies | 1746 |
| A. L. Lavoisier | Ácido contém oxigênio | Ácido: espécie química rica em oxigênio Base: espécie química pobre em oxigênio | Propriedades intrínsecas das espécies | 1778 |
| H. Davy | Ácido contém hidrogênio | Ácido: espécie química rica em hidrogênio Base: espécie química pobre em hidrogênio | Propriedades intrínsecas das espécies | 1810 |
| A. Ure | Depende do modo como os constituintes estão combinados | -------------------------- | Relativa: depende do modo que estão combinados | 1823 |
| J. V. Liebig | Ácido contém hidrogênio, que pode ser substituído por metais | Ácido: espécie química rica em hidrogênio ácido Base: espécie química pobre em hidrogênio ácido | Propriedades intrínsecas das espécies | 1838 |
| S. A. Arrhenius | Ácidos originam íons H+ em água Bases originam íons OH− em água | Ácido: fonte de íons H+(soluçãoaquosa) Base: fonte de íons OH−(soluçãoaquosa) | Propriedades intrínsecas das espécies | 1880 |
| E. C. Franklin | Ácidas aumentam a concentração do cátion característico do solvente Bases aumentam a concentração do ânion característico do solvente | Ácido: fonte de cátions (A+) (dosolvente) Base: fonte de ânions (A−) (dosolvente) | Relativa: depende do modo que estão combinados | 1905 |
| A. Hantzsch | Diferentes classes de ácidos de acordo com a reação específica | Ácido: HNO3(perdadoprótonfacilitada) Pseudo‐ácido: CH3NO2(perdadoprótondificultada) | Relativa: depende do modo que estão combinados | 1923 |
| J. N. Brönsted | Ácidos doam íons H+ e formam espécies básicas conjugadas dos ácidos | Ácido: fonte de íons H+(independentedosolvente) Base: receptores de íons H+(independentedosolvente) | Propriedades intrínsecas das espécies | 1923 |
| T. M. Lowry | Ácidos doam um próton Bases aceitam um próton | Ácido: fonte de íons H+(independentedosolvente) Base: receptores de íons H+(independentedosolvente) | Propriedades intrínsecas das espécies | 1923 |
| G. N. Lewis | Ácidos aceitam par de elétrons Bases doam par de elétrons | Ácido: espécie química pobre em elétrons (independentedosolvente) Base: espécie química rica em elétrons (independentedosolvente) | Relativa: depende do modo que estão combinados | 1923 |
| H. P. Cady e H. M. Elsey | Ácidos aumentam a concentração do cátion característico do solvente Bases aumentam a concentração do ânion característico do solvente | Ácido: fonte de cátions (A+) (dosolvente) Base: fonte de ânions (A−) (dosolvente) | Relativa: depende do modo que estão combinados | 1928 |
| H. Lux e H. Flood | Ácido é um receptor do ânion O2− e base um doador do ânion O2‐ | No par: BaO+CO2 ⇄ Ba2++CO3‐ Ácido: CO2 Base: BaO | Propriedades intrínsecas das espécies | 1939 |
| M. I Usanovich | Ácido doa cátions, ou aceita ânions ou elétrons Base doa ânions, ou elétrons | Ácido: fonte de íon A+ ou coletor de ion A‐ Base: fonte de ânion A− ou coletor de íon A+ | Relativa: depende do modo que estão combinados | 1939 |
| F. I. Lindqvist e V. Gutmann | Ácido cátion‐trópico é um doador de cátion e base um receptor Base ânion‐trópico é um doador de ânion e ácido um receptor de ânion | Ácido ⇄ base+cátion característico Base ⇄ ácido+ânion característico | Relativa: depende do modo que estão combinados | 1954 |
| R. G. Pearson | Subclassificação de ácidos e bases de Lewis, denominados duros e moles. A atribuição do caráter duro ou mole, tanto para o ácido como para base, está relacionada à polarizabilidade da espécie | Ácidos duros: cátions dos metais alcalinos e alcalinos terrosos e do bloco d com raio pequeno e carga alta Ácidos moles: cátions do bloco d com raio grande e carga baixa Bases duras: espécies pouco volumosas que doam elétrons Bases moles: espécies volumosas que doam elétrons | Propriedades intrínsecas das espécies | 1963 |
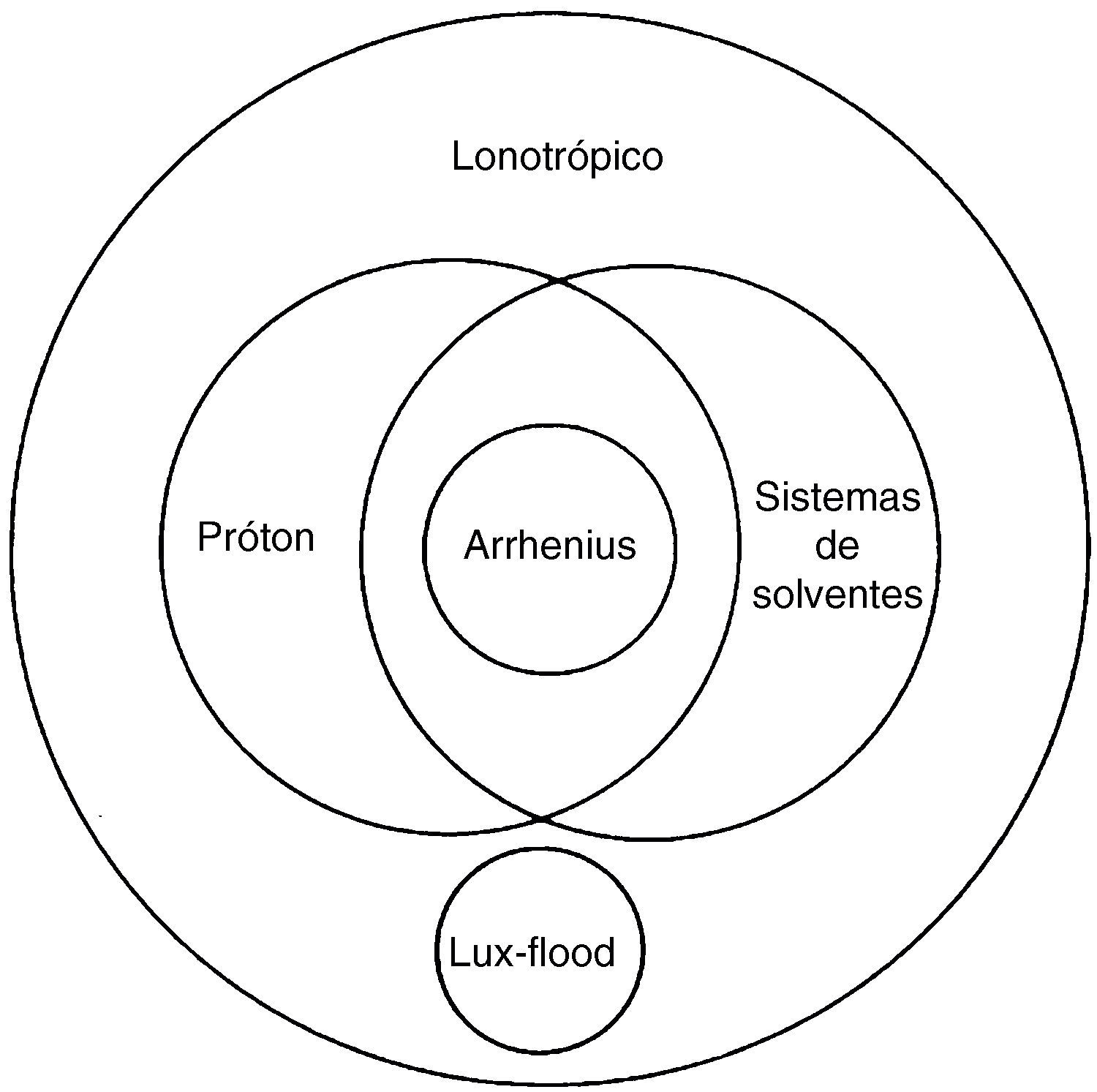
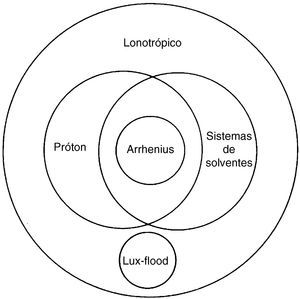
Jensen (1980), em seu livro, a fim de ilustrar a construção das definições ácido‐base, inseriu um diagrama de Venn interrelacionando as variadas definições iônicas ácido‐base, conforme figura 2. É um diagrama muito difundido nos livros didáticos de química do ensino médio. Recomenda‐se a leitura subsequente do livro do Jensen para uma abordagem mais extensa e conceitual das definições ácidos‐bases.
Diagrama de Venn ilustrando a interrelação das definições ácido‐base (adaptado) (Jensen, 1980).
Apesar da funcionalidade de exemplificar como as definições foram se tornando mais sofisticadas na construção do conhecimento químico, o diagrama é um potencial promotor de concepções alternativas, que produzirá erros conceituais aos estudantes. Pois, é subentendido no diagrama que todo ácido de Arrhenius é também um ácido de Brönsted‐Lowry, no diagrama é chamada de definição de próton. Entretanto, esta concepção é errônea, pois a afirmação não é válida. Por exemplo, o sistema reacional abaixo.
A molécula H2O é uma base de Arrhenius, segundo sua definição de espécie liberadora de OH‐ em solução aquosa, contudo a molécula H2O é um ácido de Brönsted‐Lowry, segundo a definição de doador de próton. Portanto, esta abordagem deve ser levada em consideração pelo professor de química em sala de aula, a fim de esclarecer as limitações de uma teoria científica. Este procedimento não é evidente ao explorar o diagrama de Venn proposto por Jensen (1980).
A reconstrução das definições de ácidos e bases foi descrita de modo resumido frente ao longo período da história. Sabemos que, para que o leitor tenha maiores entendimentos específicos de todos os cientistas citados no trabalho deverá realizar uma leitura adicional, além das recomendadas supracitadas, por isso recomendamos de imediato o trabalho de Chagas (2000) e Bell (1947). Justificamos a carência de detalhes por acreditar que a essência do estudo é a influência do aspecto social, político e econômico nos bastidores da ciência atual, mais especificamente sobre as definições modernas de ácidos e bases.
Considerações finaisUma percepção que tivemos no desenvolvimento desse trabalho é de que as novas definições sempre são uma generalização da precedente, ou explicam fenômenos que a precedente não conseguia responder. A tendência de uma nova definição não é de se contrapor às definições anteriores, mas de ampliá‐las. É interessante constatar que uma diferente interpretação do conceito de ácidos e bases no século XIX tenha influenciado tanto as linhas de pesquisas até os dias atuais. No mapa cronológico, isso é observado na sequência das ideias de A. Ure e J.V. Liebig como «articulações de braços» das definições atuais.
Ao longo da história verifica‐se que as definições de ácidos e bases apresentaram muitas divergências. Muitas vezes, por um período de tempo, houve a valorização de uma definição em detrimento de outra, mesmo que essa apresentasse maior poder de explicações dos fenômenos estudados. Entende‐se com isso que o estudo da evolução das definições sobre ácido‐base tem um potencial enorme para se trabalhar com os alunos a natureza da ciência dentro das disciplinas de química, principalmente na história da química.
Acreditamos que o mapa cronológico é uma ferramenta didática eficiente para ilustrar a evolução da ciência no desenvolvimento das definições ácido‐base. Ele tem como finalidade ser empregado no aprendizado em sala de aula, pois permite ao aluno compreender as conexões das definições científicas e analisar o perfil da evolução dos trabalhos científicos.
Notas- 1.
Consideramos a teoria de Ostwald e Arrhenius por entendermos que Ostwald teve participação muito ativa na corroboração das ideias de Arrheius. Para saber mais: Traesel (2012).
- 2.
O esquema (3) do texto original da citação é a equação química NH4++OH−⇌NH4OH.
Os autores declaram não haver conflito de interesses.
AgradecimentosAo IFSP – São Paulo, pela bolsa de iniciação científica concedida.
Willian Lewis foi químico e físico inglês, com contribuições na pesquisa propriedade ácidas e básicas (Bell, 1947).
A revisão por pares é da responsabilidade da Universidad Nacional Autónoma de México.
Claude‐Louis Berthollet foi químico francês, com maiores contribuições na arte de tingimento (Crosland, 1979).
Provavelmente, estes termos referem‐se respectivamente a HCN e H2S nos dias atuais.
Jöns Jacob Berzelius foi químico sueco, com contribuições na área de isolamento de elemento químico (Wisniak, 2000).
Acreditamos que H. Davy estava se referindo a alguma substância ácida com átomo de cloro.
Andrew Ure foi médico, químico e geólogo escocês, com contribuições em vastas áreas, como dicionário da química (Ure e Hunt, 1860).
Justus von Liebig foi químico e inventor alemão, com contribuições na área de química orgânica (Bell, 1947).
Edward Curtis Franklin foi químico americano, com contribuições na área de sistemas de solventes em amônia líquida (Bell, 1947).
Howard M. Elsey e Hamilton Perkins Cady, que foram químicos americanos, tiveram grandes contribuições na área de sistemas de solventes (Jensen, 1980).
Arthur Rudolf Hantzsch foi químico alemão, com grandes contribuições na síntese de piridina (Bell, 1947).
Hermann Lux foi químico alemão e Hakon Flood foi químico norueguês; ambos tiveram grandes contribuições na definições ácido‐base (Tanabe, 1970).
Michail Illyich Usanovich foi químico soviético, com contribuições na área de soluções quantitativas (Jensen, 1980).
Viktor Gutmann foi químico austríaco e Fritz Ingvar Lindqvist foi um químico sueco; ambos contribuíram com desenvolvimento da teoria eletrônica (Chagas, 2000).
Ralph G. Pearson foi um físico‐químico inorgânico, desenvolveu o conceito de ácidos e bases duros e moles (Pearson, 1963).