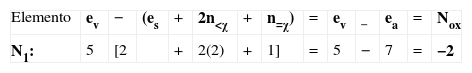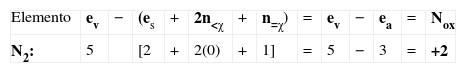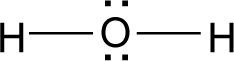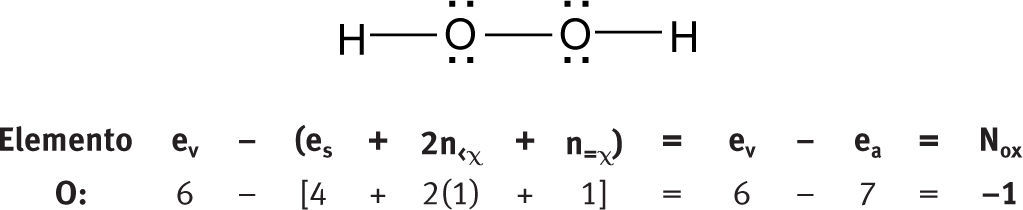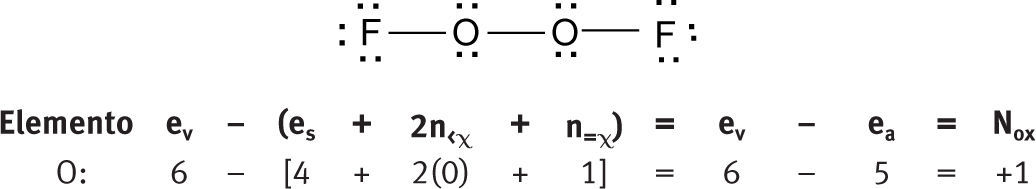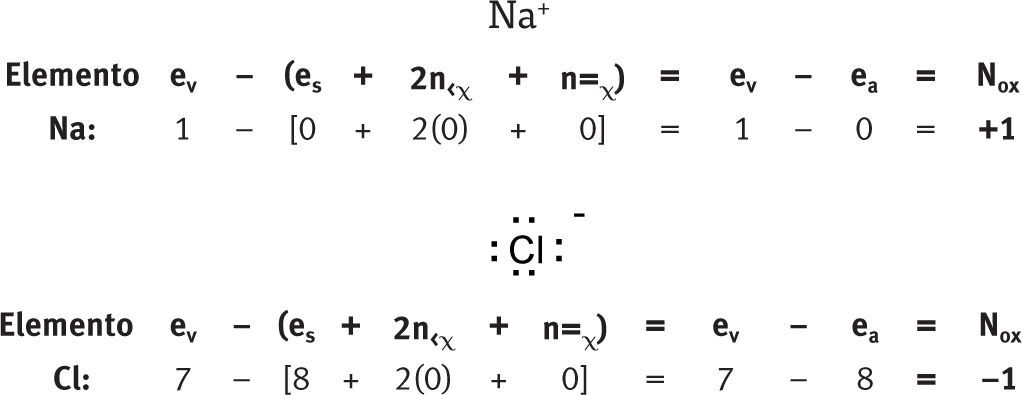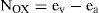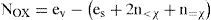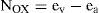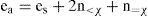In this paper a suitable formula for assigning oxidation numbers is presented. The proposed formula is the mathematical expression of Kauffman (1986) method to assign oxidation numbers for organic compounds. However, it is applicable to any chemical system that can be represented by Lewis structures. We discuss a large number of representative systems emphasizing that, by using this formula, there is no need to postulate arbitrary rules or exceptions or “uncommon” oxidation numbers. This formula, as well as being widely applicable, allows to establish a more precise definition of oxidation number in terms of the connectivity of an element in a given chemical system.
En este trabajo se presenta una fórmula adecuada para asignar números de oxidación. La fórmula propuesta es la expresión matemática del método de Kauffman (1986) para asignar números de oxidación en compuestos orgánicos. Sin embargo es aplicable a cualquier sistema químico que pueda ser representado mediante estructuras de Lewis. Se discute un número grande de sistemas representativos destacándose que mediante el uso de esta fórmula no hay necesidad de postular reglas arbitrarias ni excepciones ni números de oxidación “no comunes”. Esta fórmula además de ser de amplia aplicación, permite establecer una definición más precisa de número de oxidación en términos de la conectividad de un elemento en un determinado sistema químico.
Ya se ha discutido previamente sobre la dificultad para aprender (¡y enseñar!) a determinar los números de oxidación (Anderson, 1998, Calzaferri, 1999, Holder, 2002, Look, 2011). Generalmente, la asignación de números de oxidación se hace a través de la aplicación de dos conjuntos de reglas, uno para los compuestos inorgánicos (Table 1) y el otro para los orgánicos (Table 2). Dichas reglas son imprecisas, contradictorias y requieren de un número enorme de excepciones. En alguna de las últimas veces que traté de enseñarlas, mis alumnos —viendo mi desesperación y mi impotencia— comentaron dos cosas respecto a estas reglas:
- —
“Están muy sacadas de la manga”
- —
“Deberían de ser matematizables”
Reglas para determinar números de oxidación en sustancias inorgánicas (Calzaferri, 1999, Chang, 2003; Spencer, 2000).
|
Es útil saber que:
|
Reglas para determinar números de oxidación en compuestos orgánicos (Kauffman, 1986; Spencer, 2000).
|
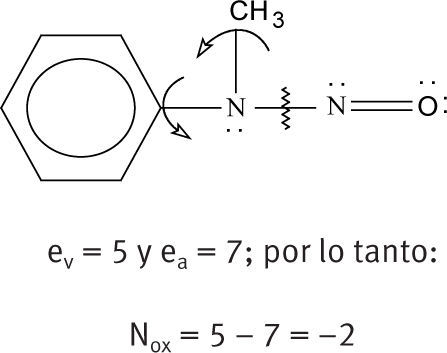
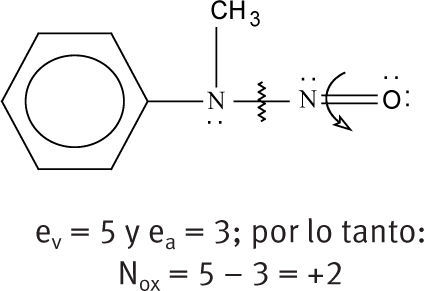
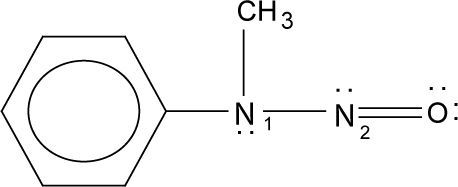
| Como ejemplo, se muestra cómo se asignan los números de oxidación a los dos nitrógenos de la N-nitroso-N-metilanilina. Para el nitrógeno unido al grupo fenilo, tenemos: |
| Del mismo modo, para el nitrógeno del grupo nitroso, tenemos: |
Este trabajo pretende dar respuesta a ambas inquietudes, es decir, quitarle lo artificial y mágico a la asignación del número de oxidación mediante la proposición de una fórmula matemática adecuada.
Reglas para determinar el número de oxidaciónEl primer conjunto de reglas está basado en la asignación convencional del número de oxidación al hidrógeno y al oxígeno, así como en el postulado de que la suma algebraica de los números de oxidación es igual a la carga de la especie. Estas reglas básicas van seguidas de una larga lista de reglas secundarias. Este conjunto de reglas es totalmente axiomático. Para un alumno es difícil encontrarle un sentido químico puesto que no hace, al menos no en lo inmediato, ninguna alusión a alguna propiedad química o estructural (Table 1).
El segundo conjunto de reglas tiene más sentido químico. Básicamente consiste en comparar el ambiente electrónico de un elemento en una molécula con la del mismo elemento en un átomo aislado. El ambiente electrónico del elemento en el átomo aislado se considera simplemente como el número de electrones de valencia. Sin embargo, el ambiente electrónico del átomo en la molécula (que debería ser directamente la carga parcial sobre él) se mide tan solo de una manera gruesa (Table 2.).
Se cuentan todos los electrones alrededor del elemento considerando que:
- —
Se le asignan dos electrones por cada enlace a un elemento menos electronegativo.
- —
Se le asigna un electrón por cada enlace a un elemento de la misma electronegatividad.
- —
No se le asigna ningún electrón por los enlaces a elementos de mayor electronegatividad.
- —
Se le asignan, obviamente, todos los electrones solitarios que estén unidos a él.
Esta asignación de electrones (la cual se hace mentalmente o mediante un dibujo) implica manejar cada enlace polar como si fuera iónico. Además, este procedimiento nos lleva a definir el número de oxidación de una manera, por demás, barroca: “el número de oxidación es la carga que tendría un átomo si el compuesto fuera iónico” (Spencer, 2000). Sobra decir que todo esto genera una enorme confusión conceptual en los alumnos.
En este trabajo se propone una nueva fórmula, basada en este segundo conjunto de reglas, en la que el número de oxidación se determina a partir de la estructura de Lewis, tal cual, sin tener que imaginar la “ionización” de ningún enlace covalente.
La nueva fórmula muestra una expresión matemática para ea y permite establecer una definición no convencional para el número de oxidación basada en el arreglo geométrico (específicamente en la conectividad de los elementos en los sistemas polinucleares) y ayuda a evitar algunos de los problemas conceptuales más comunes en la enseñanza de este tema.
Números de oxidaciónA pesar de las dificultades que existen para asignarles un valor, los números de oxidación continúan jugando un papel muy importante en química. Su uso en la predicción de la composición de las sustancias, así como en la identificación y balanceo de las reacciones rédox es especialmente valioso. Sin embargo, su verdadera importancia reside en el hecho de que uno de los tipos de reacción química más importantes (el de las reacciones de óxido-reducción) se define precisamente en términos del número de oxidación (Spencer, 2000; Vitz 2002): Un elemento se oxida cuando, en un cambio químico, su número de oxidación aumenta. Un elemento se reduce cuando, en un cambio químico, su número de oxidación disminuye.
La asignación del número de oxidación no es algo sencillo. Principalmente porque, como se mencionó antes, existen dos conjuntos de reglas. Vale la pena señalar los siguientes aspectos:
- 1.
Ambos conjuntos de reglas no parecen tener ninguna relación entre sí.
- 2.
Estos conjuntos de reglas no dejan claro con qué propiedad química o estructural está relacionado el número de oxidación. Mientras que en las reglas para los compuestos inorgánicos parece estar relacionado con la carga eléctrica, en las de los compuestos orgánicos parece estar relacionado con la conectividad de los elementos en la partícula (siempre y cuando se considere una eventual “ionización” del enlace covalente).
- 3.
Por lo mismo, dichas reglas parecen estar basadas en argumentos sumamente convencionales. En el caso específico de los compuestos inorgánicos, todas las reglas son arbitrarias. No se puede deducir nada con base en algún criterio químico. Lo único que queda es memorizarlas todas. En el caso de los compuestos orgánicos solo hay una convención pero es muy inquietante: ¿por qué hay que hacer iónicos los enlaces covalentes para poder determinar el número de oxidación?
- 4.
Para los compuestos inorgánicos hay muchas excepciones a las reglas fundamentales.
- 5.
Para vencer este obstáculo se requiere añadir a las reglas fundamentales un enorme número de reglas complementarias.
Además estas reglas inducen a varios errores de tipo conceptual (Duit, 2007, Kind, 2004):
- —
Inducen a pensar que las diferencias entre las sustancias orgánicas y las inorgánicas son de orden fundamental.
- —
Inducen a pensar que todas las sustancias inorgánicas son iónicas y que todas las orgánicas son covalentes.
- —
Hacen creer que el número de oxidación y la carga son la misma cosa. Confundir el número de oxidación con la carga también ha generado el muy difundido error de llamarle valencia al número de oxidación.
- —
Hacen creer que las diferencias entre los tres tipos de enlace químico (covalente, metálico e iónico) son de orden fundamental y, estrictamente, no es así: en los tres casos se trata de interacciones eléctricas entre partes positivas y negativas (núcleos y electrones —en los primeros dos— y cationes y aniones —en el último).
- —
Hacen creer que el número de oxidación es una propiedad absoluta de los átomos aislados y no relativa al ambiente en el que se encuentre el elemento en cuestión: “el número de oxidación de … es …”, “el elemento… tiene un número de oxidación de…”, “los números de oxidación se determinan …”, etcétera.
Se propone asignar los números de oxidación mediante la siguiente fórmula:
donde, para cierto elemento E en una determinada molécula:
- —
Nox es el número de oxidación que será asignado a ese elemento en dicha molécula.
- —
ev el número de electrones de valencia del elemento E.1
- —
es es el número de electrones solitarios alrededor de ese elemento en la representación de Lewis.
- —
nχ es el número de enlaces del elemento E con elementos de menor electronegatividad.
- —
n=χ es el número de enlaces del elemento E con elementos con la misma electronegatividad.
Esta fórmula se deriva de la que se usa en las reglas de asignación para compuestos orgánicos:
mediante la proposición de la siguiente expresión matemática para el término de electrones asignados, ea (que usualmente se calcula mentalmente):
A pesar de derivarse de las reglas para los compuestos orgánicos, esta fórmula es aplicable prácticamente a todo tipo de sustancias. Consiste en comparar el ambiente electrónico de un elemento en un átomo aislado con el ambiente electrónico de un elemento idéntico en un cierto sistema químico. Este ambiente se mide de una manera muy gruesa en términos de cuántos electrones de valencia son compartidos y con quién se comparten.
En la siguiente sección se ejemplifica el uso de esta fórmula para algunos casos representativos:
- —
Números de oxidación en partículas neutras
- •
Moléculas polinucleares
- •
Átomos
- •
- —
Números de oxidación en iones aislados
- •
Iones mononucleares aislados
- •
Iones polinucleares aislados
- •
- —
Números de oxidación en intermediarios
- •
Iones carbonio
- •
Radicales libres
- •
Carbaniones
- •
Carbenos
- •
Para mostrar cómo funciona la fórmula (1), vamos a aplicarla a la N-nitroso-N-metilanilina.
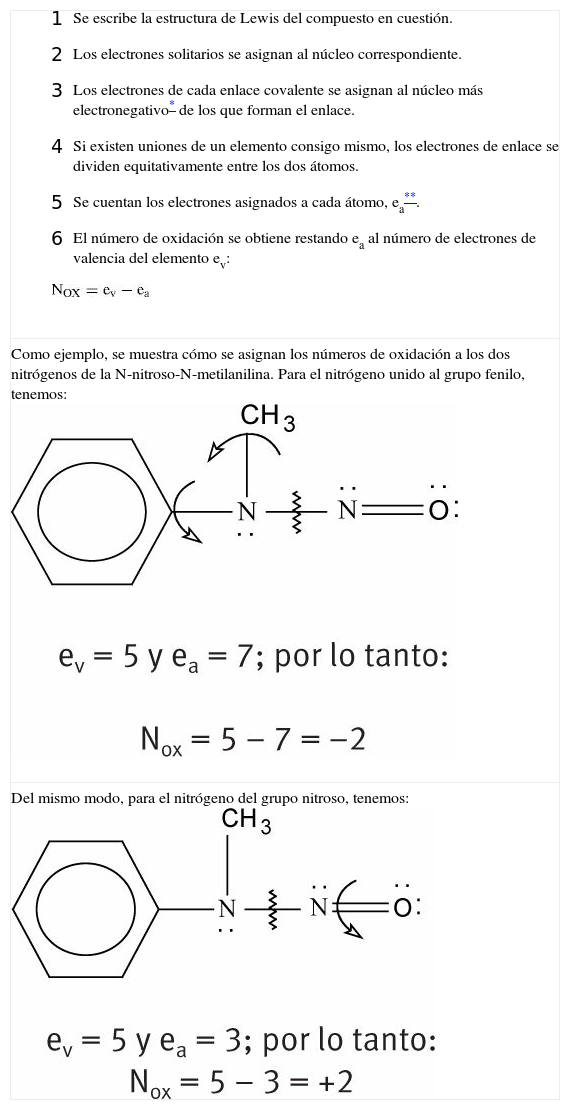
Por ejemplo, el número de oxidación que hay que asignar al nitrógeno 1 (el metílico) de la estructura de Lewis del nitroetano se determina así:
De la figura, se ve que el nitrógeno 1 tiene dos electrones solitarios, está unido a 2 elementos de menor electronegatividad que él (los carbonos), a ninguno de mayor electronegatividad y a uno de igual electronegatividad (el otro nitrógeno). Por tratarse de nitrógeno, su número de electrones de valencia es 5, es decir, que un átomo de nitrógeno aislado tiene 5 electrones disponibles en su última capa. Así, sustituyendo en la fórmula (3):
Haciendo esto para el otro nitrógeno, se obtiene:
Como se puede ver, se obtiene el mismo resultado que el que obtuvimos previamente al aplicar las reglas para compuestos orgánicos. Solo que, en este caso, no fue necesario imaginar enlaces iónicos. A continuación se muestra la aplicación de la fórmula a diversos sistemas químicos.
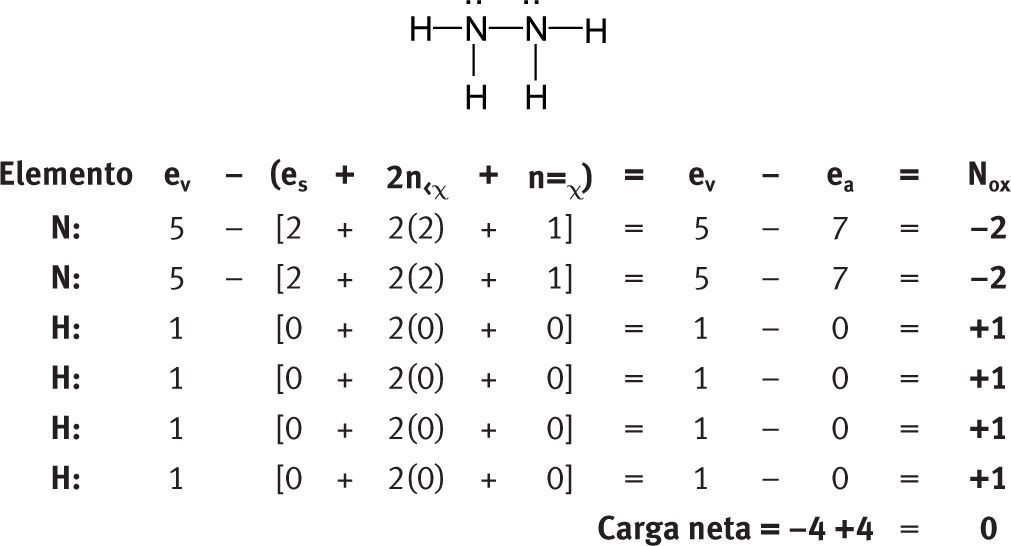
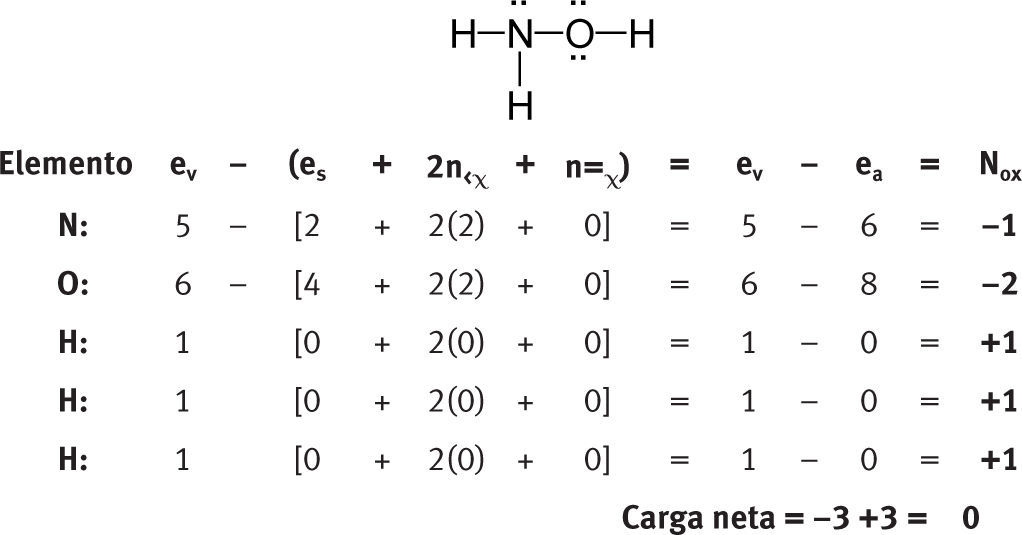
Números de oxidación en moléculas aisladasMoléculas neutras polinuclearesTomemos como ejemplo algunas moléculas representativas:
Como se puede ver, no es necesario postular que los números de oxidación del hidrógeno y del oxígeno son +1 y −2, respectivamente. Estos números de oxidación (los más comunes para este par de elementos) se obtienen de manera natural al aplicar la fórmula.
Tampoco es necesario postular que la suma de los números de oxidación de una sustancia neutra es igual a cero. Se obtiene naturalmente al aplicar la fórmula.
A pesar de que esta fórmula es la expresión matemática de las reglas para las sustancias orgánicas, la fórmula se puede aplicar perfectamente a una sustancia inorgánica como el agua.
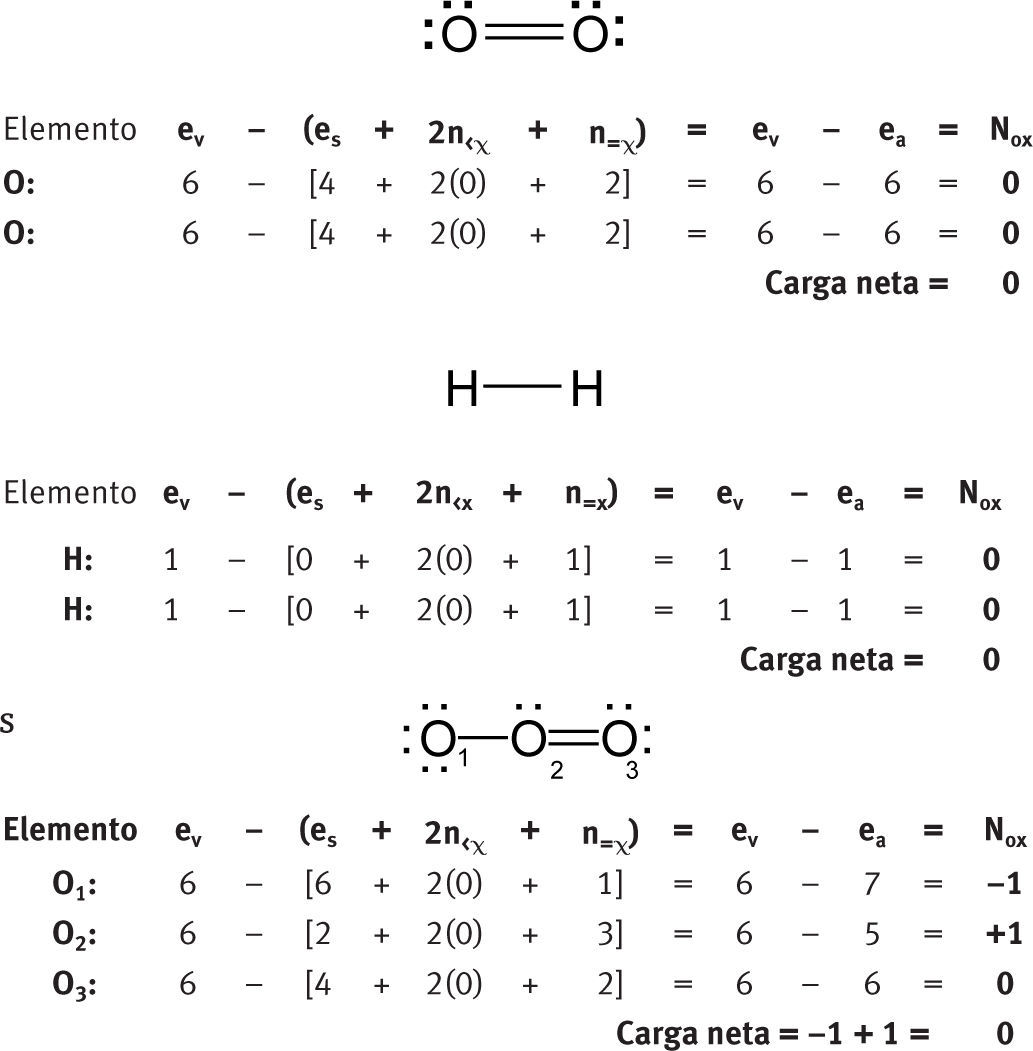
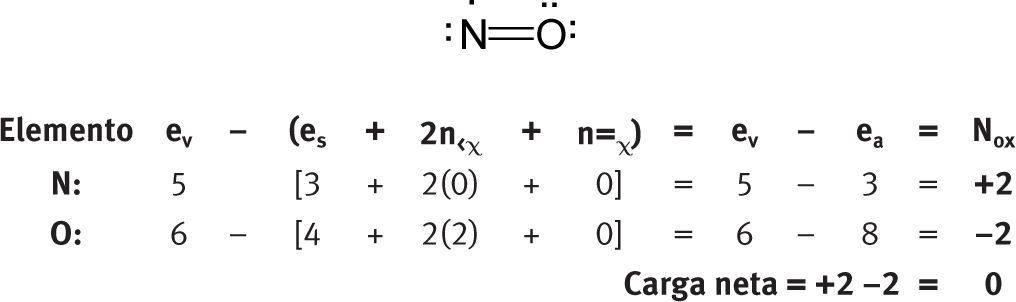
Moléculas neutras homonuclearesComo se ve, no es cierto que en los elementos libres (esto es, en estado no combinado), cada átomo tiene un número de oxidación de cero. La aplicación de esta fórmula permite distinguir claramente el diferente ambiente electrónico de los tres átomos de oxígeno en las moléculas de ozono.
Moléculas neutras heteronuclearesTampoco es necesario establecer como excepciones los otros números de oxidación que se pueden asignar a los elementos de oxígeno.
Tampoco es necesario separar a los hidruros como caso de excepción. El número de oxidación del hidrógeno, así como el de todos los demás elementos, no es una propiedad absoluta sino que es relativo a su conectividad en cada sistema químico.
En la mayoría de los casos, se obtiene el mismo número de oxidación para un determinado elemento sin importar cuál de las estructuras resonantes se escoja para aplicar la fórmula.
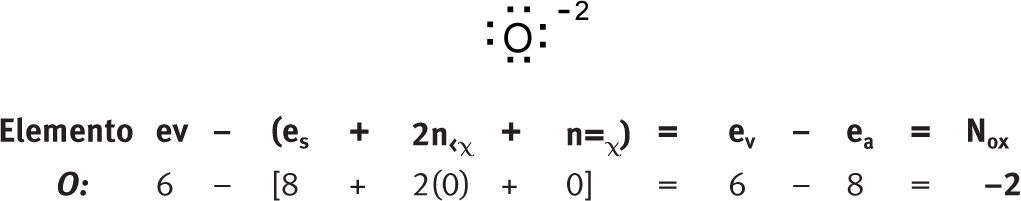
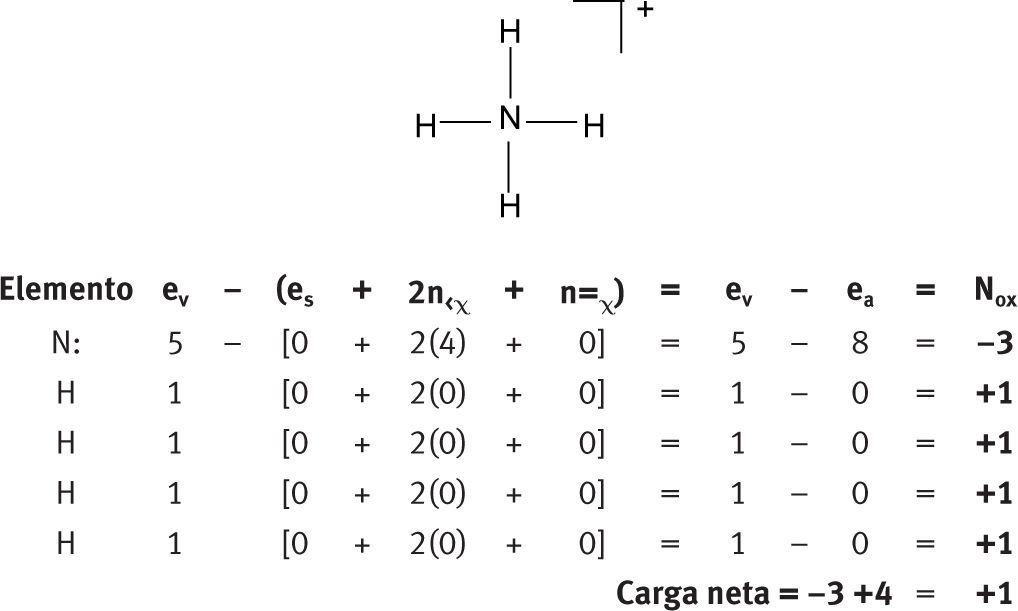
Números de oxidación en iones aisladosIones mononucleares aisladosDe la aplicación de la fórmula se desprende, de manera natural, que para los iones mononucleares, el número de oxidación coincide numéricamente con la carga del ion.
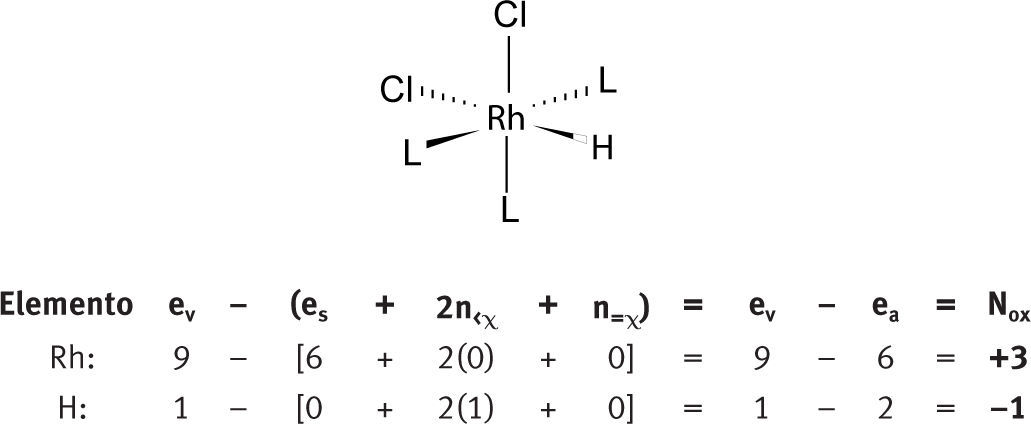
Iones polinucleares aisladosNúmeros de oxidación “no comunes”Anderson (1998) ha identificado cuatro casos en los que se obtienen números de oxidación no comunes:
- —
Cuando la sustancia contiene enlaces homonucleares.
- —
Cuando hay hidrógenos unidos directamente al elemento al que se le quiere determinar el número de oxidación.
- —
Cuando las electronegatividades de 2 elementos son prácticamente iguales.
- —
Cuando en la molécula hay un número impar de electrones.
A continuación se aplica la fórmula (1) a algunos de estos casos.
Sistemas con enlaces homonuclearesEstos sistemas están considerados en la fórmula mediante el término b=χ. Van los cálculos:
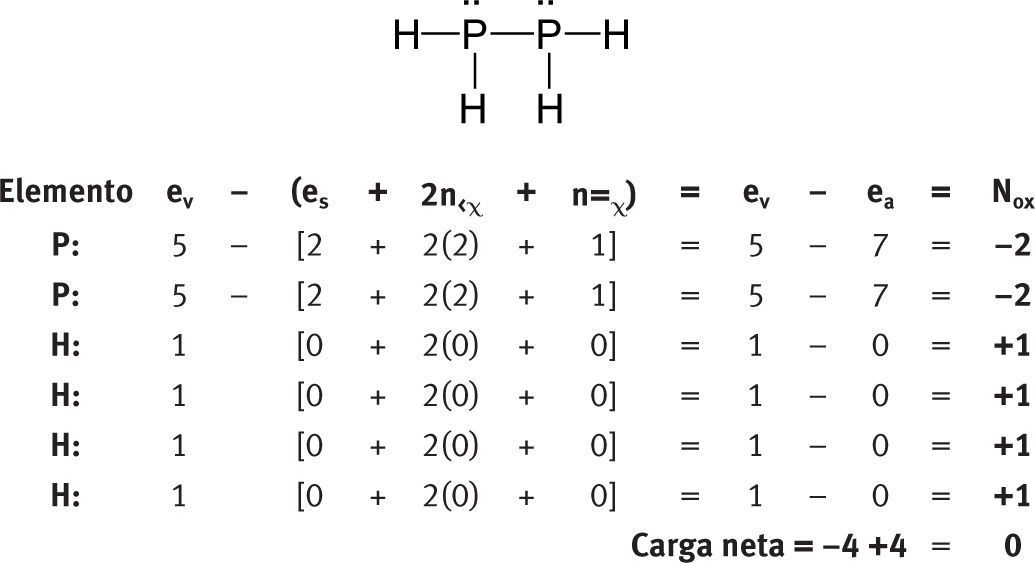
Números de oxidación de elementos con hidrógenos unidos directamente a ellosDos elementos distintos con electronegatividades prácticamente igualesDado que no existe una sola escala de electronegatividad, a veces no es fácil decidir cuál es la diferencia de electronegatividad de los elementos enlazados, especialmente cuando los valores de electronegatividad de ambos son muy similares. Este tipo de problema aparece cuando se tienen enlaces P-H, N-Cl, As-H y C-S. Tradicionalmente se considera:
Así, para los siguientes casos, los números de oxidación calculados con la fórmula serían:
Moléculas con un número non de electronesAl aplicar esta fórmula para asignar números de oxidación se ve que no hay números de oxidación “comunes” ni “no comunes” sino que se asignan los que tienen que ser según su conectividad.
ConclusionesCon la fórmula presentada:
- —
No se necesita postular el número de oxidación para H y O.
- —
No se necesita postular el número de oxidación para los elementos.
- —
No se necesita postular que la suma de los Nox es igual a la carga de la especie.
- —
Los peróxidos y los hidruros ya no son casos de excepción.
- —
No se necesitan dos conjuntos de reglas para los compuestos inorgánicos y los orgánicos.
- —
Queda claro que Nox no es una propiedad intrínseca de un elemento sino una propiedad relativa que depende de la conectividad de dicho elemento en un cierto sistema molecular.
- —
Nox puede ser definido como un indicador que compara el ambiente electrónico de un átomo de cierto elemento en una molécula con el ambiente electrónico de un átomo aislado de ese mismo elemento (otras definiciones de Nox se pueden encontrar en Jensen (2011), Look (2011) y Vitz (2002).
ev se refiere específicamente al número de electrones disponibles de la última capa de un átomo aislado del elemento E. Para los elementos del bloque S, ev es igual al número de electrones de tipo s de la última capa (eS). Sin embargo, para los del bloque P, ev es igual a la suma de los electrones de tipo s más los de tipo p (eS + eP). Esto quiere decir que aunque haya electrones d y f en la última capa no se consideran electrones de valencia. Para los del bloque D y F, ev son la suma de los electrones s más los d (eS + eD) o f (eS + eF) según sea el caso.
Así, para elementos del bloque S: ev=es
para elementos del bloque P: ev=es+ep
para elementos del bloque D: ev=es+eD
para elementos del bloque F: ev=es+eF