En los últimos tiempos la inmunoterapia ha experimentado una gran expansión en el tratamiento oncológico, destacando sus resultados favorables en comparación con los esquemas de quimioterapia clásicos. Sin embargo, como consecuencia de la alteración de la tolerancia inmune en los tejidos periféricos sanos pueden desarrollarse eventos adversos inmunorrelacionados (irAE) secundarios1. A continuación presentamos un caso de diabetes mellitus (DM) asociada a atezolizumab (inhibidor de PDL-1), entidad poco frecuente en la práctica clínica habitual.
Se trata de un varón de 82años diagnosticado de adenocarcinoma de pulmón estadioIV (lesiones neoplásicas bilaterales y adenopatías mediastínicas prevasculares, T4N2M1a) en tratamiento con atezolizumab en monoterapia (1.200mg cada 21días). En la evaluación física y el cribado hormonal pre-tratamiento se registró un peso de 78kg, IMC 26,8kg/m2 y clase funcional ECOG0, sin alteraciones del perfil tiroideo ni en el control glucémico. No constaban otros antecedentes personales ni familiares de interés, incluidos DM, dislipemia o hipertensión arterial. No realizó tratamiento con corticoides ni otros fármacos adicionales.
Transcurridas 24 semanas desde el inicio, el paciente acudió al servicio de urgencias hospitalarias por astenia, poliuria y polidipsia de tres días de evolución, junto con astenia intensa y obnubilación. Las pruebas complementarias mostraron una glucemia de 1.078mg/dl, pH arterial 7,22 con anión GAP 16mEq/l, ácido láctico 2,3mmol/l y cuerpos cetónicos positivos en orina (equivalente a 30-40mg/dl). Los valores de creatinina y urea aumentaron a 1,98mg/dl y 96mg/dl, respectivamente (previos 0,96mg/dl y 24mg/dl), sin encontrarse alteraciones sugestivas de afectación pancreática exocrina. El juicio clínico fue diabetes de inicio con cetoacidosis diabética grave junto a fracaso renal agudo secundario.
Tras 48h se logró la estabilización clínica y se remitió a Hospital de Día de Diabetes (HDD), donde recibió educación diabetológica básica e inició insulinoterapia subcutánea en régimen basal-bolo (42U/24h, 0,54U/kg/24h). Durante las 15 semanas posteriores se programaron 5 visitas de control en HDD de forma coordinada con el servicio de Oncología, derivándose posteriormente a Consultas Externas de Diabetes para seguimiento.
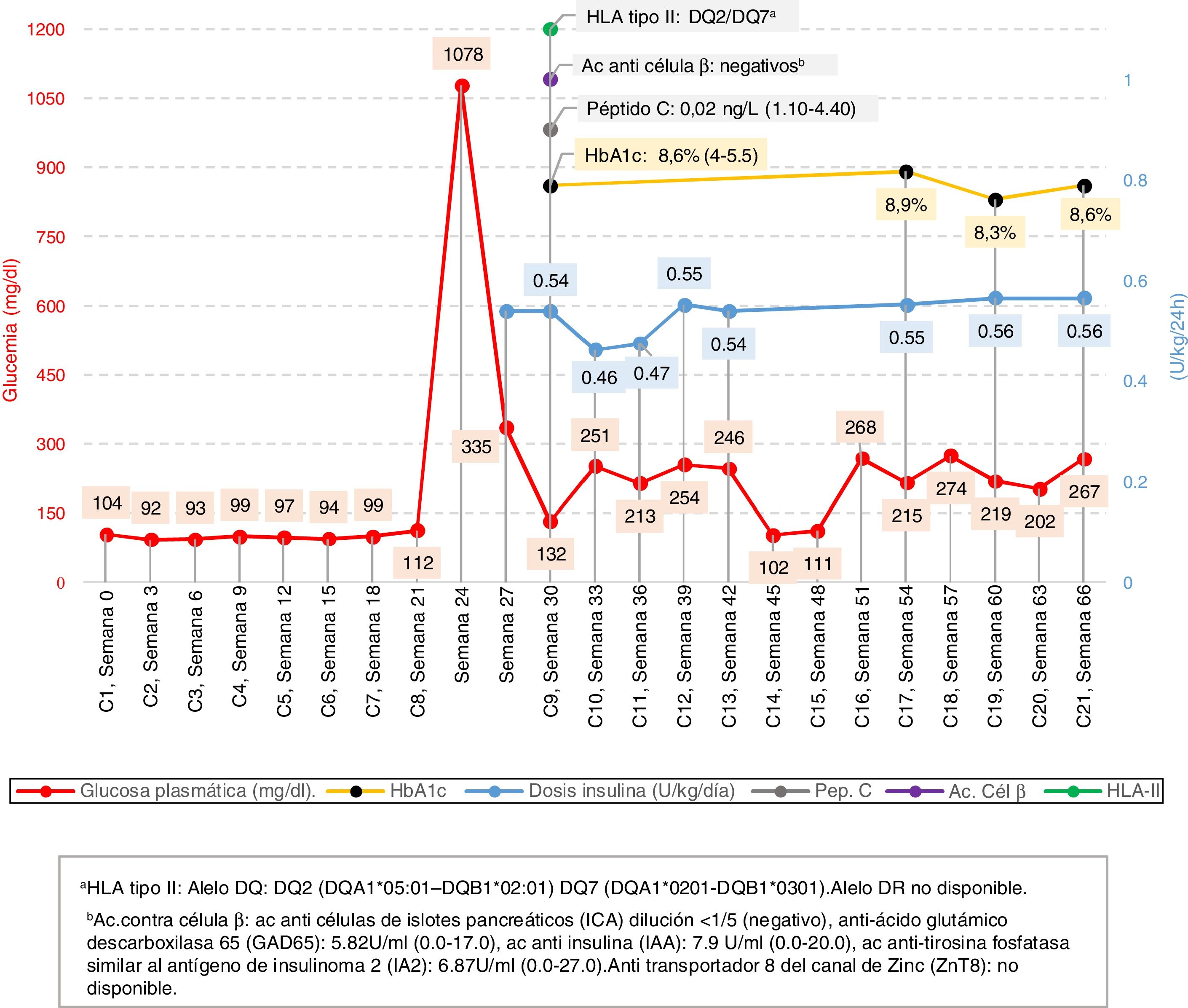
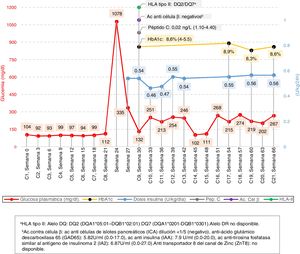
Ante el diagnóstico de sospecha de DM relacionada con atezolizumab se amplió el estudio con determinación de péptidoC (0,02ng/l), HbA1c (8,6%, 70mmol/mol), anticuerpos anti-célulaβ (con resultado negativo) y determinación genética de HLA-II de riesgo (positivo para DQ2)2. Los resultados y la evolución analítica se recogen en la figura 1.
Cronograma y evolución analítica. Se incluyen los resultados según el número de ciclo administrado de atezolizumab y semana de tratamiento.
aHLA tipo II. Alelo DQ: DQ2 (DQA1*05:01-DQB1*02:01) DQ7 (DQA1*0201-DQB1*0301). Alelo DR no disponible.
bAc anti célula β. Anticuerpos anti-células de islotes pancreáticos (ICA) dilución <1/5 (negativo), anti-ácido glutámico descarboxilasa65 (GAD65): 5,82U/ml (0,0-17,0), anticuerpos anti insulina (IAA): 7,9U/ml (0,0-20,0), anticuerpos anti-tirosina fosfatasa similar al antígeno de insulinoma2 (IA2): 6,87U/ml (0,0-27,0). Anti transportador 8 del canal de zinc (ZnT8): no disponible.
Posteriormente los requerimientos de insulina no disminuyeron significativamente durante el seguimiento, persistiendo actualmente un control metabólico subóptimo (HbA1c >8,5%). En los controles oncológicos no se evidenció progresión tumoral ni se observaron alteraciones tiroideas o cardiovasculares (diabetes de corta evolución).
Atezolizumab es un anticuerpo monoclonal anti PDL-1 de la familia de los inhibidores de puntos de control inmune (immune checkpoint inhibitors [ICI]) aprobado para el tratamiento del cáncer de mama, urotelial y pulmonar no microcítico3. Su mecanismo de acción va dirigido a bloquear proteínas de membrana (PD-1, PDL-1 o CTLA-4) que inician señales inhibitorias en los linfocitosT, con el objetivo de incrementar su capacidad de acción frente a células neoplásicas. Como consecuencia de la alteración de los mecanismos de control inmune es frecuente observar irAE endocrinos (sobre todo tiroideos)4. Sin embargo, el desarrollo de DM secundaria (DM-ICI) es excepcional (incidencia estimada de 0,2-1,4%)5. En España tan solo hemos hallado el reportado por León et al.6 en 2019 en relación con durvalumab.
El tiempo de aparición desde el inicio del tratamiento es variable, con una mediana en torno a 15-20 semanas. La DM-ICI presenta características específicas diferenciadoras de otras formas de DM autoinmune. La presentación es súbita, frecuentemente con cetoacidosis (71%) y niveles de péptidoC próximos a 0 (insulinopenia persistente), lo que la hace difícilmente predecible. En nuestro caso, en la semana 21 se objetivó una glucemia de 112mg/dl en un control rutinario que no se consideró clínicamente relevante (fig. 1). Este hecho sugiere que ante alteraciones leves de este parámetro podría ser beneficioso iniciar precozmente el proceso diagnóstico.
En la DM-ICI no se observan períodos de remisión transitorios («luna de miel») y los requerimientos de insulina permanecen constantes en el tiempo, a diferencia de la DM1 o la LADA, donde son habituales períodos de hasta 2años con péptidoC conservado7. Los niveles de HbA1c pueden ser normales al diagnóstico debido al rápido desarrollo de la enfermedad (en nuestro caso la determinación corresponde a 8semanas tras el inicio)8. Estas características la asemejan a la DM fulminante asiática, por lo que podrían compartir mecanismos fisiopatológicos9.
Por otro lado, mientras que en la DM1 más del 90% de los casos presentan positividad para al menos un anticuerpo anti-célulaβ, en la DM-ICI este hecho solo se ha observado en un 50%, siendo el más frecuente anti-GAD658. Además, Stamatouli et al.10 han sugerido la relación entre la presencia del alelo HLAII-DR4 y el desarrollo de DM-ICI. Otros haplotipos de riesgo para DM1 que podrían ser predisponentes son DR4/DQ8 y DR3/DQ2, aunque es necesario estudiar un mayor número de casos para confirmar esta relación5,8.
Para el seguimiento de los pacientes que inician tratamiento con ICI podrían ser útiles determinaciones de glucemia periódicas, junto con información detallada al paciente sobre síntomas sugestivos, estableciendo mecanismos de consulta precoz en caso de presentarlos. No hay consenso sobre el cribado sistemático de HbA1c y anticuerpos anti-célulaβ dado su aparente bajo valor predictivo, a pesar de que son de elección en formas clásicas de DM y pueden aportar valor una vez presentado el evento5,8. También podría considerarse la determinación de marcadores pancreáticos de daño exocrino (como la lipasa pancreática), cuya elevación se ha demostrado hasta en el 90% de los casos de DM fulminante asiática8,9.
A pesar de la baja incidencia de DM-ICI, cabe esperar que el número de casos aumente en los próximos años, dada la extensión progresiva del uso de estos fármacos en la práctica clínica habitual. Por ello nos parece imprescindible su conocimiento y notificación, de modo que nos permita planificar estrategias de manejo multidisciplinar entre Oncología y Endocrinología, para lo cual planteamos el modelo de HDD como un recurso óptimo.
AutoríaTodos los autores declaran haber contribuido de forma sustancial en la concepción, desarrollo del borrador y aprobación de la versión que se presenta de este artículo.
Conflicto de interesesLos autores declaran que no existen conflictos de intereses.