La esclerosis lateral amiotrófica es una enfermedad neurodegenerativa en la que el soporte nutricional especializado es básico. Los objetivos de nuestro estudio fueron describir el soporte nutricional al inicio del seguimiento y su impacto en la antropometría y supervivencia.
Material y métodosSe creó un registro interhospitalario para los hospitales de Castilla-León a través de una plataforma web diseñada a tal efecto. Se realizó una anamnesis sobre la evolución e historia nutricional de la enfermedad, y se determinó antropometría clásica. Se registró el tratamiento nutricional prescrito. Se midieron los parámetros al inicio, a los 6 y a los 12 meses del seguimiento nutricional.
ResultadosSe analizaron un total de 93 pacientes (49 [52,7%] espinal; 44 [47,3%] bulbar). La vía de soporte nutricional al inicio fue dieta oral en 36 (38,7%) pacientes; la suplementación oral nutricional en 46 (49,5%) pacientes y en 11(11,8%) pacientes gastrostomía endoscópica percutánea. Se observó un descenso del índice de masa corporal entre la primera y la segunda visita (inicio: 24,18 [3,29] kg/m2; 6 meses: 23,69 [4,12] kg/m2; p<0,05). Se observó una menor pérdida de peso a los 6 meses respecto al inicio del seguimiento nutricional (inicio:8,09 [8,72%]; 6 meses: 1,4 [6,29%]; p<0,01). Treinta y seis (38,7%) pacientes fallecieron sin diferencias en función del inicio del soporte. La supervivencia desde el inicio de los síntomas fue mayor en el grupo de pacientes con nutrición artificial, aunque sin alcanzar la significación estadística (oral: 28 [20,25] meses; suplementación oral nutricional: 30 [16,75-48,25] meses; gastrostomía endoscópica percutánea: 39 [27-52] meses; p=0,90).
ConclusionesLos pacientes con ELA presentan un deterioro severo del estado nutricional antes del inicio del soporte nutricional. Tras la intervención nutricional se observó una ralentización en la pérdida ponderal y del deterioro nutricional.
Amyotrophic Lateral Sclerosis (ALS) is a neurodegenerative disease in which specialized nutritional support is essential. The objectives of our study were to describe nutritional support at the beginning of follow-up and its impact on anthropometry and survival.
MethodsAn interhospital registry was created for the hospitals of Castilla-León through a web platform designed for this purpose. An anamnesis was carried out on the evolution and nutritional history of the disease; and classical anthropometry was determined. The prescribed nutritional treatment was recorded. The parameters were measured at the beginning, at six and twelve months of nutritional follow-up.
ResultsA total of 93 patients [49 (52.7%) spinal; 44 (47.3%) bulbar)] were analyzed. The nutritional support route at the beginning was oral diet in 36 (38.7%) patients; oral nutritional supplementation (SON) in 46 (49.5%) patients; and in 11 (11.8%) patients percutaneous endoscopic gastrostomy (PEG). A decrease in the body mass index (BMI) was observed between the first and second visit [Start: 24.18 (3.29) kg/m2; 6 months: 23.69 (4.12) kg/m2; P<.05]. Less weight loss was observed at 6 months compared to the start of nutritional follow-up [Start: 8.09 (8.72)%; 6 months: 1.4 (6.29)%; P<.01]. 36 (38.7%) patients died but with no differences according to when nutritional support was started. Survival from the onset of symptoms was higher in the group of patients with artificial nutrition, although without reaching statistical significance [Oral: 28 (20.25) months; SON: 30 (16.75-48.25) months; PEG: 39 (27-52) months; P=.90].
ConclusionsPatients with ALS present a severe deterioration in nutritional status before the start of nutritional support. After the nutritional intervention, a slowdown in weight loss and nutritional deterioration was observed.
La esclerosis lateral amiotrófica (ELA) es una enfermedad neuromuscular degenerativa que se produce por la disminución gradual de funcionamiento de neuronas motoras de la corteza cerebral, bulbo raquídeo y médula espinal. Esta situación produce una parálisis muscular que conduce a un deterioro motor progresivo y que puede conducir a la muerte1.
La incidencia de ELA en Europa y Norteamérica se encuentra entre 1,5 y 2,5 personas por 100.000habitantes/año, mientras que la prevalencia se mueve en valores entre 2,7 y 7,4 casos por 100.000 habitantes2,3. La incidencia es ligeramente superior en varones —1,3-1,5:1— e incrementa con la edad con un pico en torno a los 70 años. La supervivencia de esta enfermedad es del 20% a los 5 años tras el diagnóstico4.
En la actualidad no existe ningún tratamiento curativo y el pronóstico de la enfermedad no es bueno4. Sin embargo, existen medidas eficaces para incrementar la calidad de vida de los pacientes y prolongar su supervivencia, entre los que destacan asegurar y mantener desde las fases iniciales de la enfermedad un correcto estado nutricional para prevenir la aparición de complicaciones médicas relacionadas con la malnutrición.
La mayor parte de los pacientes diagnosticados de ELA desarrollan algún grado de desnutrición durante el transcurso de la enfermedad, pudiendo observarse en el 16-55% de los pacientes al diagnóstico5. Este deterioro nutricional se debe a varias condiciones directamente relacionadas con la fisiopatología de la enfermedad: anorexia relacionada con la situación psicosocial del paciente y posibles efectos secundarios medicamentosos; debilidad abdominal y de músculos pélvicos que produce estreñimiento, que puede reducir la ingesta de manera indirecta; la alteración de la masticación y en la deglución en relación con la alteración de las neuronas motoras bulbares; hipermetabolismo «paradójico», sobre todo en primeras fases, que condiciona un aumento del catabolismo a pesar de la disminución de la movilidad; y la disfunción cognitiva en forma de demencia frontotemporal (20-25% de los pacientes)6.
La ELA es una enfermedad con una evolución muy variable y que depende de características individuales. No obstante, el estado nutricional en esta enfermedad se ha mostrado como base de la supervivencia en estos pacientes7.
Una de las causas que favorece la pérdida de peso en los pacientes con ELA, y por lo tanto compromete su supervivencia, es el desarrollo de disfagia. La prevalencia de disfagia es variable en función de las series y el método de evaluación de la misma (métodos relacionados con la anamnesis [EAT-10]), exploraciones clínicas dirigidas (método volumen-viscosidad) o métodos de visualización directa (videofluoroscopia o laringoscopia). La evaluación clínica ha detectado disfagia entre un 6% y un 15% de los pacientes, mientras que la utilización de pruebas o exploraciones específicas ha demostrado la detección de entre un 41,1% a un 70% de alteraciones de la deglución en estos pacientes. La evaluación endoscópica ha mostrado prevalencias entre el 47,8% y el 72,7% de los pacientes en función de la forma de inicio, mientras que la videofluoroscopia ha demostrado algún tipo de disfagia hasta en el 75% de los casos6. En muchas ocasiones la disfagia es el síntoma de inicio y constituye una de las complicaciones más graves en estos pacientes8. El consejo dietético en la disfagia se realiza para facilitar la deglución, optimizar la ingesta nutricional y disminuir el riesgo de aspiración9. En los casos en los que la capacidad de ingesta se vea claramente comprometida optamos por métodos más invasivos, como la colocación de una sonda de gastrostomía.
Por esta razón un soporte nutricional temprano y adecuado, y la consecución del mantenimiento de peso y parámetros nutricionales pueden mejorar la evolución de la enfermedad6.
Los objetivos del estudio fueron evaluar la influencia del soporte nutricional especializado sobre los parámetros antropométricos en el paciente con ELA; describir la vía nutricional y la técnica de soporte al inicio del seguimiento del paciente con ELA en la consulta de nutrición clínica; y conocer la influencia de los distintos tipos de soporte nutricional específico al inicio del seguimiento sobre la supervivencia.
Material y métodosDiseñoSe diseñó un estudio observacional longitudinal de cohortes (dieta oral adaptada, suplementación artificial y nutrición enteral completa) para evaluar la situación nutricional al inicio del seguimiento por la unidad de nutrición y el efecto de la situación nutricional en la supervivencia.
Se incluyeron en el estudio aquellos pacientes remitidos a consulta de nutrición clínica con diagnóstico de enfermedad de motoneurona en 7 hospitales de la comunidad autónoma de Castilla y León entre enero de 2015 y diciembre de 2017.
ProcedimientosTras la firma del consentimiento informado y la inclusión de pacientes en el estudio se registró a los pacientes en una plataforma web creada a tal efecto en la página del Centro de Investigación en Endocrinología y Nutrición (www.ienva.org), cumpliendo la Ley de Protección de datos LOPD15/1999. Este estudio fue llevado a cabo de acuerdo con la Declaración de Helsinki y todos los procedimientos fueron aprobados por el Comité de Ética en Investigación Médica (CEIm) del Hospital Clínico Universitario de Valladolid con el código PI 17-543. Se registraron las variables al inicio del soporte nutricional y cada 6 meses durante el seguimiento del paciente en la unidad de nutrición clínica.
Con los datos obtenidos se realizó un análisis estadístico descriptivo de prevalencia y situación nutricional de los pacientes. Posteriormente se realizó un análisis estadístico inferencial univariante y multivariante, para evaluar la evolución de la enfermedad, así como el efecto del soporte nutricional sobre las variables de desenlace propuestas.
VariablesCaracterísticas de la enfermedadSe recogieron el sexo, la fecha de nacimiento y el tipo de ELA caracterizada por la forma de inicio. De esta manera se clasificaron los pacientes como ELA de inicio espinal y ELA de inicio bulbar. El diagnóstico de ELA y otras enfermedades de motoneurona se realizó según los Criterios de «Airlie House» y «El Escorial»10.
Para caracterizar la evolución de la enfermedad se recogieron la fecha de inicio de los síntomas, la fecha de diagnóstico de la enfermedad realizada en el servicio de neurología y la fecha en la que se valoró por primera vez en el servicio de endocrinología y nutrición. Además, se valoraron los ingresos asociados a la enfermedad. También se analizó la tasa de exitus y la fecha en que se produjeron los mismos.
Tipo de tratamiento nutricionalSe dividió a los pacientes en 3 grupos en función del soporte nutricional especializado iniciado en al inicio del seguimiento en la consulta de nutrición clínica.
Dieta oral (ORAL): aquellos pacientes en los que se inició el tratamiento nutricional con dieta oral adaptada a sus requerimientos y capacidad de deglución mediante una modificación en la calidad y en la textura de la dieta.
Suplementación oral nutricional (SON): pacientes en los que, debido al no alcance de requerimientos por vía oral, se decide añadir a la dieta adaptada en cantidad y/o textura suplementación artificial oral.
Nutrición enteral completa por sonda de gastrostomía (GEP): pacientes con una alteración en la capacidad de deglución que no les permite alcanzar los requerimientos por dieta oral. En estos pacientes se inició tratamiento con nutrición enteral completa mediante gastrostomía endoscópica percutánea (GEP).
AntropometríaLa evaluación antropométrica de los sujetos se realizó mediante la determinación del peso, la talla y el índice de masa corporal.
El peso se midió con una exactitud de ±0,1kg con una báscula a los 0,1kg más cercanos (SECA, Birmingham, Reino Unido). La altura se midió con el paciente en pie con un tallímetro (SECA, Birmingham, Reino Unido). El índice de masa corporal (IMC) se calculó usando la fórmula: peso (kg)/talla×talla (m2).
Si el paciente acudía en silla de ruedas y no podía movilizarse el peso se midió indirectamente (peso del paciente en la silla–peso de la silla de ruedas). La talla en estos casos se determinó mediante la distancia cubital.
Se utilizó el porcentaje de pérdida de peso (%PP) para valorar la diferencia relativa de peso.
Valoración nutricionalEl estado nutricional de los pacientes se midió mediante la valoración global subjetiva (VGS). Esta es una prueba sencilla para diagnóstico y categorización de desnutrición que integra variables de la anamnesis y exploración física. Este test se subdivide en 3 categorías: A: buen estado nutricional; B: desnutrición moderada; y C: desnutrición grave11.
Análisis de datosLos datos se almacenaron en una base de datos del paquete estadístico SPSS 23.0 (SPSS Inc. Il, EE. UU.) con licencia oficial de la Universidad de Valladolid. Se realizó un análisis de normalidad de las variables continuas con la prueba de Kolmogorov-Smirnov.
Las variables continuas se expresan como media (desviación estándar) y las variables no continuas como mediana (p25-p75). Las variables paramétricas se analizaron con la «t» de Student no pareada y pareada y ANOVA, y las no paramétricas con los test de Friedman, Wilcoxon, K Kruscal y U-Mann-Whittney.
Las variables cualitativas se expresaron como porcentajes (%) y se analizaron con el test de Chi-cuadrado (con correcciones de Fisher y Yates cuando sea necesario).
Se realizó un análisis de supervivencia basado en el tipo de soporte nutricional al inicio del seguimiento nutricional.
Se realizó un análisis multivariante mediante una regresión logística binaria para evaluar el peso del tipo del inicio de soporte nutricional sobre la supervivencia más de 12 meses desde el inicio del seguimiento nutricional, estratificando por edad, estado nutricional al inicio y forma de inicio de ELA.
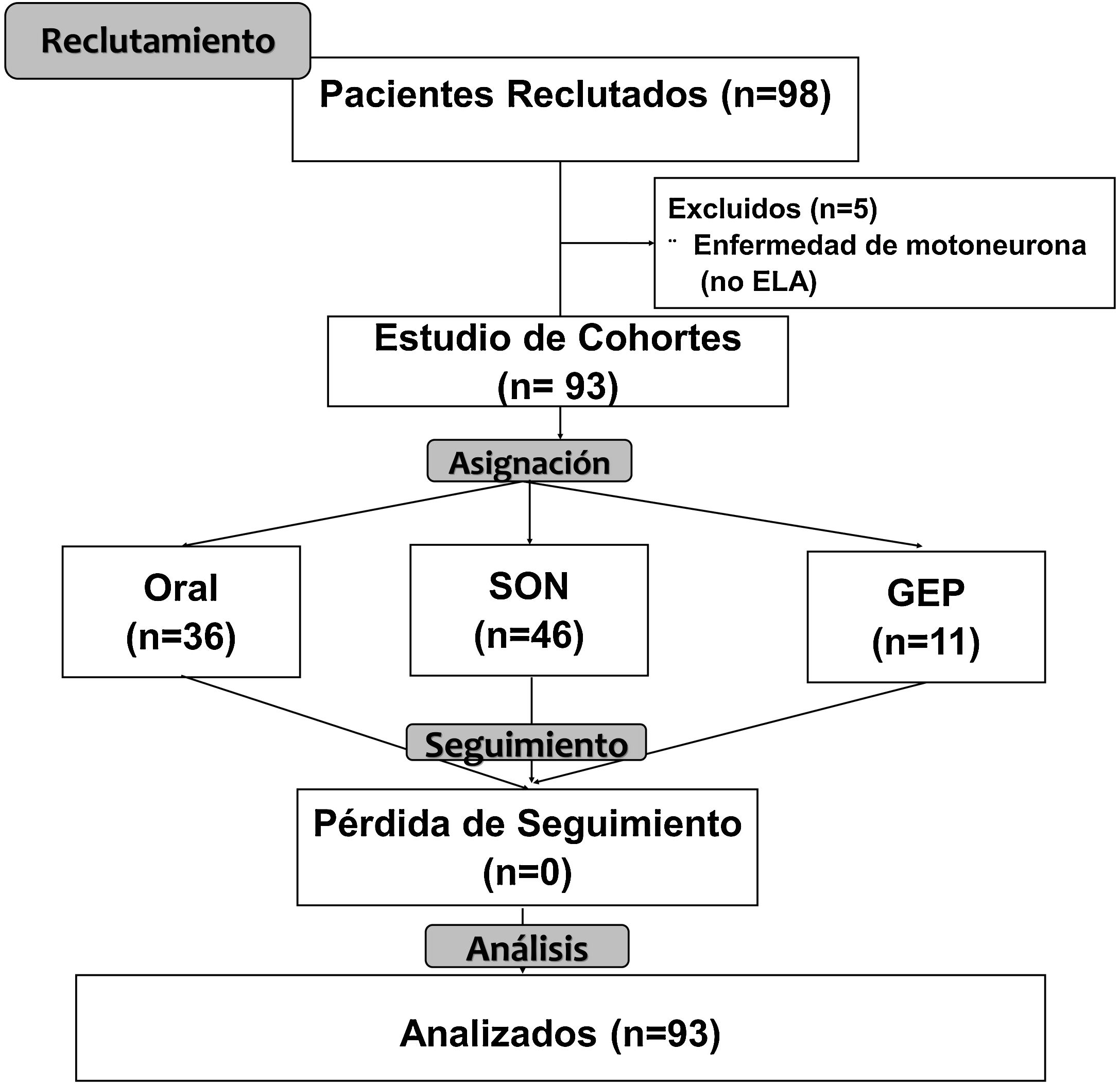
ResultadosSe reclutaron un total de 98 pacientes, de los cuales 93 (94,9%) tenían un diagnóstico de esclerosis lateral amiotrófica (ELA), 2 (2%) presentaban atrofia bulbar progresiva y 3 (3,1%) padecían esclerosis lateral primaria. Entre los pacientes con ELA 49 (52,7%) presentaron síntomas de inicio espinal y 44 (47,3%) tuvieron síntomas de inicio bulbar (fig. 1).
Del total de pacientes analizados 53 (57%) fueron hombres y 40 (43%) fueron mujeres. La edad media de los pacientes fue de 64,63 (17,67) años (espinal: 61 [17,48] años; bulbar: 67,5 [18,07] años; p=0,08).
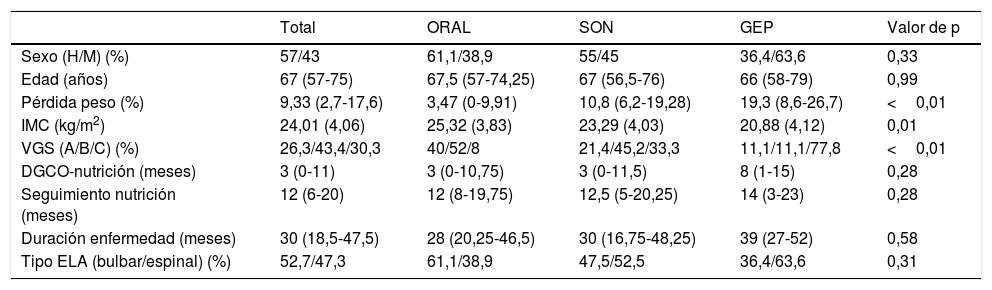
La vía de soporte nutricional al inicio fue dieta oral en el 36 (38,7%) de los pacientes; la SON se pautó en 46 (49,5%) los pacientes y en 11 (11,8%) se planteó nutrición enteral completa (GEP). La mediana de seguimiento en la unidad de nutrición clínica fue de 12 (6-20) meses. No se observaron diferencias significativas en cuando a edad, sexo, demora desde el diagnóstico hasta la primera consulta en la unidad de nutrición, duración de la enfermedad desde el inicio de los síntomas ni la forma de inicio de la ELA. Se observó una mayor pérdida de peso y un menor IMC al inicio del seguimiento nutricional en los pacientes con SON y GEP (tabla 1).
Diferencias en las variables iniciales y de seguimiento en función del tipo de soporte nutricional al inicio
| Total | ORAL | SON | GEP | Valor de p | |
|---|---|---|---|---|---|
| Sexo (H/M) (%) | 57/43 | 61,1/38,9 | 55/45 | 36,4/63,6 | 0,33 |
| Edad (años) | 67 (57-75) | 67,5 (57-74,25) | 67 (56,5-76) | 66 (58-79) | 0,99 |
| Pérdida peso (%) | 9,33 (2,7-17,6) | 3,47 (0-9,91) | 10,8 (6,2-19,28) | 19,3 (8,6-26,7) | <0,01 |
| IMC (kg/m2) | 24,01 (4,06) | 25,32 (3,83) | 23,29 (4,03) | 20,88 (4,12) | 0,01 |
| VGS (A/B/C) (%) | 26,3/43,4/30,3 | 40/52/8 | 21,4/45,2/33,3 | 11,1/11,1/77,8 | <0,01 |
| DGCO-nutrición (meses) | 3 (0-11) | 3 (0-10,75) | 3 (0-11,5) | 8 (1-15) | 0,28 |
| Seguimiento nutrición (meses) | 12 (6-20) | 12 (8-19,75) | 12,5 (5-20,25) | 14 (3-23) | 0,28 |
| Duración enfermedad (meses) | 30 (18,5-47,5) | 28 (20,25-46,5) | 30 (16,75-48,25) | 39 (27-52) | 0,58 |
| Tipo ELA (bulbar/espinal) (%) | 52,7/47,3 | 61,1/38,9 | 47,5/52,5 | 36,4/63,6 | 0,31 |
A: buen estado nutricional; B: riesgo de desnutrición; C: desnutrición severa; Dgco: diagnóstico; ELA: esclerosis lateral amiotrófica; GEP: gastrostomía endoscópica percutánea; H: hombre; IMC: índice masa corporal; M: mujer; SON: suplementación oral nutricional; VSG: valoración global subjetiva.
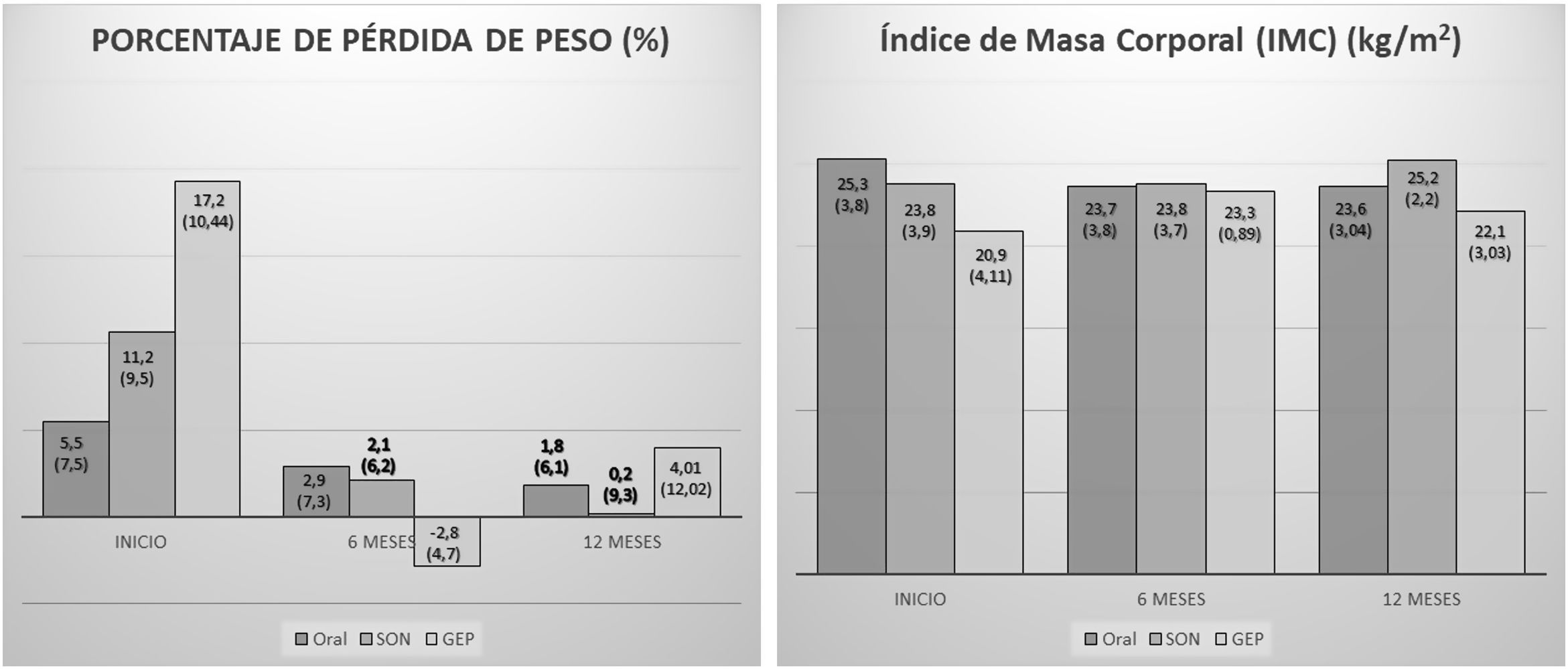
Se observó un descenso del IMC entre la primera y la segunda visita a los 6 meses (inicio: 24,18 [3,29] kg/m2; 6 meses: 23,69 [4,12] kg/m2; p<0,05). Entre los pacientes que continuaron el seguimiento tampoco se observaron diferencias en el IMC a los 12 meses (6 meses: 24,48 [2,81] kg/m2; 12 meses: 24,01 [2,69] kg/m2; p=0,31). No se observaron diferencias significativas al estratificar entre los grupos de inicio de soporte nutricional (fig. 2).
La velocidad de pérdida de peso fue menor a los 6 meses de seguimiento respecto a la observada al inicio del seguimiento nutricional (inicio: 8,09 [8,72%]; 6 meses: 1,4 [6,29%]; valor de p<0,01); no hubo cambios en la velocidad de pérdida de peso a los 12 meses (6 meses: 1,8 [6,67%]; 12 meses: 1,43 [8,81%]; p=0,87). Se observó un enlentecimiento significativo de la pérdida de peso en los pacientes con suplementación oral nutricional (fig. 2).
No se observaron diferencias significativas entre los grupos en los cambios en el IMC (kg/m2) (6 meses [ORAL: –0,74 [1,7]; SON: –0,5 [1,48]; GEP: 0,76 [1,1]; p=0,24); 12 meses (ORAL: –0,5 [1,59]; SON: –0,21 [2,4]; GEP: –1,2 [3,2]; p=0,76) y el porcentaje de pérdida de peso (%) (6 meses [ORAL: 0,15 [–1,8-7,6]; SON: 0,66 [–2,65-6,9]; GEP: –2,81 [–7,47-0,45]; p=0,28); 12 meses (ORAL: 0 [–1,96-8,6]; SON: 0 [–4,26-2,48]; GEP: 4,01 [–2,67-12,69]; p=0,22) ni a los 6 ni a los 12 meses.
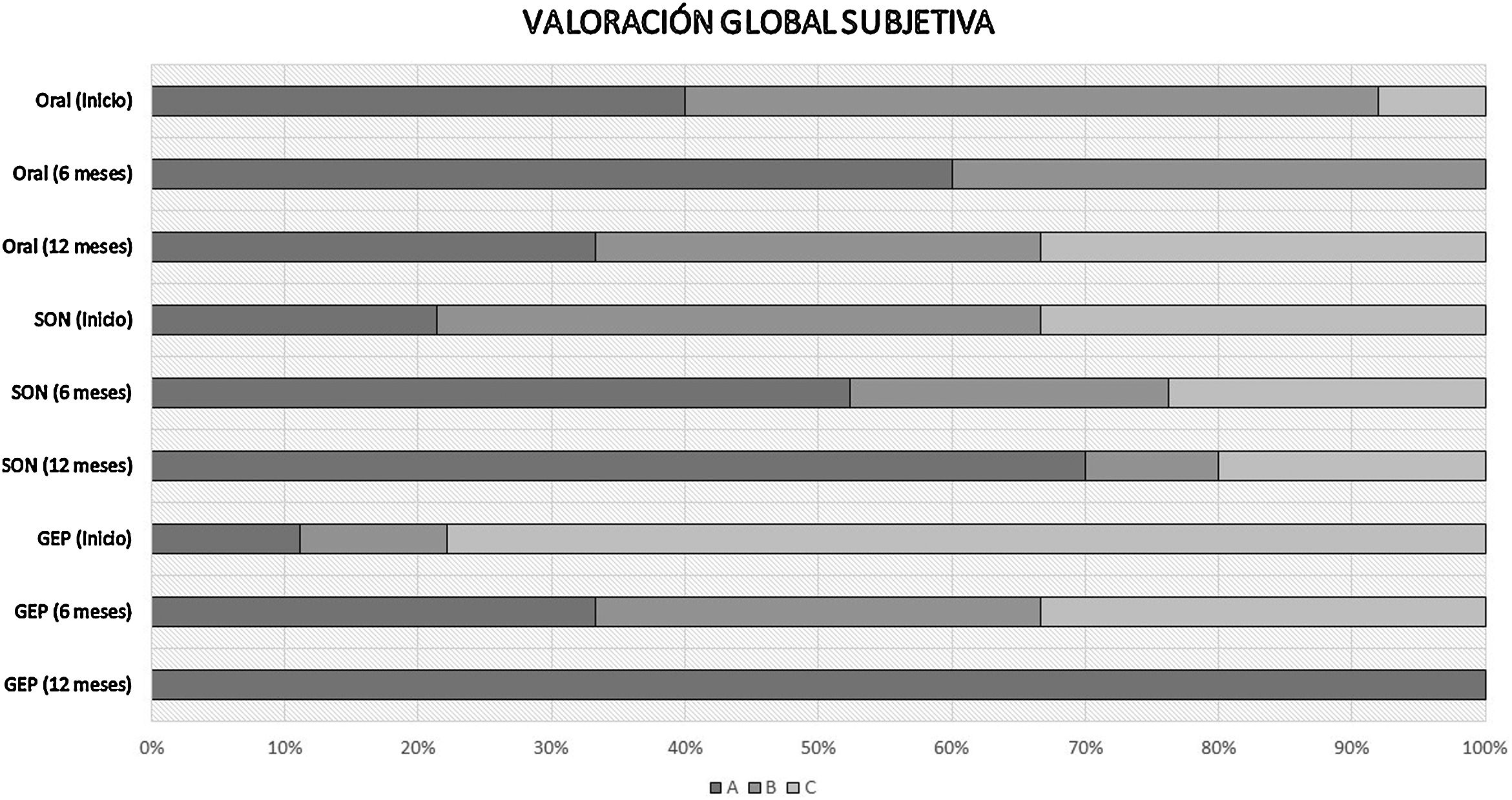
Valoración nutricionalSe observó un aumento del porcentaje de pacientes con buen estado nutricional medido por VGS y una mejoría de la situación nutricional medida por VGS a los 6 y 12 meses en todos los grupos de estudio (fig. 3).
Diferencias en la evolución de la valoración nutricional según valoración global subjetiva (VGS).
A: buen estado nutricional; B: riesgo de desnutrición; C: desnutrición severa en función del soporte nutricional al inicio del seguimiento nutricional.
GEP: gastrostomía endoscópica percutánea; Oral: dieta oral; SON: suplementación oral nutricional.
La mediana de seguimiento de los pacientes desde el diagnóstico fue de 30 (18,5-47,5meses). Del total de pacientes 36 (38,7%) fallecieron durante el período de seguimiento (espinal: 22 pacientes [44,9%]; bulbar: 14 pacientes [31,8%]); la mediana de tiempo entre el diagnóstico y el exitus fue 15,50 (8,25-27) meses (espinal: 15,50 [8,75-15,50] meses; bulbar: 15,50 [6,50-24,50] meses).
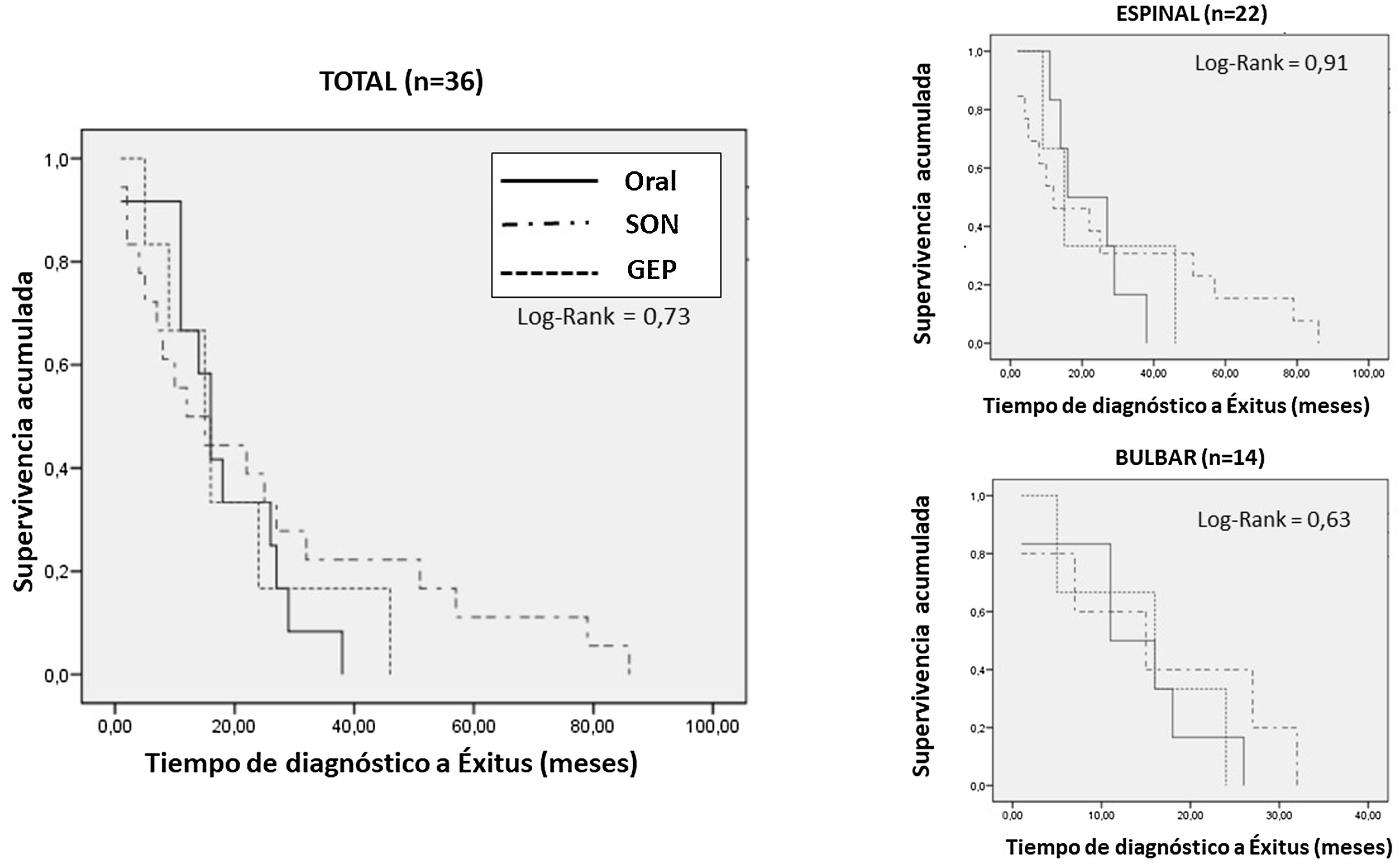
Al analizar en función del tipo de soporte nutricional pautado al inicio del seguimiento en consulta de nutrición (dieta oral adaptada, dieta oral adaptada+suplementación oral nutricional, nutrición enteral por sonda) no hubo diferencias en la tasa de exitus (ORAL: 12 [33%]; SON: 18 [39,1%]; GEP: 6 [54,5%]; p=0,45). El tiempo de supervivencia desde el inicio de los síntomas fue ligeramente mayor en el grupo de pacientes con GEP y suplementación artificial, aunque no significativo (ORAL: 28 [20,25-46,5] meses; SON: 30 [16,75-48,25] meses; GEP: 39 [27-52] meses; p=0,90). Las curvas de supervivencia de Kaplan Meier se muestran en la figura 4.
Curvas de supervivencia de Kaplan Meier en función del tipo de nutrición al inicio del seguimiento nutricional en el total de la muestra de pacientes fallecidos y estratificadas en función de forma inicio (espinal/bulbar).
GEP: gastrostomía endoscópica percutánea; Oral: dieta oral; SON: suplementación oral nutricional.
Se realizó un análisis multivariante para evaluar el tipo del inicio de soporte nutricional sobre la supervivencia de más de 12 meses desde el inicio del seguimiento nutricional, estratificando por edad, estado nutricional al inicio y forma de inicio de la ELA, sin diferencias significativas (OR: 0,97 [IC 95%: 0,35-2,71]; p=0,95).
DiscusiónEste estudio pretendía valorar el efecto de los distintos métodos de soporte nutricional especializado al inicio del seguimiento en la consulta de nutrición clínica en el paciente con ELA. Los principales resultados observados fueron que la mayor parte de los pacientes iniciaban soporte nutricional con dieta adaptada y suplementación artificial oral. Los pacientes con suplementación artificial y gastrostomía mostraron una estabilidad e incluso mejoría de los parámetros antropométricos. En los pacientes en los que se inició terapia con nutrición artificial (suplementación o gastrostomía), a pesar de comenzar el seguimiento en la consulta con un peor estado nutricional, mostraron una tendencia a la mejoría en la supervivencia, aunque no significativa.
Habitualmente el paciente con ELA presenta algún grado de desnutrición al diagnóstico de la enfermedad. Es muy importante el cribado sistemático de la desnutrición en estos pacientes, tanto en el diagnóstico como en el seguimiento, y la derivación a un servicio de nutrición especializado6. Esta valoración debe realizarse al menos con una antropometría básica con peso, talla e índice de masa corporal, además de con una medición del porcentaje de pérdida de peso. En el estudio desarrollado estos parámetros se realizaron en todos los pacientes acompañados de una valoración nutricional mediante la valoración global subjetiva. Se observó un deterioro del estado nutricional independiente de la forma de inicio de la ELA, más llamativo en los pacientes en los que se comenzó con soporte nutricional artificial. La indicación de este tipo de soporte nutricional probablemente se relacionó con el estado nutricional detectado. Se excluyeron del análisis otras formas de enfermedad de motoneurona para tener cierta homogeneidad en el desarrollo de la enfermedad y los síntomas.
En este estudio la mediana de remisión al servicio de nutrición fue de 3 meses. Paradójicamente, en los pacientes con GEP, que eran los pacientes con peor estado nutricional, esta derivación era más tardía y ya con la gastrostomía implantada. El inicio del soporte nutricional debe ser lo más temprano posible independientemente del grado de desnutrición. De hecho, en el contexto de equipos multidisciplinares la remisión más temprana a un servicio de nutrición se asocia con una menor tasa de desnutrición12.
La realización de un soporte nutricional especializado desde el diagnóstico se asocia a mejoría en parámetros de la evolución de la enfermedad. En la muestra analizada se pudo objetivar que aquellos pacientes en seguimiento consiguieron una disminución en la progresión de la pérdida de peso, una estabilización del peso, incluso en el caso de la GEP se conseguía una ganancia de peso en los primeros 6 meses. Estos resultados concuerdan con datos como los de Morassuti et al., que mostraron que el inicio de un protocolo específico nutricional conducía a una menor pérdida de peso y a una mayor supervivencia al año13.
El tipo de soporte nutricional al inicio también es controvertido debido a la escasa evidencia existente al respecto. En nuestro estudio detectamos que la técnica más frecuente de soporte nutricional especializado utilizada fue la dieta oral adaptada en tipo y textura, con suplementación artificial oral añadida. Esta situación puede deberse al estado nutricional del paciente y a la llamativa disminución de la ingesta observada. En cuanto al uso de suplementación artificial oral en la ELA, Dorst et al. compararon 2 tipos de suplementos nutricionales hipercalóricos, uno de ellos con alto contenido en grasa y otro con alto contenido en hidrato de carbono, mostrando ambos una mejoría en el peso14. Otro estudio de Körner et al. demostró también que una suplementación oral hipercalórica puede mejorar los test de calidad de vida, consiguiendo estabilizar o, incluso, aumentar el peso15. En resumen, en las situaciones en que está indicado utilizar suplementación oral artificial podría ser recomendable la utilización de productos hipercalóricos e hiperproteicos para la estabilización del peso.
Independientemente del uso de suplementación nutricional el consejo dietético basado en la capacidad de ingesta oral del paciente es básico. De hecho, el mantenimiento del placer en la ingesta influye en la decisión de implantación de gastrostomía; esto se debe a que si se consigue una buena adaptación de la dieta oral el paciente conseguirá aportar una cantidad de nutrientes ajustada a su situación patológica y podremos optimizar su situación nutricional16. Por esta razón, en el estudio realizado, incluso en los pacientes con adaptación de la dieta oral (mediante modificación de la textura o el tipo de alimentos) se conseguía una estabilización del peso, aunque no tan llamativa como en los casos en los que usábamos nutrición artificial.
La progresión de la enfermedad conduce en mayor o menor medida a distintos grados de disfagia y a una dificultad para la alimentación que condiciona que el paciente no pueda alcanzar sus requerimientos energéticos con la dieta oral. Por tanto, será preciso buscar vías alternativas de alimentación para poder obtener los requerimientos nutricionales adecuados y evitar complicaciones asociadas a la disfagia, como la broncoaspiración. El estudio de Stavroulakis et al. mostró que los factores que más influían, tanto en la familia como en el paciente en la implantación de la gastrostomía, era la dificultad de la ingesta (comidas largas y con esfuerzo), los atragantamientos y la pérdida de peso17. En general, la implantación de GEP se asocia a una mejoría inicial de los parámetros antropométricos, y a cierto beneficio en la supervivencia, como pudimos observar en nuestros datos.
La influencia en la supervivencia del tipo de nutrición de inicio no se ha planteado como tal en la literatura. En el estudio de López-Gómez et al. se mostraba que aquellos pacientes que comenzaron seguimiento con un equipo especializado de nutrición tenían una supervivencia mayor que aquellos que no18, pero no existía diferenciación en función del soporte nutricional de inicio. En el estudio de Luchesi et al. se demostró que la indicación de alimentación no-oral se relaciona con una menor duración de la enfermedad19, pero podría relacionarse con fases avanzadas de la enfermedad. En nuestro estudio no se pudieron obtener diferencias significativas en relación con el tipo de soporte nutricional de inicio, aunque se pudo observar una tendencia al aumento de supervivencia en pacientes que iniciaban soporte nutricional artificial (suplementación oral o nutrición enteral completa) respecto a en los que únicamente se realizaba adaptación de la dieta. Esta situación puede relacionarse con la propia mejoría asociada al incremento del aporte calórico-proteico conseguido con la nutrición artificial y con mejor evolución de la enfermedad de base. De hecho, Dorst et al. mostraron un aumento de la supervivencia en pacientes con ingestas calóricas elevadas, aunque en este estudio no se evalúa una fórmula en especial20.
La principal limitación de este estudio es la variabilidad en la clínica y en la progresión de la enfermedad para realizar una adecuada comparación y extrapolación de la supervivencia. Esta variabilidad puede condicionar la significación estadística, dado que se necesitarían tamaños muestrales más grandes en una enfermedad con baja prevalencia. Por otra parte, la realización de un estudio multicéntrico en una enfermedad tan compleja produce distintos protocolos de actuación y remisión a los pacientes a la consulta de nutrición. A pesar de este punto, el seguimiento y tratamiento en las distintas unidades de nutrición se realizó de una manera homogénea.
Es necesario generar evidencia en relación con el soporte nutricional en esta enfermedad con estudios con diseños prospectivos y multicéntricos para poder controlar las variables de desenlace en muestras de tamaño más elevado. También sería muy interesante la evaluación del efecto del soporte nutricional sobre la composición corporal más allá de las variables antropométricas «clásicas».
ConclusionesLa principal vía de nutrición al inicio del soporte nutricional especializado en el paciente con ELA fue la vía oral con adaptaciones dietéticas y suplementación artificial asociadas. Los pacientes con ELA presentan un deterioro severo del estado nutricional asociado a una pérdida de peso moderada-severa antes del inicio del soporte nutricional. Tras el inicio del soporte nutricional especializado se observó una ralentización en la pérdida ponderal y una mejoría del estado nutricional en los primeros meses de seguimiento.
FinanciaciónEl presente trabajo ha sido financiado con 2 becas científicas competitivas: Beca de Investigación de la Gerencia Regional de Salud de Castilla y León (SACyL), con código GRS 1238/A/16, y Beca de Investigación de la Sociedad Castellano-Leonesa de Endocrinología, Diabetes y Nutrición (SCLEDyN) en 2017.
Conflicto de interesesNo existe conflicto de intereses por parte de ninguno de los miembros del estudio en relación con el desarrollo de este.