El tratamiento con antineoplásicos orales tipo inhibidores de tirosina quinasa (ITK) es novedoso, y por ello se conoce poco sobre cómo afectan al estado nutricional (EN), la ingesta dietética, la calidad de vida, y su influencia sobre la supervivencia. Este estudio pretende aportar información sobre estos componentes, para dirigir las recomendaciones nutricionales futuras.
Pacientes y métodoEstudio prospectivo y observacional en adultos que inician ITK, donde se valoró el EN mediante el cuestionario de valoración subjetiva global generada por el paciente (VSG-GP), medidas antropométricas, parámetros bioquímicos e ingesta dietética (Recuerdo de 24h). La calidad de vida se estudió con EORTC QLQ-C30. El análisis estadístico empleó pruebas no paramétricas y la supervivencia se analizó mediante curvas de Kaplan-Meier y log-rank.
ResultadosEl 21,7% de la muestra presentó desnutrición moderada según VSG-GP; el 74,2% mostró pérdida de peso moderada a los 6 meses, aunque ningún paciente tuvo un IMC<18,5kg/m2. Los pacientes moderadamente desnutridos presentaron menor supervivencia a los 4 años del diagnóstico (log-rank=0,015).
El 44,4% realizó una ingesta energética inferior a las recomendaciones ESPEN 2017 y ningún paciente cubrió requerimientos proteicos (1,5g proteína/kg peso) durante el seguimiento.
Una peor puntuación en la escala global de salud del EORTC QLQ-C30 se relacionó con peor EN.
ConclusionesEl tratamiento con ITK no parece afectar de manera importante el EN y la calidad de vida a los 6 meses de seguimiento. Se debe prevenir la desnutrición, mediante un consejo nutricional individualizado, pues se relaciona con menor supervivencia.
Treatment with oral antineoplastic agents known as tyrosine kinase inhibitors (TKIs) is new and, thus, little is known about their impact on nutritional status (NS), dietary intake, quality of life, and survival. The aim of this study was to provide information on these components in order to guide future nutritional recommendations.
Patients and methodA prospective, observational study in adults who start treatment with TKIs, in whom NS was assessed using the Patient-Generated Subjective Global Assessment (PG-SGA), anthropometric measures, biochemical parameters, and dietary intake (24-hour dietary recall). The EORTC QLQ-C30 was used to assess quality of life. Nonparametric tests were used in statistical analysis, and survival was analyzed using Kaplan-Meier and log-rank curves.
ResultsOf the overall sample, 21.7% had moderate malnutrition according to PG-SGA, and 74.2% moderate weight loss at 6 months, but no patient had BMI<18.5kg/m2. Patients with moderate malnutrition had lower survival at four years of diagnosis (log-rank=0.015).
Energy intake was lower than recommended by the ESPEN 2017 congress, and no patient covered the protein requirements (1.5g protein/kg weight) during follow-up.
A worse score on the global health scale of the EORTC QLQ-C30 was related to worse NS.
ConclusionsTreatment with TKIs does not appear to have a significant impact on NS and quality of life after 6 months of follow-up. Malnutrition should be prevented through individualized nutritional advice because it is related to shorter survival.
El cáncer es una de las enfermedades de mayor impacto sanitario, no solo por su prevalencia, sino por su alta morbimortalidad, siendo según la Organización Mundial de la Salud (OMS) la segunda causa de muerte a nivel global1 y cuya repercusión sobre la calidad de vida del paciente y su entorno es muy importante.
Los tratamientos antineoplásicos orales han estado disponibles desde 1953, con el objetivo de facilitar la administración de la quimioterapia y ofrecer una mayor comodidad y calidad de vida. Su uso ha evolucionado sustancialmente desde finales de los años 90 gracias a los avances de la biología molecular2. Actualmente, las terapias biológicas de bloqueo específico y dirigido contra dianas concretas de la célula tumoral han dado lugar a nuevos citostáticos orales que representan cerca del 25% de estos abordajes terapéuticos3 y, en nuestros medio, aproximadamente el 38% del global de la quimioterapia4. Dentro de este grupo de fármacos, los inhibidores de tirosina quinasa (ITK) son la familia más representativa, suponiendo más del 90% del total.
Durante el tratamiento oncológico se pretende mantener un buen estado nutricional y prevenir la frecuente desnutrición asociada a la astenia, anorexia, pérdida de peso, etc., que se ve favorecida por las diferentes terapias antitumorales (quimioterapia, radioterapia, inmunoterapia, trasplante de médula, etc.), lo que se ha relacionado con menores supervivencias5. Además, se debe tener en cuenta que para desarrollar recomendaciones nutricionales efectivas, que permitan mantener o mejorar el estado nutricional de una población, se han de estudiar sus preferencias y hábitos alimentarios.
El tratamiento con antineoplásicos orales, a pesar de representar una alternativa de tratamiento muy atractivo, se asocia con nuevos retos que podrían condicionar su utilización. Además, debido a su relativa reciente comercialización, existe poca literatura que evalúe la influencia del estado nutricional en la supervivencia global. Por todo ello, el presente estudio pretende valorar el estado nutricional, la ingesta energética, de macro- y micronutrientes, así como la calidad de vida que presenta un grupo de pacientes oncológicos que comienzan tratamiento con ITK. Asimismo, se estudiará la supervivencia global de los pacientes a 4 años y la influencia del estado nutricional en la misma.
Materiales y métodosEstudio observacional prospectivo de un grupo de pacientes oncológicos del Hospital General Universitario Gregorio Marañón que inició tratamiento antineoplásico oral con ITK. Los pacientes fueron reclutados en el momento de la primera dispensación de su tratamiento en la Unidad de Pacientes Externos del Servicio de Farmacia durante el periodo de julio del 2012 a junio del 2013. Se excluyeron aquellos pacientes que presentaban un ECOG>2 y tratamiento concomitante con radioterapia o que participasen en un ensayo clínico. El protocolo fue aprobado por el Comité de Ética e Investigación del propio hospital y realizado según los principios básicos de la Declaración de Helsinki. Se informó a los pacientes de que la participación en el estudio era voluntaria y todos los que participaron firmaron el consentimiento informado.
El estudio se llevó a cabo en colaboración con los Servicios de Farmacia, Oncología y la Unidad de Nutrición. Se estructuró en 4 visitas: basal (antes de comenzar con el tratamiento), al mes, 3 meses y 6 meses del inicio del tratamiento. Fue monitorizado por 2 dietistas con experiencia para disminuir el sesgo interobservador, de las técnicas y herramientas escogidas. Al inicio del estudio se recogieron las variables demográficas (sexo, edad), los tratamientos oncológicos previos (quimioterapia y/o radioterapia), los días desde el diagnóstico hasta la inclusión en el estudio, el tipo de tumor y de ITK. En todas las visitas se recogieron las siguientes variables:
Estado nutricionalPara valorar el estado nutricional se emplearon medidas antropométricas (peso, talla y circunferencia media muscular del brazo del lado no dominante [CMB]), el cuestionario de valoración subjetiva global generada por el paciente (VSG-GP)6, que categoriza a los pacientes en 3 grupos según su estado nutricional (A=bien nutrido, B=moderadamente desnutrido y C=severamente malnutrido), y la fuerza muscular del brazo dominante (FM) medida con el dinamómetro de Collin; también se recogieron parámetros hematológicos y bioquímicos (hemoglobina, proteínas viscerales, albúmina, prealbúmina, colesterol total y sus fracciones HDL y LDL). Se categorizó el índice de masa corporal (IMC) según la OMS como bajo peso (<18,5kg/m2), peso normal (18,5-24,9kg/m2), sobrepeso (25-29,9kg/m2) y obesidad (≥30kg/m2). Se consideró pérdida de peso moderada aquella en la que hubo un porcentaje de pérdida menor del 7,5% en 3 meses o del 10% en 6 meses; y pérdida de peso grave aquella que fue mayor del 10,5% con respecto al peso del paciente antes de iniciar tratamiento con ITK. Las circunferencias se expresaron en percentiles (p.) según la población de referencia7,8 y se clasificaron como sobrepeso (p.>85), normalidad (p.15-85), desnutrición leve (p.10-15), desnutrición moderada (p.5-10) y desnutrición grave (p.<5). Para el cálculo teórico del gasto energético diario total se empleó la fórmula de Harris-Benedict con un factor de estrés de 1,2 por el tratamiento oncológico y un factor de actividad por deambulación de 1,39.
Ingesta dietéticaPara valorar la ingesta dietética se empleó un recuerdo de 24 horas (R24h). La ingesta dietética recogida se calibró mediante el programa informático DietSource 3.0®.
Calidad de vidaPara valorar la calidad de vida se utilizó el cuestionario de calidad de vida EORTC QLQ-C3010, compuesto por distintas escalas: 5 funcionales (física, rol, cognitiva, emocional y social), 8 de síntomas (fatiga, náuseas-vómitos, dolor, disnea, insomnio, anorexia, estreñimiento y diarrea) y una que evalúa el estado global de salud. Las puntuaciones de las escalas fueron transformadas para obtener una puntuación de 0 a 100, según instrucciones del manual EORTC QLQ-30. Los resultados son más positivos cuanto mayor es la puntuación para las escalas sociales y global de salud, mientras que para los síntomas una mayor puntuación supone una peor situación de dicho síntoma.
Análisis estadísticoPara el análisis estadístico se comprobó la normalidad de la muestra mediante las pruebas de Kolmogorov-Smirnov para muestras independientes y Shapiro-Wilk. Se emplearon técnicas descriptivas para las variables cualitativas, como frecuencias absolutas y relativas (porcentajes), y para las cuantitativas se calcularon mediana y rango intercuartílico [RI]; para la inferencia estadística se usaron las pruebas de Chi-cuadrado, test de Friedman y Wilcoxon para estudiar la evolución de las variables cuantitativas y la correlación de Spearman para las cualitativas. Además, para conocer cómo influyeron la patología de base, el estado nutricional y los ITK sobre las características del paciente y la ingesta se realizó Kruskall-Wallis y U de Mann-Whitney. Se estudió la supervivencia desde la inclusión en el estudio hasta 4 años tras su finalización mediante el método de Kaplan-Meier, y su relación con el estado nutricional según VSG-GP con la prueba de log-rank. Todos los resultados se llevaron a cabo mediante el paquete estadístico IBM SPSS® Statistics 21. Se consideró significación estadística a partir de valores de p<0,05.
ResultadosCaracterísticas de los pacientesSe evaluaron 31 pacientes durante el periodo de inclusión, de los cuales solo 22 cumplieron los criterios de inclusión. Desde el diagnóstico hasta el comienzo con el tratamiento de ITK habían transcurrido una mediana de 100[26-628] días. Finalizaron el estudio 17 (77%) pacientes. Las causas de salida se produjeron entre el tercer y sexto mes del seguimiento y fueron: 3 fallecimientos, un abandono voluntario y un cambio de tratamiento ante la progresión tumoral.
La muestra incluyó 12 hombres y 10 mujeres, con una edad de 66[50-76] años, que presentaron los siguientes diagnósticos: cáncer renal (47,8%), cáncer hepático (21,7%), cáncer de pulmón y tumor de estroma gastrointestinal (GIST), ambos con el 13%, y leucemia (4,5%). Siete de estos pacientes recibieron algún tratamiento oncológico previo (2 quimioterapia i.v. y 5 radioterapia). El ITK más pautado fue el pazopanib (30,4%), seguido del sorafenib (21,7%), imatinib y sunitinib, ambos con el 17,5%. El menos prescrito fue el gefitinib (13%).
Estado nutricionalLa situación del estado nutricional antes de comenzar con el tratamiento, según VSG-GP, fue A en el 73,9% y B para el 21,7% de los pacientes. No hubo ningún paciente que presentase desnutrición severa (C). Tampoco se relacionó el número de días desde el diagnóstico con esta clasificación del estado nutricional. Además, a lo largo de los 6 meses de seguimiento, el estado nutricional según VSG-GP no sufrió cambios significativos.
Las medidas antropométricas basales fueron: IMC de 27[27,2-30,7]kg/m2 y CMB de 23,6[21,6-26]cm. El 45,5% de la muestra presentaba un IMC en rango de normalidad, el 22,7% en sobrepeso y el 31,8% en obesidad. La FM basal fue 23,5[17,2-31]N, situándose el 36,4% de la muestra por debajo del percentil10 (desnutrición moderada) y correlacionándose positivamente con la CMB (p=0,007; R2=0,32). Se produjo una pérdida de peso moderada a los 3 meses en el 65,6% y grave en el 4,3%; y a los 6 meses, el 74,2% de la muestra tuvo una pérdida de peso moderada del 2,2[(−2,9)−4,9]%, pero ningún paciente presentó un IMC<18,5kg/m2.
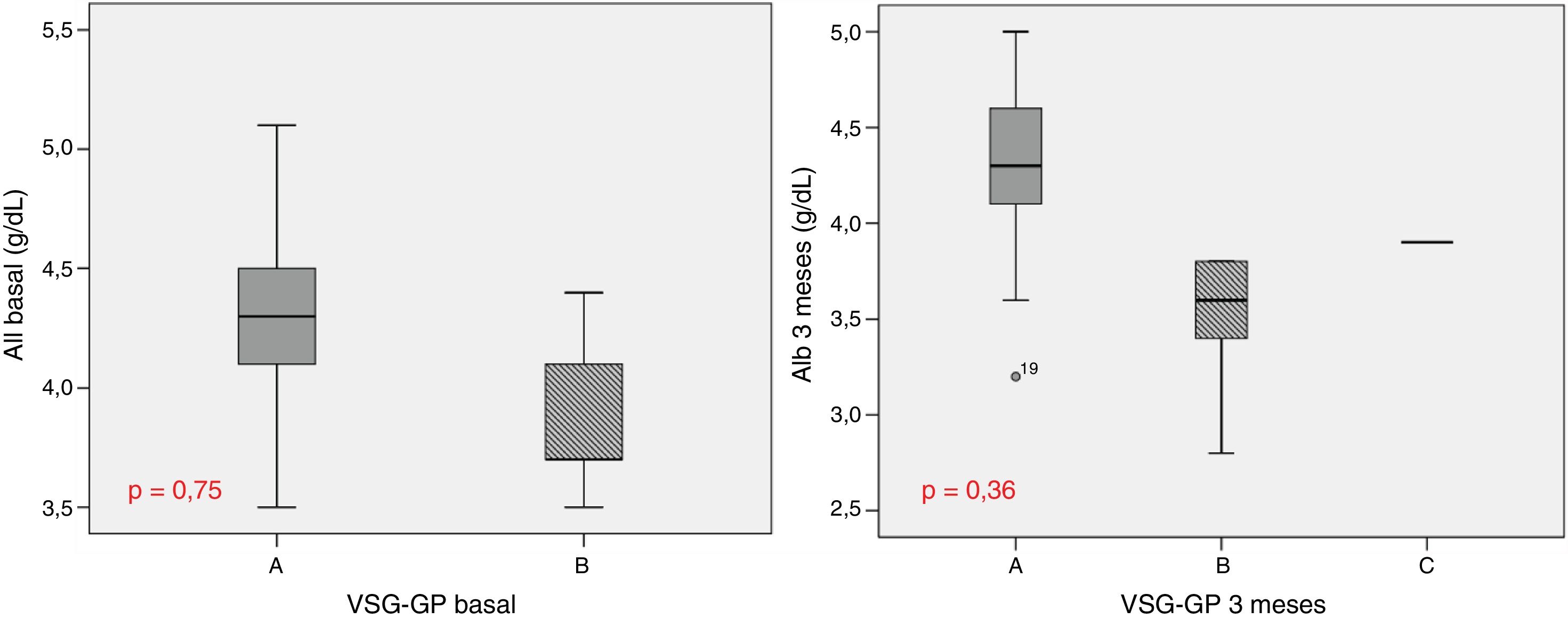
La descripción del seguimiento de los parámetros hematológicos y bioquímicos se expresa en la tabla 1. Antes del comienzo con ITK, el 27,3% de la muestra presentó una hemoglobina <12g/dL, el 15,9% una prealbúmina entre 5 y 15mg/dL y el 8,6% proteínas viscerales totales <6,2g/dL. El colesterol total estuvo elevado (>200mg/dL) en el 52,2%, presentando cifras bajas de HDL (<40mg/dL) en el 13% y altas de LDL (>130mg/dL) en el 21,4%. Se observaron peores puntuaciones en la VSG-GP en aquellos pacientes con un porcentaje de pérdida de peso mayor y una disminución de la albúmina (fig. 1). Las cifras de albúmina según VSG-GP fueron de 4,3[4,0-4,5]g/dL para estados nutricionales con valoración A y de 3,7[3,6-4,3]g/dL para B (p=0,75). No hubo valores por debajo de 3,5g/dL en ningún paciente. Tampoco hubo cambios significativos en los parámetros hematológicos y bioquímicos teniendo en cuenta el tipo de ITK.
Evolución de los parámetros bioquímicos y hematológicos
| Parámetros | Basal (n=22) | 3 meses (n=22) | 6 meses (n=18) | p |
|---|---|---|---|---|
| Hb (g/dL) | 13,7 [11,6-14,8] | 13,6 [11,4-14,7] | 13,1 [11,6-15,2] | 0,838 |
| Albúmina (g/dL) | 4,2 [3,8-4,4] | 4,2 [3,8-4,5] | 4,2 [4-4,4] | 0,641 |
| Prealbúmina (mg/dL) | 27 [18-34] | 26 [22,5-30,5] | 22 [20-24] | 0,575 |
| Proteínas séricas (g/dL) | 7 [6,5-7,5] | 6,7 [6,4-7,2] | 7 [6,3-7,4] | 0,747 |
| Colesterol total (mg/dL) | 205 [183-224] | 192 [173-219] | 180 [151-226] | 0,137 |
| HDL colesterol (mg/dL) | 57 [49-67] | 58 [48-66] | 53 [44-69] | 0,556 |
| LDL colesterol (mg/dL) | 113 [96-145] | 112 [85-125] | 91 [77-133] | 0,230 |
La ingesta durante el último mes antes de comenzar el tratamiento con ITK fue calificada de «sin cambios» por el 45,5% de la muestra y de «mayor de lo habitual» y «menor de lo habitual» por el 27,3% para ambas percepciones, según VSG-GP.
Según el cuestionario R24h basal, el número de comidas antes de comenzar con el tratamiento fue de 4,5 [4-5], tomando un 47,8% de la población estudiada 5 o más comidas al día, un 52,2% tomaban 3-4 comidas al día y el resto, 2 o menos. Un mayor número de comidas diarias se relacionó positivamente con una mayor ingesta calórica (p=0,04), precisando de al menos 5 comidas al día para superar las 2.000kcal.
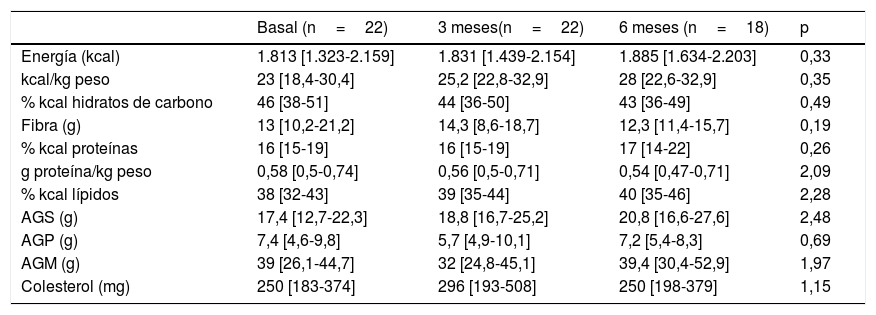
Las variables estudiadas de la ingesta dietética se muestran en la tabla 2, y no se modificaron significativamente durante la evolución. El 86,4% no alcanzó las recomendaciones de 0,8g proteína/kg de peso al día. Además, hubo diferencias significativas por sexo para el consumo de proteínas, siendo desde el inicio mayor en los hombres (0,7[0,56-0,83]g/kg peso) que en las mujeres (0,51[0,35-0,62]g/kg peso) (p<0,03). A los 6 meses de seguimiento no se consiguieron cubrir los requerimientos calóricos específicos para pacientes oncológicos (25-30kcal/kg de peso al día) para el 44,4% de la muestra y ningún paciente consiguió cubrir los requerimientos proteicos (1,5g proteína/kg peso al día). La ingesta energética total que aportaban los ácidos grasos saturados (AGS) fue del 10[6,7-10,5]%, del 17[15,5-21,6]% para ácidos grasos monoinsaturados (AGM) y del 3[3-4,4]% para ácidos grasos poliinsaturados (AGP). La ingesta de colesterol superó los 300mg/día en el 31,8% y el consumo de fibra dietética fue <30g/día en el 91,3%; estas ingestas no se relacionaron con patrones alterados del perfil lipídico estudiado. No se observaron diferencias teniendo en cuenta la patología de base o ITK pautado y tampoco se encontró relación entre ninguno de los parámetros de la ingesta dietética, bioquímicos ni hematológicos con el estado nutricional según VSG-GP. Ningún paciente recibió suplementación nutricional oral durante el seguimiento.
Evolución de la ingesta dietética
| Basal (n=22) | 3 meses(n=22) | 6 meses (n=18) | p | |
|---|---|---|---|---|
| Energía (kcal) | 1.813 [1.323-2.159] | 1.831 [1.439-2.154] | 1.885 [1.634-2.203] | 0,33 |
| kcal/kg peso | 23 [18,4-30,4] | 25,2 [22,8-32,9] | 28 [22,6-32,9] | 0,35 |
| % kcal hidratos de carbono | 46 [38-51] | 44 [36-50] | 43 [36-49] | 0,49 |
| Fibra (g) | 13 [10,2-21,2] | 14,3 [8,6-18,7] | 12,3 [11,4-15,7] | 0,19 |
| % kcal proteínas | 16 [15-19] | 16 [15-19] | 17 [14-22] | 0,26 |
| g proteína/kg peso | 0,58 [0,5-0,74] | 0,56 [0,5-0,71] | 0,54 [0,47-0,71] | 2,09 |
| % kcal lípidos | 38 [32-43] | 39 [35-44] | 40 [35-46] | 2,28 |
| AGS (g) | 17,4 [12,7-22,3] | 18,8 [16,7-25,2] | 20,8 [16,6-27,6] | 2,48 |
| AGP (g) | 7,4 [4,6-9,8] | 5,7 [4,9-10,1] | 7,2 [5,4-8,3] | 0,69 |
| AGM (g) | 39 [26,1-44,7] | 32 [24,8-45,1] | 39,4 [30,4-52,9] | 1,97 |
| Colesterol (mg) | 250 [183-374] | 296 [193-508] | 250 [198-379] | 1,15 |
AGM: ácidos grasos monoinsaturados; AGP: ácidos grasos poliinsaturados; AGS: ácidos grasos saturados.
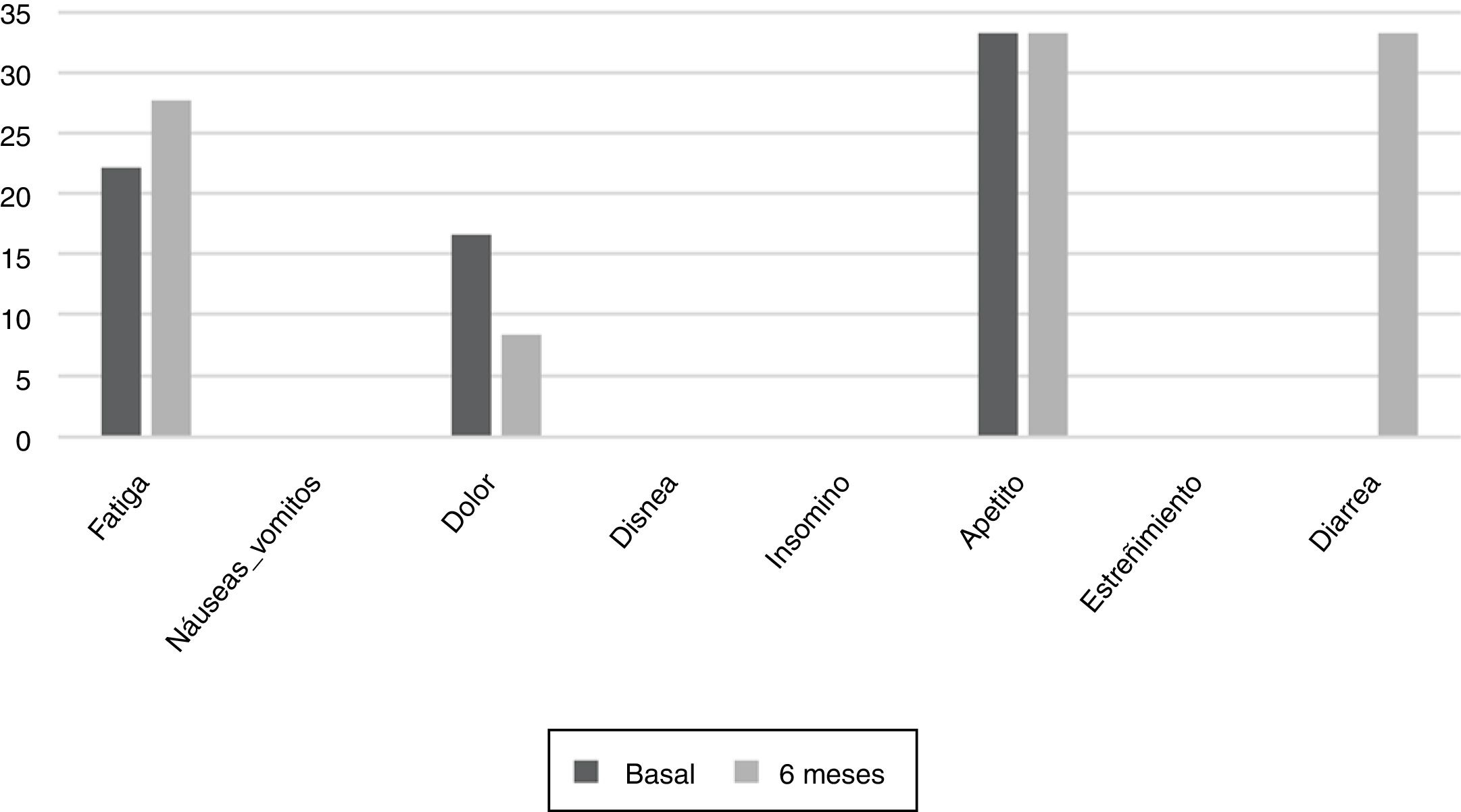
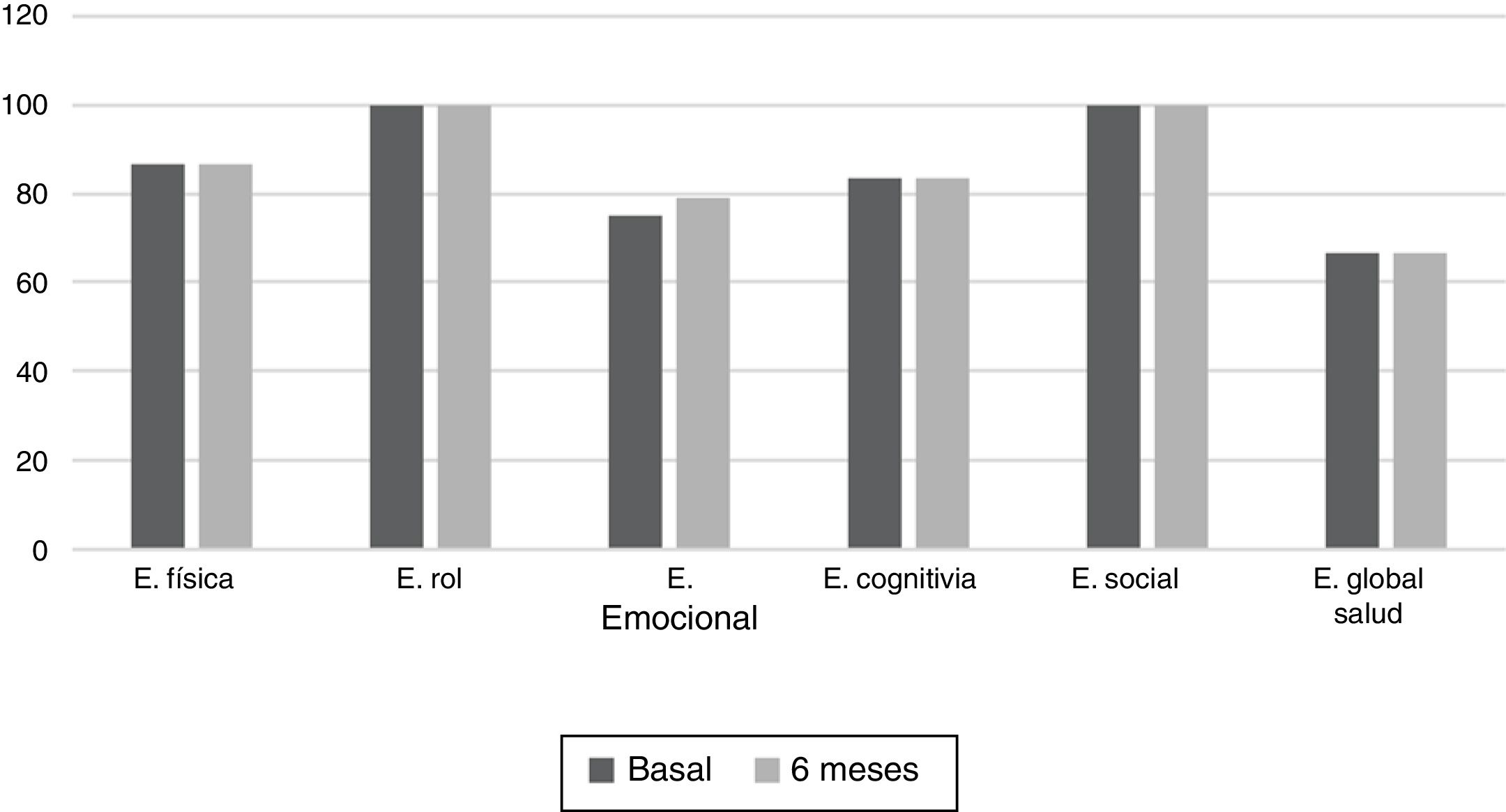
Los resultados del EORTC QLQ-C30 se muestran en las figuras 2 y 3. Antes de comenzar el tratamiento las escalas funcionales más afectadas fueron la escala física y la cognitiva, mientras que para los síntomas fueron la fatiga, el estreñimiento y la diarrea. A los 6 meses de seguimiento no se encontraron diferencias significativas en estos resultados, aunque se incrementaron los síntomas de diarrea y fatiga.
Las escalas funcionales que se relacionaron con el estado nutricional, tanto antes del inicio del tratamiento con ITK como durante el seguimiento con el fármaco, fueron la escala física (p=0,01), de rol (p=0,008), emocional (p=0,046) y escala global de salud (p=0,008). El único síntoma que se relacionó con el estado nutricional fue el apetito, que tuvo puntuaciones menores en los pacientes con estado nutricional A.
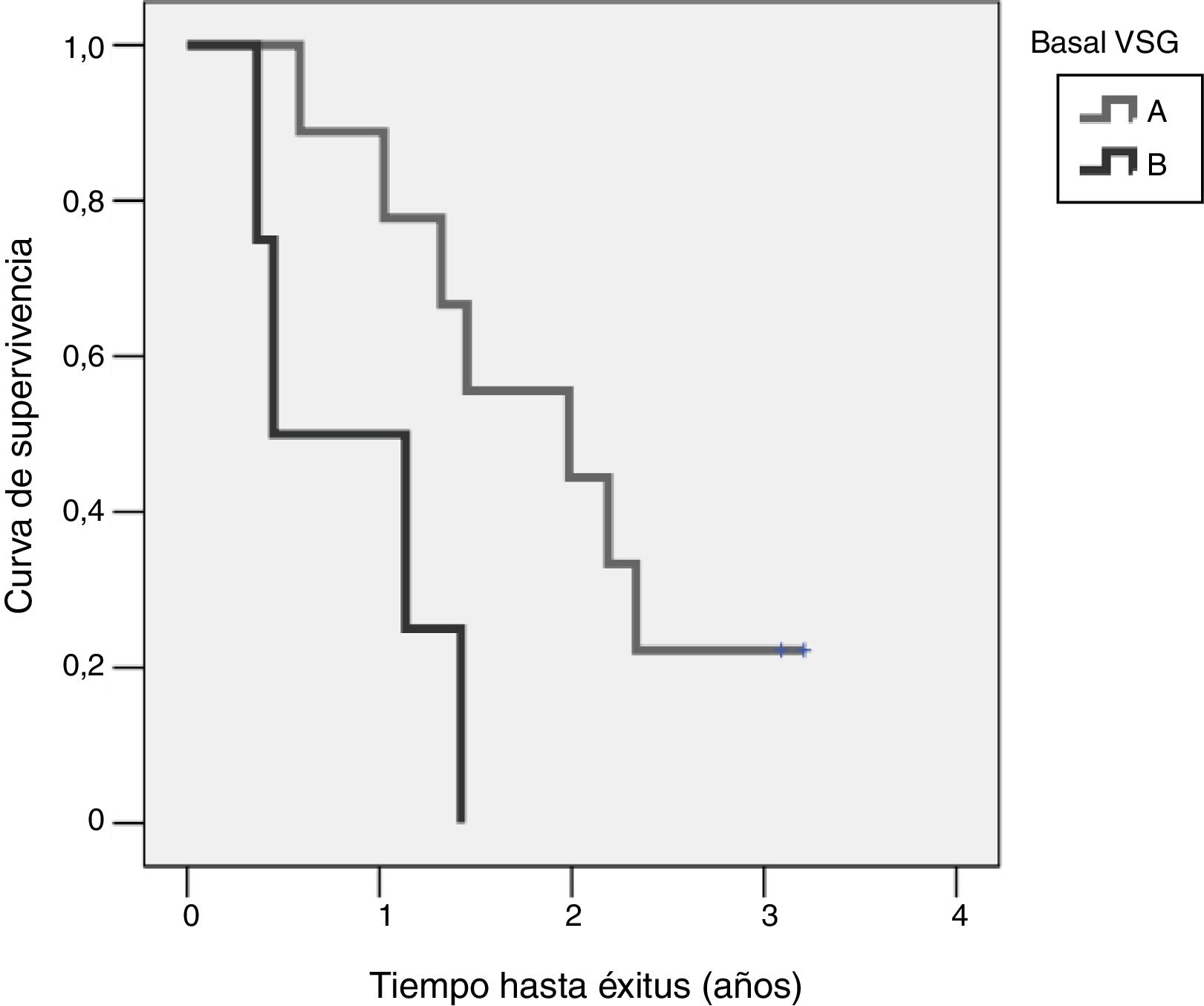
Estudio de la supervivencia y su relación con el estado nutricionalLa supervivencia global a 4 años desde la inclusión en el protocolo fue del 85% a los 5 meses, del 69% al año y del 15% a los 2 años y medio. Si tenemos en cuenta el estado nutricional en el momento de la inclusión del protocolo, se observa una diferencia significativa (log-rank=0,015) entre los pacientes con buen estado nutricional (A según VGS-GP), que vivieron una mediana de 725[158-1.291] días desde su diagnóstico, y los pacientes con estado nutricional B según VSG-GP, que vivieron una mediana de 164[141-440] días. En la figura 4 se puede observar la diferencia en la supervivencia según el estado nutricional por VSG-GP.
DiscusiónLos profesionales sanitarios deben tener en cuenta la gran variedad de factores que afectan el resultado de la evolución de un paciente que comienza terapia mediante ITK. Este tipo de tratamiento domiciliario se considera menos agresivo que la quimioterapia intravenosa, y por ello sus consecuencias pueden pasar desapercibidas en la práctica clínica habitual. Los resultados de este estudio sirven de aproximación sobre lo que este tipo de terapias antineoplásicas orales pueden producir sobre el estado nutricional, la ingesta energética y la calidad de vida. Además de reafirmar que el estado nutricional puede condicionar la supervivencia de estos pacientes.
En primer lugar, este estudio pone de relevancia la importancia de la valoración nutricional integral. La VSG-GP sigue siendo la herramienta de referencia en estos pacientes, pero siempre manteniendo el cribado nutricional para una adecuada derivación11. La presentación de desnutrición en nuestra muestra fue inferior a otros estudios4,5,12. El uso de herramientas antropométricas de manera aislada puede infraestimar la prevalencia de desnutrición pues, mientras que durante el seguimiento ningún paciente presentó bajo peso o percentiles por debajo de 15, sí hubo pérdidas de peso moderadas en más del 70% de la muestra. La FM parece ser un marcador interesante de la presencia de desnutrición, ya que condiciona peores resultados en la escala física de la calidad de vida, que desde el inicio fue de las más afectadas. La pérdida de peso mayor del 10% en los últimos 6 meses ha demostrado ser factor independiente de mortalidad13, y la FM se asocia de forma independiente con la supervivencia y la calidad de vida en pacientes oncológicos14. Por tanto, serán estas variables antropométricas las que deberían incluirse en la práctica clínica habitual. Respecto a los parámetros bioquímicos y hematológicos analizados, cabe destacar que más del 80% de la muestra presentaba niveles séricos de albúmina, prealbúmina y proteínas viscerales en rango de normalidad, aunque los pacientes moderadamente desnutridos presentaban niveles de albúmina inferiores a los bien nutridos. No se observó que los ITK afectasen de manera significativa a los parámetros evaluados, por lo que se avala su seguridad a este nivel.
Con respecto a las modificaciones en la alimentación de estos pacientes, es preciso comentar que se han observado diferentes percepciones de la variación que había sufrido la cantidad en su ingesta habitual antes de comenzar con el tratamiento de ITK, que puede deberse a múltiples causas como una alteración de la respuesta automática de la palatabilidad y recompensa de los alimentos15 o la localización del tumor16. En este estudio se ha observado que el conservar la sensación de apetito se relaciona con el mantenimiento de un estado nutricional adecuado. Sin embargo, las medianas de ingesta calórica y proteica, previas al comienzo del tratamiento, se sitúan por debajo de las recomendaciones de la Sociedad Europea de Nutrición Clínica y Metabolismo (ESPEN)17. Además, al no realizarse una intervención nutricional individualizada durante el seguimiento, la ingesta deficiente no sufre modificaciones significativas; esto podría influir en las diferencias de supervivencia encontradas entre los pacientes bien nutridos y moderadamente desnutridos, pues consumos de energía y proteínas por debajo del 50% de los requerimientos incrementan la mortalidad a los 6 meses18. De hecho, estudios recientes han demostrado como un aumento en el riesgo nutricional previo a un tratamiento puede asociarse a una menor supervivencia19,20. Por ello, dentro del manejo dietético-nutricional se ha de considerar la importancia del número de comidas dentro del patrón dietético, pues aunque el predominante de la muestra fue de 3-4 comidas diarias, y similar al descrito por otros estudios21, nuestros resultados observaron que se deberían aumentar a más de 5 para facilitar el alcanzar los requerimientos energéticos. Además, convendría insistir en la ingesta suficiente de alimentos con proteína de alto valor biológico, como la clara de huevo, el pescado blanco y el azul o las carnes de ave, sin piel o grasa visible, que pueden ser añadidos a primeros platos de verdura para complementarlos, y deberían estar presentes diariamente como segundos platos en estos pacientes, para cubrir los requerimientos proteicos.
Dentro de las consideraciones metodológicas, hemos de tener en cuenta que el R24h se basa en datos subjetivos, y puede sobre- o infraestimar la ingesta, pero en los pacientes oncológicos parece ser una herramienta adecuada para el estudio calórico y proteico22. La distribución de la ingesta energética en los macronutrientes de la muestra difiere ligeramente de la descrita (hidratos de carbono: 50-56%; grasas: 25-30% de la energía)18, pues los hidratos de carbono no alcanzan el 45% de la energía, siendo el consumo de fibra dietética menor de 30g al día en más del 90% de los pacientes. Además, la compensación calórica parece realizarse a expensas de un mayor consumo de grasas (39%), lo que conlleva que un tercio de la muestra consuma cifras de colesterol por encima de 300mg diarios. Estos excesos o déficits de componentes dietéticos no se han relacionado con alteraciones patológicas del perfil lipídico. Para controlar el aporte de colesterol dietético conviene restringir la ingesta de quesos grasos, mantequilla, nata y salsas que las contengan, así como mayonesa y repostería/bollería industrial, evitar piezas de carne grasas (tocino, panceta, embutidos…) y que la ingesta de huevos enteros no supere las 4 raciones semanales. Por otro lado, un aporte diario de 3 raciones de fruta, 2 de verduras y 5 de cereales, así como legumbre 3-4 veces a la semana, ayudará a conseguir una ingesta suficiente de fibra.
Durante todo el estudio se ha evaluado la calidad de vida de los pacientes, pues se ha descrito que el deterioro del estado nutricional es uno de los factores que más influyen en esta23. Los síntomas más comunes al inicio del estudio fueron la fatiga, el dolor y la modificación del apetito24; las variaciones del apetito son frecuentes durante los tratamientos antineoplásicos. Durante el seguimiento los pacientes no presentaron grandes cambios, aunque la diarrea aumentó en más de un tercio de ellos, probablemente como consecuencia del daño producido en la mucosa intestinal y del colon, que además cursa con una producción excesiva de fluidos secretados en la luz intestinal. La presencia de náuseas o vómitos no aumentó como en otros estudios, donde llegaban a afectar a más del 40% de la población25. Será útil informar al inicio del tratamiento con ITK de la probabilidad de diarrea como efecto secundario, y facilitar el manejo dietético y de hidratación para que sepan cómo actuar en el caso de aparición. La estabilidad durante el seguimiento en las escalas de calidad de vida revela una buena tolerancia al tratamiento y un buen pronóstico de supervivencia26, pero también se ha observado que la falta de intervención nutricional puede condicionar la tolerancia al tratamiento y la calidad de vida27.
En relación con las posibles limitaciones del estudio, se debe tener en cuenta que acceder a la participación indica un interés o preocupación sobre la salud que podría condicionar los resultados por el efecto Hawthorne28. Además, el estudio de la ingesta presenta las limitaciones de las propias técnicas que incluyen las variaciones de los programas de calibración de dietas29. Sin embargo, el uso de distintos métodos para valorar el estado nutricional hace de este estudio una oportunidad de plantear abordajes prácticos para la toma de decisiones; y aunque la muestra es pequeña, los resultados demuestran que los ITK no parecen influir negativamente sobre el estado nutricional, y que la ingesta dietética en la población oncológica está afectada cuantitativa y cualitativamente antes de comenzar el tratamiento.
En este estudio se han aportado posibles recomendaciones dietéticas a tener en cuenta para evitar que los pacientes presenten dietas deficitarias, basándonos en la evidencia científica observada de su patrón alimentario. Parece oportuno plantear la elaboración de un documento informativo para pacientes que comienzan con este tratamiento, donde se ponga de relieve la importancia de realizar un número de comidas diarias de al menos 5, la importancia de la ingesta de alimentos proteicos pero con bajo contenido en colesterol, así como una ingesta suficiente de verduras, frutas, legumbres y cereales, incluso antes de iniciar cualquier tratamiento. Nuestros resultados reflejan como un deterioro del estado nutricional puede condicionar una diferencia en la supervivencia. Por tanto, reforzar la presencia de los profesionales de la dietética y la nutrición antes, durante y tras el tratamiento oncológico como parte del equipo multidisciplinar, para que sea accesible a todos, incluso con terapias aparentemente poco agresivas a nivel nutricional, sería una fuente de calidad de vida30.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.