La importante prevalencia y morbimortalidad de la obesidad ha ocasionado un aumento de pacientes sometidos a cirugía bariátrica. Son numerosos los beneficios reportados de la cirugía de la obesidad en distintas esferas de la salud. Sin embargo, no ocurre lo mismo sobre el hueso, donde tiene un impacto negativo. Los mecanismos fisiopatológicos que subyacen en el deterioro del tejido óseo de estos pacientes son complejos y requieren de un estudio en profundidad. El adecuado conocimiento de estos factores permitirá adoptar las herramientas más oportunas para un adecuado abordaje terapéutico.
The important prevalence and morbidity of obesity has generated an increase in bariatric surgery. It has a positive effect in obesity-related comorbidities. However, it's detrimental to bone health. The underline pathophysiological mechanisms are complex and heterogeneous. The knowledge of these factors may lead us to develop an adequate therapeutic intervention.
La obesidad es un problema sanitario de primer orden en base a su elevada prevalencia y a las consecuencias que conlleva sobre la morbimortalidad de la población que la sufre. Según la Organización Mundial de la Salud, la obesidad y el sobrepeso han alcanzado caracteres de epidemia a nivel mundial. En 2014, más de 1.900 millones de adultos tenían sobrepeso, de los cuales más de 500 millones eran obesos, con perspectiva de ir en aumento si no se logra invertir esta tendencia1. En España, los datos del estudio ENPE (estudio transversal diseñado para representar a la población española de adultos entre 25 y 64 años) estiman una prevalencia de sobrepeso del 39,3% y de obesidad general del 21,6%2.
Este alarmante incremento ha llevado consigo un aumento de los pacientes sometidos a tratamiento quirúrgico de la obesidad, ya que la cirugía bariátrica es un tratamiento eficaz en este trastorno, no solo para el control del peso, sino también para las comorbilidades asociadas (diabetes mellitus tipo 2, hipertensión arterial, enfermedad respiratoria, dislipidemia, etc.)3,4. Por el contrario, en el tejido óseo parece tener un efecto negativo que es preciso considerar, con una alteración en la densidad mineral ósea (DMO) y de la microarquitectura ósea5. La consecuencia es, lamentablemente, la aparición de fracturas por fragilidad. Se ha demostrado en varios estudios retrospectivos un incremento significativo del riesgo de fractura en pacientes sometidos a cirugía bariátrica frente a controles6–8. Este incremento del riesgo de fractura es mayor para aquellas técnicas con un mayor componente malabsortivo9. No obstante, teniendo en cuenta las limitaciones de los estudios retrospectivos, es necesario llevar a cabo más investigaciones de tipo prospectivo.
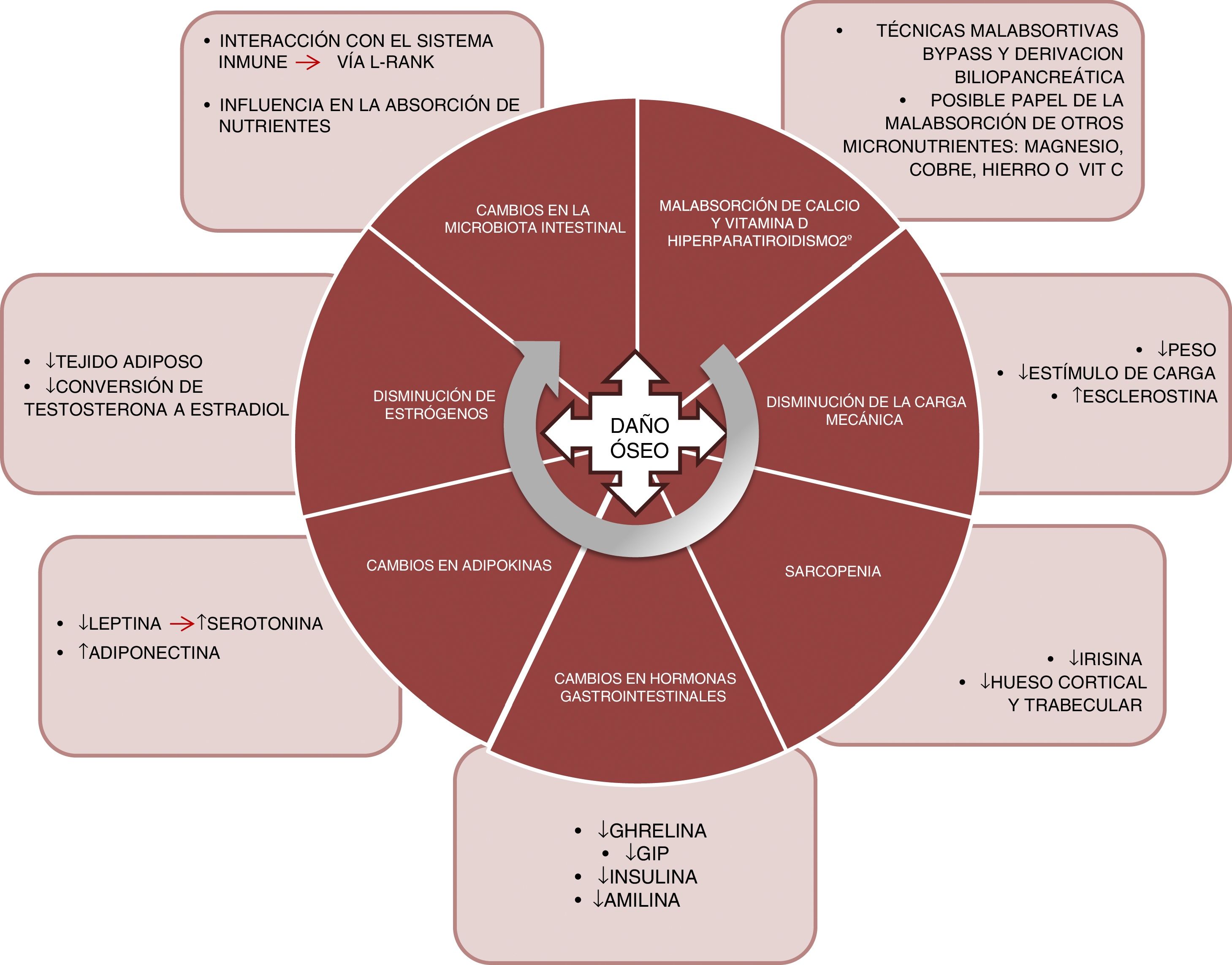
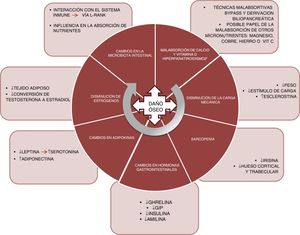
FisiopatologíaLos mecanismos que subyacen a este efecto deletéreo en el hueso son heterogéneos y todavía no se conocen plenamente. En la figura 1 se resumen los principales factores que conocemos en la actualidad y que detallamos a continuación:
Malabsorción. El primer factor implicado sería la malabsorción de calcio y vitamina D. Las técnicas como el bypass o la derivación biliopancreática alteran la absorción de estos nutrientes, pudiendo dar origen a un hiperparatiroidismo secundario10. Calcio y fósforo son nutrientes fundamentales en la mineralización del hueso y, por lo tanto, determinantes de la resistencia del mismo a la aparición de fracturas por fragilidad. Asimismo, el papel de la vitamina D es crucial en el metabolismo óseo. Su absorción tiene lugar en yeyuno e íleon, por lo que se ve afectada por aquellas técnicas quirúrgicas que excluyen parte de ese tramo intestinal. El déficit de vitamina D tras la cirugía bariátrica está ampliamente documentado11, con prevalencias del 44% tras bypass gástrico y del 50% tras la derivación biliopancreática12.
Por otro lado, habría que considerar si el déficit de otros micronutrientes, como el magnesio, tiene un papel relevante en el deterioro de la salud ósea en estos pacientes13. La deficiencia de magnesio es relativamente frecuente tras la cirugía. Dalcanale et al. describen un déficit de magnesio tras bypass gástrico del 32,1%14. La hipomagnesemia está asociada a un descenso de la masa ósea, ya que influye sobre la secreción de PTH y sobre la respuesta del hueso a dicha hormona, dando origen a hipocalcemias refractarias a la suplementación con calcio. Otros micronutrientes, como la vitamina C y ciertos oligoelementos (cobre, manganeso y cinc), actúan como cofactores en la síntesis de las proteínas de la matriz ósea, las colagenasas metaloproteinasas de la matriz, necesarias para el normal metabolismo óseo, y su deficiencia podría ser otra causa de disminución de la masa ósea en estos pacientes. Y también se han descrito problemas en la absorción de dichos nutrientes tras bypass gástrico15 y derivación biliopancreática16.
Finalmente, existen dudas sobre el papel del hierro en el riesgo de fractura. Un estudio transversal de la cohorte The Osteoporotic Fractures in Men Study (MrOs)– demuestra que la saturación de la transferrina y el hierro sérico son predictores independientes de los valores de FGF-2317. Según esto, niveles disminuidos de hierro podrían ocasionar la elevación de FGF-23, que ocasionaría una disminución de la reabsorción de fósforo, una disminución en la síntesis de 1,25(OH)2D3 y, en consecuencia, favorecería la desmineralización ósea. No obstante, son necesarios estudios que confirmen la correlación del metabolismo del hierro y del FGF-23 en estos pacientes, ya que algunos estudios sitúan la prevalencia de déficit de hierro a los 10 años del bypass en torno al 20%18.
Disminución en la carga. El osteocito es la célula del tejido óseo que actúa como mecanosensor, capaz de detectar cambios en la carga a través de modificaciones en el flujo canalicular que modulan los niveles tanto de esclerostina como de DKK1 (inhibidores de la vía anabólica WNT). Así pues, en los pacientes sometidos a cirugía bariátrica, la importante pérdida ponderal ocasiona una disminución en este estímulo mecánico, con el consecuente incremento de los niveles de esclerostina. Muschitz et al. realizaron un estudio en 52 mujeres premenopáusicas sometidas a cirugía bariátrica (bypass o sleeve) que fueron seguidas durante 24 meses y donde se objetivó un incremento significativo de la esclerostina y del marcador de resorción CTX, así como una disminución en la DMO tras la intervención19. En otro estudio realizado en 107 adultos con obesidad aleatorizados en 4 grupos (control, dieta, ejercicio y ejercicio con dieta) se objetivó una pérdida significativa de peso en 2 de los grupos: dieta y dieta con ejercicio; pero de estos 2, solo se incrementó la esclerostina en el grupo con dieta, por lo que se concluye que el estímulo mecánico producido por el ejercicio es fundamental en la regulación de los niveles de esclerostina20.
Sarcopenia. La pérdida de peso que produce la cirugía bariátrica no ocurre solo a expensas de la masa grasa. Al igual que ocurre al realizar un plan de alimentación hipocalórico, también se acompaña de una pérdida de masa muscular21. El músculo es un protagonista importante del metabolismo óseo, y cada vez hay más documentación al respecto. Existe un diálogo entre el hueso y el músculo en el que participan miocinas importantes como la irisina. El tratamiento con irisina recombinante ha demostrado, en modelo murino con pérdida de masa ósea producida por suspensión, preservar la densidad ósea trabecular y cortical, así como el volumen trabecular medido por micro-TC22. En la cohorte MrOS (5.994 varones), se evaluó el riesgo de fractura para los pacientes con sarcopenia, obesidad sarcopénica, obesidad sin sarcopenia o ninguna de las condiciones. Se objetivó un incremento del riesgo de fractura significativo en sarcopenia aislada (HR 2,02; 1,06-3,84) y en obesidad sarcopénica (HR 3,11; 1,18-8,17)23.
Cambios en hormonas gastrointestinales. El tracto gastrointestinal es considerado el mayor órgano endocrino. Son diversas las hormonas cuyas concentraciones se ven afectadas tras la cirugía de la obesidad. La ghrelina es una de las más importantes. Esta hormona es secretada principalmente en el fundus gástrico y el duodeno. Tiene un efecto positivo en el hueso, estimulando la formación ósea24, e indirecto, ya que estimula la secreción de hormona de crecimiento. Las variaciones en los niveles de ghrelina tras la intervención dependerán de si el reservorio gástrico excluye o no el fundus. Así pues, y como cabe esperar, existe una disminución significativa de ghrelina en aquellos pacientes sometidos a gastrectomía vertical o cruce duodenal, donde el reservorio es vertical25–27.
El GIP es secretado en el duodeno y el yeyuno proximal y produce un efecto positivo en el hueso, evitando la resorción ósea y favoreciendo la formación, tal y como se ha demostrado en modelo animal28. Se ha objetivado una disminución significativa de GIP en aquellas técnicas que excluyen el duodeno, como son el bypass y la derivación biliopancreática29,30.
En el íleon terminal se secretan el GLP-1 y el péptido YY. Aunque en modelo animal ha demostrado un efecto positivo en el hueso31, no se conoce bien el papel de estos péptidos sobre el metabolismo óseo en humanos, ya que los resultados son dispares32. Tras la cirugía de la obesidad, se ha descrito un incremento muy significativo de la secreción posprandial de GLP-133,34.
Finalmente, las hormonas pancreáticas, insulina35 y amilina36, se ven afectadas de manera similar tras la cirugía bariátrica, experimentando una reducción significativa en el contexto de una menor resistencia insulínica. Ambas hormonas, como es bien sabido, tienen un efecto anabólico en el hueso37.
Cambios en adipocinas. La leptina es secretada principalmente por el tejido adiposo blanco y experimenta una significativa disminución tras la cirugía bariátrica, en relación con la pérdida de masa grasa38. Por el contrario, la adiponectina experimenta un incremento tras la cirugía bariátrica39. El papel de la leptina en el hueso ha sido fuente de discusión; en modelo animal de ratón ob/ob, genéticamente deficitarios de leptina, el tratamiento con leptina produce un incremento de la formación ósea40, y en modelo de experimentación parece demostrar un efecto beneficioso, favoreciendo la diferenciación osteoblástica41. Sin embargo, este efecto no se ha demostrado en estudios clínicos. Recientemente, un estudio plantea una nueva vía de actuación de la leptina en el remodelado óseo a través de la serotonina. Fue realizado en ratones modificados genéticamente carentes de serotonina cerebral (al anular el gen de la enzima triptófano hidroxilasa, Tph2 −/−)42. La serotonina ha demostrado tener un potente efecto en la inhibición de la formación ósea y cabría esperar que los niveles de serotonina estuviesen elevados tras la cirugía de la obesidad, lo cual es consistente con la pérdida de masa ósea observada tras la cirugía.
Disminución de estrógenos. La cirugía bariátrica ocasiona una pérdida rápida de tejido adiposo que puede afectar a la conversión, vía aromatasa, de la testosterona en estradiol43,44. Los estrógenos tienen un importante papel en la regulación del metabolismo óseo que ha sido bien documentado, especialmente la inhibición de la resorción ósea, que favorece la apoptosis de los osteoclastos a través del aumento de TGF-β, además de inhibir la producción de IL-6, principal estímulo para la resorción, y participar en la regulación de la principal vía de resorción, la del ligando del RANK45,46.
Finalmente, un campo para la investigación será el de cómo afectan los cambios en la microbiota intestinal en el metabolismo óseo de estos pacientes. Se han descrito modificaciones en la microbiota intestinal tras las diversas técnicas de cirugía bariátrica47. La microbiota podría influir en el metabolismo óseo a través de diversos mecanismos, como la absorción de nutrientes, o mediante interacción con el sistema inmune, capaz de regular la osteoclastogénesis a través de la vía del ligando del RANK48.
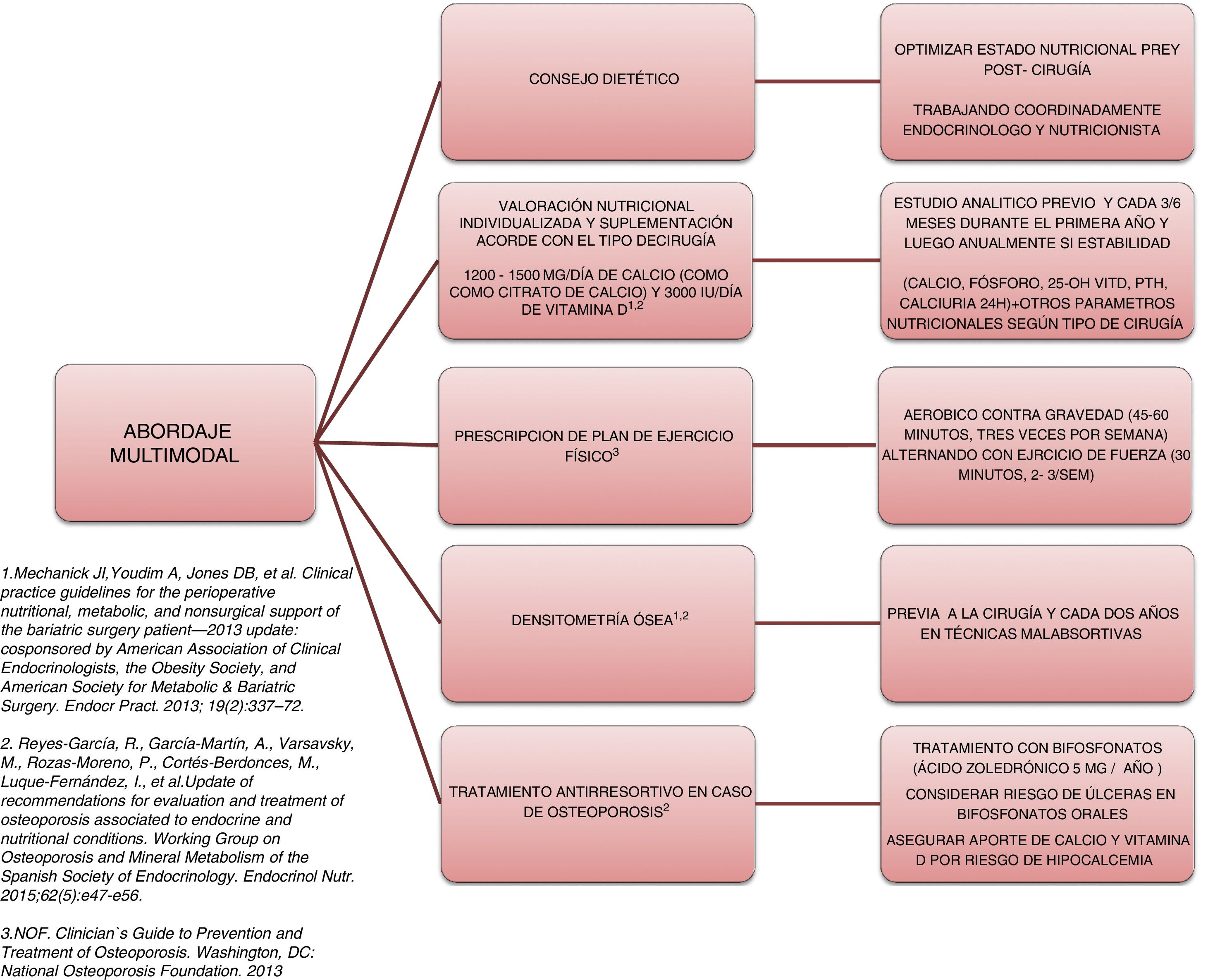
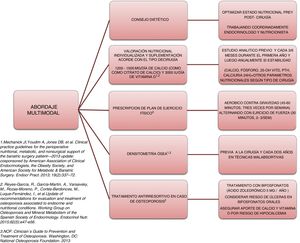
Abordaje y plan terapéuticoLa complejidad y la heterogeneidad de la fisiopatología que subyace en el deterioro óseo en estos pacientes hacen necesario un abordaje multimodal (fig. 2).
El primer paso necesario es asegurar un adecuado estado nutricional. Para ello, es precisa la valoración y el seguimiento por un especialista de Endocrinología y Nutrición que realice el consejo nutricional previo y poscirugía y que prescriba los suplementos necesarios para evitar déficits nutricionales. Las recomendaciones de la mayoría de las sociedades científicas, como la American Society for Metabolic and Bariatric Surgery guidelines49 y el Grupo de trabajo de osteoporosis y metabolismo mineral de la SEEN50, recomiendan la suplementación con 1.200 a 1.500mg/día de calcio (como citrato de calcio) y 3.000IU/día de vitamina D. White et al. muestran en una cohorte de 283 pacientes que fueron suplementados tras la cirugía con 1.200mg de citrato de calcio y 1.000IU de vitamina D3, una tasa de hiperparatiroidismo secundario del 46,6%51. En este sentido, lo recomendable al suplementar es titular los niveles de vitamina D periódicamente hasta alcanzar concentraciones de 30ng/ml50.
Otro aspecto importante a realizar en el abordaje multimodal de estos pacientes es la necesidad de prescribir ejercicio físico para prevenir o tratar la sarcopenia y la pérdida de masa muscular acelerada, y favorecer así el metabolismo óseo. Un estudio de intervención realizado en 220 pacientes intervenidos de bypass o sleeve, y aleatorizados a intervención o grupo control, objetivó una menor pérdida de DMO y un incremento significativamente menor en los marcadores de remodelado óseo52. En dicho estudio, los pacientes del grupo intervención eran suplementados con 28.000IU de colecalciferol a la semana, durante las 8 semanas previas a la cirugía, tras la cual recibían suplementación con 16.000IU/semana, 1.000mg de citrato de calcio y suplemento de proteína diario ajustado según el IMC (rango de 35-60g/día). Todos los pacientes de dicho grupo iniciaron un programa de ejercicio, monitorizado por expertos, a las 2 semanas de la cirugía: marcha nórdica adaptada a la frecuencia cardiaca (mínimo de 45min, 3 veces por semana) y ejercicios de fuerza (mínimo 30min, 2 veces por semana). Estos resultados coinciden con los publicados por Campanha-Versiani et al. en un grupo de 37 obesos sometidos a bypass y con un programa supervisado de ejercicio físico aeróbico contra gravedad y de fuerza53. Teniendo en cuenta la evidencia publicada, la National Osteoporosis Foundation54 recomienda 2 tipos de ejercicios efectivos para mantener la densidad ósea: 1) los ejercicios donde se soporta el peso corporal o weight-bearing exercises, es decir, actividades realizadas contra la gravedad (como caminar, saltar, marcha nórdica, etc.), y 2) los ejercicios de fuerza, donde se realiza una contracción muscular ante una resistencia externa. Por otro lado, la práctica de ejercicio regular mejora la agilidad, la fuerza y el equilibrio, y podrían ayudar a prevenir las caídas. Por todo ello, deberían estar presentes en el plan terapéutico de los paciente sometidos a cirugía bariátrica.
La valoración ósea mediante densitometría (DXA) es una herramienta útil en la valoración de estos pacientes. Son numerosos los estudios prospectivos que demuestran la pérdida de DMO tras la cirugía bariátrica55. Se ha especulado si esta disminución de la densidad podría ser un mecanismo adaptativo normal, pero lo cierto es que existe un incremento significativo de fracturas en esta población. Por ello, el Grupo de trabajo de osteoporosis y metabolismo mineral de la SEEN recomienda la realización de DXA para monitorizar la DMO basal precirugía y posteriormente cada 2 años en pacientes sometidos a técnicas malabsortivas (bypass gástrico en Y de Roux, derivación biliopancreática). Asimismo, recomiendan la realización basal y posteriormente cada 6 a 12 meses de parathormona, calcio, fósforo, 25-OH-vitamina D y calciuria de 24h50. La principal limitación de la DXA es que ofrece únicamente una información cuantitativa del hueso y no cualitativa y que hace necesaria la utilización de otros métodos de valoración ósea. Son escasos los estudios que analizan la utilidad de nuevas técnicas de valoración ósea, como el Trabecular Bone Score. Los resultados en este sentido no parecen consistentes. Un estudio prospectivo realizado en 38 pacientes sometidos a bypass no mostró ninguna reducción significativa en el Trabecular Bone Score tras 3 años de seguimiento56. Por el contrario, Muschitz et al.52, en el estudio anteriormente citado, sí que encontraron reducciones tras la cirugía, tanto en el grupo control como en el grupo sometido a intervención con suplementación de calcio, vitamina D, proteínas y ejercicio, aunque la afectación fue significativamente mayor en el grupo control (−10,5 vs. −3,4%; p=0,03). La principal limitación de esta técnica, al igual que ocurre con la DMX, es que el exceso de grasa a nivel lumbar atenúa y limita la exploración. Es por ello que no se recomienda realizar esta técnica en pacientes con un IMC>37kg/m2.
Los marcadores de remodelado óseo son una herramienta sencilla para la valoración del metabolismo óseo. Hay múltiples estudios que documentan incrementos significativos de marcadores tras la cirugía, que se mantienen a largo plazo tras la misma. En un estudio prospectivo de pacientes sometidos a bypass gástrico, se objetivó un incremento significativo (al año y a los 2 años) tanto del marcador de formación ósea P1NP como del marcador de resorción ósea CTX57. Resultados similares publicaron Biagioni et al. también tras bypass gástrico, con incrementos significativos a los 3 meses de la intervención de los marcadores CTX (0,2 [0,1; 2,2] vs. 0,6 [0,4; 6,0] ng/mL), RANKL (0,1 [0,0; 0,5] vs. 0,3 [0,0; 2,0] pmol/L) y esclerostina (21,7 [3,2; 75,1] vs. 34,8 [6,4; 80,5] pmol/L) (p<0,005)58. El marcador de resorción CTX ha demostrado una alta correlación con el proceso de resorción; su determinación en suero hace que sean más reproducibles y disminuye la variabilidad de la determinación en orina (que debe ser corregida por la excreción de creatinina), y las últimas técnicas desarrolladas para su determinación en suero han demostrado disminuir notablemente las variaciones intra e interensayo, por lo que el consenso publicado por la IOF y la IFCC59 recomiendan su determinación como marcador de resorción ósea de referencia en el diseño de estudios observacionales y de intervención. No obstante, la utilidad de esta herramienta para el seguimiento de estos pacientes está todavía por demostrar.
Finalmente, ante el diagnóstico de osteoporosis, es preciso iniciar tratamiento con un agente antirresortivo. Los bifosfonatos deben ser considerados en dicho tratamiento, aunque teniendo presente el riesgo que muestran las formulaciones orales de producir ulceración de la boca anastomótica y de problemas en su absorción. Así pues, el Grupo de trabajo de osteoporosis y metabolismo mineral de la SEEN50 recomienda el ácido zoledrónico 5mg una vez al año o ibandronato 3mg cada 3 meses como tratamiento de elección. Si existe un alto riesgo de fractura se podría considerar denosumab o un agente anabólico como teriparatida. En cualquier caso, es de suma importancia, a la hora de iniciar el tratamiento para la osteoporosis, el asegurar un adecuado aporte de calcio y vitamina D, ya que el inicio de la terapia antirresortiva puede ocasionar una hipocalcemia grave.
ConclusionesEn conclusión, la fisiopatología que subyace en el deterioro del tejido óseo de los pacientes sometidos a cirugía bariátrica es compleja. Precisa de un abordaje multimodal en el periodo previo y poscirugía. El papel del especialista en Endocrinología y Nutrición es clave y fundamental para el adecuado manejo de estos pacientes. Las herramientas de imagen para la valoración ósea (como DXA y Trabecular Bone Score) están limitadas por el exceso de adiposidad a nivel lumbar. Otras herramientas como los marcadores de remodelado óseo carecen de evidencia suficiente para demostrar su utilidad clínica, lo que hace más difícil el manejo de estos pacientes. Son necesarios más estudios que permitan optimizar el seguimiento y prevenir la aparición de fracturas por fragilidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.