La evolución en los tratamientos oncológicos ha supuesto un aumento de la supervivencia del cáncer infantil cercana al 80% a 5 años, por lo que 1/500 adultos jóvenes será un superviviente. Las secuelas endocrinas son las más comunes y afectan al 40-60%, siendo las más frecuentes las alteraciones del crecimiento y la disfunción gonadal y tiroidea. Los pacientes con tumores del sistema nervioso central, leucemias y linfomas son los que presentan más secuelas, y estas dependen del tipo de cáncer, su localización, la edad de diagnóstico y el protocolo de tratamiento; las terapias de mayor riesgo son la radioterapia craneal y el trasplante de progenitores hematopoyéticos. Dado este elevado riesgo, las guías internacionales recomiendan a los endocrinólogos evaluar prospectivamente a los supervivientes. Algunas de las alteraciones endocrinas no se manifestarán hasta la vida adulta, por lo que debemos crear programas de transición, así como ser activos en la investigación para reducir las secuelas endocrinas de los tratamientos del cáncer.
Thanks to the advances in cancer treatment, the five-year survival rate after childhood cancer has increased up to 80%. Therefore 1/500 young adults will be a survivor. Endocrine sequelae are most common, affecting 40-60% of survivors. The most frequent sequelae include growth failure and gonadal and thyroid diseases. Sequelae occur more frequently in survivors from central nervous system tumors, leukemia, and lymphoma. Their development will depend on the type of cancer, its location, age at diagnosis, and treatment administered. Treatments associated to more endocrine sequels are cranial radiotherapy and hematopoietic cell transplantation. Because of the high prevalence of endocrine sequelae, international guidelines recommend endocrinologists to prospectively evaluate the survivors. As some of these endocrine changes will not develop until adult life, transition programs should be implemented, and active investigation should be made to decrease the endocrine consequences of cancer treatment.
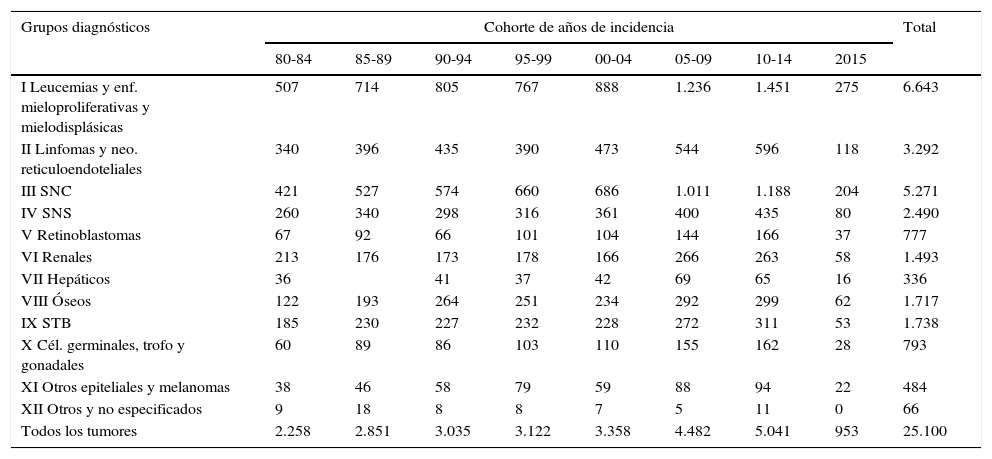
La evolución de los tratamientos oncológicos ha determinado una mejoría de la supervivencia a 5 años hasta del 80% para todos los cánceres, llegando al 90% en el caso de las leucemias y linfomas. Aproximadamente uno de cada 285 niños será diagnosticado de cáncer y 1/530 adultos jóvenes será superviviente de cáncer1. En España disponemos del Registro Español de Tumores Pediátricos2: entre 1980 y 2015 se registraron 25.100 casos entre 0-14 años, lo que puede darnos idea del volumen de adultos jóvenes de nuestro país que son supervivientes de cáncer infantil. Se describe que un 62% de adultos supervivientes tendrán alguna secuela médica y 40-60% tendrán patología endocrina, lo que supone un riesgo muy superior respecto a la población3,4.
En esta revisión intentamos dar una visión global sobre el seguimiento de los supervivientes de cáncer infantil centrándonos en los conocimientos actuales sobre las secuelas endocrinas, con el objetivo de optimizar su seguimiento y mejorar su supervivencia a largo plazo.
Nuevas perspectivas del tratamiento del cáncer en niños y adolescentesLos cánceres más frecuentes en la edad pediátrica son las leucemias, linfomas y tumores del sistema nervioso central (tabla 1). Las secuelas en los supervivientes dependerán del tipo de cáncer, su localización, la edad de diagnóstico y el protocolo de tratamiento (dosis y fraccionamiento de radioterapia; tipo y dosis acumuladas de quimioterápicos). Entre los cambios del tratamiento de la leucemia se encuentran la identificación de factores de riesgo, la intensificación del tratamiento y mejoría del soporte, la reducción del uso de la radioterapia profiláctica y la introducción del trasplante de progenitores hematopoyéticos (TPH) en recaídas, que ha permitido mejorar la supervivencia. En algunas enfermedades, tales como el linfoma de Hodgkin o tumor de Wilms, con altas tasas de superviviencia, el objetivo actual es reducir sus secuelas. Otras enfermedades, tales como astrocitomas malignos o sarcomas metastásicos, presentan hoy todavía un mal pronóstico y el objetivo es desarrollar nuevas terapias que mejoren su supervivencia5,6.
Registro Español de Tumores Infantiles (RETI-SEHOP). Casos registrados por grupo diagnóstico, cohortes de año de incidencia y verificación microscópica (VM)
| Grupos diagnósticos | Cohorte de años de incidencia | Total | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 80-84 | 85-89 | 90-94 | 95-99 | 00-04 | 05-09 | 10-14 | 2015 | ||
| I Leucemias y enf. mieloproliferativas y mielodisplásicas | 507 | 714 | 805 | 767 | 888 | 1.236 | 1.451 | 275 | 6.643 |
| II Linfomas y neo. reticuloendoteliales | 340 | 396 | 435 | 390 | 473 | 544 | 596 | 118 | 3.292 |
| III SNC | 421 | 527 | 574 | 660 | 686 | 1.011 | 1.188 | 204 | 5.271 |
| IV SNS | 260 | 340 | 298 | 316 | 361 | 400 | 435 | 80 | 2.490 |
| V Retinoblastomas | 67 | 92 | 66 | 101 | 104 | 144 | 166 | 37 | 777 |
| VI Renales | 213 | 176 | 173 | 178 | 166 | 266 | 263 | 58 | 1.493 |
| VII Hepáticos | 36 | 41 | 37 | 42 | 69 | 65 | 16 | 336 | |
| VIII Óseos | 122 | 193 | 264 | 251 | 234 | 292 | 299 | 62 | 1.717 |
| IX STB | 185 | 230 | 227 | 232 | 228 | 272 | 311 | 53 | 1.738 |
| X Cél. germinales, trofo y gonadales | 60 | 89 | 86 | 103 | 110 | 155 | 162 | 28 | 793 |
| XI Otros epiteliales y melanomas | 38 | 46 | 58 | 79 | 59 | 88 | 94 | 22 | 484 |
| XII Otros y no especificados | 9 | 18 | 8 | 8 | 7 | 5 | 11 | 0 | 66 |
| Todos los tumores | 2.258 | 2.851 | 3.035 | 3.122 | 3.358 | 4.482 | 5.041 | 953 | 25.100 |
0-14 años, 1980-2015. Excluidos no clasificables en la ICCC-3.
Casos excluidos por no clasificables en la ICCC-3: 2.040.
Total de casos registrados incluyendo no clasificables en la ICCC-3: 27.140.
Fuente: reproducción con permiso de Peris et al.2.
La revisión del Childhood Oncology Group (COG) reflejó las carencias existentes en el control de los supervivientes; el 68% de los pacientes tratados entre 1970-1986 no habían sido controlados regularmente, y el 39% no tenían ningún contacto con el centro que los trató3. Las diferentes cohortes estudiadas han seguido metodologías diferentes, pero reportan un riesgo de problemas médicos comparable7. Para estimar adecuadamente el exceso de riesgo, algunas cohortes como Childhood Cancer Survivor Study o Adult Life after Childhood Cancer in Scandinavia comparan la incidencia con una cohorte de hermanos de los supervivientes o población sana comparable4,8. Fruto de estos estudios COG publica en 2003 una guía clínica (COG-LTFU Guidelines), con recomendaciones específicas sobre el seguimiento de los supervivientes, con un apartado específico sobre secuelas endocrinológicas9.
Las secuelas endocrinas se encuentran entre las más frecuentes dentro de las alteraciones descritas, junto a la patología cardiovascular. Los supervivientes de tumores del sistema nervioso central (SNC), leucemias y linfoma de Hodking son los que presentan más secuelas. La cohorte Adult Life after Childhood Cancer in Scandinavia presenta un riesgo relativo de patología endocrina de 4,8 (95% CI 4,6-5,0), siendo más elevado en los menores de 20 años. En la cohorte Childhood Cancer Survivor Study se describe un riesgo relativo de hipotiroidismo (RR 14,3; [95% CI] 9,7–21,0), de déficit de hormona de crecimiento (GH) (RR=277,8; [95% CI] 111,1–694,9), de necesidad de inducir pubertad (RR=86,1; [95% CI] 31,1–238,2), y de osteoporosis (RR=24,7; [95% CI] 9,9–61,4). La patología endocrina tiene además implicaciones en la morbilidad cardiometabólica a largo plazo en el adulto, que afecta al 18% de los supervivientes3,4. Hay todavía pocos trabajos que describan la prevalencia de patología endocrina aplicando prospectivamente las guías COG-LTFU. Una de las series más extensas describe 519 pacientes con tumores que no afectaban al SNC, evaluados a una media de 7,2 años posdiagnóstico, a una edad media de 12,1 años; las secuelas endocrinas estaban presentes en el 57,6%10. En nuestro centro, tras la implementación de la unidad de seguimiento del superviviente de cáncer, revisamos las secuelas endocrinas de 194 pacientes (incluidos los tumores de SNC), con edad media 10 años, a los 5,2 años postratamiento. El 63% de ellos tenía alguna patología endocrina; además, en su primera visita casi un 30% de supervivientes tenía patología endocrino-metabólica no diagnosticada y/o tratada previamente11.
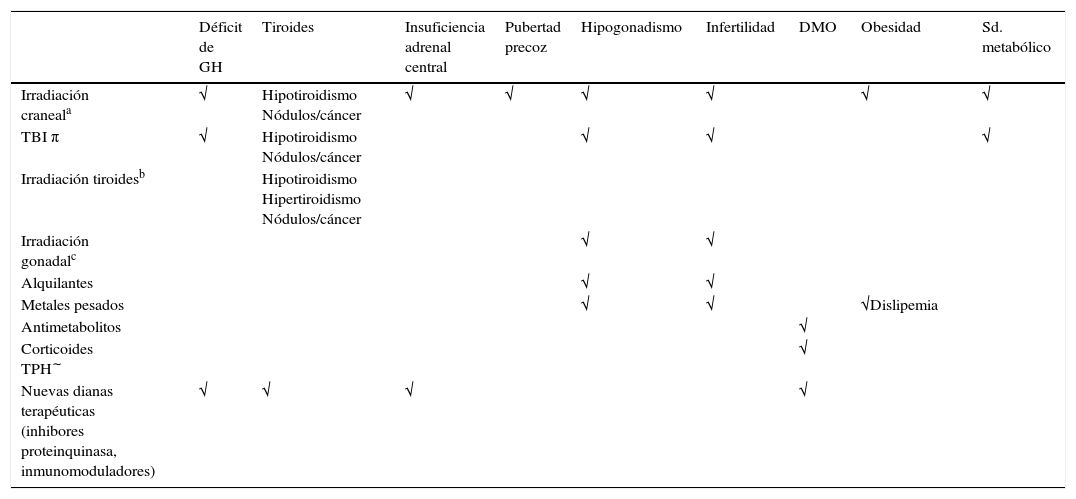
Secuelas endocrinológicas en supervivientes de cáncer infantilA continuación se describen las secuelas endocrinas; para facilitar su descripción se analizarán según el riesgo reportado para los diferentes tratamientos recibidos (tabla 2)12.
Secuelas endocrinológicas en supervivientes de cáncer infantil: riesgo según los tratamientos recibidos
| Déficit de GH | Tiroides | Insuficiencia adrenal central | Pubertad precoz | Hipogonadismo | Infertilidad | DMO | Obesidad | Sd. metabólico | |
|---|---|---|---|---|---|---|---|---|---|
| Irradiación craneala | √ | Hipotiroidismo Nódulos/cáncer | √ | √ | √ | √ | √ | √ | |
| TBI π | √ | Hipotiroidismo Nódulos/cáncer | √ | √ | √ | ||||
| Irradiación tiroidesb | Hipotiroidismo Hipertiroidismo Nódulos/cáncer | ||||||||
| Irradiación gonadalc | √ | √ | |||||||
| Alquilantes | √ | √ | |||||||
| Metales pesados | √ | √ | √Dislipemia | ||||||
| Antimetabolitos | √ | ||||||||
| Corticoides TPH∼ | √ | ||||||||
| Nuevas dianas terapéuticas (inhibores proteinquinasa, inmunomoduladores) | √ | √ | √ | √ |
DMO: densidad mineral ósea; TBI: total body irradiation (irradiación corporal total).
Adaptado de: Nandagopal et al.12.
La radioterapia craneal (RTC) produce un aumento significativo del riesgo de secuelas por afectación hipotálamo-hipofisaria. El impacto dependerá de la dosis, del fraccionamiento y del campo de irradiación. El grado de afectación se ha correlacionado con el denominado biological effective dose, fórmula que permite comparar esquemas terapéuticos y predecir el efecto en la función hipofisaria13.
Según describen algunos trabajos la edad es otro factor importante; a menor edad mayor afectación hipofisaria. Además el riesgo de disfunción hipofisaria aumenta con el tiempo, por lo que el seguimiento debe prolongarse durante años. Se ha sugerido que la utilización de otras técnicas como la RT con protones podría reducir el riesgo de secuelas, pero se precisa de más estudios para concluir si disminuye las secuelas endocrinológicas a largo plazo14.
Eje somatotropo (GH)La afectación hipofisaria más frecuente y la que se presenta más precozmente es la de la GH, que se ha objetivado tras dosis de 18Gy y se ha observado ya en los 12 meses posteriores al tratamiento, también en relación con un daño hipotalámico15,16. En pacientes con antecedente de tumor del SNC y RTC se considera que un test patológico es suficiente para el diagnóstico17. Se ha analizado si existe un aumento de riesgo de recurrencia en los pacientes tratados con hormona de crecimiento recombinante (rhGH), pero los estudios no parecen confirmarlo. Los supervivientes tienen un mayor riesgo de segundas neoplasias de forma independiente a tratarse o no con rhGH; aunque algunos trabajos habían señalado un aumento de riesgo de segundas neoplasias (principalmente meningiomas y gliomas), análisis posteriores parecen correlacionar ese riesgo con el antecedente de haber recibido RTC18,19. A pesar de que no hay estudios al respecto, los documentos de consenso recomiendan esperar un año después de que el tratamiento del cáncer esté completado para asegurar que no hay una recurrencia temprana20.
El seguimiento protocolizado de supervivientes ha permitido optimizar el tratamiento con rhGH, observándose una mejoría en su talla final probablemente debido a un inicio más precoz del tratamiento, nuevos esquemas terapéuticos y el uso de análogos de GnRH en los casos de pubertad precoz21. La literatura recoge que solo en el 60% de los adultos tratados con rhGH tras un cáncer infantil el déficit de GH se reevalúa en la transición a adultos22. Como señalan algunos autores, a pesar de los beneficios demostrados del tratamiento con rhGH en adultos, en el caso de los supervivientes la evidencia de estos beneficios puede verse limitada por el efecto negativo de los tratamientos recibidos. En este sentido, será preciso ampliar los estudios prospectivos con evaluación endocrino-metabólica y de calidad de vida en la edad adulta23,24.
Eje corticotropoEl déficit de ACTH es más infrecuente y tardío. Se requieren seguimientos de más de 10 años para detectar déficits en un grupo significativo de pacientes en las cohortes estudiadas. Dadas las características de los pacientes oncológicos, la utilización del test de hipoglucemia insulínica está restringido, lo que dificulta la evaluación completa del eje hipotálamo-hipofisario-adrenal; sin embargo hay autores que describen una aceptable correlación entre el test de hipoglucemia insulínica y el estímulo con glucagón, por lo que este último podría emplearse como alternativa25. A largo plazo se ha descrito una afectación del eje corticotropo en un 19% de los pacientes26.
Eje tirotropoEl eje hipotálamo-hipofisario-tiroideo parece ser el menos afectado. Sin embargo, hay autores que apuntan a que la incidencia reportada del 6% de hipotiroidismo central en algunos trabajos se debe a una subestimación en los casos con T4 libre normal. Por ello preconizan añadir a dicha valoración el estudio de la elevación fisiológica nocturna de la TSH y el test de TRH, estableciendo con ello una prevalencia de dicha alteración del 36%27.
Eje gonadotropoLa RTC a dosis superiores a 18Gy predispone a desarrollar pubertad precoz o adelantada; el sexo femenino o la irradiación a una edad menor aumentan el riesgo. Dosis de 40Gy pueden producir pubertad retrasada o hipogonadismo central en el 11-15% de pacientes28.
HiperprolactinemiaLas dosis altas (> 40Gy) se relacionan también con hiperprolactinemia, por lo que se recomienda realizar medición de prolactina en caso de presentar clínica sugestiva.
QuimioterapiaAfectación gonadalLa disfunción gonadal es el principal efecto secundario de la quimioterapia. Fundamentalmente los agentes alquilantes (principalmente la ciclofosfamida a dosis ≥ 7,5g/m2, ifosfamida ≥ 60mg/m2, el protocolo mecloretamina, vincristina, procarbazina y prednisona (MOPP) ≥ 3 ciclos o busulfán ≥ 600mg/m2) tienen un alto poder gonadotóxico29. Este riesgo se multiplica si se añade RT a nivel gonadal, pélvico o total body irradiation (TBI). Parece no haber diferencias en el caso de pacientes tratados en etapas prepuberal o puberal30. El tejido testicular es especialmente sensible al efecto de los agentes alquilantes; en concreto las células de Sertoli y la espermatogénesis pueden verse afectadas más frecuentemente que las células de Leydig, que suelen mantener su función. Se ha descrito que un 70% de los tratados por linfoma de Hodgkin con protocolo MOPP, sin radioterapia, presentaban azoospermia u oligospermia, por lo que se ha sustituido este protocolo por nuevas asociaciones con menor toxicidad31. Por ello dentro de los programas de seguimiento debe incluirse la valoración de la espermatogénesis. Nuevos marcadores bioquímicos, como la inhibina B, parecen tener una correlación superior con la espermatogénesis que la FSH32. Sin embargo, hay autores que apuntan que ambas tienen una especificidad baja, por lo que recomiendan realizar medición testicular y seminograma en los supervivientes33.
El tejido ovárico parece ser menos sensible que el testicular, aunque este riesgo se incrementa si se añade RT y/o TPH. La afectación del ovario puede repercutir en la pubertad, aumentar el riesgo de fallo ovárico prematuro (FOP) o de infertilidad a largo plazo. La incidencia acumulada de FOP en supervivientes a los 40 años es del 8%34. No hay estudios que comparen los diferentes esquemas terapéuticos respecto al riesgo individual de cada fármaco. Se creía que los ovarios de las pacientes menores de 10 años eran más resistentes al efecto de la quimioterapia; sin embargo hay autores que han descrito que el riesgo no difiere entre las pacientes tratadas en pre- o pospubertad35,36. Las supervivientes, aun con ciclos regulares, están en riesgo de tener menor reserva ovárica y por tanto una vida fértil más corta. Además de las gonadotrofinas, se plantea la prometedora utilidad de nuevos marcadores como la hormona antimülleriana. Pacientes tratadas con el protocolo MOPP tienen una reducción de la hormona antimülleriana con respecto a otros supervivientes de cáncer37; sin embargo su correlación con la fertilidad/fecundidad futura no está bien establecida y requiere más estudios. La utilidad del recuento de folículos antrales por ecografía transvaginal, no ha sido establecida definitivamente en las supervivientes de cáncer infantil y requerirá de trabajos prospectivos38.
CrecimientoDiversos trabajos en los pacientes con leucemia constatan una disminución del crecimiento durante el tratamiento quimioterápico y una falta de crecimiento recuperador hasta finalizar el tratamiento intensivo. En series de pacientes con leucemia tratados sin RT se observa una afectación discreta de la talla final (disminución de –0,59 SD), que no se correlaciona con una alteración en los test de GH realizados, ya que se ha descrito un déficit de GH solo en el 0,9-1,2% de casos; por este motivo no recomienda su cribado sistemático39.
Radioterapia cervicalLa utilización de RT cervical, principalmente en los casos de linfomas, supone un mayor riesgo de afectación tiroidea. Se ha descrito hipotiroidismo a dosis superiores a 10Gy, y más raramente hipertiroidismo; se ha descrito hipotiroidismo hasta en el 75% de los pacientes con linfomas. Existe además un mayor riesgo de nódulos tiroideos y/o cáncer de tiroides a dosis de 20 a 29Gy; este riesgo disminuye con dosis superiores a 30Gy, consistente con el efecto de destrucción celular. El riesgo es mayor para los niños menores de 5 años. Se han descrito latencias de 94 meses para el desarrollo de hipotiroidismo y de hasta 10-20 años para la aparición de nódulos, lo que indica que el seguimiento debe prolongarse a largo plazo40,41. Actualmente está recomendado el seguimiento de estos pacientes por riesgo de cáncer de tiroides, pero no hay consenso sobre el método de cribado a utilizar. En una revisión reciente de la literatura, se describe que la detección de cáncer papilar de tiroides en estadios iniciales en niños se asocia a menor recurrencia y mortalidad; sin embargo, a diferencia de lo observado en adultos, no hay evidencia de una menor morbilidad a largo plazo12,42,43–45.
Radioterapia abdominalEl tejido testicular es altamente sensible a la RT; en adultos se ha descrito afectación a dosis entre 0,2-0,7Gy, con aumento de la FSH y alteración en el seminograma24. Se describe azoospermia con dosis de 6 -10Gy, e insuficiencia de células de Leydig con dosis ≥ 20Gy46. En las series de supervivientes tratados con quimioterapia y RT a dosis 30-45Gy en la infancia, aun siendo poco numerosas, se recoge que el 83% sufre azoospermia. Sin embargo un 17% pueden recuperar la espermatogénesis 12-15 años postratamiento, por lo que los autores recomiendan controles seriados25. En el caso del ovario se refiere que cerca del 40% de las pacientes con linfoma de Hodgkin que recibe RT sufren FOP. En estos casos la recuperación de la función gonadal es excepcional. Además se ha descrito en pacientes irradiadas un mayor riesgo de abortos, de recién nacidos con bajo peso y de hemorragias posparto47.
Trasplante de progenitores hematopoyéticosLas secuelas endocrinológicas son las más frecuentes tras un TPH; son multifactoriales, debidas a la terapia de rescate que se suma a los efectos acumulativos de la quimioterapia, a la terapia esteroidea a altas dosis y a la utilización de TBI. El riesgo de patología endocrina en estos pacientes es entre dos y tres veces superior4. De forma muy frecuente presentan hipogonadismo (83%), hipotiroidismo (56%) y déficit de GH (50%). Esta frecuencia es incluso superior a la de los pacientes tratados con RTC profiláctica, probablemente debido a un menor fraccionamiento de la dosis. Es además un factor de riesgo para el crecimiento, tanto en los pacientes que se acondicionaron con RT como en los que no. Por otra parte, predispone no solo al sobrepeso, sino también a un aumento de adiposidad central y de riesgo metabólico48.
Nuevas dianas terapéuticasTambién en el ámbito del cáncer pediátrico se han introducido en los últimos años tratamientos novedosos; sin embargo su repercusión sobre las secuelas endocrinas precisa más estudios49,50. Los inhibidores de proteincinasas, el interferón alfa y los anticuerpos monoclonales se han relacionado con alteraciones tiroideas (tiroiditis e hipotiroidismo)51. Se han descrito alteraciones del eje corticotropo, en ocasiones subclínicas, en el tratamiento con inhibidores de proteincinasas, por lo que se recomienda su control sistemático52. El ipilimumab se ha reportado como causante de hipofisitis, provocando panhipopituitarismo53. Se ha demostrado desaceleración del crecimiento en pacientes tratados con imatinib, más severo en niños más pequeños54. Así mismo, se ha descrito en adultos alteraciones del metabolismo fosfocálcico relacionadas con los inhibidores de proteincinasas55.
Terapias combinadas - secuelas multifactorialesMetabolismo fosfocálcicoSe ha constatado una disminución de la densidad mineral ósea (DMO) en supervivientes de cáncer infantil, cuya causa es multifactorial. Se ha señalado un mayor riesgo asociado al tratamiento con TPH, metotrexate o corticoides de larga duración, y en pacientes de mayor edad. Dado que está en debate cuál es el mejor método para medir la DMO en la edad pediátrica, el método de cribado de elección es controvertido. Según recomendaciones de COG-LTFU se aconseja realizar una densitometría o TAC cuantitativa en los supervivientes de alto riesgo al entrar en el programa de seguimiento, y repetir si clínicamente está indicado. Tampoco está definido el Z-Score asociado a un aumento de riesgo de fracturas en la edad pediátrica, por lo que no hay un consenso en los valores para recomendación de tratamiento en estos casos4. Hay autores que, en términos de eficacia para disminuir las fracturas a largo plazo, recomiendan incentivar la actividad física y optimizar la ingesta de calcio y niveles de vitamina D en los supervivientes56,57.
ObesidadAlgunos autores no incluyen la obesidad como secuela, dada su multifactorialidad y difícil relación causa-efecto con los tratamientos. Su prevalencia es variable; hay autores que recogen frecuencias de sobrepeso/obesidad de entre 25/18%, inferiores incluso a las referidas en la población juvenil del área geográfica. Presentan más riesgo los pacientes con RTC>20Gy, mujeres o irradiados<4 años. Sí se observa, sin embargo, un aumento del riesgo metabólico: 26% de pacientes con resistencia a la insulina y 23% con dislipemia, en relación con un aumento de la adiposidad abdominal, o con ciertas terapias como TPH y/o TBI58,59.
ConclusiónEn la última década hemos iniciado el camino para mejorar la salud de los supervivientes de cáncer infantil. En ese sentido, la creación de los registros internacionales de supervivientes ha supuesto un punto de inflexión. Sin embargo, hay mucho camino por recorrer; debemos ampliar la implementación de unidades multidisciplinares de atención al superviviente de cáncer infantil, ser proactivos en su seguimiento y en el registro de secuelas, y asegurar una continuidad entre las unidades pediátricas y de adultos, dado que muchas de las secuelas de los supervivientes no serán patentes hasta la vida adulta. Las sociedades científicas tienen una función primordial, promoviendo el seguimiento de los supervivientes, favoreciendo el establecimiento de vínculos entre las unidades pediátricas y de adultos, y facilitando estrategias generales, que incentiven un estilo de vida saludable, porque nuestra meta ya no es solo curar al paciente.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses.
Mi agradecimiento al equipo de Hemato-Oncología del Hospital Sant Joan de Déu por su apoyo, y en especial a la Dra. Ofelia Cruz, Dr. Albert Catalá y Dra. Ibañez por sus valiosas aportaciones en esta revisión.