INTRODUCCIÓN
La acromegalia es una enfermedad caracterizada por la hipersecreción persistente de hormona del crecimiento (GH) en pacientes adultos1. Las células somatotropas productoras de GH comportan el 50% de las células de la hipófisis anterior y están localizadas sobre todo en las zonas laterales de la glándula2. El número de células somatotropas no se modifica con la edad y no se altera en enfermedades sistémicas. No hay tampoco diferencias en cuanto al sexo en su número o estructura3. Estas células toman bien tintes acidófilos y la inmunoperoxidasa revela depósitos granulares de GH en el citoplasma. Bajo el microscopio electrónico son esféricas u ovales y poseen un gran retículo endoplásmico rugoso (RER) y complejos de Golgi.
La acromegalia se debe en más del 95% de las ocasiones a un adenoma hipofisario localizado en el lóbulo anterior de la hipófisis1. En la mayor parte de los casos el tumor se sitúa en una de las porciones laterales de la glándula, pues es donde se encuentra la mayor parte de las células productoras de GH4. En algunos casos, el adenoma se extiende fuera de la silla turca e invade tejidos vecinos, como el esfenoides, el nervio óptico y el cerebro. Ocasionalmente, el tumor es ectópico y se encuentra en el seno esfenoidal o en la región parafaríngea5,6. En 2 estudios7,8 con 194 pacientes acromegálicos se demostró que las concentraciones de GH se correlacionan con el tamaño del tumor hipofisario y con la extensión supraselar de éste. El tamaño tumoral se relacionaba de forma inversa con la edad, de forma que en los pacientes más jóvenes los adenomas productores de GH eran de mayor tamaño en el momento del diagnóstico y presentaban un crecimiento mucho más rápido que en pacientes mayores.
Durante muchos años se mantuvo la idea de que los tumores productores de GH eran siempre adenomas acidófilos. Los avances en los métodos bioquímicos y de imagen han permitido realizar un diagnóstico más temprano y preciso de los adenomas productores de GH. En función de los hallazgos histológicos, inmunohistoquímicos y de la microscopia electrónica se han identificado 8 lesiones hipofisarias diferentes relacionadas con la acromegalia1,9 (tabla 1).
ADENOMAS SOMATOTROPOS ESCASA Y DENSAMENTE GRANULADOS
Desde el punto de vista ultraestructural hay 2 tipos celulares presentes en la inmensa mayoría de los casos de acromegalia10,11: los adenomas con células escasamente granuladas (ES) y los densamente granulados (DG). Juntos constituyen más del 20% de todos los adenomas hipofisarios asociados con la acromegalia12 y han sido considerados como variantes del mismo tipo de tumor10,13.
Los adenomas EG suelen ser cromófobos y la inmunoperoxidasa revela la presencia de GH, pero no de otras hormonas hipofisarias. En ellos se ha sugerido una mayor agresividad y velocidad de crecimiento14. Son adenomas grandes que presentan pleomorfismo nuclear y celular. La immunorreactividad para la GH se suele limitar al aparato de Golgi. Su ultraestructura es característica y diferente de la de las células somatotropas no tumorales. Presentan núcleos celulares excéntricos, cóncavos o multilobulados, en ocasiones acompañados de una zona clara perinuclear15. El RER está escasamente desarrollado y tiene perfiles cortos y aislados, o bien se desarrolla formando pilas paralelas. El aparato de Golgi presenta un cuerpo fibroso característico de este tipo celular, formado por una acumulación esférica de filamentos intermedios, con inmunorreactividad positiva para ubiquitina y queratina. El cuerpo fibroso puede atrapar los sáculos de Golgi y otras organelas citoplasmáticas, como los centriolos. Los gránulos secretores son pequeños y están dispersos (100-250 nm). Se han descrito adenomas somatotropos EG no secretores16, en los que se ha sugerido una alteración en el procesamiento postranslacional del producto génico17.
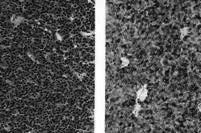
Los adenomas DG son más frecuentes en pacientes de mediana edad, sin que haya diferencias en cuanto al sexo. Presentan un crecimiento lento y clínicamente cursan como una acromegalia de larga evolución. El citoplasma de estas células es intensamente acidófilo (fig. 1). Son los clásicos tumores acidófilos en la hematoxilina-eosina (HE). Presentan un patrón estructural trabecular, sinusoidal o difuso y fuerte inmunorreactividad para GH distribuida de forma uniforme por el citoplasma. No es rara la presencia de inmunopositividad para subunidad-* o un perfil plurihormonal para prolactina o tirotropina15. En la microscopia electrónica se observa la presencia de células DG que se asemejan a las células somatotropas no tumorales. Presentan núcleos esféricos eucromáticos con nucléolo prominente, un RER bien definido y un complejo de Golgi globular formado por sáculos ligeramente dilatados, a menudo en forma de gránulos de secreción electrodensos (400-500 nm). El citoplasma exhibe organelas bien definidas.
Fig. 1. El panel izquierdo muestra la tinción con H&E de un ade-noma hipofisario secretor de GH. Obsérvese la intensa acidofilia y el patrón de células regulares y redondeadas con núcleos promi-nentes. El panel derecho muestra la inmunohistoquímica para GH en el mismo tumor. (Cortesía de Dra. M. García Villanueva. Servi-cio de Anatomía Patológica. Hospital Ramón y Cajal)
En algunas publicaciones, los tumores EG y DG presentan una incidencia similar10,13. Sin embargo, en otros trabajos predominan los DG16. Desde el punto de vista funcional son similares y ambos se acompañan de concentraciones séricas elevadas de GH y factor de crecimiento similar a la insulina tipo I (IGF-I). No se ha encontrado ninguna correlación entre el grado de celularidad granular y los valores séricos de GH o IGF-I18,19. Al comparar los adenomas EG frente a los DG se observa una mejor respuesta al tratamiento con octreótida en los segundos20, con un descenso al 70% de los valores basales de GH, frente al 32% en los EG. También se han descrito adenomas somatotropos no secretores con esta estructura celular17. Los adenomas EG predominan en las mujeres, la edad de inicio es más temprana, son de mayor tamaño y con mayor frecuencia presentan extensión supraselar; asimismo, la tasa de curación poscirugía es menor15. Sin embargo, no hay diferencias entre EG y DG con respecto a las concentraciones de GH e IGF-I ni con respecto a la prevalencia de hipertensión arterial y diabetes mellitus. La respuesta al estímulo con hormona liberadora de tirotropina (TRH) predomina en los adenomas DG que suprimen la secreción de GH en más de un 50% tras la administración de bromocriptina. Esta relación entre el estímulo a la TRH y la respuesta a la bromocriptina ya había sido demostrada en los adenomas productores de GH21,22. Además, se ha demostrado in vitro en adenomas resistentes a los análogos de la somatostatina que la adición de agonistas dopaminérgicos a los análogos potencia el efecto de éstos23. Los adenomas DG también responden con mayor frecuencia a la estimulación con hormona liberadora de la hormona de crecimiento. La respuesta a la radioterapia parece similar en ambos tipos de tumores. Pese a estas diferencias clínicas entre las 2 clases de adenomas, parece que su agresividad depende más del tamaño tumoral y la edad del paciente, ya que ambos subtipos celulares presentan un índice de proliferación similar24.
El patrón de distribución de la citoqueratina intracitoplasmática parece relacionarse con los índices de proliferación tumoral. Mazal et al25 describieron dos patrones de distribución en adenomas somatotropos. Uno de ellos tenía forma de punteado (adenomas tipo I), más frecuente en células EG, y se ha relacionado con el cuerpo fibroso característico de este tipo celular26. En el otro tipo (adenomas tipo 2), la distribución es de forma fibrilar perinuclear y más frecuente en células DG15. Los adenomas tipo 2 presentaron con mayor frecuencia inmunorreactividad para otras hormonas, como prolactina, hormona luteinizante (LH), hormona foliculostimulante (FSH); subunidad-* y tirotropina (TSH). Sin embargo, los adenomas de tipo I tenían un índice de crecimiento mayor, fueron más frecuentes en mujeres y en personas más jóvenes, y en el momento del diagnóstico presentaban un mayor tamaño y más agresividad, con una alta incidencia de extensión supraselar y al seno cavernoso.
El análisis de secreción in vitro de la GH con placa hemolítica reversa revela que los adenomas DG y los mamosomatotropomas presentan una secreción mayor de GH durante el mismo tiempo de incubación, frente a los EG y los tumores mixtos de este tipo celular y células lactotropas27. Además, se demostró que los adenomas más activos presentaban una respuesta más rápida a la adición de octreótida a la placa. Sin embargo, en estudios previos in vivo no encontraron diferencias en las concentraciones plamáticas de GH entre los tumores EG y DG15,19, aunque sí parece un hallazgo universal la presencia de una menor inmunorreactividad para GH en los EG.
Otro de los factores analizados en cuanto a la correlación anatomoclínica de estos tumores es la presencia de células folículo-estrelladas. Los adenomas con células folículo-estrelladas, positivas para la proteína S-100, presentan unas concentraciones preoperatorias de GH mayores que los adenomas sin estas células28. Sin embargo, no se ha observado ninguna asociación entre el tamaño tumoral y la presencia de este tipo celular.
La única alteración genética que se ha relacionado de forma inequívoca con el desarrollo de adenomas hipofisarios productores de GH es la mutación puntual del GNAS1, que activa de forma constitucional la adenilato ciclasa al inhibir la actividad GTP-asa de la Gs-*. Esta mutación se ha encontrado hasta en un 40% de los adenomas somatotropos29. No se han observado diferencias clínicas en el crecimiento tumoral y en tasas de recidiva entre los adenomas con o sin la mutación30,31. Sin embargo, los pacientes positivos para la mutación presentan un cuadro clínico muy florido en adenomas pequeños, lo que sugiere una mayor actividad secretora. Este dato concuerda con el aspecto ultraestructural de estos adenomas, que se corresponden con tumores DG con un aparato secretor bien desarrollado30. Además, estos tumores son muy sensibles a la acción de la somatostatina. En estudios in vitro se ha demostrado que los adenomas resistentes a la somatostatina son negativos para esta mutación31, mientras que los positivos reducen con rapidez las concentraciones de GH tras la somatostatina32.
ADENOMAS SECRETORES DE GH Y PROLACTINA
La hiperprolactinemia aparece en el 20-40% de los tumores secretores de GH. La elevación de la prolactina puede ser consecuencia de diferentes mecanismos33: poblaciones de células mixtas, cosecreción de ambas hormonas por la misma célula o bien por alteraciones en la conexión hipotálamo-hipofisaria. Estudios inmunohistoquímicos realizados en series amplias de adenomas somatotropos han revelado que el 30% se asocia sólo con positividad para GH y otro 20% son tumores mixtos positivos para GH y prolactina34. El porcentaje de tumores con células que cosecretan GH y prolactina es muy variable y puede alcanzar aproximadamente el 50% de los casos35-38. Algunos autores han estudiado en pacientes acromegálicos la correlación entre las concentraciones de prolactina prequirúrgicas y posquirúrgicas con las características y la evolución del adenoma. Sugieren que las concentraciones elevadas de prolactina en el momento del diagnóstico y su persistencia tras la cirugía, se asocian con un curso clínico menos favorable39. Se ha propuesto que la identificación de los pacientes acromegálicos con hiperprolactinemia podría tener importancia no sólo para el pronóstico, sino que además permitiría seleccionar a los pacientes que se podrían beneficiar de un tratamiento con agonistas dopaminérgicos. En los últimos años se han probado nuevos tratamientos para los tumores mixtos que consisten en la asociación de análogos de la somatostatina y agonistas dopaminérgicos, así como moléculas quiméricas que se unen a la vez a los receptores de la somatostatina y dopaminérgicos40.
ADENOMAS MIXTOS PRODUCTORES DE GH Y PROLACTINA
Los adenomas mixtos productores de GH y prolactina37,41,42 están compuestos por 2 tipos celulares diferentes: células somatotropas que producen GH y células lactotropas que producen prolactina. Por tanto, son tumores dimorfos y bihormonales37,38,41-43. Son histológicamente benignos y pueden ser acidófilos, cromófobos o combinar una mezcla de células acidófilas y cromófobas. En ocasiones se acompañan de microcalcificaciones, que muestran la presencia de células productoras de prolactina. La técnica de la inmunoperoxidasa revela la presencia de GH en algunas células del adenoma y prolactina en otras (fig. 2). Por microscopia electrónica, ambos tipos celulares pueden ser DG o EG. En algunos tumores, sobre todo en niños y adolescentes, pueden aparecer células bihormonales38.
Fig. 2. Inmunohistoquímica positiva para prolactina en un adeno-ma mixto secretor de GH y prolactina. (Cortesía de Dra. M. Gar-cía Villanueva. Servicio de Anatomía Patológica. Hospital Ramón y Cajal)
Clínicamente13, estos tumores se asocian con acromegalia o gigantismo, amenorrea, galactorrea, infertilidad, disminución de la libido e impotencia. La mayor parte de estos adenomas muestra un crecimiento lento, aunque puede también invadir y producir extensión supraselar y síntomas locales, como alteraciones visuales y cefalea. La elevación de GH es más manifiesta que la de prolactina.
En raras ocasiones, la acromegalia y la hiperprolactinemia se deben a la aparición simultánea de 2 adenomas, uno productor de GH y otro productor de prolactina.
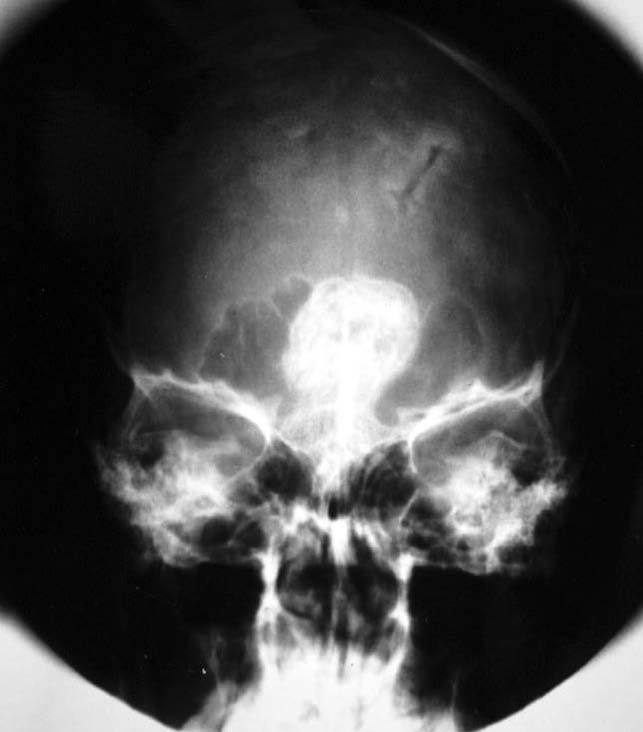
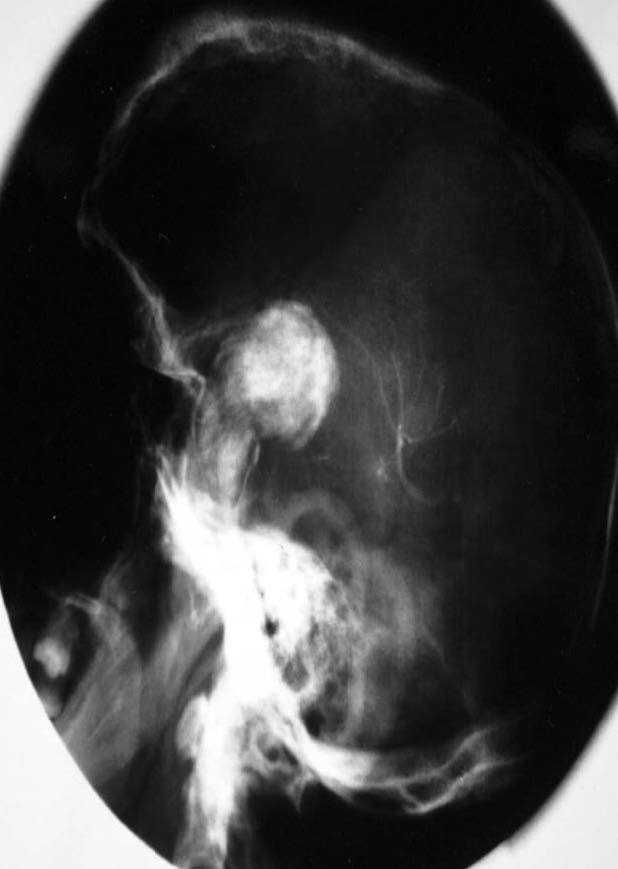
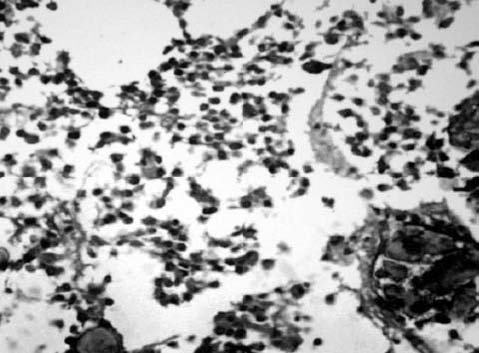
Una variante histológica poco frecuente, descrita en prolactinomas44, somatotropinomas45-47 y adenomas mixtos productores de GH y prolactina48, es la calcificación completa del tejido neoplásico, conocida comúnmente como piedra hipofisaria (figs. 3-5). Esta calcificación se ha relacionado en algunos prolactinomas con la presencia de depósitos de ácido hialurónico y condroitín-sulfato48, mientras que otros autores apuestan por una calcificación metastásica del tejido y la cápsula tumoral47. Estos adenomas productores de GH se han relacionado con un curso evolutivo lento47.
Fig. 3. Radiografía simple, anteroposterior de cráneo en una pa-ciente con adenoma mixto calcificado productor de GH y prolacti-na (piedra hipofisaria)48. (Con permiso de la revista Medicina Clínica, Ediciones Doyma, S.L.)
Fig. 4. Radiografía simple, lateral del cráneo del mismo paciente48. (Con permiso de la revista Medicina Clínica, Ediciones Doyma, S.L.)
Fig. 5. Hematoxilina-Eosina de adenoma mixto productor de GH y prolactina48. Obsérvese el esfacelado del tejido al resistirse al mi-crotomo y las zonas de calcificación metastásica con cristales de hidroxiapatita. (Con permiso de la revista Medicina Clínica, Edi-ciones Doyma, S.L.)
ADENOMAS MAMOSOMATOTROPOS
Son adenomas poco frecuentes. Estos tumores están compuestos por un tipo de célula bien diferenciada, en la cual hay GH y prolactina observadas por técnicas de inmunoperoxidasa, y muestran características comunes de las células lactotropas y somatotropas en el microscopio electrónico34,49,50. Son bihormonales y monomorfas.
Clínicamente, se asocian con más frecuencia a acromegalia que a hiperprolactinemia. Las concentraciones de prolactina suelen ser normales o moderadamente elevadas. Son tumores de crecimiento lento, intraselares y con buena respuesta a la cirugía.
Las células son acidófilas y no se tiñen con HE ni paraaminosalicílico. La inmunoperoxidasa revela prolactina y GH en el citoplasma de la misma célula. Son muy inmunorreactivas para GH, pero débilmente para prolactina. En el microscopio óptico son esféricas u ovales, con un gran núcleo, un nucléolo prominente y abundante citoplasma. Tienen un RER y un aparato de Golgi bien desarrollados13. Los gránulos de secreción son abundantes, esféricos, electrodensos y miden entre 300 y 2.000 nm. La presencia de exocitosis y grandes depósitos extracelulares de material secretor es característica de este tipo de adenoma9.
Diferenciar un adenoma somatotropo del adenoma mixto productor de GH y prolactina no es fundamental, porque ambos expresan el mismo comportamiento biológico. Sin embargo, excluir un adenoma acidófilo de células madre sí es importante, ya que la evolución de este último es mucho más agresiva, como se comentará a continuación13.
ADENOMAS ACIDOFILOS DE CÉLULAS MADRE
Los adenomas de células madre son tumores monomorfos compuestos por un tipo de célula inmadura, precursora común de la célula somatotropa y lactotropa49,51. Clínicamente, es un tumor con crecimiento rápido que invade los tejidos vecinos, de forma que en el 50% de los casos se extiende hacia el seno esfenoidal o la nasofaringe51. Son normalmente adenomas cromófobos, aunque pueden mostrar una leve acidofilia debido a la acumulación de mitocondrias y retículo endoplásmico liso, más que a la presencia de gránulos de secreción. En el microscopio electrónico, las células muestran un citoplasma inmaduro, escaso desarrollo de las membranas del RER y complejos de Golgi, mitocondrias gigantes y varias formas de cambios oncocíticos, así como cuerpos fibrosos. Los gránulos de secreción son escasos, miden 100-300 nm y son esféricos o de configuración irregular. En la mitad de los casos, la tinción con HE revela la vacuolización del citoplasma, en relación con el gigantismo mitocondrial13. La inmunoperoxidasa muestra GH y prolactina en el citoplasma de la misma célula. La inmunopositividad es generalmente más fuerte para la prolactina que para la GH, que incluso en algunas zonas puede ser negativa. Clínicamente, los pacientes tienen hiperprolactinemia, pero el grado de elevación de ésta en suero es menor de lo que sería predecible según el tamaño tumoral. Pueden cursar con amenorrea, galactorrea, infertilidad, disminución de la libido e impotencia. Las concentraciones séricas de GH raramente están elevadas. Pueden aparecer rasgos acromegálicos, lo que sugiere la secreción de una molécula anormal de GH, que puede ser biológicamente activa pero no se observa en el radioinmunoanálisis.
El reconocimiento de este tipo de tumores es útil, ya que con frecuencia muestran un rápido crecimiento, invaden tejidos vecinos y su extirpación quirúrgica completa es difícil.
ADENOMAS PLURIHORMONALES CON PRODUCCION DE GH
Estos tumores representan entre el 10 y el 15% de todos los adenomas productores de GH operados52, y todavía son más frecuentes en las series de autopsias. No se incluyen en este tipo de neoplasias los adenomas con producción simultánea de GH y prolactina. Tampoco se incluyen los adenomas corticotropos que producen varios fragmentos de proopiomelanocortina o adenomas gonadotropos que producen LH y FSH.
Los adenomas plurihormonales de la hipófisis producen 2 o más hormonas con diferente composición química, inmunorreactividad y acción biológica53-56. Se pueden dividir en tumores monomorfos y plurimorfos. Los adenomas monomorfos presentan un solo tipo celular que produce 2 o más hormonas, demostradas mediante la técnica de la inmunoperoxidasa. El microscopio electrónico revela un tipo de célula que no se observa en la adenohipófisis normal o en los adenomas hipofisarios que producen sólo una hormona. Los adenomas plurimorfos se componen de 2 o más poblaciones celulares. Son realmente adenomas mixtos, aunque cada célula contiene una hormona y en la tinción química se observa que las células se comportan de forma similar a las no tumorales.
La mayoría de estos tumores produce exceso de GH y se asocia a acromegalia y/o gigantismo. La combinación más prevalente es GH, prolactina y una o más glucoproteínas, entre las que la TSH es la más frecuente (las hormonas glucoproteínicas incluyen FSH, LH, TSH y gonadotropina coriónica, aunque esta última no es habitual en los adenomas hipofisarios). Los adenomas plurihormonales no muestran diferencias en cuanto al sexo, pero aparecen con mayor frecuencia en niños y adolescentes (10%)52. Aproximadamente, el 10% aparecen en el seno de una neoplasia endocrina múltiple tipo 1, con una mayor incidencia que otros tipos de adenomas hipofisarios. La mayor parte de estos tumores son macroadenomas (80%) y alrededor del 50% son invasivos en el momento de la cirugía.
Clínicamente, casi el 70% de los pacientes presenta signos de exceso de GH, mientras que los efectos de la hiperprolactinemia se manifiestan en el 20% de los casos. A pesar de la elevada frecuencia de inmunorreactividad positiva a la TSH (90%), el hipertiroidismo es raro52. Con frecuencia se observa la presencia de la subunidad-*. Hay inmunorreactividad para la corticotroprina (ACTH) en un 7% de éstos, pero la elevación de las concentraciones hormonales es excepcional57,58. Se han propuesto varias posibles razones para explicar la ausencia de elevación sérica de las hormonas a pesar de la presencia de una inmunohistoquímica positiva y una diferenciación ultraestructural específica13: a) la hormona puede ser producida pero no secretada; b) la hormona puede ser producida pero puede presentar una degradación intracelular; c) algunas peculiaridades estructurales en las hormonas pueden permitir su identificación inmunocitoquímica, pero sin que haya bioactividad; d) que se elaboren sólo partes del producto, como en el caso de la subunidad-*, o finalmente e) que haya mecanismos fisiológicos de retroalimentación, de forma que las bajas concentraciones de los productos secretados por el tumor supriman la hipófisis no tumoral o el adenoma.
En el microscopio óptico estos tumores pueden ser acidófilos o cromófobos; asimismo, la tinción es variable y depende del contenido en glucoproteínas. Aunque la mayor parte de los tumores producen GH, prolactina y TSH, los estudios ultraestructurales muestran que son monomorfos, bimorfos o trimorfos, con igual frecuencia. La mayor parte de los tumores monomorfos está compuesta por células somatotropas DG.
CARCINOMAS PRODUCTORES DE GH
Aunque los tumores hipofisarios pueden ser muy agresivos y asociarse a la destrucción de los tejidos blandos y el hueso, se requiere la presencia de metástasis a distancia para asegurar el diagnóstico de carcinoma hipofisario59. Los adenomas hipofisarios invasivos representan formas intermedias entre los adenomas benignos y los carcinomas hipofisarios metastáticos60. No hay grandes diferencias histológicas entre tumores hipofisarios benignos, invasivos y malignos. Los carcinomas hipofisarios, al igual que los adenomas, están compuestos por células de la adenohipófisis60,61. Su naturaleza maligna no se basa en aspectos microscópicos, y la distinción entre adenoma y carcinoma es imposible basándose solamente en criterios histológicos59,60. La presencia de hipercelularidad, pleomorfismo nuclear, de algunas figuras mitóticas, necrosis, hemorragia e incluso la invasión, no son indicadores fiables de la malignidad tumoral60,62. Varios autores han propuesto como criterio necesario para el diagnóstico la presencia de metástasis a distancia en el espacio subaracnoideo, el tejido cerebral o fuera del sistema nervioso central13,62.
Los carcinomas hipofisarios son raros y casi siempre se presentan como casos aislados. En una revisión realizada por Kaltsas et al63, en la que se incluye 95 casos, la mayor parte es no funcionante. Tan sólo 13 de estos tumores son catalogados como productores de GH y presentan una gran predisposición a desarrollar metástasis en el sistema nervioso central. La edad de presentación es relativamente baja (media ± desviación estándar [DE], 35 ± 3 años) en comparación con la de otros carcinomas hipofisarios63. Estos pacientes presentan una clínica de acromegalia y concentraciones séricas de GH elevadas. El tumor muestra un rápido crecimiento e invasión de las estructuras vecinas. Desde el punto de vista endocrinológico, sus manifestaciones incluyen distintos grados de hipopituitarismo. Además de las metástasis en el sistema nervioso central, pueden desarrollar diseminación a distancia en el hígado, el hueso, los ganglios linfáticos y el corazón43.
CONCLUSIONES
El avance en las técnicas de inmunohistoquímica y análisis de ultraestructura ha permitido identificar las diferentes lesiones relacionadas con la hipersecreción de GH. Aunque hay numerosos trabajos que intentan relacionaclínico de los pacientes, hay controversia en cuanto a la utilidad de los resultados entre diferentes autores. Los datos procedentes de estos trabajos no se suelen utilizar habitualmente en la práctica clínica. Nuevas aportaciones que clarifiquen la relación entre morfología y función deben ayudarnos a mejorar el tratamiento y el seguimiento de los pacientes con acromegalia.